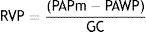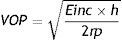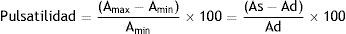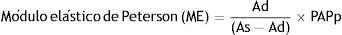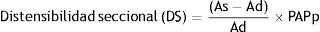la circulación pulmonar normal del adulto es un sistema de baja resistencia y alta capacitancia. Conocer su anatomía y fisiología es importante para comprender los efectos de la enfermedad vascular pulmonar sobre la situación funcional y pronóstico en la hipertensión pulmonar.
Objetivoanalizar las características anátomo-funcionales de la circulación pulmonar y sus cambios con la edad y respuesta al ejercicio. Caracterizar la rigidez arterial pulmonar y su relación con la poscarga.
Metodologíase hizo una revisión narrativa de la información disponible.
Conclusionesla circulación pulmonar presenta un doble origen: las arterias pulmonares de ‘conducción’ extraparenquimatosas y las arterias pulmonares de ‘resistencia’ intrapulmonares. La poscarga arterial pulmonar puede estimarse mediante la resistencia vascular (componente estacionario) y la complacencia arterial (componente pulsátil) cuya relación es inversa y su producto caracteriza la constante de tiempo. La rigidez arterial pulmonar constituye un factor para gobernar la poscarga dinámica, y su aumento constituye un hecho temprano en el desarrollo de hipertensión pulmonar. La respuesta de la circulación pulmonar al ejercicio tiene un rol importante en el diagnóstico subclínico de la hipertensión pulmonar.
The normal adult pulmonary circulation is a low resistance and high capacitance system. Knowledge of its anatomy and physiology is important in order to understand the effects of pulmonary vascular disease on the functional status and prognosis in pulmonary hypertension.
ObjectiveTo analyse the anatomic-functional characteristics of pulmonary circulation and its changes with age and response to exercise, as well as to describe pulmonary artery stiffness and its relationship with afterload.
MethodologyA narrative review is presented on the information available.
ConclusionsThe pulmonary arterial circulation is of dual origin: the extra-parenchymal “conduction” pulmonary arteries and the intrapulmonary “resistance” pulmonary arteries.
The pulmonary arterial afterload can be estimated using the vascular resistance (stationery component) and the arterial compliance (pulsatile component) which has an inverse relationship, and its product represents the time constant. Pulmonary artery stiffness is a factor to regulate the dynamic afterload, and its increase is an early indication in the development of pulmonary hypertension. The response of the pulmonary circulation to exercise has an important role in the sub-clinical diagnosis of pulmonary hypertension.
En condiciones normales, la circulación pulmonar del adulto es un sistema de alto flujo, baja resistencia y baja presión diseñado para favorecer el intercambio gaseoso pulmonar, con el cual se evita la salida de fluido desde los vasos pulmonares hacia el espacio intersticial y permite que el ventrículo derecho opere con un costo energético bajo. Como consecuencia de la presión transmural baja, las paredes de las arterias pulmonares son delgadas, y tienen gran capacidad de dilatarse y reclutarse frente a un aumento del flujo sanguíneo pulmonar. No obstante, debido a las presiones bajas, la circulación pulmonar es muy sensible a las influencias mecánicas, en tanto que el ventrículo derecho de paredes finas, no está preparado para los cambios rápidos de las condiciones de carga, sobre todo de poscarga1.
Conocer la anatomía y fisiología de la circulación pulmonar es muy importante para comprender las diferentes alteraciones de la circulación pulmonar asociadas a las enfermedades cardiovasculares, que conllevan peor situación funcional y mayor mortalidad. No obstante, el estudio de la circulación pulmonar resulta difícil ya que se requiere de un abordaje invasivo (cateterismo cardíaco derecho, en situaciones artificiales (sala de hemodinamia), en posiciones no representativas (acostado) y en reposo. El empleo de técnicas no invasivas (ecocardiografía, resonancia magnética) ha facilitado el estudio de la hemodinamia pulmonar en diferentes estados de actividad humana.
Características anátomo-funcionalesEl pulmón adulto tiene un sistema vascular doble: la circulación bronquial y la circulación pulmonar. Mientras que el sistema bronquial se encarga de oxigenar las estructuras no respiratorias del pulmón, la circulación pulmonar transporta sangre desoxigenada a los alvéolos para el intercambio gaseoso.
El crecimiento y desarrollo de los vasos pulmonares ocurre en paralelo al desarrollo del pulmón. Básicamente, el crecimiento vascular pulmonar involucra los procesos de vasculogénesis (formación de nuevos vasos a partir de las células endoteliales, reuniría los vasos periféricos) y de angiogénesis (formación de nuevos vasos a partir de la ramificación de vasos preexistentes vía proceso de brotación o “sprouting”, e involucraría los vasos centrales)2, a los que se agregaría un tercer proceso de fusión, necesario para ‘conectar’ los vasos angiogénicos y los vasculogénicos3.
Desde el punto de vista anátomo-histológico existen tres tipos de arterias:
- a)
Arterias elásticas: arteria pulmonar (AP) común (20mm) con sus ramas, arterias lobares, segmentarias y subsegmentarias, hasta arterias de 1mm de diámetro, que constituyen la transición entre bronquios y bronquiolos. Su pared está formada por varias láminas elásticas separadas por capas de músculo liso vascular y son capaces de contraerse. Proveen reserva elástica distensible.
- b)
Arterias musculares: comprenden arterias con lámina elástica interna y externa bien desarrolladas y una gruesa capa de músculo liso vascular concéntrica. Desde 1.000-50μ a 100μ, corresponden a las arterias acinares, sitio fundamental en el control activo. Son las responsables de la hipertensión pulmonar precapilar y la vasoconstricción hipóxica. A medida que el diámetro arterial se reduce, las láminas elásticas se hacen menos prominentes, siendo reemplazadas por músculo liso vascular
- c)
Arterias de pequeño calibre con un diámetro menor a 100μ: más allá de los bronquiolos terminales y dentro del acino respiratorio, las arterias pierden gradualmente el músculo liso vascular, disponiéndose en forma espiralada y discontinua, hasta desaparecer en arteriolas intracinares menores a 30μ. Carecen de lámina elástica interna4,5.
Como se aprecia, a diferencia del árbol sistémico, no existen verdaderas arteriolas muscularizadas, determinando que la resistencia vascular periférica tenga una distribución más homogénea: 46% arterial, 34% capilar y un 20% a venoso6. Por último, la red capilar de 50-100 m2 constituye la membrana alvéolo-capilar de 1 micra de espesor. Tanto a y b (arterias elásticas y musculares) conforman los vasos extraalveolares de fuerte control neurohumoral y gaseoso (control activo), en tanto que las arterias de pequeño calibre y la red capilar poseen escasa o nula muscularización y constituyen los llamados vasos intraalveolares de fuerte control pasivo secundario a las variaciones de la presión alveolar (según las zonas de West).
Como vimos, la vasculatura pulmonar presenta doble origen embriológico que se fusiona en el desarrollo de las arterias pulmonares (Aps) de ‘conducción’ extraparenquimatosa que se originan a partir del sexto arco aórtico y las arterias pulmonares de ‘resistencia’ intrapulmonar que se vienen desde el brote del mesénquima pulmonar, al punto de partida de la expansión del plexo capilar4,7,8. Las arterias pulmonares de conducción (1° y 2° orden) se dilatan o no se contraen frente a la hipoxia, en tanto que las arterias pulmonares de resistencia (< 2mm de diámetro, 4° orden y distal) se vasocontraen con la hipoxia4. De esta manera las arterias pulmonares distales determinan en gran parte la resistencia vascular periférica, siendo el sitio de vasoconstricción hipóxica (mecanismo que permite direccionar la perfusión desde zonas pobremente ventiladas a zonas ventiladas, reflejo de Euler-Liljestrand). En contraste, las arterias pulmonares proximales de ‘conducción’ se dilatan o no responden a la hipoxia en forma similar a las arterias sistémicas. Por último, es interesante destacar la peculiaridad de la inervación autónoma dada fundamentalmente por el sistema nervioso simpático, la que predomina en el sector proximal, disminuyendo su densidad hacia la periferia, en concordancia con el músculo liso vascular.
Caracterización de la poscarga pulmonarEn mecánica cardíaca la poscarga representa la carga o resistencia impuesta al ventrículo durante la contracción. Dicha carga determina la tensión parietal del ventrículo, que debe ser vencida para lograr expulsar sangre y generar el gasto cardíaco. La carga hidráulica arterial puede describirse en forma completa por la impedancia de entrada que surge como consecuencia de la relación entre la presión pulsátil y el flujo pulmonares. Sin embargo, esta descripción no sólo es difícil de obtener, sino también compleja de interpretar por lo que se han propuesto varias descripciones simplificadas de la circulación arterial9. La más conocida se basa en el modelo de Windkessel de dos elementos, que incluye parámetros fisiológicos fácilmente interpretables y describe la hemodinámica en términos de resistencia y complacencia. La resistencia vascular periférica representa el componente estacionario y se halla principalmente en las pequeñas arterias y arteriolas ya que la resistencia depende en gran medida del diámetro del vaso. La complacencia arterial total representa el componente pulsátil que es la capacidad de almacenamiento de todas las arterias y arteriolas en su conjunto. La complacencia arterial total está relacionada con la elasticidad de la pared arterial y las características geométricas del vaso, dadas por el radio y el espesor de la pared. La circulación pulmonar normal se caracteriza por la baja resistencia y alta capacitancia de su vasculatura, con grandes posibilidades para la distensión y reserva de reclutamiento. Se estima que el componente pulsátil de la carga arterial pulmonar representa el ∼25% de la potencia del ventrículo derecho en promedio, en comparación con el ∼10% de la circulación sistémica10.
Si bien, tanto la resistencia vascular periférica como la complacencia arterial total han demostrado ser de valor pronóstico en hipertensión pulmonar, los datos acerca de la primera son contradictorios. El registro francés no demostró que esta sea un predictor pronóstico independiente en la hipertensión pulmonar arterial, y el registro americano REVEAL mostró que una resistencia vascular periférica > 32 unidades Wood se asocia con mayor mortalidad en hipertensión pulmonar arterial11,12. Por el contrario, la complacencia arterial total es un fuerte predictor de mortalidad en pacientes con hipertensión pulmonar arterial e hipertensión pulmonar asociada con esclerodermia13,14. De esta manera, la complacencia arterial total sería una medida de la poscarga del ventrículo derecho superior a la resistencia vascular periférica para explicar la insuficiencia del ventrículo derecho.
Resistencia vascular periféricaEs una medida del grado en que la circulación pulmonar se resiste al flujo medio y depende de la viscosidad de la sangre y el tamaño y número de vasos15. El gradiente de presión del flujo pulmonar medio es el gradiente transpulmonar que resulta de la presión arterial pulmonar media (PAPm) menos la presión arterial pulmonar de enclavamiento (PAWP) o presión auricular izquierda. La fórmula estándar para calcular la resistencia vascular periférica es la siguiente (basada en la ley de Ohm de circuitos eléctricos):
La resistencia vascular periférica es un componente de los criterios actuales del diagnóstico para hipertensión pulmonar precapilar, que se define por PAPm ≥ 25mm Hg, PAWP ≤ 15mm Hg y resistencia vascular periférica > 3 unidades Wood16. Hay algunas limitaciones de la ecuación estándar de la resistencia vascular periférica. En la enfermedad vascular pulmonar asociada a hipertensión pulmonar precapilar, la presión media a flujo cero está significativamente por encima de la PAWP, lo que concuerda con el alto gradiente entre PAP diastólica (PAPd) y PAWP y la ordenada en el origen de las curvas lineales de PAPm-gasto cardiaco o la curva de caída de la PAP luego de la oclusión del balón17,18. Por tanto, el uso de la ecuación anterior podría sobreestimar el valor de la resistencia vascular periférica. Otra limitación conceptual incluye los supuestos de que la sangre se comporta como un fluido newtoniano y que las arterias actúan como tubos rígidos, siendo colapsables y distensibles15.
Complacencia arterialLa distensibilidad del árbol arterial hace que las arterias se expandan de forma pasiva durante la sístole y colapsen durante la diástole. El almacenamiento sistólico de este volumen de sangre amortigua la eyección pulsátil del ventrículo derecho y disminuye el trabajo sistólico del mismo. La complacencia arterial total es difícil de medir in vivo con base en la fórmula ΔV/ΔP, ya que parte del volumen sistólico (VS) sale del sistema arterial hacia la periferia (microcirculación) durante la eyección cardiaca. De esta forma, el ΔV estimado por el volumen sistólico excede el volumen almacenado por las arterias pulmonares distensibles, y la estimación de complacencia arterial total en la práctica clínica como VS/PAPp (PAP pulsátil) puede sobrestimar la verdadera complacencia arterial total hasta en un 61%19,20.
La complacencia arterial total está determinada por el valor de la PAPm operativa y por la viscoelasticidad de la pared arterial pulmonar, la que depende principalmente del el contenido de elastina y fibras de colágeno y la cantidad y el grado de activación del músculo liso vascular en la pared21,22. Por consiguiente, una disminución de complacencia arterial total puede resultar, por un lado, de un aumento en la PAPm sin un verdadero cambio en las propiedades viscoelásticas de la pared PA y por otro lado, de un aumento de la rigidez parietal de las arterias pulmonares debido a la remodelación vascular23.
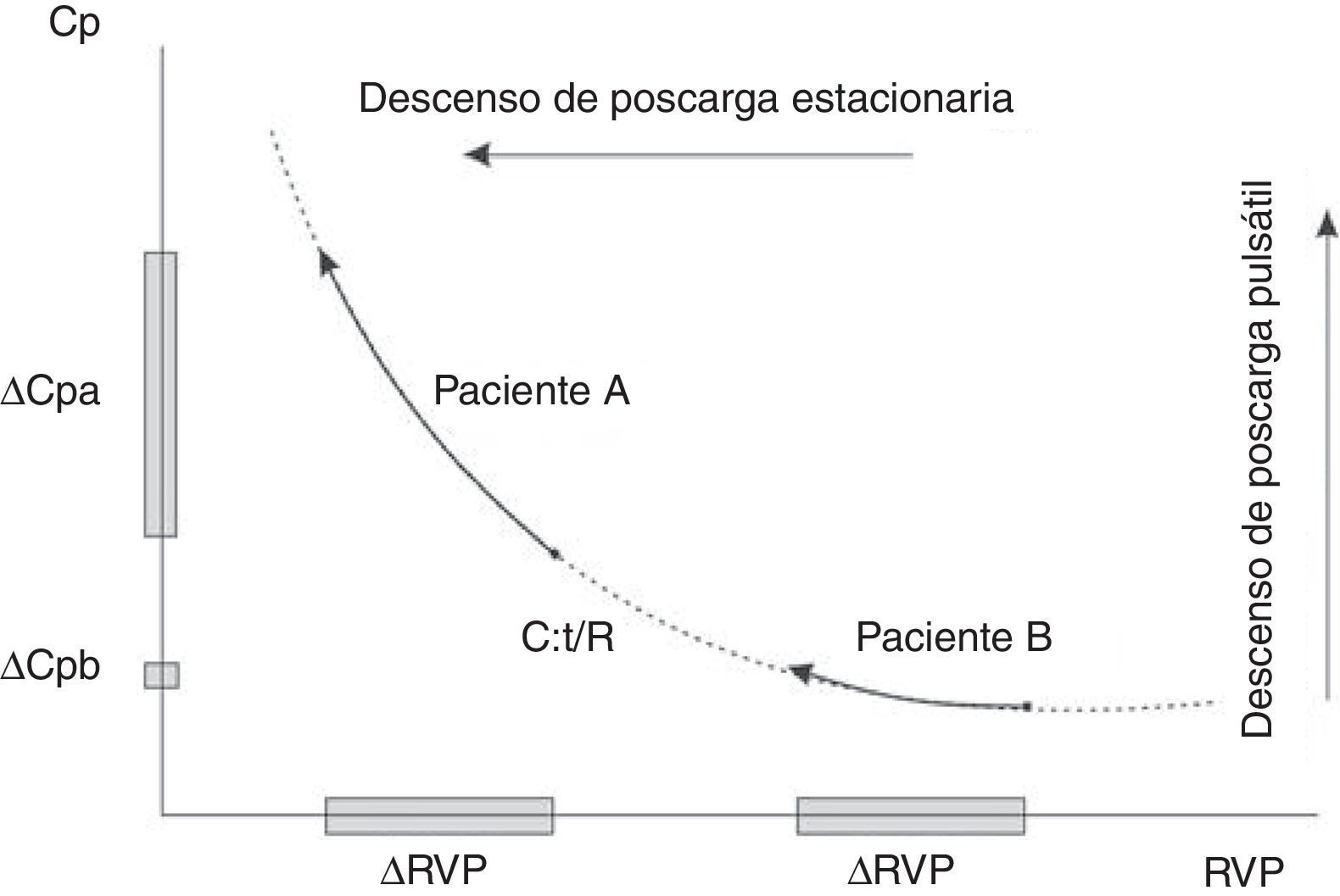
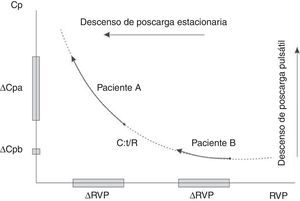
Relación de la resistencia vascular pulmonar y la complacencia arterialEsta relación es inversa tanto en condiciones normales como en la enfermedad, incluyendo hipertensión pulmonar arterial, hipertensión pulmonar tromboembólica crónica e hipertensión pulmonar asociada a cardiopatía izquierda y usualmente se ajusta con una relación hiperbólica24 (fig. 1). La relación inversa entre la resistencia vascular periférica y la complacencia arterial total puede explicarse por varios factores:
- a)
La PAPm, que es el principal determinante de la complacencia arterial total.
- b)
La distribución longitudinal de la resistencia y la capacitancia de los vasos de la circulación pulmonar.
- c)
La presencia de acoplamiento matemático ya que el volumen sistólico aparece en ambas variables y que la PAPm (resistencia vascular periférica) y la PAPp (complacencia arterial total) tienen una relación ∼ 1:125.
El producto de la resistencia vascular periférica y la complacencia arterial total tiene unidades de tiempo (tiempo-RC) y representa la constante de tiempo de la circulación pulmonar, que caracteriza la caída diastólica de la PAP25,26. Este concepto proviene del modelo Windkessel de dos elementos donde la caída diastólica de la PAP se rige por la resistencia vascular periférica y la distensibilidad arterial total. Sin embargo, como se ha mencionado antes, las estimaciones empíricas de la resistencia vascular periférica y la complacencia arterial total son propensas a errores, pudiendo se sobreestimadas por las ecuaciones estándar. Así pues, no sorprenden los altos valores de referencia del tiempo-RC (estimación empírica) de ∼0,5-0,7 s.
En contraste, mediante el empleo del método semilogarítmico, el tiempo-RC estimado tuvo un promedio de 0,16-0,39 s y 0,21-0,83 s en sujetos normales y en pacientes con hipertensión pulmonar, respectivamente27,28. Este método resulta de la transformación logarítmica de una función exponencial simple ajustada a la curva temporal de la caída diastólica de la PAP.
Más allá de los métodos de cálculo del tiempo-RC, ¿es invariable la constante de tiempo-RC?29 Razonando por el absurdo, si el tiempo-RC fuera constante, ello determinaría que la complacencia arterial total y la resistencia vascular periférica fueran medidas redundantes, ya que el conocimiento de una es suficiente para obtener el valor de la otra25. En otras palabras, ello implicaría que la complacencia arterial total no puede cambiar independientemente de la resistencia vascular periférica y por tanto no sería un determinante pronóstico independiente30. Hoy en día es claro que varias condiciones están asociadas con alteraciones significativas del tiempo-RC. Tanto la hipertensión pulmonar precapilar, como la hipertensión pulmonar poscapilar y los sujetos normales presentan constantes de tiempo diferentes. Se ha sugerido que el valor del tiempo-RC es constante dentro de cada subgrupo de hipertensión pulmonar lo que implica un rango estrecho de valores del tiempo-RC25,30. Sin embargo, el paradigma de un valor constante del tiempo-RC ya no es sostenible a partir de la mayoría de datos que muestran un gran desvío estándar y un alto coeficiente de variación (más del 25%)25. Los pacientes con hipertensión pulmonar tromboembólica crónica operable se caracterizan por una onda de reflexión más predominante que la hipertensión arterial pulmonar idiopática. El análisis isobárico del componente estacionario explica que la complacencia arterial total es desproporcionadamente inferior, con un desplazamiento hacia abajo y hacia la izquierda, de la relación hiperbólica inversa entre la resistencia vascular periférica y la complacencia arterial total en los pacientes con hipertensión pulmonar tromboembólica crónica y un tiempo-RC significativamente menor respecto a la cohorte de hipertensión pulmonar arterial idiopática (0,5 ± 0,13 frente a 0,6 ± 0,3 s)31,32. Así, entonces, la evidencia actual emergente demuestra que el tiempo-RC puede ser más corto en la hipertensión pulmonar, no sólo debido a un árbol arterial pulmonar rígido causado por el aumento de la presión venosa pulmonar (hipertensión pulmonar asociada a cardiopatía izquierda), sino también a un aumento de la reflexión de la onda causada por la presencia de obstrucción pulmonar proximal (hipertensión pulmonar tromboembólica crónica operable), aumentando la poscarga y el trabajo total del ventrículo derecho a expensas del componente pulsátil25,29,33.
Estimación de la rigidez arterial pulmonar y su relación con la poscargaLa rigidez de la AP es un factor importante que gobierna la poscarga dinámica. La rigidez de la AP proximal puede aumentarse en etapas tempranas en el curso de la hipertensión pulmonar, lo que sugiere un rol potencial de la rigidez arterial pulmonar en el desarrollo y progresión de la hipertensión pulmonar. La asociación entre la rigidez vascular y la gravedad de la enfermedad se debe a varios factores:
- a)
El aumento de rigidez parietal reduce el efecto Windkessel de las arterias elásticas, que afecta la función de amortiguación de las mismas.
- b)
El aumento de rigidez parietal aumenta la poscarga del ventrículo derecho independientemente de la resistencia vascular periférica.
- c)
El grado de disfunción del ventrículo derecho en la hipertensión pulmonar está relacionada de forma independiente a la rigidez de la AP.
- d)
Se ha demostrado que los cambios en las formas de onda de flujo y presión debidos al aumento de rigidez de la circulación pulmonar estimulan vías de señalización celular a nivel de los vasos distales y los pulmones que agravan la enfermedad vascular existente34,35. El aumento de la rigidez arterial observada en la hipertensión pulmonar puede ser secundario a presiones elevadas de distensión y/o a cambios estructurales de la pared arterial.
La estimación de la rigidez arterial puede realizarse a tres niveles: global o sistémico, regional y local. La rigidez arterial sistémica puede estimarse por la inversa de la complacencia arterial total (PAPp/VS). La rigidez arterial regional clásicamente se evalúa mediante la velocidad de la onda de pulso (VOP)36. La VOP se define como la velocidad de desplazamiento de la onda de presión a lo largo de la pared arterial, y depende del módulo elástico y de factores geométricos del vaso según la ecuación de Moens-Korteweg:
Donde Einc es el módulo elástico de Young, h y r son el espesor y radio del vaso, respectivamente y p es la densidad de la sangre. El valor normal de la VOP en el ser humano es de 1,6 ± 0,5 a 3,8 ± 1 m/s a partir de estudios con cardiorresonancia37.
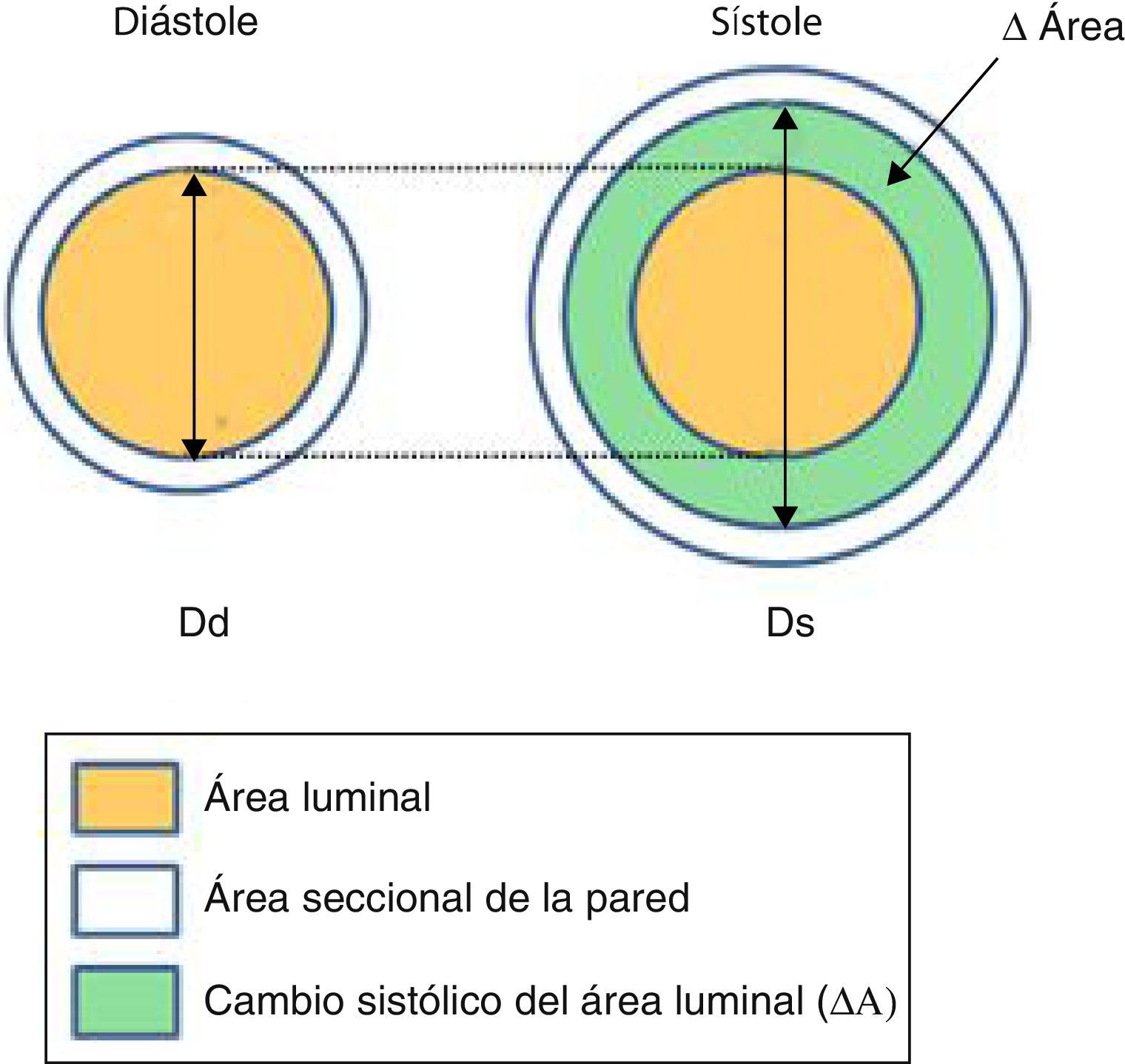
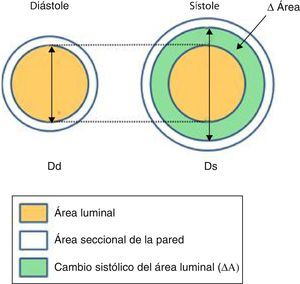
Nos centraremos en los índices de rigidez arterial locales, definidos como las propiedades de la pared arterial por unidad de longitud o por unidad de la sección y derivan de la variación pulsátil de la geometría arterial (fig. 2) y la PAPp.
Arriba: esquema que muestra los cambios del área seccional (ΔÁrea: área sistólica - área diastólica) del vaso durante el ciclo cardíaco. (Ds y Dd: diámetros sistólico y diastólico). Abajo: imágenes de una arteria pulmonar segmentaria mediante ultrasonido intravascular en sístole y diástole.
La pulsatilidad corresponde al cambio relativo del área durante el ciclo cardíaco:
Donde Amax y Amin son las áreas máxima y mínima, que corresponden a las áreas sistólica y diastólica, respectivamente. La pulsatilidad puede medirse a través de cardiorresonancia, ecocardiografía o ultrasonido intravascular. Una pulsatilidad < 40% predice la presencia (sensibilidad: 93%; especificidad: 63%) y el pronóstico de la hipertensión pulmonar38,39, en tanto que la pulsatilidad arterial depende de la presión intraluminal y las propiedades viscoelásticas de la pared arterial y la rigidez arterial depende del grado de remodelación parietal. Por ende, la cuantificación aislada de la pulsatilidad es insuficiente para caracterizar en forma completa las propiedades elásticas de la arteria pulmonar, lo que a su vez explica la ausencia de su correlación con los parámetros hemodinámicos39. En la práctica clínica, se pueden obtener los siguientes índices de rigidez arterial local36:
El ME corresponde a la inversa del coeficiente de distensibilidad (PAPp que determina un cambio relativo del área seccional del vaso), DS corresponde al cambio relativo de la luz del vaso para un cambio de la PAPp y la CS corresponde al cambio absoluto del área seccional durante la sístole para el valor de PAPp operacional. Es de destacar que los índices de rigidez arterial local normalizados con la PAPp se correlacionan de manera significativa con la resistencia vascular periférica y la Cp38,40.
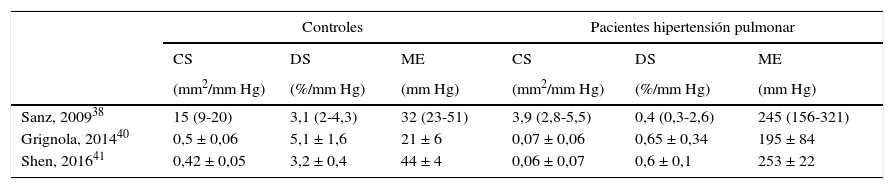
Existen pocos datos acerca de los valores normales de los índices de rigidez local de la AP. En la tabla 1 se comparan los datos de tres estudios recientes que analizan los índices de rigidez arterial pulmonar de sujetos control versus pacientes con hipertensión pulmonar de diferentes etiologías. Por su parte, Sanz et al. midieron la arteria pulmonar principal (24-26mm) mediante cardiorresonancia, y Grignola et al. y Shen et al. emplearon el IVUS midiendo AP elásticas entre 2-5mm de diámetro38,40,41.
Comparación de los índices de rigidez arterial pulmonar en controles y pacientes con hipertensión pulmonar
| Controles | Pacientes hipertensión pulmonar | |||||
|---|---|---|---|---|---|---|
| CS | DS | ME | CS | DS | ME | |
| (mm2/mm Hg) | (%/mm Hg) | (mm Hg) | (mm2/mm Hg) | (%/mm Hg) | (mm Hg) | |
| Sanz, 200938 | 15 (9-20) | 3,1 (2-4,3) | 32 (23-51) | 3,9 (2,8-5,5) | 0,4 (0,3-2,6) | 245 (156-321) |
| Grignola, 201440 | 0,5 ± 0,06 | 5,1 ± 1,6 | 21 ± 6 | 0,07 ± 0,06 | 0,65 ± 0,34 | 195 ± 84 |
| Shen, 201641 | 0,42 ± 0,05 | 3,2 ± 0,4 | 44 ± 4 | 0,06 ± 0,07 | 0,6 ± 0,1 | 253 ± 22 |
Media ± DS o mediana (rango intercuartil). CS: complacencia seccional; DS:distensibilidad seccional; ME: módulo elástico.
Existen reportes que indican que la resistencia vascular periférica aumenta y la extensibilidad de la arteria pulmonar principal disminuye con la edad42,43. Debido a que en la era actual la demografía en hipertensión pulmonar se ha desplazado a una población más añosa, es preciso diferenciar a los pacientes de edad avanzada con “rigidez asociada a la edad” de los vasos pulmonares, de aquellos que verdaderamente tienen vasculopatía pulmonar. Además, no está claro cómo definir la respuesta vascular pulmonar durante el ejercicio como “anormal”, especialmente en sujetos mayores de 50 años de edad, cuyos vasos pulmonares pueden responder de manera diferente al ejercicio que los de las personas más jóvenes. Es muy importante definir la respuesta vascular pulmonar anormal al ejercicio en los sujetos con la hemodinámica normal en reposo ya que varios estudios sugieren que la hipertensión pulmonar asociada al ejercicio puede corresponder a una etapa incipiente y quizás más tratable de la hipertensión pulmonar establecida en reposo44,45.
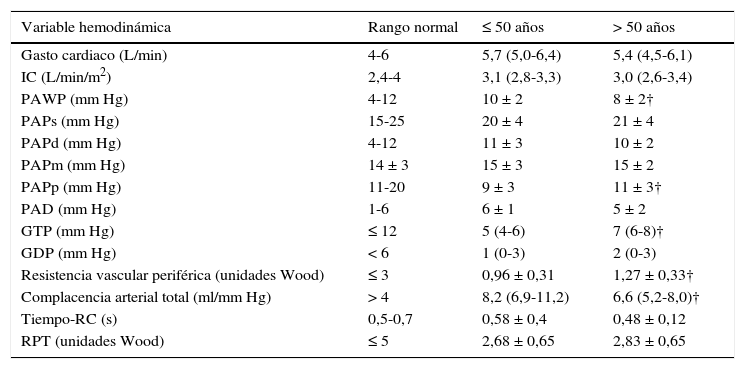
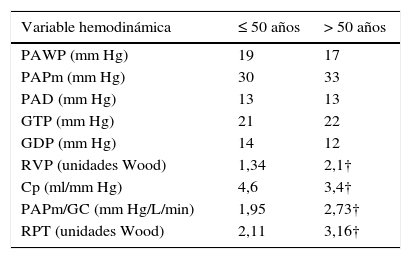
Muy recientemente se evaluó una cohorte (n = 66) de sujetos normales consecutivos (basada en la capacidad de ejercicio conservada y hemodinamia normal en reposo en posición supina) con intolerancia al esfuerzo inexplicada mediante una prueba de esfuerzo cardiopulmonar invasivo46. Los sujetos mayores 50 años de edad (n = 41) fueron comparados con los sujetos ≤ 50 años de edad (n = 25). En reposo, el cateterismo cardiaco derecho evidenció diferencias significativas de la PAPp, PAWP, resistencia vascular periférica y complacencia arterial total, con valores de PAPm, presión de la aurícula derecha, y gasto cardiaco similares (tabla 2). Si bien durante el pico de esfuerzo la PAP media (23 ± 5 versus 22 ± 4mm Hg) y la PAWP (9 ± 5 versus 9 ± 4mm Hg) no fue diferente para los sujetos mayores de 50 respecto a los ≤ 50 años de edad, el gasto cardiaco y la complacencia arterial total pico fueron más bajos y la resistencia vascular periférica pico fue mayor en sujetos de edad avanzada en comparación con los más jóvenes46. Ello determinó que la pendiente del cociente PAPm/GC fuera significativamente menor en los sujetos menores de 50 años (1,05 ± 0,45 versus 1,59 ± 0,57mm Hg/L/min). En la tabla 3 se muestran los límites superiores de normalidad (LSN) de la hemodinamia durante el ejercicio máximo en posición vertical en ambos grupos etarios.
Valores normales de la hemodinamia pulmonar en reposo
| Variable hemodinámica | Rango normal | ≤ 50 años | > 50 años |
|---|---|---|---|
| Gasto cardiaco (L/min) | 4-6 | 5,7 (5,0-6,4) | 5,4 (4,5-6,1) |
| IC (L/min/m2) | 2,4-4 | 3,1 (2,8-3,3) | 3,0 (2,6-3,4) |
| PAWP (mm Hg) | 4-12 | 10 ± 2 | 8 ± 2† |
| PAPs (mm Hg) | 15-25 | 20 ± 4 | 21 ± 4 |
| PAPd (mm Hg) | 4-12 | 11 ± 3 | 10 ± 2 |
| PAPm (mm Hg) | 14 ± 3 | 15 ± 3 | 15 ± 2 |
| PAPp (mm Hg) | 11-20 | 9 ± 3 | 11 ± 3† |
| PAD (mm Hg) | 1-6 | 6 ± 1 | 5 ± 2 |
| GTP (mm Hg) | ≤ 12 | 5 (4-6) | 7 (6-8)† |
| GDP (mm Hg) | < 6 | 1 (0-3) | 2 (0-3) |
| Resistencia vascular periférica (unidades Wood) | ≤ 3 | 0,96 ± 0,31 | 1,27 ± 0,33† |
| Complacencia arterial total (ml/mm Hg) | > 4 | 8,2 (6,9-11,2) | 6,6 (5,2-8,0)† |
| Tiempo-RC (s) | 0,5-0,7 | 0,58 ± 0,4 | 0,48 ± 0,12 |
| RPT (unidades Wood) | ≤ 5 | 2,68 ± 0,65 | 2,83 ± 0,65 |
Media ± DS; mediana (rango intercuartílico). Cp: capacitancia arterial pulmonar; GC: gasto cardíaco; IC: índice cardíaco; GDP y GTP: gradiente diastólico pulmonar y transpulmonar, respectivamente; PAPs, PAPd, PAPm, PAPp: presión arterial pulmonar sistólica, diastólica, media y pulsátil, respectivamente; PAD: presión auricular derecha; RPT y RVP: resistencia pulmonar total y vascular pulmonar, respectivamente († P <0,01 comparando sujetos ≤ 50 y > 50 años)46.
Límites superiores de normalidad de la hemodinamia pulmonar durante el máximo ejercicio en posición vertical
| Variable hemodinámica | ≤ 50 años | > 50 años |
|---|---|---|
| PAWP (mm Hg) | 19 | 17 |
| PAPm (mm Hg) | 30 | 33 |
| PAD (mm Hg) | 13 | 13 |
| GTP (mm Hg) | 21 | 22 |
| GDP (mm Hg) | 14 | 12 |
| RVP (unidades Wood) | 1,34 | 2,1† |
| Cp (ml/mm Hg) | 4,6 | 3,4† |
| PAPm/GC (mm Hg/L/min) | 1,95 | 2,73† |
| RPT (unidades Wood) | 2,11 | 3,16† |
Cp: capacitancia arterial pulmonar; GDP y GTP: gradiente diastólico pulmonar y transpulmonar, respectivamente; PAPm: presión arterial pulmonar media; PAPm/GC: pendiente del cociente PAPm/gasto cardíaco; PAD: presión auricular derecha; RPT y RVP: resistencia pulmonar total y vascular pulmonar, respectivamente († P < 0,01 comparando sujetos ≤ 50 y > 50 años)46.
Por último, estos LSN hemodinámicos con el ejercicio concuerdan con la nueva definición de hipertensión pulmonar relacionada con el ejercicio: PAPm > 30mm Hg y la resistencia pulmonar total > 3mm Hg.min.ml-1, que ha demostrado reducir el número de falsos positivos en el diagnóstico de hipertensión pulmonar relacionada con el ejercicio en sujetos sanos47,48.
ConclusionesEn condiciones normales, la circulación pulmonar del adulto es un sistema de baja resistencia, alta capacitancia y baja presión diseñado para favorecer el intercambio gaseoso pulmonar y disminuir el costo energético del ventrículo derecho.
La poscarga ventricular tiene dos componentes: uno estacionario y otro pulsátil. El primero está representado por la resistencia vascular periférica y la PAPm, en tanto que el segundo está relacionado con la complacencia arterial total y la PAPp y depende tanto de factores ventriculares, como de factores del árbol arterial. La rigidez de la AP constituye un factor importante para controlar la poscarga dinámica. El aumento de la rigidez de la AP proximal es un hecho temprano en el desarrollo y la progresión de la hipertensión pulmonar.
La respuesta del árbol pulmonar al ejercicio, tiene un papel cada vez más importante en el diagnóstico subclínico de la hipertensión pulmonar arterial.
FinanciaciónNinguna.
Conflicto de interesesNinguno.