La fibrilación auricular es la arritmia crónica más común en todo el mundo; se puede presentar aún en ausencia de otra enfermedad subyacente y en corazones sanos1. Con mayor frecuencia se asocia con otras enfermedades como hipertensión, valvulopatías y falla cardiaca2. Puede ser una arritmia recurrente, que se clasifica de acuerdo con su cronicidad y duración, en paroxística, la cual termina espontáneamente; persistente, que requiere cardioversión ya sea eléctrica o farmacológica para restaurar el ritmo sinusal, y permanente, en la que se considera inapropiado el intento de cardioversión por el remodelamiento tanto eléctrico como estructural3.
Aunque el estudio AFFIRM demostró que no hay beneficio clínico en el intento de mantener ritmo sinusal en pacientes con fibrilación auricular en quienes usaban antiarrítmicos y eran llevados en forma repetida a cardioversión, esta intervención se usó en ambos brazos del estudio4,5. La restauración del ritmo sinusal puede ser un objetivo terapéutico importante en pacientes jóvenes o altamente sintomáticos. Es así como la cardioversión permanece como una intervención útil, comúnmente usada en pacientes con fibrilación auricular6.
HistoriaDesde los siglos xvii y xix se empleaba la terapia eléctrica para tratar diversas arritmias y hoy se considera el tratamiento de elección para algunas de ellas. Carl et al. describieron la inducción de fibrilación ventricular al aplicar corriente galvánica en corazones de perros en 1850. Posteriormente, McWilliam documentó que la electricidad podía inducir fibrilación ventricular en un modelo canino, teoría que fuera retomada por Batelli y Prevost para demostrar que no sólo se inducía fibrilación ventricular, sino que además con la misma corriente se podía terminar la arritmia7,8. Por su parte, el Hospital John Hopkins estudió los efectos de la electricidad y sus aplicaciones y a partir de allí se desarrollaron dispositivos para administrar energía con fines médicos. Soy et al. desarrollaron en 1955 el primer desfibrilador externo de corriente alterna, y demostraron que la desfibrilación externa podía hacerse de modo seguro y eficaz9. En 1986, Alexander afirmó que el desarrollo de este método, comúnmente usado, es un brillante paradigma en el campo clínico y un profundo entendimiento de la ciencia básica, dando oportunidad a la mente preparada10.
Cardioversión eléctricaEl desarrollo de nuevos fármacos ha incrementado la popularidad de la cardioversión farmacológica, aunque persisten algunas desventajas, incluyendo el riesgo de taquicardia ventricular inducida por drogas u otras arritmias letales. La cardioversión farmacológica es menos efectiva que la eléctrica, pero esta última requiere sedación o anestesia. No hay evidencia que el riesgo de embolia o evento cerebro-vascular difiere entre ambos tipos de cardioversión, de modo que las recomendaciones de anticoagulación permanecen igual para ambos métodos6.
El uso de las terapias antiarrítmicas en fibrilación auricular requiere el entendimiento de las propiedades electrofisiológicas de la aurícula y los mecanismos de la fibrilación auricular, considerando los conceptos de remodelamiento eléctrico atrial y el papel de la capa muscular de las venas pulmonares. La teoría más aplicada en el mecanismo de la fibrilación auricular es la de Moe11, quien propone que la perpetuación de la fibrilación auricular obedece a múltiples frentes de ondas, concepto que fue desarrollado más tarde por Allesie con la teoría de los circuitos reentrantes12. De otro lado, Peng-Shen explica esta teoría en las venas torácicas, que son altamente arritmogénicas por tener en las desembocaduras fibras musculares separadas por tejido fibrótico, lo cual posee alta anisotropía13.
Las razones clínicas para restaurar y mantener el ritmo sinusal en pacientes con fibrilación auricular incluyen mejoría de los síntomas, así como prevención de taquicardiomiopatía y falla cardiaca. Existen algunas consideraciones cuando se planea la cardioversión: tiempo y porcentaje de cardioversión, duración del evento arrítmico e historia de la enfermedad estructural cardiaca.
Mecanismos de cardioversiónLos estudios han demostrado que los antiarrítmicos basan sus efectos en la prolongación de la longitud de onda de los frentes de onda fibrilantes14. Así, a medida que aumenta la longitud de onda, el número de frentes de onda disminuye y la probabilidad de terminar la fibrilación auricular aumenta. Otra teoría explica que la perpetuación de fibrilación auricular se basa en ondas en espiral que rotan a partir de un centro con menor velocidad15, como lo demostraron Kawase et al.16, utilizando pilsicainide. Aún no está claro por qué los antiarrítmicos clase IC son tan efectivos en la cardioversión de fibrilación auricular de reciente inicio, mientras fallan en la fibrilación auricular crónica, pero este hecho probablemente se explique por la remodelación atrial de la fibrilación auricular crónica.
¿En qué momento cardiovertir?Hasta la fecha se tiene como paradigma cardiovertir lo más pronto posible, pues se disminuye la probabilidad de desarrollar trombos intracavitarios y recaídas por remodelamiento eléctrico17. Según una publicación reciente de Schwartzman et al.18, existe un tiempo especial que va desde los primeros minutos de inicio hasta 24 a 48 horas en que se producen una serie de cambios electrofisiológicos intracelulares que se caracterizan por una sobrecarga inicial de calcio intracelular, dando así vía libre para el “remodelamiento eléctrico atrial” en la fibrilación auricular. Esta sobrecarga de calcio acorta el potencial de acción, a pesar del intento de la célula por disminuir la sobrecarga cálcica y así el automatismo, que está aumentado19. Durante las primeras horas de fibrilación auricular no ocurren cambios regulatorios y las células se hallan “calientes”, para responder normalmente a la liberación de calcio intracelular con el consecuente automatismo anormal, y producir ectopias desde las venas pulmonares20.
Después del surgimiento del remodelamiento atrial, el potencial de acción acortado reduce la sobrecarga de calcio y la expresión sarcolémica de canales iónicos, disminuyendo así la excitabilidad celular y la respuesta a la liberación de calcio con una subsecuente mengua del automatismo. Aunque seductora, esta hipótesis basada en la observación de portadores de dispositivos de cardioversión automática de fibrilación auricular, requiere verificaciones mediante trabajos con otro tipo de pacientes en condiciones clínicas comunes, antes de adoptarse como medida general para todo aquel con fibrilación auricular.
Mecanismo de la cardioversión eléctricaLa cardioversión eléctrica libera una carga de energía sincronizada con la actividad intrínseca del corazón, mediante la detección de la onda R del electrocardiograma, para administrar la energía durante la sístole, evitando el período vulnerable del ciclo cardíaco, que va desde 60 a 80ms antes de la cúspide de la onda T, hasta 20-30ms después21.
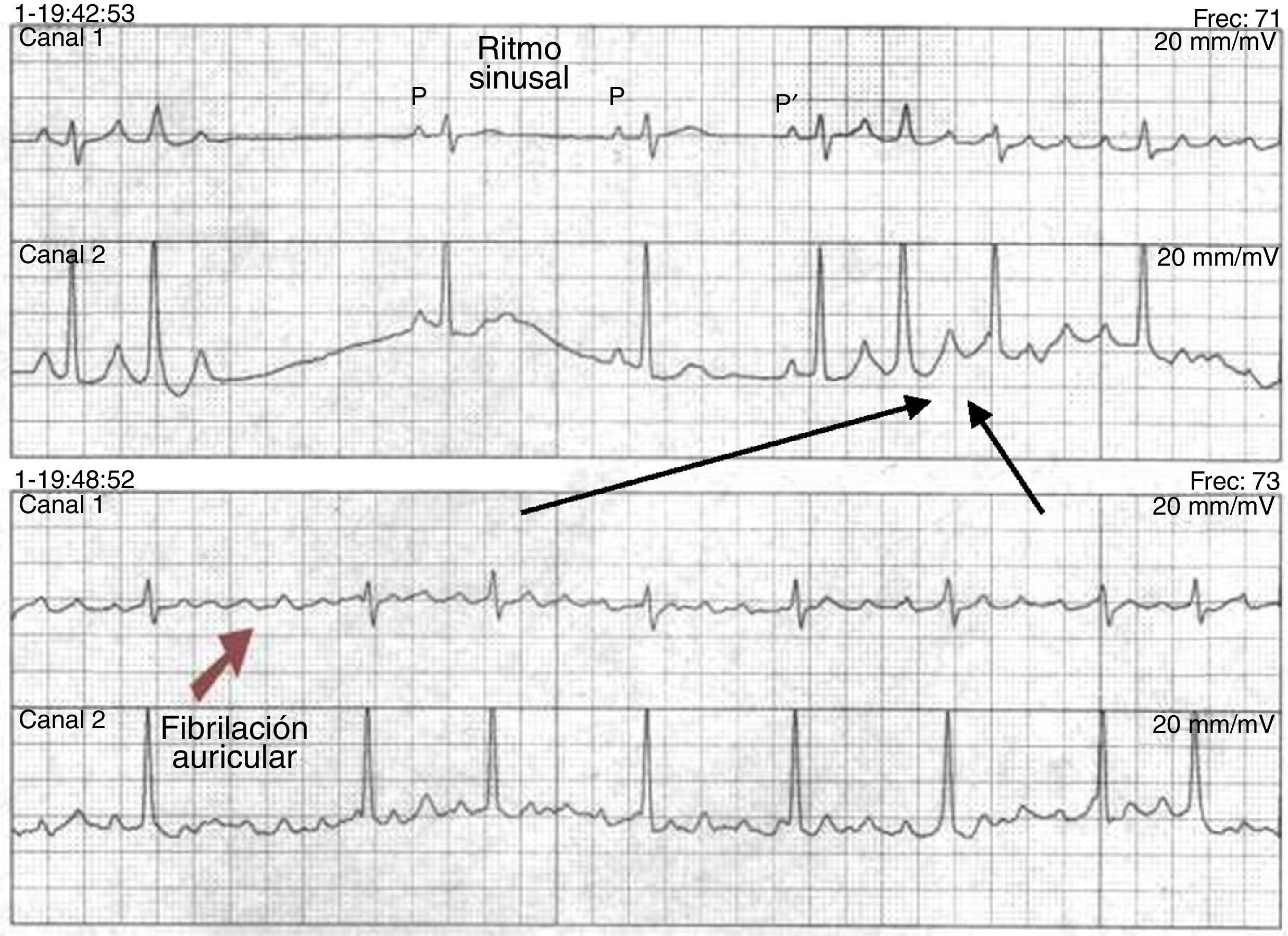
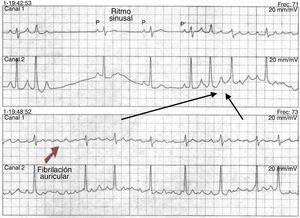
La cardioversión eléctrica termina un ritmo anormal, excepto la fibrilación ventricular, administrando una cantidad de energía sincronizada y despolarizando todo el tejido involucrado en un circuito reentrante, que lo hace refractario e incapaz de mantener o propagar la reentrada. Existen dos teorías para explicar los mecanismos responsables de la terminación de la arritmia mediante cardioversión22; la primera se conoce como “hipótesis de la masa crítica”, que explica que un nivel alto de energía puede terminar la actividad fibrilatoria por completo, debido a que esta es sostenida por una cantidad de miocardio y termina cuando todo éste es completamente despolarizado. La segunda es la teoría del “límite superior de vulnerabilidad”, que afirma que la magnitud del choque debe ser mayor que el choque que reinicia la arritmia. Los choques no exitosos son ligeramente más débiles de lo necesario para desfibrilar23. Estos choques menores terminan la actividad fibrilatoria en el frente de onda durante la fibrilación, pero estimulan otras regiones del miocardio en su fase vulnerable, reiniciando y dando lugar a nuevos frentes de onda que reinician la fibrilación24 (fig. 1). Cambios similares ocurren en el umbral de desfibrilación con variables en la polaridad de los electrodos y la duración de la onda25.
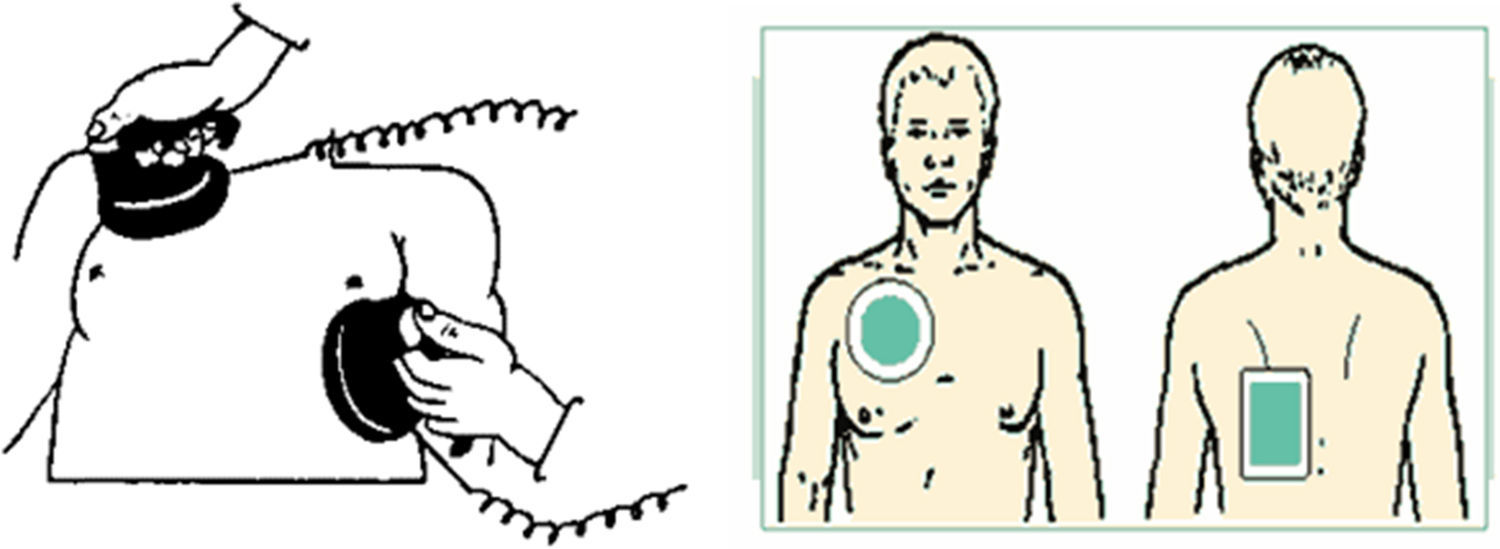
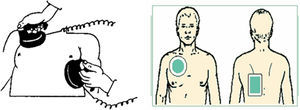
Cardioversión transtorácicaDesde las primeras descripciones en 1962, este método se ha convertido en el estándar para terminar la fibrilación auricular. Se ha descrito como seguro y eficaz, y se han optimizado las estrategias para incrementar el éxito de la cardioversión en cuanto a formas de onda de energía. El éxito depende de la enfermedad cardiaca de base, la cantidad de energía suministrada, la edad y el sexo. La densidad de corriente que llega efectivamente al miocardio es inversamente proporcional a la impedancia de los tejidos que se interponen entre el músculo cardiaco y los electrodos, y depende también del tamaño y la posición de los electrodos, el voltaje de los capacitores y la forma de onda de la energía (fig. 2).
La posición de los electrodos sobre la pared torácica es determinante para lograr una cardioversión efectiva. Es mayor en posición anteroposterior con una probabilidad de 87 contra 76%. La impedancia torácica depende del tamaño y la composición de los electrodos, del contacto entre estos y la piel, del gel usado para disminuir la impedancia, de la distancia entre los electrodos, de la superficie corporal, de la fase del ciclo respiratorio (al suministrar la descarga hacia el final de la expiración se aprovecha la menor cantidad de tejido pulmonar entre reja costal y corazón), del número de cargas administradas y del tiempo entre descargas26.
La impregnación de los electrodos con gel de electrolitos reduce la resistencia. Así mismo, un mayor tamaño de electrodos se traduce en menor impedancia, pero con palas muy grandes la cantidad de energía que llega al corazón es menor. De otra parte, palas muy pequeñas pueden producir lesión por una gran cantidad de energía que llega al miocardio. El tamaño óptimo de las palas para cardioversión es de 8 a 12cm como lo recomiendan Dalzell et al.27
La probabilidad del éxito de cardioversión eléctrica disminuye con una alta impedancia y baja energía, pero esto se mejora con la medición de la impedancia en un choque corto al inicio del procedimiento28. De otro lado, el uso de desfibriladores de onda bifásica incrementa la probabilidad de cardioversión sobre los antiguos monofásicos. La bifásica cardiovirtió el 94 vs. el 79% en quienes se usó la monofásica. Así mismo, los pacientes en el grupo de desfibriladores bifásicos requirieron menor cantidad de energía, mientras que no hubo diferencias significativas en cuanto al éxito de la cardioversión con el uso de onda bifásica exponencial o rectilínea. La posición anteroposterior de las paletas fue superior a la posición antero-anterior; sin embargo, esto es más cierto cuando el fenómeno arrítmico compromete ambas aurículas, pues en esta posición se abarcan las dos aurículas y existe mayor separación entre ambos electrodos con más cantidad de tejido pulmonar entre corazón y pared torácica, lo cual se puede disminuir al posicionar el electrodo anterior hacia la izquierda del esternón29. En las mujeres se debe evitar posicionar sobre el tejido mamario.
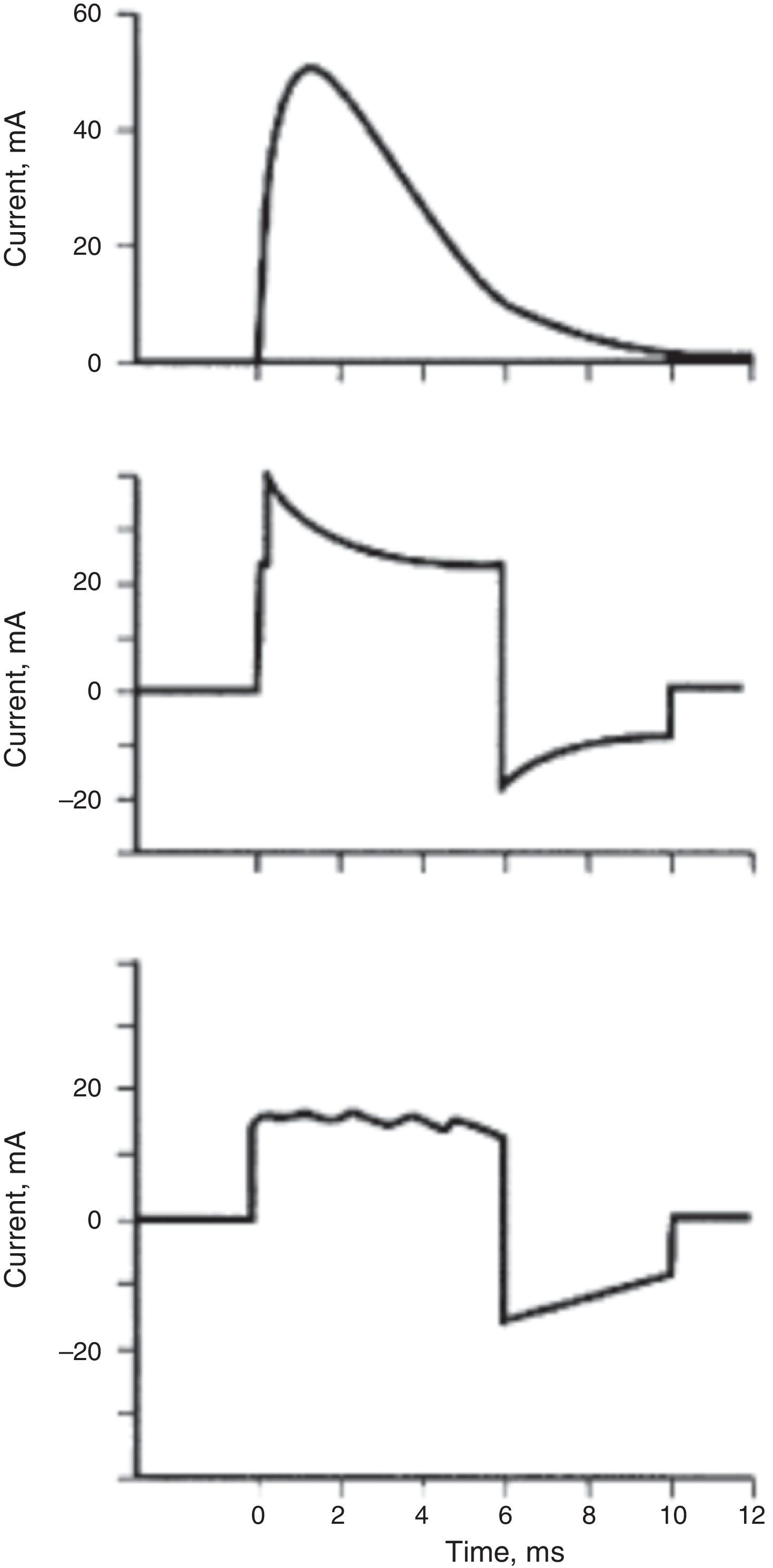
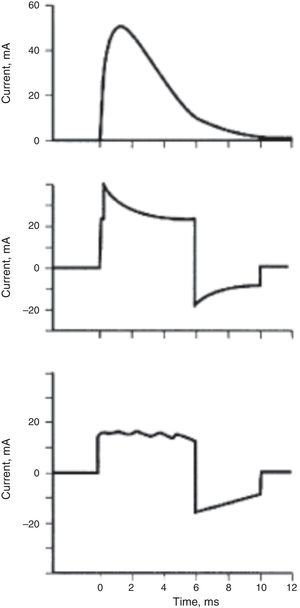
Cantidad de energía y modo de administraciónPara sincronizar la descarga con el QRS y monitorizar al paciente, se requieren unas buenas paletas que muestren con claridad las ondas P y R. Se prefiere comenzar con una descarga de mayor energía; si es monofásica con 200 Joules (J) o si es bifásica con 100J. Algunos autores recomiendan 25J para cardiovertir flutter atrial. La cantidad de energía va incrementándose hasta un máximo de 360J. Sin embargo, otros recomiendan el uso de dosis de energía iniciales mayores para reducir el número total de choques y por consiguiente la dosis total de energía liberada. El tiempo entre dos descargas no debe ser inferior a un minuto; estas estrategias reducen el riesgo de lesión miocárdica30. Los monofásicos administran la totalidad de la energía en una sola polaridad, la cual viaja en dirección única, en forma sinusoidal. Los bifásicos tienen la capacidad de reversar la corriente en determinado momento del choque, con lo cual se logra disminuir el umbral de desfibrilación al crear más refractariedad postchoque en un mayor porcentaje de miocitos que el monofásico (fig. 3). Reducen los requerimientos de energía en al menos un 25 a 45%. Los desfibriladores bifásicos ajustan la cantidad de energía liberada de acuerdo con la impedancia transtorácica31,32.
Diferentes formas de onda para desfibrilación. Arriba: onda monofásica tradicional; Medio: onda bifásica exponencial truncada ajustada a la corriente de acuerdo con la impedancia transtorácica, la que sucede por variación en la duración del pulso durante la primera fase. Abajo: la onda bifásica mantiene una corriente constante durante la primera fase, ajustada de acuerdo con las diferencias en la impedancia de la pared torácica. Tomada de: Takata TS, Page RL, Joglar JA: automated external defibrillatiors technical considerations and clinical promise. Annals of Intern Med. 2001; 135(11):990-8.
Ricard et al. demostraron que para la fibrilación auricular de menos de 24 horas de duración, fueron suficientes 200J o menos de energía para cardiovertir el 98% de los pacientes33. Si la duración de la fibrilación auricular era superior, se requerían mayores cargas de energía (mayor de 48 horas, 14% con 100J; 39% con 200J; 95% con 300J); cuando usaron los monofásicos, iniciaron con dosis menores de energía y requirieron mayores dosis totales para lograr una cardioversión eléctrica exitosa. No se evidenciaron efectos adversos con dosis mayores de energía en una carga inicial mayor.
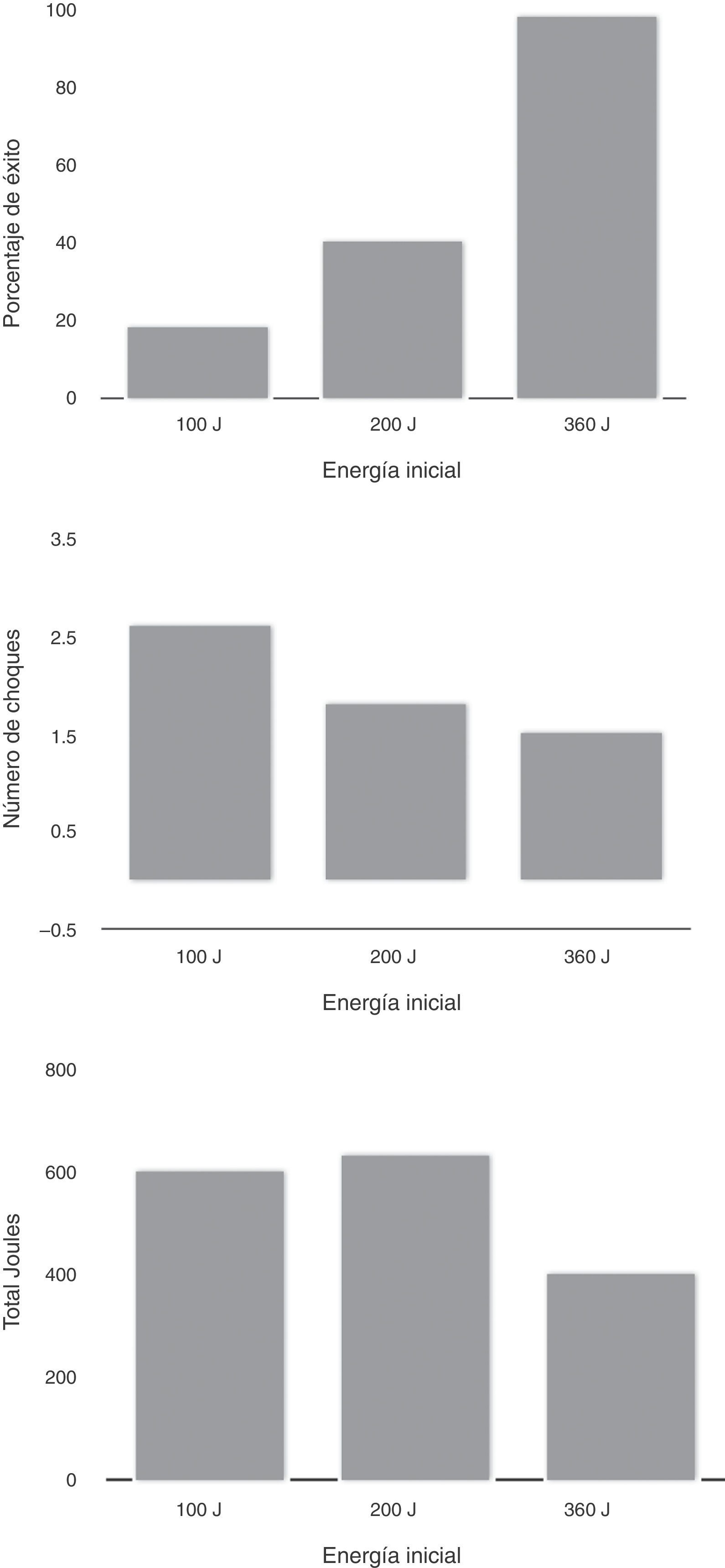
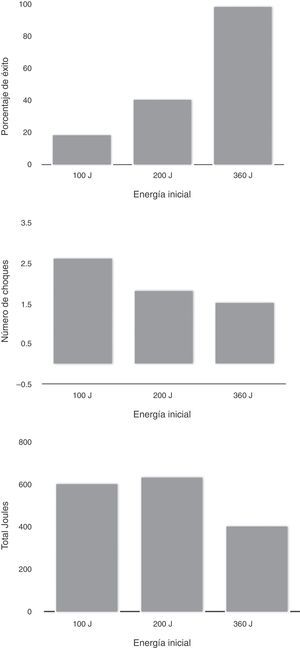
El uso de ondas bifásicas no solo incrementa la probabilidad de cardioversión exitosa, sino que minimiza la cantidad de energía, en particular los bifásicos exponenciales. Un aspecto importante de este tipo de onda es que compensa la impedancia de la pared torácica por mantener una constante de energía durante la primera fase de desfibrilación. Al comparar onda bifásica vs. monofásica, Mittal et al.26, observaron que los pacientes recibieron 5 choques: 100, 150, 200, y 200J de onda bifásica o 360J de onda monofásica, y finalmente en forma cruzada al máximo nivel de la onda alterna. En los tres primeros niveles de energía la onda bifásica fue muy superior a la monofásica (60% vs. 22% a 100J, 77% vs. 44% a 150J, y 90% vs. 53 a 200J). Los pacientes sometidos a onda bifásica recibieron menor número de choques y la lesión dérmica fue menor (fig. 4).
Al analizar la cardioversión electiva usando desfibriladores monofásicos, comparados con 100 o 200J, el mayor nivel (360J) se tradujo en mayor porcentaje de éxito (A), menor número de choques (B) y menor energía total (C). p>0,0001; p=0,05. Modificada de: Mittal S, Ayati S, et al. Transthoracic cardioversion of atrial fibrillation. Comparison of rectilinear biphasic versus damped sane wave monophasic shocks. Circulation. 2000;101:1282-7.
Se recomienda que los pacientes con fibrilación auricular persistente se cardioviertan iniciando con una descarga de 200J en onda bifásica. En fibrilación auricular de menos de 24 horas de duración se puede iniciar con 100J. Si se cuenta con un desfibrilador monofásico, la recomendación es iniciar con alta energía (300 a 360J).
La cardioversión eléctrica se realiza bajo sedación o anestesia general para evitar el dolor relacionado con el choque; se prefieren medicaciones de corta acción que producen sedación. Cuando la recuperación es temprana y hay adecuada anticoagulación previa, el paciente puede ser dado de alta en pocas horas34 (tabla 1).
Pretratamiento en cardioversión de pacientes con fibrilación auricular persistente: Efectividad de varios antiarrítmicos
| Eficacia | Conversión y prevención de RIFA | Supresión RSFA y mantenimiento | Recomendación | Evidencia |
|---|---|---|---|---|
| PROBADA | Amiodarona | Todas en recomendación I (excepto ibutilide)+BB | I | B |
| Flecainida | ||||
| Ibutilide | ||||
| Propafenona | ||||
| Quinidina | ||||
| Sotalol | Sotalol | |||
| Ranolazina | ||||
| INCIERTA | Betabloqueadores | Diltiazem | IIb | C |
| Diltiazem | Dofetilide | |||
| Disopiramida | Verapamilo | |||
| Dofetilide | ||||
| Procainamida | ||||
| Verapamilo |
RIFA: recaída inmediata de fibrilación auricular, RSFA: recaída subaguda, BB: beta-bloqueador. Todas excepto la amiodarona y los BB se deben iniciar dentro del hospital.
De acuerdo con lo que se defina como éxito en la cardioversión eléctrica, este puede ser cercano al 70% y dependerá del tiempo que sostenga el paciente en ritmo sinusal y de la enfermedad de base. Un análisis multivariado muestra como predictores de éxito: duración menor de un año, diámetro auricular menor de 6cm, fracción de eyección del ventrículo izquierdo superior a 40%, edad menor de 65 años, presencia de flutter atrial; mientras predicen fracaso de la cardioversión la presencia de crecimiento atrial, enfermedad cardiaca estructural de base y cardiomegalia. Cerca del 86% de los pacientes cardiovertidos permanece en ritmo sinusal por tres días, cifra que se incrementa hasta un 94% cuando se repite el procedimiento con antiarrítmicos como quinidina o disopiramida después de un intento fallido inicial. Solo 23% de los casos permanece en ritmo sinusal después de un año y 16% después de dos años. En quienes se reportan recaídas, un nuevo intento bajo efecto farmacológico resulta en ritmo sinusal en 40% y 33% al año y dos años respectivamente. Para aquellos que recaen nuevamente, en un tercer intento mantienen el ritmo sinusal un 54% al año y 41% a los dos años35.
En algunos casos se pueden utilizar otras alternativas que incluyen modificación en la posición de los electrodos y uso simultáneo de dos cardiodesfibriladores (en sujetos muy obesos) manipulados simultáneamente por el mismo operador y con electrodos adheribles a la piel, para administrar cargas hasta de 720J.
RecurrenciaSe define como la recaída en ritmo de fibrilación auricular posterior a la cardioversión después de haber logrado al menos dos latidos sinusales; se dice que es temprana cuando ocurre dentro de pocas horas a días posteriores a la consecución del ritmo sinusal, con una incidencia de 12 a 16% mediante cardioversión externa o interna. Los mecanismos que la explican serían despolarizaciones prematuras tempranas con intervalo de acoplamiento corto o estímulos desde las venas pulmonares más que una simple despolarización prematura aislada. La recurrencia temprana es la mayor causa de fallo y puede prevenirse con la administración de una carga mayor de energía o con la combinación de agentes antiarrítmicos. La cura definitiva es el aislamiento de las venas pulmonares. Se define como recaída inmediata cuando ocurre en los siguientes minutos postcardioversión eléctrica36.
Cardioversión en situaciones especialesEmbarazoEn los casos de mujeres embarazadas que tengan indicación de cardioversión eléctrica puede ajustarse la dosis de la energía de acuerdo con el peso de la paciente (entre 5-10J/kg de peso). La posición de los electrodos y las demás medidas técnicas no requieren modificaciones especiales, por un lado, porque los dispositivos actuales, con las dosis de energía recomendada y con la posición de los electrodos no permiten una dispersión mayor de la energía fuera de la caja torácica, y por otro, porque dados los períodos refractarios extremadamente bajos del corazón fetal, este tiene poca vulnerabilidad a la energía externa y un alto umbral de inducibilidad de fibrilación ventricular37.
NiñosLa principal recomendación además de la dosis de energía ajustada al peso, es el uso de palas de menor tamaño, en promedio 4-8cm2.
ComplicacionesLas más frecuentes asociadas a la administración de energía externa son: embolia (incidencia de 1–7%) y fenómenos proarrítmicos o manifestaciones de disfunción sinusal como ectopias, bradicardia, arresto, taquicardica ventricular y fibrilación ventricular.
Lesión miocárdicaEn un estudio descriptivo en el que se usaron 400J en promedio (50-1.280) no se observaron elevaciones en los niveles de troponina T, troponina I, CK-MB en relación con la energía administrada, a pesar de una discreta elevación del segmento ST. Existe un margen amplio entre la dosis efectiva y la dosis asociada a daño miocárdico. A partir de esta dosis y en forma acumulativa se puede evidenciar lesión miocárdica debido a elevación enzimática38.
Lesión dérmicaEste daño se describe y atribuye a quemadura de primer grado infringida por las paletas y se asocia con una distribución de gel no uniforme o cantidad escasa del mismo. Sin embargo, estudios de biopsias de piel de quemaduras en estas circunstancias, revelaron un contenido mayor de eosinófilos y neutrófilos en pacientes que sufrieron quemaduras, en relación con los no quemados. Así, entonces, se considera una reacción de hipersensibilidad a la corriente como mecanismo de la quemadura asociada a cardioversión eléctrica. Este fenómeno es menos evidente con el uso de desfibriladores bifásicos39.
Recomendaciones de cardioversión eléctricaClase I- 1.
Se recomienda la cardioversión eléctrica directa, sincronizada, cuando la respuesta ventricular rápida no responde en forma oportuna a medidas farmacológicas en pacientes con isquemia miocárdica en curso, hipotensión sintomática, angina o falla cardiaca (nivel de evidencia C).
- 2.
La cardioversión eléctrica inmediata está indicada en el curso de fibrilación atrial con preexcitación y que cursa con respuesta ventricular muy rápida o con inestabilidad hemodinámica (nivel de evidencia B).
- 3.
La cardioversión eléctrica está recomendada en pacientes sin inestabilidad hemodinámica, cuando los síntomas de fibrilación atrial no son aceptados por el paciente. En caso de recaída temprana de fibrilación auricular después de cardioversión, puede repetirse un intento de cardioversión seguido de la administración de antiarrítmicos (nivel de evidencia C).
- 1.
La cardioversión eléctrica directa puede ser útil para restaurar el ritmo sinusal como parte de una estrategia de manejo a largo plazo en pacientes con fibrilación auricular (nivel de evidencia B).
- 2.
Las preferencias del paciente son una consideración razonable en la selección de cardioversiones repetidas (infrecuente) para el manejo de fibrilación auricular sintomática o recurrente (nivel de evidencia C).
- 1.
No se recomiendan repeticiones frecuentes de cardioversión eléctrica directa en quienes tienen periodos relativamente cortos de ritmo sinusal entre recaídas de fibrilación auricular después de múltiples cardioversiones, a pesar de terapia antiarrítmica profiláctica (nivel de evidencia C).
- 2.
La cardioversión está contraindicada en pacientes con toxicidad digitálica o hipokalemia (nivel de evidencia C).
En un intento por incrementar el éxito de la cardioversión eléctrica en aquellos pacientes con episodios más prolongados de fibrilación auricular o en quienes han fallado intentos previos de cardioversión eléctrica, se administran antiarrítmicos que hacen más probable la consecución de ritmo sinusal. Se han usado amiodarona y propafenona en conjunto con betabloqueadores. Se discute el beneficio de los IECA, los ARA II, los moduladores de las uniones GAP, las estatinas y el aceite de pescado como medicamentos coadyuvantes en el manejo de la fibrilación auricular y como facilitadores de cardioversión40.41. El Ibutilide es más efectivo cuando se administra como pretratamiento de cardioversión eléctrica; en un estudio que lo utilizó previo a la cardioversión, el grupo pretratado se cardiovirtió en un 100% contra 72% del grupo no premedicado. El grupo restante de los no cardiovertidos inicialmente se convirtió de manera satisfactoria a ritmo sinusal cuando la cardioversión eléctrica fue repetida bajo efecto de ibutilide42. Reportes recientes estimulan el uso de ranolazina, un medicamento antianginoso, para la prevención de recaídas tempranas posteriores a la cardioversión eléctrica43. El sotalol por su efecto sobre el potencial de acción al bloquear el componente rápido de los canales de potasio, corrige las prolongaciones del QT, consecuencia de la remodelación eléctrica, reduciendo la probabilidad de arritmias postcardioversión al disminuir el periodo vulnerable del ciclo cardíaco44.
Recomendaciones de pretratamientoClase IIa- 1.
El pretratamiento con amiodarona, flecainida, ibutilide, propafenona o sotalol puede ser utilizado para incrementar el éxito de conversión a sinusal en cardioversión eléctrica y prevenir la recaída (nivel de evidencia B).
- 2.
En pacientes con recaída de fibrilación auricular posterior a cardioversión farmacológica exitosa, puede usarse medicación antiarrítmica previa a un nuevo intento de cardioversión (nivel de evidencia C).
- 1.
Para pacientes con fibrilación auricular persistente, puede considerarse la administración de beta-bloqueadores, disopiramida, diltiazem, dofetilide, procainamida o verapamilo, aunque la eficacia de estos medicamentos para prevenir la recaída de fibrilación auricular postcardioversión eléctrica es incierta (nivel de evidencia C).
- 2.
La administración extrahospitalaria de antiarrítmicos para incrementar el éxito de la cardioversión eléctrica, puede ser considerada en pacientes sin enfermedad cardiaca estructural (nivel de evidencia C).
- 3.
La administración extrahospitalaria de antiarrítmicos para incrementar el éxito de la cardioversión eléctrica, puede ser considerada en pacientes con algunas formas de enfermedad cardiaca, una vez el medicamento ha sido utilizado con seguridad ellos (nivel de evidencia C).
Los autores declaran no tener ningún conflicto de intereses.