La cardiomiopatía periparto es una causa poco común de la insuficiencia cardiaca aguda por la disfunción sistólica ventricular izquierda en las mujeres que se encuentran en el tercer trimestre del embarazo o durante los meses siguientes al puerperio. Se expone el caso de una paciente de 37 años de edad primigestante con fertilización in vitro que ingresa con cuadro clínico de preeclampsia severa y estado fetal insatisfactorio, llevada a cesárea de emergencia, presentando posteriormente clínica de insuficiencia cardiaca aguda caliente-húmeda. Se presenta una revisión de la literatura de esta patología con el diagnóstico, las manifestaciones clínicas, el tratamiento y el pronóstico.
Peripartum cardiomyopathy is a rare cause for acute heart failure caused by left ventricular systolic dysfunction in women in their third trimester of pregnancy or during the months of the postpartum period. The case of a 37 year-old primiparous patient with in vitro fertilisation is presented; she was admitted with symptoms of severe preeclampsia and fetal distress, hence she was taken for emergency c-section, later showing symptoms of hot-humid acute heart failure. A literature review of this condition with the diagnosis, clinical manifestations, treatment and prognosis is presented.
Paciente femenina de 37 años de edad, sin antecedentes de importancia, primigestante, con embarazo de 34 semanas por fertilización in vitro. Fue remitida a urgencias de consulta externa por doppler fetoplacentario sugestivo de insuficiencia placentaria y restricción del crecimiento intrauterino. Al ingreso con epigastralgia y cifras tensionales de 149/91 mmHg; por lo que se le diagnosticó preeclampsia severa y estado fetal insatisfactorio. Fue llevada a cesárea de emergencia y presentó hemorragia postparto, requiriendo transfusión de dos unidades de glóbulos rojos y ácido tranexámico con adecuada respuesta y rendimiento.
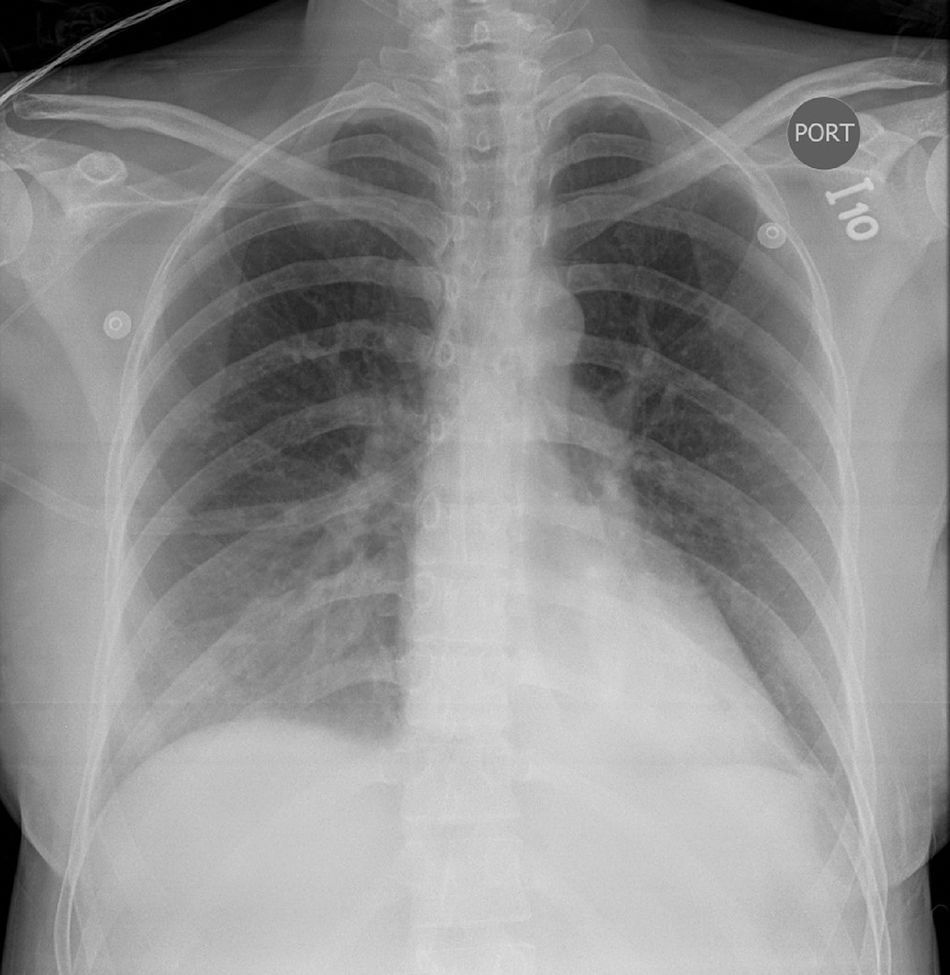
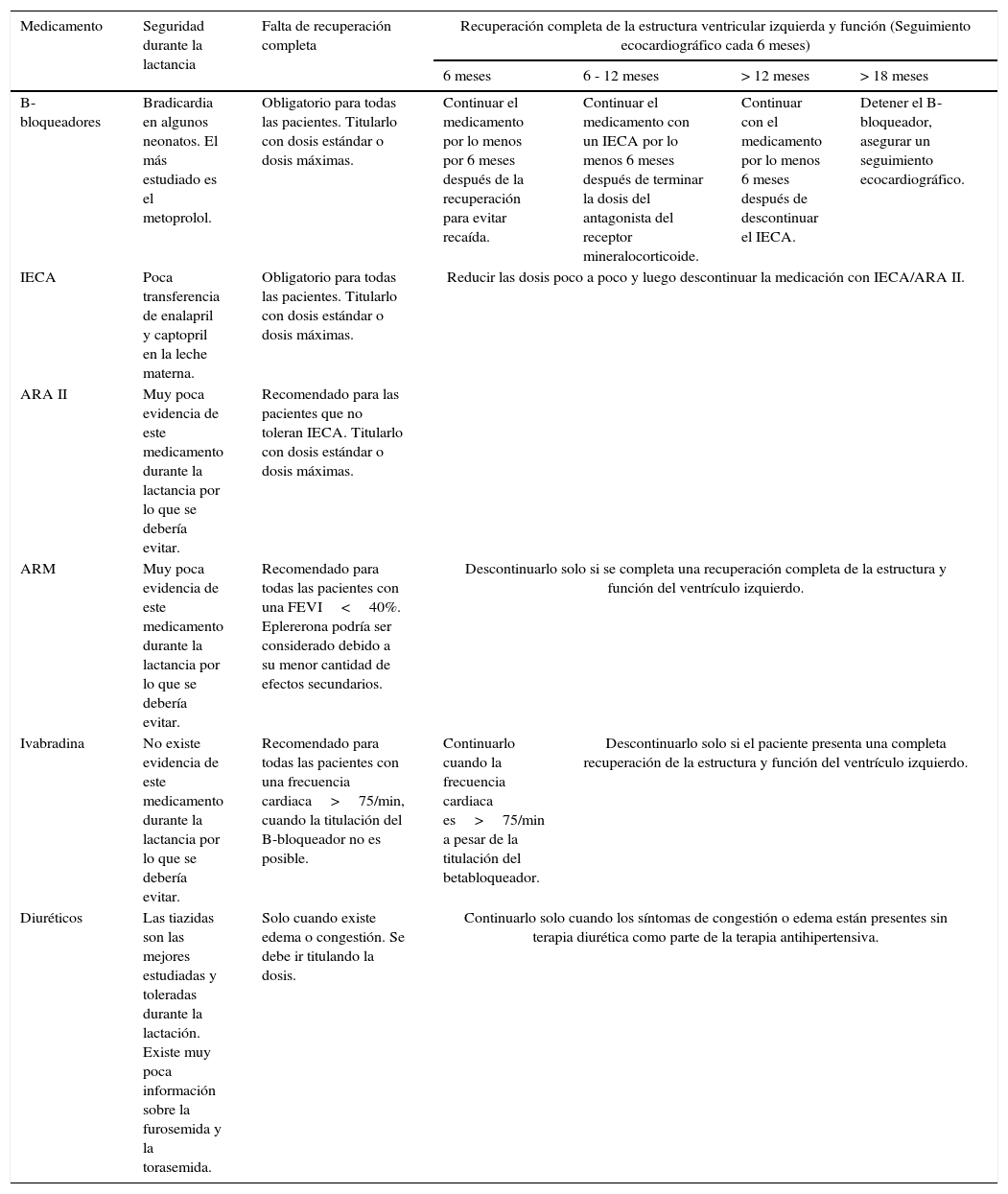
Durante el postoperatorio inmediato se inició manejo con el labetalol por persistencia de síntomas de vasoespasmo dados por el aumento del dolor en el epigastrio, la cefalea, la hiperreflexia y la elevación de las cifras tensionales. La paciente presentó deterioro del estado general, con tensión arterial de 153/81mmHg, taquicardia 119 latidos por minuto, taquipnea 22 respiraciones por minuto, temperatura de 36,2 grados centígrados y desaturación hasta el 66% en la pulsoximetría con oxígeno al medio ambiente. Al examen físico se detectó: ingurgitación yugular, estertores finos en ambos campos pulmonares y ritmo de galope por presencia del tercer ruido cardiaco en la auscultación. En el examen abdominal, presentó dolor generalizado sin signos de irritación peritoneal y edema con fóvea grado II en extremidades inferiores. Los gases arteriales mostraron: acidosis metabólica, hiperlactatemia e hipoxemia severa. La radiografía del tórax mostró opacidades intersticiales en ambas bases pulmonares con derrame pleural, sugestivos de edema pulmonar (fig. 1). La paciente se trasladó a la unidad de cuidados intensivos para iniciar soporte con la ventilación mecánica no invasiva, la nitroglicerina a 0,25 mcg/kg/minuto y la furosemida endovenosa.
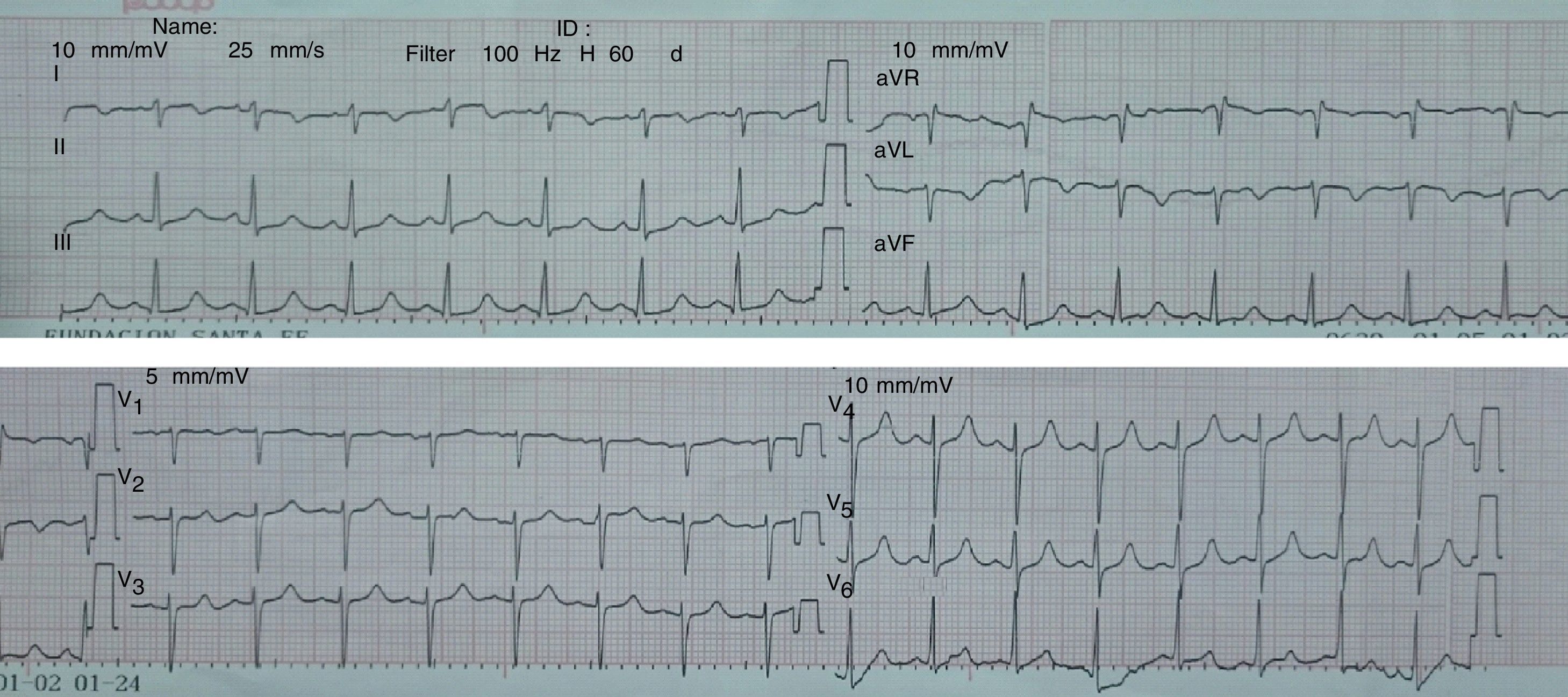
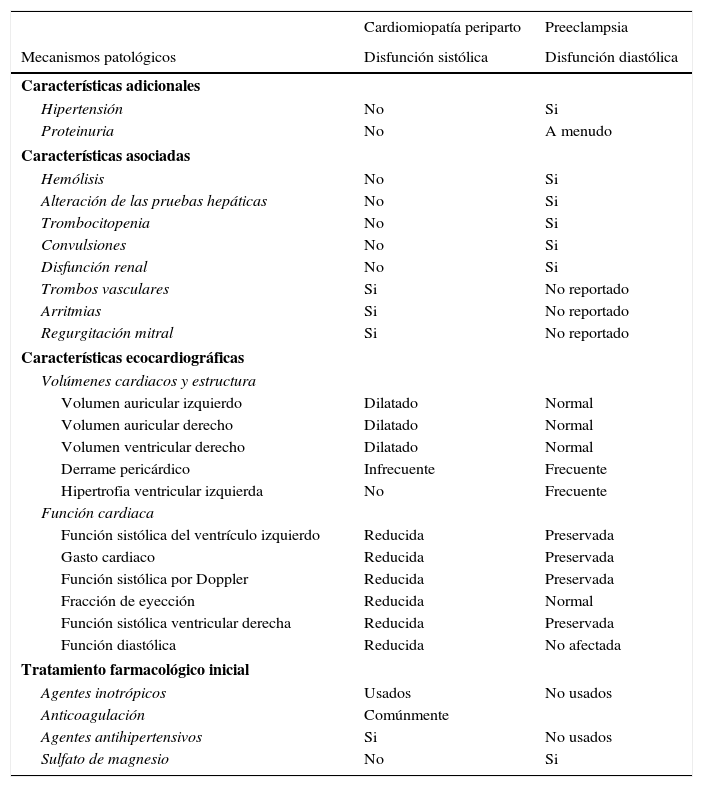
Los paraclínicos evidenciaron taquicardia sinusal en el electrocardiograma (fig. 2), aumento progresivo de las transaminasas, bilirrubinas y deshidrogenasa láctica en química sanguínea, además, leve prolongación de las pruebas de coagulación y el deterioro de la función renal. Los electrolitos y el hemograma sin cambios respecto a valores previos.
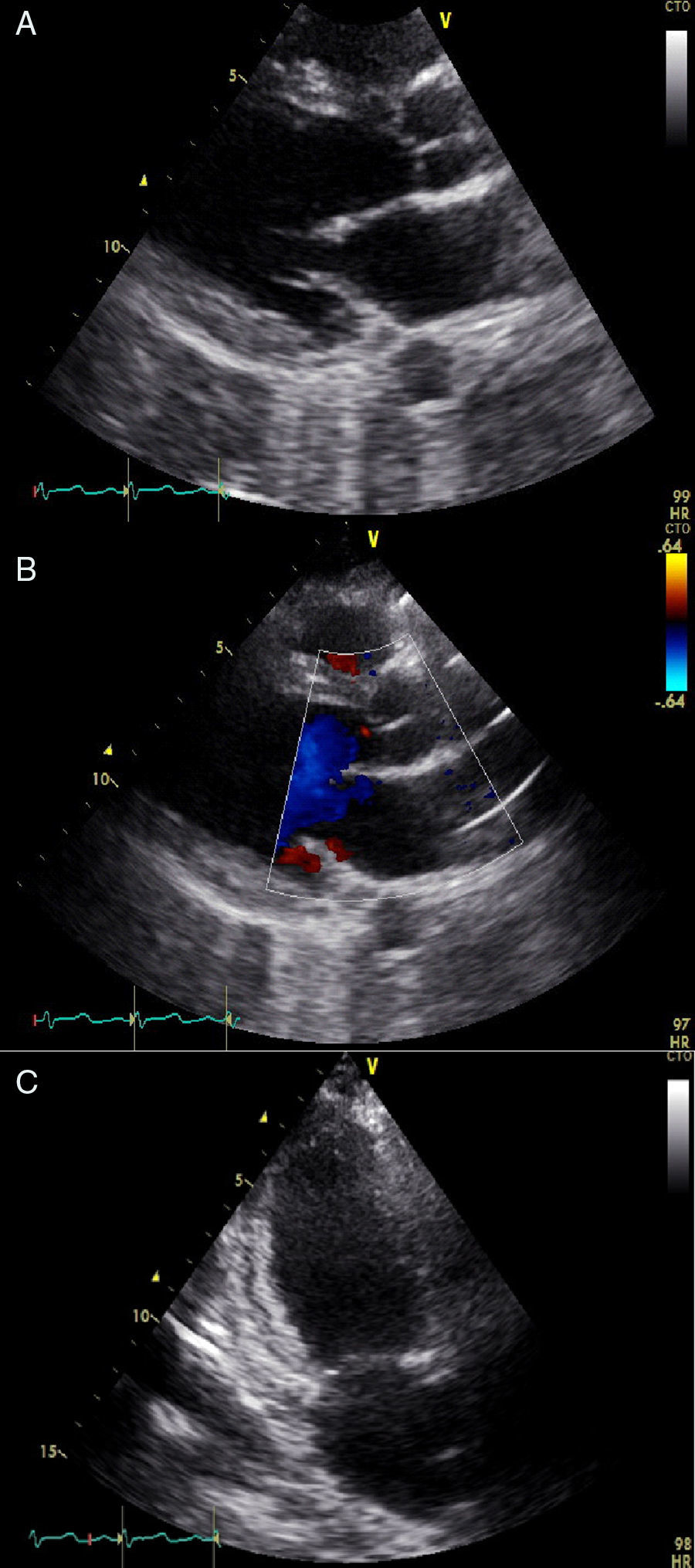
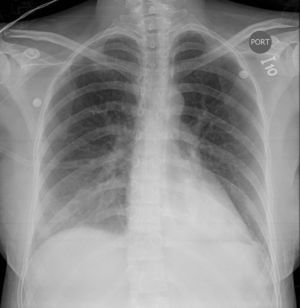
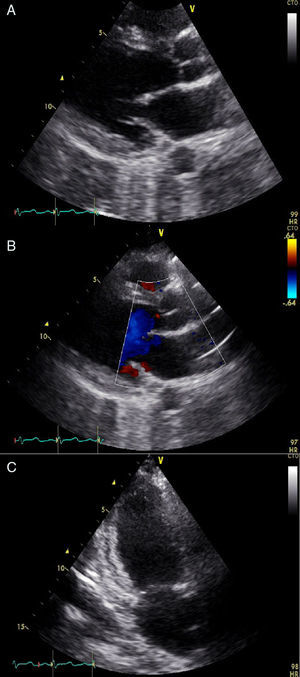
El ecocardiograma transtorácico mostró disfunción moderada del ventrículo izquierdo con una fracción de eyección del 38% e hipoquinesia generalizada. Junto con las manifestaciones clínicas de la paciente se sospecha cardiomiopatía periparto en el contexto de preeclampsia severa y síndrome HELLP (fig. 3). Se ajustó el tratamiento de la falla cardiaca, y se continuó vigilancia en la unidad de cuidados intensivos. La paciente evolucionó satisfactoriamente y es dada de alta a los 3 días.
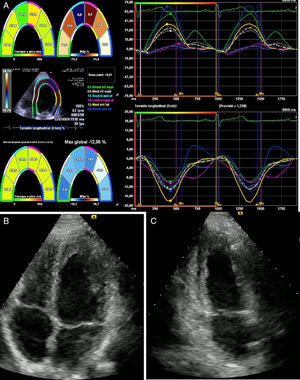
Ecocardiograma transtorácico. A: Eje largo horizontal. B: Doppler color. C: Apical dos cámaras. En las tres figuras se observa una alteración generalizada de la contractilidad, especialmente, en la pared lateral, con alteración en la capacidad de deformación longitudinal de la fibra miocárdica (Strain longitudinal global: -8,4%), con disfunción moderada del ventrículo izquierdo con una fracción de eyección del 38%.
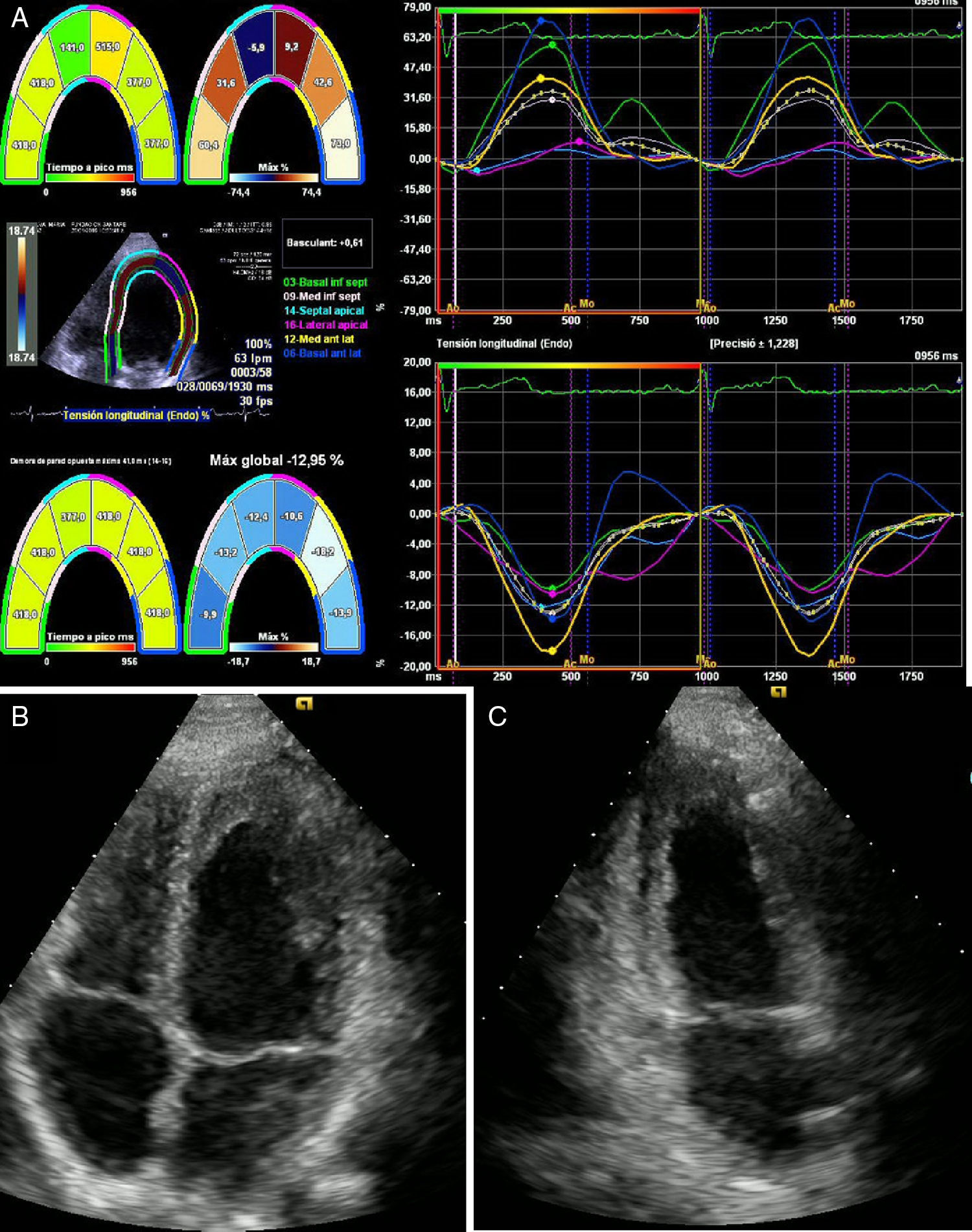
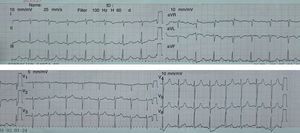
Un mes después asistió a consulta externa con resultado de ecocardiograma que evidenciaba función sisyodiastólica biventricular dentro de límites normales y fracción de eyección del ventrículo izquierdo conservada del 62% (fig. 4).
DiscusiónLa cardiomiopatía periparto es una patología que se puede presentar durante el último trimestre del embarazo o en los meses siguientes al parto, la cual ha cobrado importancia en los últimos años dada su gran morbimortalidad y aumento del costo en la salud1. Esta patología se caracteriza por disfunción ventricular izquierda con fracción de eyección menor del 45% y síntomas de falla cardiaca en las pacientes previamente sanas. Se estima que su incidencia oscila entre 1:2289 a 1:2229 nacidos vivos en Estados Unidos, 1:1000 en Sudáfrica, 1:300 en Haití y 1:100 en Zaira, sin encontrar estadísticas en Latinoamérica y Colombia2.
Aún no se tiene claridad en los procesos fisiopatológicos que se encuentran asociados con la aparición de esta patología pero algunos autores han descrito el imbalance angiogénico, la liberación de mediadores inflamatorios, la alteración de la respuesta inmune, el aumento del estrés oxidativo, la producción de prolactina y el factor de crecimiento endotelial como posibles causas3–5. Al igual que algunos factores de riesgo como: antecedente familiar, edad mayor de 30 años, ascendencia africana, embarazo múltiple, historia de preeclampsia y eclampsia, hipertensión postparto, abuso de cocaína y terapia tocolítica mayor a 4 semanas con betaagonistas adrenérgicos6,7.
La presentación clínica puede variar dependiendo de las características de la paciente pero ante la sospecha, se deben buscar signos de falla cardiaca congestiva dados por: disnea progresiva asociada a tos, ortopnea, disnea paroxística nocturna, edema en miembros inferiores y en algunos casos hemoptisis. En la gran mayoría de las pacientes el diagnóstico es difícil debido a que la disnea y el edema podrían presentarse como cambios fisiológicos en el curso de una gestación normal. Al examen físico se encuentran signos de aumento de la presión venosa yugular, con impulso apical desplazado, estertores, ritmo de galope por tercer ruido y en algunos casos soplo de insuficiencia mitral. No obstante, estos varían en su presentación dependiendo de las comorbilidades y la severidad del cuadro8.
El diagnóstico suele ser de exclusión, por lo que se debe hacer un enfoque diagnóstico en busca de descartar las causas pulmonares y cardiovasculares de la disnea y la hipoxemia en el periparto y el puerperio (tablas 2 y 3). El cumplimiento de los criterios clínicos se debe complementar con estudios adicionales como un electrocardiograma, en busca de los cambios inespecíficos del segmento ST y la onda T o complicaciones dadas por la isquemia o las arritmias. De igual manera, se debe realizar una radiografía del tórax para evaluar los signos radiológicos de la falla cardiaca o el edema pulmonar3.
Existen otros estudios más específicos que están indicados ante la sospecha como: el ecocardiograma transtorácico, el cual permite evaluar la estructura y función cardiaca; BNP o NT-proBNP los cuales se deben encontrar elevados en presencia de la cardiomiopatía. Otros estudios menos utilizados como la resonancia nuclear magnética del corazón, la angiografía coronaria y la biopsia endomiocárdica, pueden estar indicados en casos de complicaciones isquémicas o duda diagnóstica8.
El manejo de la cardiomiopatía periparto es similar al tratamiento convencional de la falla cardiaca aguda. Se deben tener en cuenta algunas consideraciones adicionales dependiendo las condiciones clínicas de la paciente. Las metas en el manejo son: mejorar la hipoxemia, el patrón hemodinámico, los síntomas y el pronóstico de la paciente9.
El manejo con los bloqueadores del receptor betaadrenérgico, los antagonistas del receptor de angiotensina II, las estatinas, la terapia antitrombótica, los diuréticos de ASA, los nitratos, los opiáceos y los vasodilatadores endovenosos se deben tener en cuenta de acuerdo a las indicaciones mencionadas en la tabla 1. No obstante, es importante recalcar que durante los últimos años la bromocriptina ha sido una de las terapias evaluadas en los estudios experimentales en donde se sugiere que existe una respuesta benéfica en las pacientes que cursan con cardiomiopatía periparto.
Manejo farmacológico y no farmacológico en la cardiomiopatía periparto
| Medicamento | Seguridad durante la lactancia | Falta de recuperación completa | Recuperación completa de la estructura ventricular izquierda y función (Seguimiento ecocardiográfico cada 6 meses) | |||
|---|---|---|---|---|---|---|
| 6 meses | 6 - 12 meses | > 12 meses | > 18 meses | |||
| B-bloqueadores | Bradicardia en algunos neonatos. El más estudiado es el metoprolol. | Obligatorio para todas las pacientes. Titularlo con dosis estándar o dosis máximas. | Continuar el medicamento por lo menos por 6 meses después de la recuperación para evitar recaída. | Continuar el medicamento con un IECA por lo menos 6 meses después de terminar la dosis del antagonista del receptor mineralocorticoide. | Continuar con el medicamento por lo menos 6 meses después de descontinuar el IECA. | Detener el B-bloqueador, asegurar un seguimiento ecocardiográfico. |
| IECA | Poca transferencia de enalapril y captopril en la leche materna. | Obligatorio para todas las pacientes. Titularlo con dosis estándar o dosis máximas. | Reducir las dosis poco a poco y luego descontinuar la medicación con IECA/ARA II. | |||
| ARA II | Muy poca evidencia de este medicamento durante la lactancia por lo que se debería evitar. | Recomendado para las pacientes que no toleran IECA. Titularlo con dosis estándar o dosis máximas. | ||||
| ARM | Muy poca evidencia de este medicamento durante la lactancia por lo que se debería evitar. | Recomendado para todas las pacientes con una FEVI<40%. Eplererona podría ser considerado debido a su menor cantidad de efectos secundarios. | Descontinuarlo solo si se completa una recuperación completa de la estructura y función del ventrículo izquierdo. | |||
| Ivabradina | No existe evidencia de este medicamento durante la lactancia por lo que se debería evitar. | Recomendado para todas las pacientes con una frecuencia cardiaca>75/min, cuando la titulación del B-bloqueador no es posible. | Continuarlo cuando la frecuencia cardiaca es>75/min a pesar de la titulación del betabloqueador. | Descontinuarlo solo si el paciente presenta una completa recuperación de la estructura y función del ventrículo izquierdo. | ||
| Diuréticos | Las tiazidas son las mejores estudiadas y toleradas durante la lactación. Existe muy poca información sobre la furosemida y la torasemida. | Solo cuando existe edema o congestión. Se debe ir titulando la dosis. | Continuarlo solo cuando los síntomas de congestión o edema están presentes sin terapia diurética como parte de la terapia antihipertensiva. | |||
Tomado de: Hilfiker-Kleiner, D., Haghikia, A., Nonhoff, J., & Bauersachs, J. (2015). Peripartum cardiomyopathy: current management and future perspectives. European Heart Journal. 2015; 36:1090–1097.
Comparación de la falla cardiaca en la cardiomiopatía periparto y de la falla cardiaca en la preeclampsia
| Cardiomiopatía periparto | Preeclampsia | |
|---|---|---|
| Mecanismos patológicos | Disfunción sistólica | Disfunción diastólica |
| Características adicionales | ||
| Hipertensión | No | Si |
| Proteinuria | No | A menudo |
| Características asociadas | ||
| Hemólisis | No | Si |
| Alteración de las pruebas hepáticas | No | Si |
| Trombocitopenia | No | Si |
| Convulsiones | No | Si |
| Disfunción renal | No | Si |
| Trombos vasculares | Si | No reportado |
| Arritmias | Si | No reportado |
| Regurgitación mitral | Si | No reportado |
| Características ecocardiográficas | ||
| Volúmenes cardiacos y estructura | ||
| Volumen auricular izquierdo | Dilatado | Normal |
| Volumen auricular derecho | Dilatado | Normal |
| Volumen ventricular derecho | Dilatado | Normal |
| Derrame pericárdico | Infrecuente | Frecuente |
| Hipertrofia ventricular izquierda | No | Frecuente |
| Función cardiaca | ||
| Función sistólica del ventrículo izquierdo | Reducida | Preservada |
| Gasto cardiaco | Reducida | Preservada |
| Función sistólica por Doppler | Reducida | Preservada |
| Fracción de eyección | Reducida | Normal |
| Función sistólica ventricular derecha | Reducida | Preservada |
| Función diastólica | Reducida | No afectada |
| Tratamiento farmacológico inicial | ||
| Agentes inotrópicos | Usados | No usados |
| Anticoagulación | Comúnmente | |
| Agentes antihipertensivos | Si | No usados |
| Sulfato de magnesio | No | Si |
Tomado de: Dennis, T. Castro, J.M. Echocardiographic differences between preeclampsia and peripartum cardiomyopathy. International Journal of Obstetric Anesthesia. 2014;23:260-266.
Diagnósticos diferenciales cardiovasculares de la cardiomiopatía periparto
| Características específicas | Diagnóstico/Investigación | |
|---|---|---|
| Cardiomiopatía dilatada idiopática preexistente desenmascarada por el embarazo (CDI) | PCM se encuentra más en el postparto, mientras que la CDI se presenta usualmente en el segundo trimestre. | Historia clínica, electrocardiograma, ecocardiograma y BNP. |
| Cardiomiopatía dilatada familiar preexistente desenmascarada por el embarazo (CDF) | CDF se presenta usualmente en el segundo trimestre con una historia familiar como antecedente. | Historia clínica, electrocardiograma, ecocardiograma, BNP y test genético familiar. |
| VIH/sida cardiomiopatía | Cardiomiopatía por VIH se presenta con ventrículos no dilatados. | Prueba de VIH. |
| Enfermedad valvular preexistente desenmascarada por el embarazo | La enfermedad reumática es a menudo desenmascarada por el embarazo. PCM se presenta más en el postparto, mientras que la enfermedad valvular en el segundo trimestre. | Historia clínica, examen físico, electrocardiograma y ecocardiograma. |
| Enfermedad cardiaca hipertensiva | Excluir hipertensión severa en mujeres en riesgo antes del parto. | |
| Enfermedad cardiovascular congénita preexistente no reconocida | La enfermedad cardiovascular congénita no diagnosticada previamente está asociada con la hipertensión pulmonar. | Historia clínica, electrocardiograma y ecocardiograma. |
| Infarto de miocardio asociado al embarazo | Historia clínica (puede ser atípica). | Historia clínica, enzimas cardiacas, angiografía coronaria y ecocardiograma. |
| Embolismo pulmonar | Historia clínica. | Antecedentes médicos, Dímero D, ecocardiograma, angiografía ventilación/perfusión. |
*BNP: Péptido natriurético tipo B.
Tomado de: Sliwa, K., Hilfiker-Kleiner, D., Petrie, M., Mebazaa, A., Pieske, B., Buchmann, E., et al. Current state of knowledge on a etiology, diagnosis, management, and therapy of peripartum cardiomyopathy: a position statement from the Heart Failure Association of the European Society of Cardiology Working Group on peripartum cardiomyopathy. European Journal of Heart Failure. 2010;12:767-768.
En un estudio abierto aleatorizado realizado por Sliwa y colaboradores en Sudáfrica se comparó 10 pacientes en manejo con la bromocriptina a dosis de 2,5mg cada 12 horas por dos semanas seguidos de 2,5mg/día por 6 semanas versus terapia convencional; concluyendo que hay una tendencia a la mejoría de la fracción de eyección del ventrículo izquierdo del 27 al 58%, en el grupo de mujeres que recibió la bromocriptina respecto del grupo que recibió la terapia convencional10–13.
Los agentes inmunosupresores no se recomiendan de rutina ya que tienen muchos efectos secundarios y los pocos estudios que se encuentran, se han realizado en pacientes con miocarditis de células gigantes13.
Otros de los agentes que se plantean como posibilidad para el manejo médico son la inmunoglobulina intravenosa, la cual según Bozkurt y colaboradores, mostró un incremento en la fracción de eyección del ventrículo izquierdo del 26%. Sin embargo, no existe evidencia suficiente para recomendar su uso14.
Los desenlaces varían considerablemente dependiendo de la severidad del cuadro, con una mortalidad aproximada del 10% a dos años, 11% a tres años y 6% a 5 años. Este comportamiento puede variar en el caso de personas de raza negra en quienes la mortalidad y la morbilidad podrían incrementarse en un 28 o 29%, respectivamente. A pesar de la baja tasa de complicaciones entre el 1 y el 2% de los pacientes pueden requerir trasplante cardiaco15. Por lo anterior, es importante que todo paciente reciba acompañamiento por parte del departamento de cardiología, posterior al egreso hospitalario en el que se monitorice de forma estricta la adherencia farmacológica, la fracción de eyección con los ecocardiogramas cada 6 meses y el control del BNP o el proBNP.
ConclusionesLa cardiomiopatía periparto sigue siendo una patología con poca evidencia científica lo que dificulta su diagnóstico, manejo y tratamiento. No obstante, es importante sospecharla en toda mujer con síntomas de la falla cardiaca que se encuentre en su último trimestre de embarazo y en el puerperio.
Se debe realizar una historia clínica minuciosa en toda paciente embarazada que asiste a consulta obstétrica y ante la sospecha, debe realizarse una valoración conjunta con el departamento de cardiología en busca de disminuir futuras complicaciones. Se debe realizar un ecocardiograma y laboratorios en los que se tenga en cuenta el BNP y el proBNP para su diagnóstico y hacer un estricto seguimiento con la sección de cardiología de la función miocárdica posterior al egreso hospitalario.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflictos de InterésNinguno.
Dennis T. Castro, J.M.; Hilfiker-Kleiner, D., Haghikia, A., Nonhoff, J., & Bauersachs, J. y Sliwa, K., Hilfiker-Kleiner, D., Petrie, M., Mebazaa, A., Pieske, B., Buchmann, E., et al. Trabajo realizado en el Hospital Universitario Fundación Santa Fe de Bogotá, Calle 119 No. 7-75, Bogotá, Colombia.