En pacientes que han sido sometidos a cirugía cardiaca, la aparición de flutter auricular no es rara y representa una causa significativa de morbilidad y mortalidad ocasional1. Este tipo especial de arritmia también se conoce como taquicardia reentrante intraatrial. La ablación con radiofrecuencia se ha establecido como una terapia efectiva en este grupo de pacientes2. Los mecanismos de este flutter pueden ser típicos (involucran el istmo cavotricuspídeo) o atípicos (no participa este istmo)1,3. En algunos pacientes coexisten ambos mecanismos o pueden establecerse dos circuitos cercanos que producen activación en forma de “8”3,4.
Tipos de flutter asociados a cirugía cardiovascularLas diferentes cirugías cardiovasculares pueden comprometer diversas estructuras cardiacas. Aquellas que llevan a líneas de suturas o cambios de presiones en las aurículas pueden generar el sustrato para la aparición de flutter auricular (arritmias macrorreentrantes auriculares). A continuación se describen los tipos más comunes.
Flutter auricular derecho no dependiente del istmo cavotricuspídeo por cicatriz de atriotomíaEn esta taquicardia atrial macrorreentrante, el obstáculo central del circuito es una cicatriz de atriotomía, un parche protésico septal, una línea de sutura o una línea de bloqueo fijo secundaria a ablación con radiofrecuencia. Otros obstáculos también pueden incluir estructuras anatómicas localizadas en la vecindad de la cicatriz, como la vena cava superior y la vena cava inferior. Rara vez estos flutter auriculares se asocian con áreas de silencio eléctrico, lo cual sugiere cicatrización en pacientes no sometidos a cirugía previa. En estos casos la aparición del flutter auricular es más tardía que en los de origen izquierdo y ocurre generalmente 10 años después del procedimiento quirúrgico5.
En estos pacientes se observa una distribución característica de la cicatrización a posterolateral y lateral en la aurícula derecha y frecuentemente tienen más de un mecanismo de taquicardia. Durante ritmo sinusal o taquicardia atrial se pueden observar electrogramas de bajo voltaje por áreas de cicatriz y potenciales dobles por una línea de bloqueo previa.
Para taquicardias atriales macrorreentrantes en adultos con enfermedad congénita reparada se han identificado tres circuitos en la aurícula derecha:
- •
Circuito de pared lateral con reentrada alrededor o asociada a cicatriz de atriotomía lateral.
- •
Circuito de pared septal con reentrada alrededor de un parche septal atrial.
- •
Circuito típico de flutter atrial utilizando el istmo cavotricuspídeo.
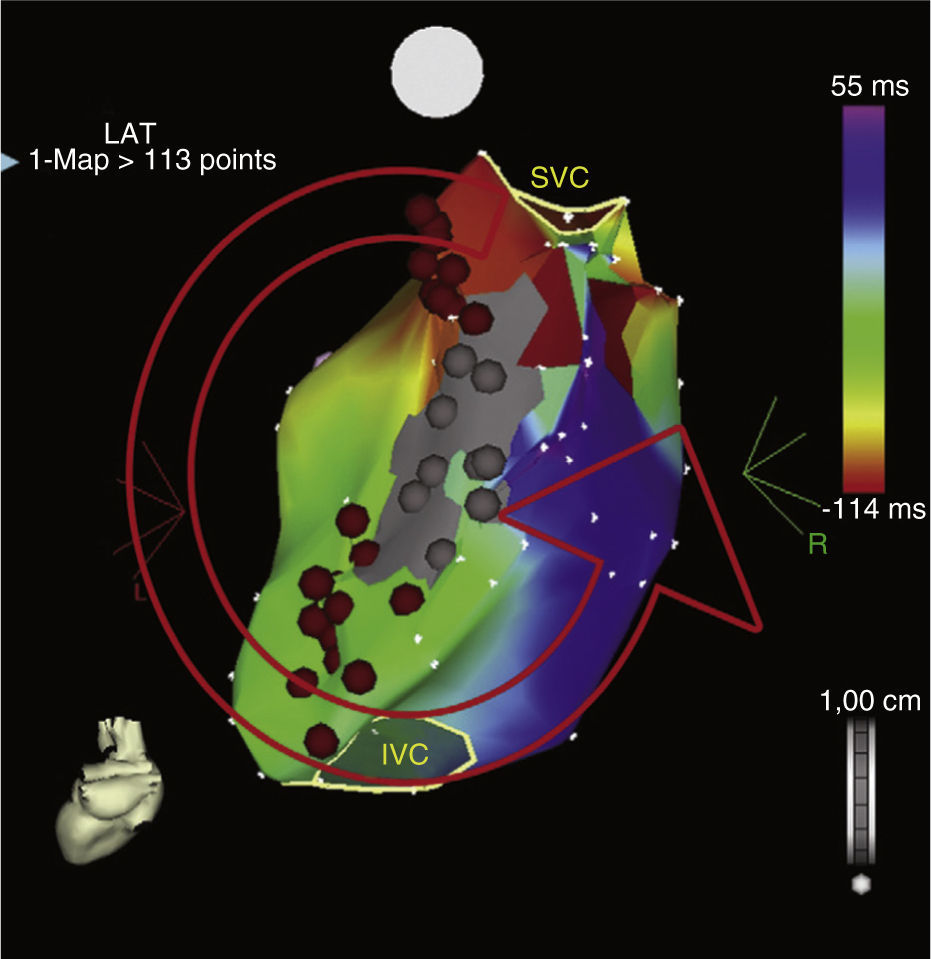
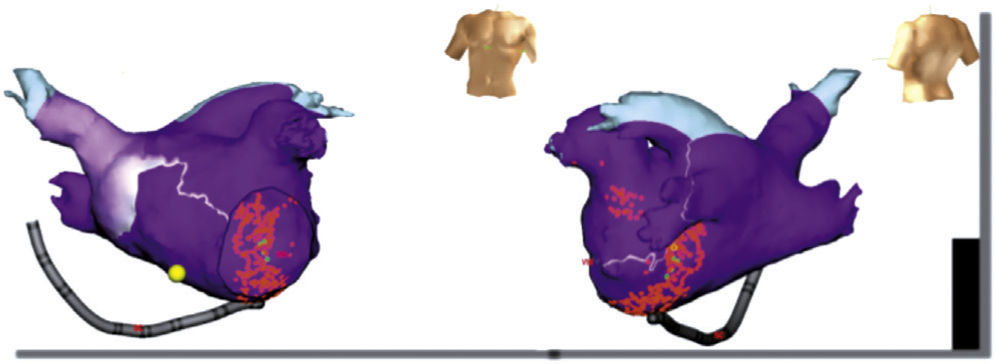
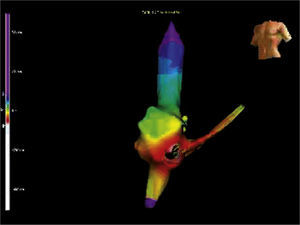
Los circuitos de macrorreentrada atriales izquierdos son infrecuentes en este grupo de pacientes (fig. 1)6.
Reentrada de asa superior. La imagen muestra un flutter atrial atípico que incluye la porción superior de la aurícula derecha, con una conducción transversa sobre la crista terminalis y una colisión del frente de onda que ocurre en la parte inferior de dicha aurícula o dentro del istmo cavotricuspídeo.
Los circuitos del flutter auricular izquierdo se asocian frecuentemente o coexisten con fibrilación atrial. La cirugía cardiaca que involucra esta aurícula o el septum atrial puede producir diferentes circuitos de flutter auricular izquierdos; sin embargo, los circuitos izquierdos también pueden hallarse en pacientes sin historia de atriotomía, en quienes la aparición de los síntomas es más temprana que en los de flutter auricular derecho y se manifiestan dos a cinco años después de la cirugía7. A menudo, en estos pacientes, los mapas electroanatómicos muestran bajo voltaje o áreas de cicatriz en la aurícula izquierda, las cuales actúan como obstáculo central o barrera en el circuito. Los flutter auriculares que más se describen son:
- •
Flutter perimitral: este circuito incluye una reentrada alrededor del anillo mitral en un movimiento en contra o a favor de las manecillas del reloj. Esta arritmia es más común en pacientes con enfermedad cardiaca estructural. No obstante, se ha descrito en pacientes sin enfermedad estructural manifiesta, aunque en ellos el mapeo electroanatómico de voltaje a menudo muestra cicatriz o áreas de bajo voltaje en la pared posterior de la aurícula izquierda como límite a este circuito. El flutter auricular perimitral es la taquicardia atrial macrorreentrante más común en pacientes con ablación previa de fibrilación atrial8.
- •
Circuitos que incluyen las venas pulmonares con o sin cicatriz auricular izquierda: varios circuitos reentrantes incluyen las venas pulmonares, especialmente en pacientes con fibrilación atrial o enfermedad de la válvula mitral y en aquellos con ablación previa de fibrilación atrial (especialmente pacientes con lesiones lineares), incluyendo circuitos reentrantes alrededor de dos o más venas pulmonares (es inusual para el circuito incluir una sola vena pulmonar) y cicatriz posterior o áreas de bajo voltaje. La línea de atriotomía izquierda usualmente se halla anterior a las venas pulmonares derechas (incisión de Waterston) creando una línea de bloqueo frente a ellas7.
- •
Circuitos septales izquierdos: incluyen la fosa ovalis, que actúa como obstáculo central para el circuito reentrante. La vena pulmonar derecha sirve como límite posterior, mientras que el anillo mitral como límite anterior. En pacientes con historia de cirugía de defectos septales atriales, las cicatrices o el parche en el septum sirven como sustrato anatómico del circuito septal izquierdo. En un estudio de 20 pacientes con flutter auricular llevados a ablación, posterior a cirugía mitral, 35% eran septales y en estos era más alta la recurrencia después de ablación9.
- •
Flutter auricular posterior a cirugía de Maze: las taquiarritmias atriales se observan aproximadamente en el 10% de los pacientes después de la cirugía de Maze para fibrilación auricular. El mecanismo más común del flutter atrial es la macrorreentrada de la aurícula izquierda, típicamente incluyendo circuitos posteriores y anteriores estabilizados por zonas de bloqueo creadas por ablación quirúrgica o amputación del apéndice auricular izquierdo. En un estudio de 47 pacientes con cirugía mitral y Maze, con seguimiento a un año, 6,5% desarrollaron flutter auricular10. En un estudio de 36 pacientes con arritmias auriculares luego de ablación quirúrgica por fibrilación auricular (7 con Maze biauricular, 18 solo izquierdo y 11 con aislamiento de venas pulmonares) se encontró que 17 correspondían a flutter auricular izquierdo, siendo los circuitos más comunes el perimitral y alrededor de las venas pulmonares. Todos fueron diagnosticados con sistemas de mapeo tridimensional11.
El mapeo de activación con el uso de catéteres multielectrodos puede ser el medio principal para definir algunos mecanismos del flutter atrial atípico derecho, especialmente si la arritmia es transitoria. Por ejemplo, la reentrada de asa inferior en sentido antihorario tiene un patrón de activación lateral hacia el septum en el istmo cavotricuspídeo y en áreas de gran avance en la aurícula derecha lateral con fusión de la morfología de las ondas a lo largo de la pared lateral6.
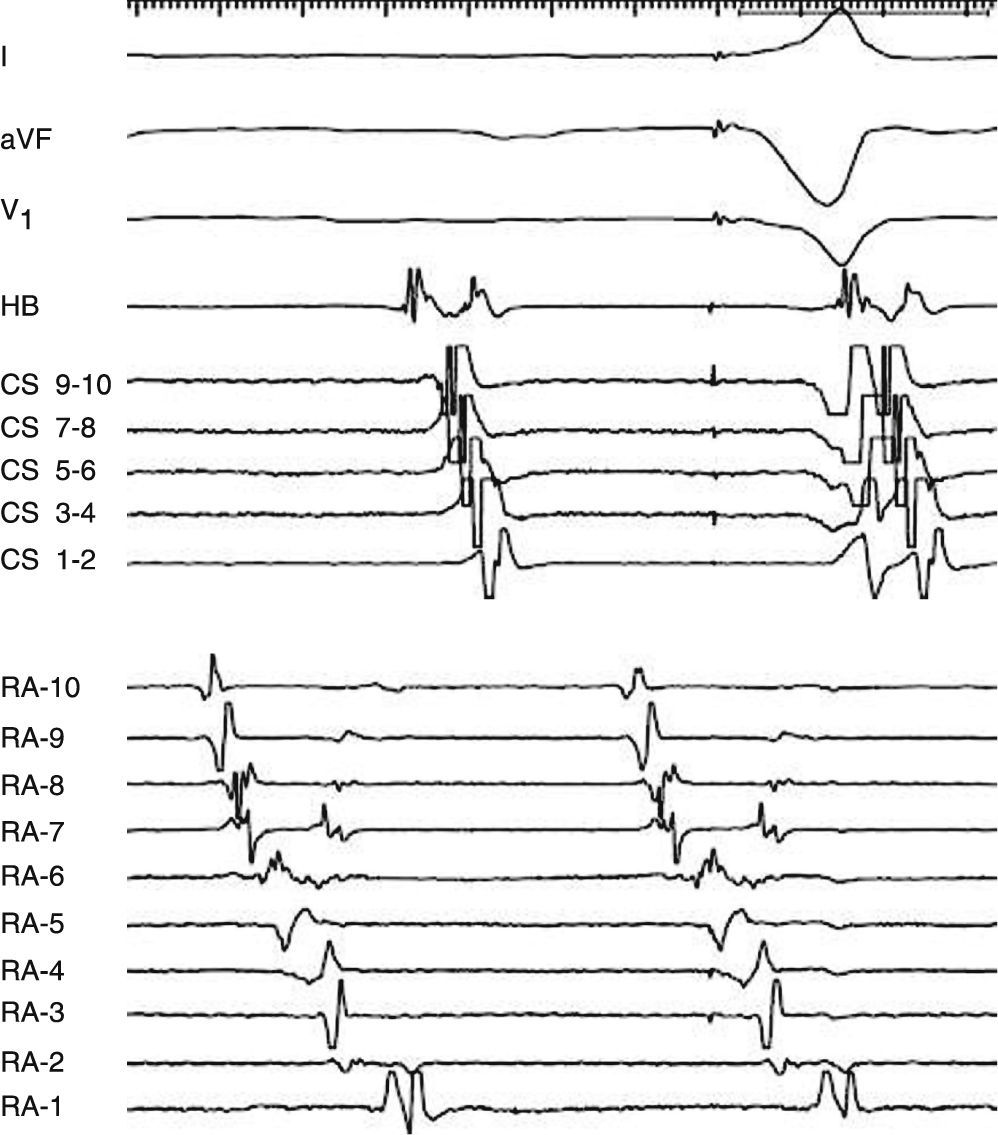
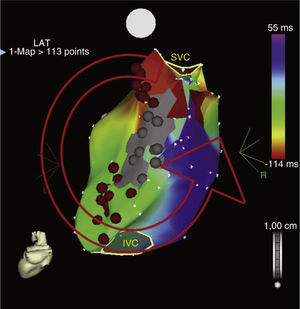
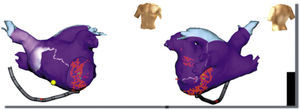
Los potenciales dobles usualmente representan líneas de bloqueo y pueden identificarse a través del mapeo convencional de activación. Si la reentrada proviene alrededor de una línea de bloqueo, los potenciales dobles se dividen ampliamente en el centro de la línea isoeléctrica y progresivamente se estrechan hacia el final de la línea en el frente de onda en movimiento12. Un ejemplo es la macrorreentrada de pared libre de la aurícula derecha. En ésta, la presencia de potenciales fragmentados y medio diastólicos son consistentes con sitios dentro de zonas críticas de conducción lenta, pero la verificación de su participación en el circuito de la taquicardia requiere de otras medidas (fig. 2).
Reentrada de pared libre de la aurícula derecha: los potenciales dobles en la pared lateral reflejan frentes de onda descendiendo y ascendiendo con estrechamiento de los intervalos entre los potenciales dobles dirigiéndose hacia la pared lateral y un electrograma fragmentado reflejando un punto de giro en el electrodo RA-6 (RA-1, lateral bajo AD; RA-10 lateral alto AD).
Por otro lado, el mapeo de activación en la aurícula izquierda en relación con una referencia fija puede identificar o excluir reentrada mitral o flutter dependiente del techo de la aurícula13.
La presencia de secuencias de activación opuestas en el anillo mitral superior e inferior (activación lateral a septal a lo largo del anillo superior y activación septal a lateral a lo largo del anillo inferior) identifican reentrada perimitral. En contraste, la presencia de direcciones de activación similar (lateral a septal) en los circuitos inferior y superior, excluyen reentrada perimitral.
La presencia de encarrilamiento oculto es una parte fundamental en la identificación de los sitios que participan en una arritmia reentrante14.
Los criterios para identificar sitios dentro del circuito son:
- •
Encarrilamiento oculto (con onda P y secuencias de activación intracardiacas parecidas a las de la taquicardia).
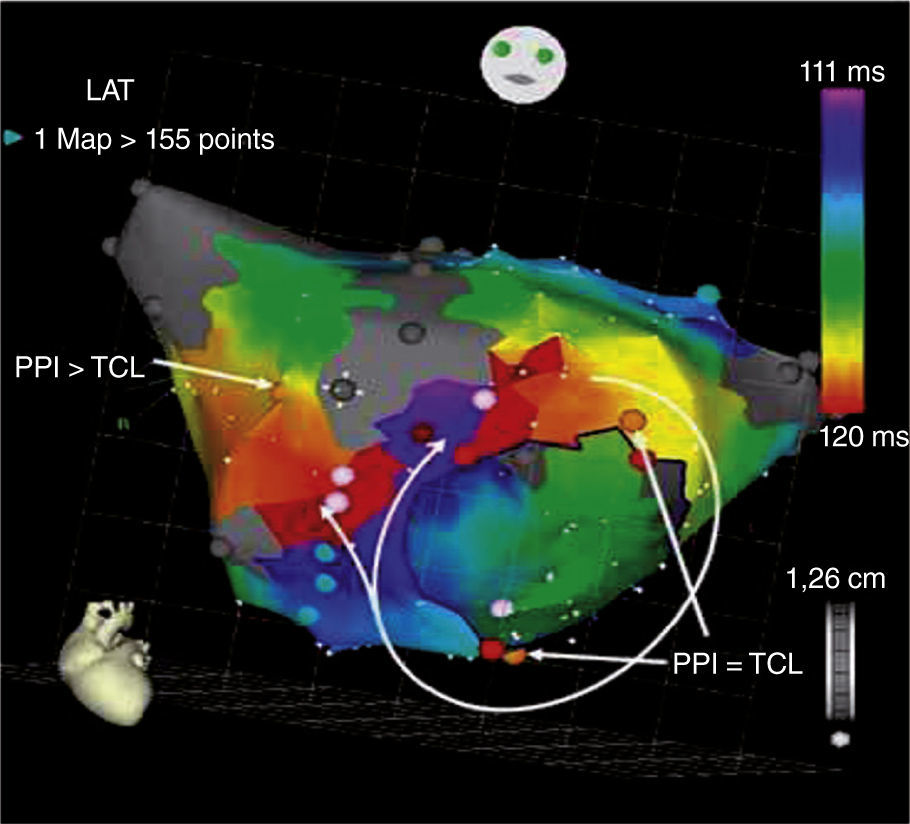
- •
Intervalo postestimulación (PPI) dentro de 30ms de la longitud de ciclo de la taquicardia registrado en el sitio de estimulación (fig. 3).
- •
Intervalo durante estimulación desde el estímulo hasta la onda P, igual al intervalo desde el electrograma hasta la onda P durante la taquicardia.
Sin embargo, este método puede tener limitaciones dadas por el enlentecimiento de la conducción asociado a la frecuencia que puede hacer que el PPI no sea igual al de la longitud de ciclo de la taquicardia y en ocasiones se presente una falla en la captura en algunos sitios del circuito reentrante.
El mapeo electroanatómico provee la visualización directa del circuito reentrante, el cual se define como la distancia más corta de la activación continua que comprende la longitud de ciclo de la taquicardia. La característica principal de las arritmias macrorreentrantes es la presencia de áreas de activación temprana adyacentes a sitios de activación tardía, con valores intermedios que conectan estas dos regiones.
Es necesario representar al menos el 90% de la longitud de ciclo de la taquicardia para visualizar el circuito reentrante. Muchas taquicardias atriales no requieren mapeo electroanatómico exhaustivo para lograr ablación exitosa, puesto que pueden hacerse inferencias acerca del mecanismo de la taquicardia y su localización a partir de una simple deducción durante el mapeo de activación y de encarrilamiento. Típicamente, si menos del 50% de la longitud de ciclo de la taquicardia está localizado a una aurícula, el circuito estará ubicado probablemente en la cámara contralateral.
El mapeo electroanatómico (NavX, St. Jude Medical, St Paul MN y Carto, Biosense Webster, Diamond Bar, CA) incluye el registro secuencial de electrogramas bipolares o unipolares que se pueden visualizar en un sistema de navegación 3D.
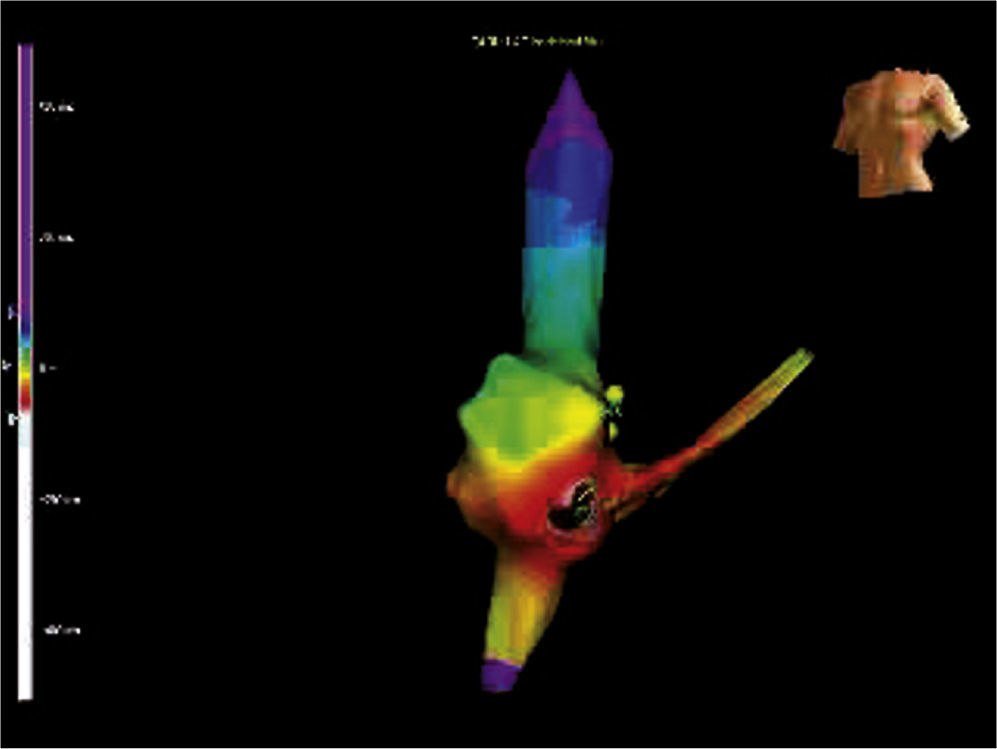
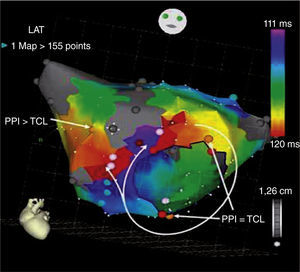
Esta técnica es una extensión del mapeo de activación por medio de gráficos de los tiempos de activación. En el mapeo de una taquicardia atrial reentrante (fig. 4), el operador define una ventana cercana a la longitud de ciclo de la taquicardia, y los tiempos de activación se asignan como “tempranos” o “tardíos” en relación con la referencia seleccionada. La información de la activación se presenta como mapa isocrónico, el cual puede mostrar la dirección del frente de onda de propagación, que además es perpendicular a los pasos isocrónicos (se necesita un gráfico de mapa de colores). Se requieren por lo menos 40 a 50 puntos para lograr un mapa de activación adecuado en cada cámara cardiaca. Las zonas con electrogramas de voltaje menor a 0,5mV y que no se dejan estimular a 20mA de amplitud de salida se definen como cicatrices atriales. El electrograma de referencia, típicamente un electrodo de seno coronario, se elige evitando tomar las señales de campo lejano que podrían quitarle precisión al mapeo.
Taquicardia atrial por microrreentrada. El mapeo de activación en la aurícula derecha demostró un área de activación más precoz en la región inferior de la aurícula derecha cercana a la hoz del seno coronario. Los puntos café corresponden a las aplicaciones de radiofrecuencia. La activación más precoz se dibuja con color blanco y a medida que se va alejando pasa por rojo, amarillo, verde, azul y el área más distal en púrpura.
El mapeo de encarrilamiento puede combinarse con el electroanatómico para definir los componentes críticos del circuito de reentrada. Esta técnica combinada es útil en situaciones en las que el mapa electroanatómico es ambiguo o cuando es difícil distinguir regiones críticas de observadores (bystanders).
El mapeo electroanatómico de no contacto (Array, St. Jude Medical) utiliza una matriz de multielectrodo que registra potenciales intracardiacos y un software para construir electrogramas unipolares virtuales sobre una representación tridimensional de una cámara. Esta técnica es útil para delinear arritmias transitorias poco sostenidas y visualizar reentrada de la pared libre de la aurícula derecha o del asa superior15.
El objetivo es buscar el istmo crítico que participa en el circuito reentrante. Para obtener una ablación satisfactoria a menudo no es necesario delinear el circuito reentrante completo puesto que la interrupción de éste en cualquier otro sitio puede terminar la taquicardia y prevenir su iniciación. El istmo crítico puede ser un canal estrecho o una región relativamente amplia, y los límites pueden incluir cicatrices o estructuras anatómicas. Los límites anatómicos fijos son más susceptibles de esta estrategia de ablación. En el caso de las taquicardias que incluyen asa doble, lo importante es identificar el istmo o corredor común. La ablación puede lograrse en el istmo común o en cada asa de forma separada. La técnica de ablación incluye la creación de una lesión lineal entre los dos límites para seccionar el istmo. En ocasiones, una lesión única puede interrumpir un istmo estrecho.
El catéter estándar de radiofrecuencia con punta de 4mm puede ser suficiente, pero la creación de lesiones lineales transmurales largas puede requerir el uso de catéteres de punta larga (8mm) o catéteres de radiofrecuencia irrigados. Es común ver reducción de los electrogramas en los sitios de ablación efectiva. Idealmente, el bloqueo bidireccional de la conducción debe verificarse después de la ablación mediante estimulación desde cualquier lado de la línea. El desvío de los frentes de onda en torno a las líneas de ablación realizadas, puede visualizarse gráficamente mediante un mapa electroanatómico reconstruido en ritmo sinusal o durante estimulación. La presencia de potenciales dobles amplios a lo largo de la línea de ablación, mientras se estimula desde un lado, provee evidencia de bloqueo de la conducción después de la ablación. Además, la reducción de los electrogramas en más de un 80% de su voltaje o a menos de 0,1mV se ha utilizado como otro objetivo de la lesión; la no inducibilidad es otro de los objetivos (fig. 5).
El seguimiento a largo plazo ha mostrado que la mayoría de los pacientes quedan libres de síntomas por arritmias incluyendo la fibrilación atrial. En dos series de flutter atrial izquierdo sometido a ablación guiada por mapeo electroanatómico, se obtuvieron pacientes libres de recurrencias sintomáticas en un 73% y 71% (rango de seguimiento de 16 y 14 meses respectivamente)16,17. Otras series de pacientes con taquicardias atriales por macrorreentrada en ausencia de intervención quirúrgica o con catéter, reportan resultados libres de arritmia sin uso de antiarrítmicos hasta en el 82% de los pacientes con taquicardias atriales derechas y hasta en un 55% de pacientes con taquicardias atriales izquierdas y un seguimiento hasta de 37 meses18. Para obtener resultados satisfactorios se pueden requerir hasta tres procedimientos. Para las taquicardias atriales macrorreentrantes que ocurren después de ablación de fibrilación atrial, la tasa de éxito es del 77% al 95%19,20. En pacientes con taquicardia atrial por macrorreentrada no asociada a ablación de fibrilación atrial, aún se desconoce la recurrencia a largo plazo de arritmias atriales después de la ablación.
ConclusionesLas taquicardias que incluyen flutter atrial no dependiente del istmo son complejas por su comportamiento eléctrico y por las variaciones anatómicas. Los aspectos más difíciles en estos casos son el mapeo y el entendimiento del circuito reentrante. En la mayoría de casos, el mapeo electroanatómico desempeña un papel importante, pero aun así se presentan problemas como electrogramas de bajo voltaje, terminación frecuente de la taquicardia y oscilación espontánea de los diferentes circuitos de la taquicardia. Los mapas se deben realizar con cuidado puesto que tomar un número insuficiente de muestras puede generar confusión.
RecomendacionesClase I- •
En el paciente con diagnóstico de flutter auricular en presencia de cirugía previa cardiaca, el procedimiento de ablación debe realizarse con guía de mapeo tridimensional (nivel de evidencia B).