La displasia arritmogénica del ventrículo derecho es una cardiopatía de origen genético, su importancia radica en la capacidad de generar muerte súbita en pacientes en la tercera y cuarta década de la vida, después de grandes esfuerzos por aumentar la sensibilidad y mejorar la capacidad diagnóstica continúa siendo un importante problema de salud pública. Los desfibriladores implantables han demostrado aumentar la supervivencia de quienes presentan arritmias letales asociadas, sin embargo, debido al carácter progresivo de la enfermedad un interrogante de importancia es cómo tratar a los pacientes con terapias apropiadas y frecuentes de estos dispositivos, la ablación por radiofrecuencia es una respuesta terapéutica seria a este dilema. En la actualidad disponemos de técnicas de ablación que combinan los métodos de la imagen TC cardiaca, la resonancia cardiaca, los mapas electroanatómicos y algunas herramientas de la electrofisiología convencional que permiten realizar ablaciones sin la inducción de arritmias ventriculares de forma sostenida y durante el ritmo sinusal, de modo similar el mejor entendimiento de la patogenia introdujo el uso de técnicas híbridas endo y epicárdica, la suma de cada uno de estos avances ha aumentado la tolerancia durante el procedimiento, ha mejorado los resultados en las etapas agudas postablación y en los seguimientos a mediano plazo, hoy los márgenes de seguridad y eficacia para esta técnica se incrementan, siendo de primera línea en diferentes situaciones de relevancia en esta compleja enfermedad.
Arrhythmogenic right ventricular dysplasia (ARVD) is a genetic disease associated with sudden cardiac death, affecting subjects in the 3rd and 4th decade of life. Despite great efforts made in order to improve its early diagnosis, ARVD remains as a major public health problem in Europe and America. Currently, risk stratification of sudden cardiac death in patients with ARVD remains challenging. Over the last decade implantable defibrillators have been shown to increase survival of patients with structural heart disease and risk factors for sudden cardiac death. However, there is no consensus about how to treat patients with recurrent appropriate implantable defibrillators therapies. Recent studies have shown that radiofrequency ablation is an effective treatment for patients with recurrent episodes of ventricular tachycardia. Specifically, substrate ablation techniques have been shown to be especially useful in the case of ARVD, as these techniques allow performing ablation during sinus rhythm. Additionally, emerging tools as electroanatomic navigation, CT or MRI have provided further knowledge of the pathogenesis of ARVD, allowing the development of novel therapeutic approaches. In this review epidemiologic, pathogenic, diagnostic and therapeutic features of ARVD are discussed, with special focus on the treatment of ventricular arrhythmias associated with ARVD.
La displasia arritmogénica del ventrículo derecho (DAVD) es una miocardiopatía de base genética que afecta principalmente a jóvenes del sexo masculino, siendo responsable hasta del 25% de las muertes súbitas en menores de 35 años1–3. Se caracteriza por la aparición de arritmias ventriculares desde etapas tempranas de la enfermedad. En algunos casos, la muerte súbita es el síntoma inicial de la enfermedad. En casos de afectación severa cursa con dilatación ventricular y desarrollo de semiología de insuficiencia cardiaca4. El desfibrilador implantable ha demostrado ser efectivo para disminuir la mortalidad en esta patología5; sin embargo, existen pacientes con descargas apropiadas y frecuentes del dispositivo debidas a episodios recurrentes de taquicardia ventricular refractarios a tratamientos farmacológicos convencionales. Estos pacientes constituyen un reto desde el punto de vista terapéutico. En ellos, aumentar la calidad de vida, disminuir las hospitalizaciones, reducir al máximo las intervenciones farmacológicas y sus efectos colaterales son un objetivo primordial. En este contexto, la ablación por radiofrecuencia del sustrato arrítmico es una alternativa segura y eficaz6–8. En la actualidad, se dispone de técnicas de ablación que no requieren de la inducción de arritmias de forma sostenida para el mapeo e identificación de los componentes críticos de los circuitos. Estas técnicas combinan el uso de las imágenes de resonancia cardiaca con los mapas electroanatómicos permitiendo la identificación de los sitios diana de la ablación durante el ritmo sinusal, aumentando el éxito y la seguridad al disminuir las complicaciones inherentes al procedimiento9–12.
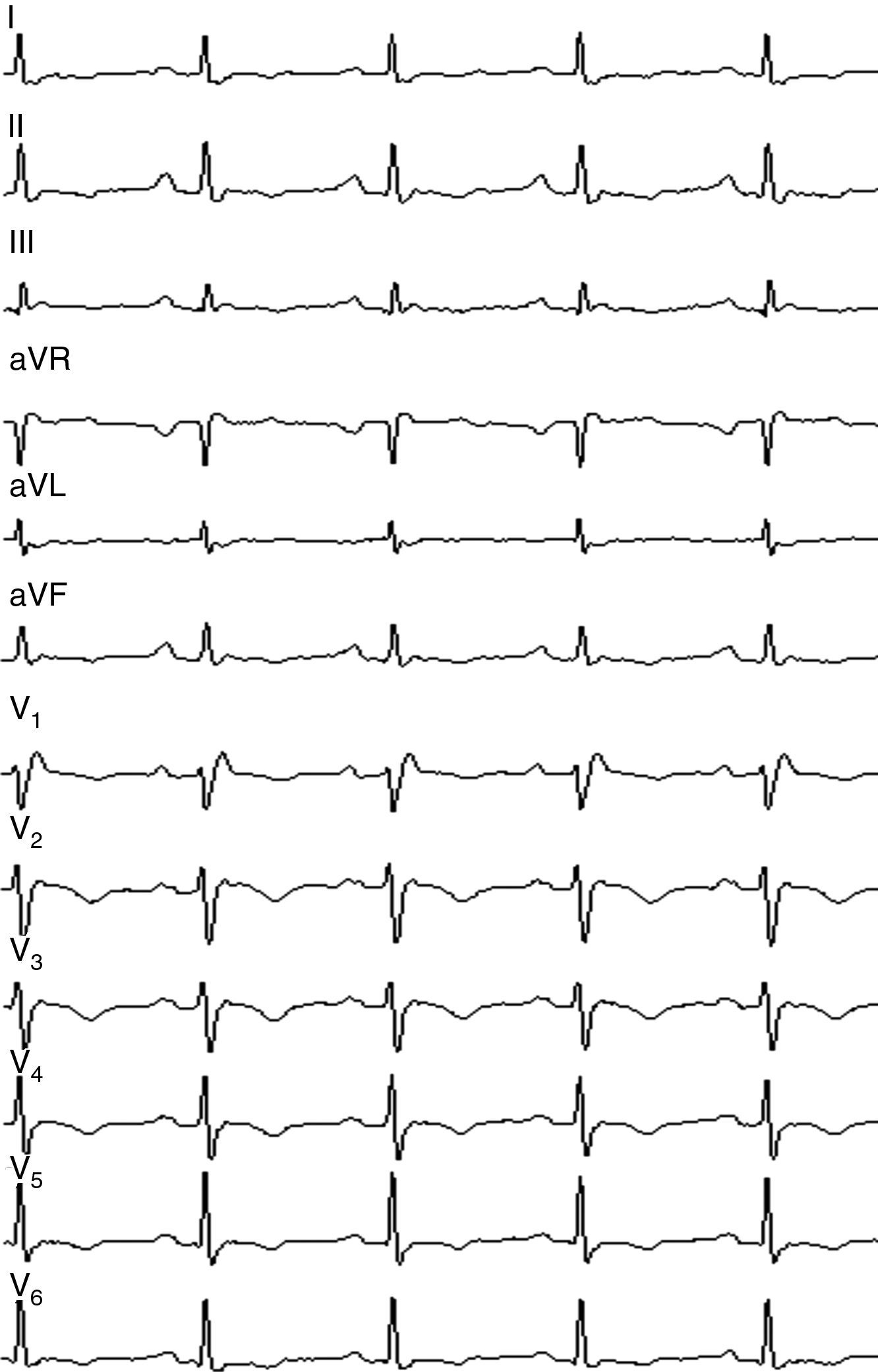
Caso clínicoVarón de 47 años de edad, presenta cuadros sincopales desde 1994 todos relacionados con esfuerzos físicos, ingreso hospitalario en 1997, se le realiza electrocardiograma que muestra ritmo sinusal, con FC 66 LPM, eje eléctrico a 60° P-R 160ms, BRDHH con QRS 140ms y fragmentación final del QRS, ondas T invertidas de V1-V6 (fig. 1), ecocardiograma que evidencia hipoquinesia lateral del ventrículo derecho con cavidades izquierdas dentro de los límites de la normalidad, el estudio holter muestra extrasistolia ventricular monomorfa frecuente con imagen BRIHH. La ventriculografía isotópica informa una fracción de eyección del ventrículo izquierdo del 60% y del ventrículo derecho del 23%, se realiza estudio electrofisiológico con protocolo para inducción de arritmias ventriculares hasta con tres extraestímulos, se desencadena una TVMS con morfología de BRIHH y eje inferior, se confirma por criterios el diagnóstico de DAVD en un familiar de primera línea de consanguinidad, el padre, con los antecedentes antes mencionados se establece el diagnóstico de DAVD al cumplir cinco criterios menores del consenso de 1994 y se indica el implante de un desfibrilador procedimiento que se realiza en junio de 1997, se da de alta al paciente y se prescribe tratamiento con sotalol oral, control por las consultas de electrofisiología y cardiología clínica. Durante el seguimiento presenta descargas apropiadas del dispositivo esporádicas para lo que se decide aumentar la dosis de sotalol con respuesta buena, ha requerido dos recambios del generador por agotamiento de la batería en los años 2001 y 2009.
El 2 de marzo de 2013 el paciente es trasladado desde otro centro hospitalario por tormenta arrítmica en el contexto de cuadro infeccioso respiratorio de probable etiología viral al verificar el dispositivo, se documentan 18 descargas apropiadas en un lapso de 14 horas. Se ingresa en unidad de cuidados intensivos, se continúa el tratamiento con amiodarona infusión prescrito desde la institución que dio la atención inicial, tras descartar factores desencadenantes (alteraciones hidroelectrolíticas, trastornos del QT adquiridos asociados al uso de medicamentos, isquemia miocárdica) se solicita valoración por el grupo de taquicardia ventricular de la sección de arritmias y se decide realizar ablación endoepicárdica del sustrato arrítmico, con el objetivo de disminuir los choques apropiados del dispositivo y controlar los síntomas.
Procedimiento realizadoLa técnica de ablación de sustrato empleada en nuestro centro consiste en la descanalización de las zonas de cicatriz existentes tanto en epicardio como endocardio.
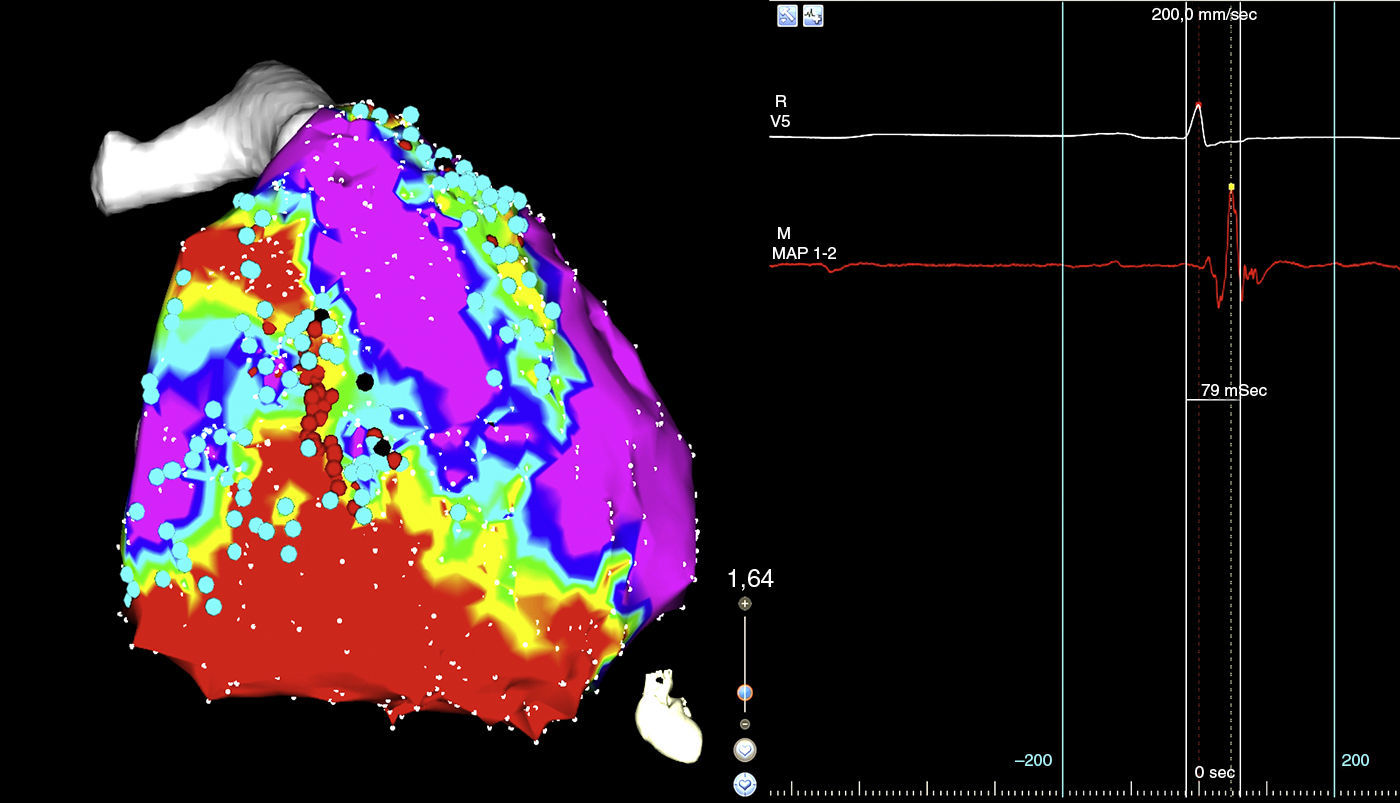
El procedimiento se realiza en el laboratorio de electrofisiología, bajo anestesia general. Tras asepsia y anestesia local de la región inguinal derecha, se colocan en la vena femoral derecha dos introductores de 6 y 12F. Se asciende el catéter tetrapolar para registro y estimulación en el ventrículo derecho; posteriormente se asciende a través de vaina deflectable (Agilis) el catéter de ablación de 3,5mm irrigado (Navistar). Con el sistema de navegación electroanatómica CARTO 3, se realiza mapa endocárdico de voltaje del ventrículo derecho hallándose extensa zona de cicatriz en segmentos inferiores e inferolaterales, así como también en tracto de salida del ventrículo derecho. En estas zonas de cicatriz se identifica la existencia de potenciales retrasados con patrón de activación secuencial conformando canales de conducción enlentecida. Estos canales son eliminados mediante la técnica de descanalización, consistente en la aplicación de radiofrecuencia en los puntos con potenciales tardíos identificados en los bordes de la cicatriz, correspondientes a la entrada teórica de los canales, fusión de electrograma de far-field y electrograma local (fig. 2). Posteriormente se realiza acceso pericárdico percutáneo subxifoideo y se realiza el mapa de voltaje epicárdico, encontrándose amplias zonas de bajo voltaje en el ventrículo derecho (el inferior, el lateral y el tracto de salida del ventrículo derecho), sobre las que se identifican potenciales tardíos (el predominio lateral y el tracto de salida del ventrículo derecho). Se realiza descanalización epicárdica aplicando radiofrecuencia en las entradas teóricas de los canales de la cicatriz. En el ventrículo izquierdo se identifican áreas con electrogramas patológicos sin evidenciarse claras zonas de bajo voltaje. Tras la ablación se realiza un protocolo de inducción de taquicardia ventricular, sin lograr inducirse ninguna taquicardia.
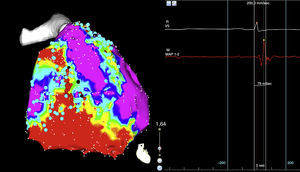
En el panel de la izquierda mapa de voltaje con el sistema de mapeo electroanatómico CARTO 3, se evidencia una zona de bajo voltaje que corresponde a cicatriz localizada en el triángulo de la displasia, el córe de color rojo, la zona que rodea la cicatriz o border zone de color verde, el tejido eléctricamente sano de color violeta, los puntos negros corresponden a los sitios teóricos de entrada a canales de conducción lenta intraescara. En el panel de la derecha imagen de polígrafo que muestra la señal del catéter de ablación, los electrogramas fusionados de far-field y el electrograma local del sitio de ingreso al canal (punto negro). El color de esta figura solo puede apreciarse en la versión electrónica del artículo.
La estancia hospitalaria total fue de nueve días después del procedimiento realizado, fue dado de alta con recomendaciones y signos de alarma además de una prescripción de Sotalol 80mg y/o cada 12 horas (hasta nueva orden médica), se indican controles por la consulta externa de electrofisiología al mes y por la consulta ambulatoria de desfibriladores cada ocho meses, hasta el momento ha tenido dos controles sin encontrarse en los contadores del dispositivo terapias apropiadas o inapropiadas. No se ha modificado el tratamiento farmacológico.
PatogénesisLa primera descripción de la enfermedad fue hecha en 1736 por Giovanni Lancisi, el Papa médico, en el libro De Motu Cordis et Aneurysmatibus; en este, describe una familia con cuatro generaciones de miembros afectados. Los síntomas incluían palpitaciones, falla cardiaca y muerte súbita. En la actualidad, la aplicación de técnicas de la biología molecular ha permitido la identificación de varios genes relacionados con la enfermedad. Desde el punto de vista genético, la enfermedad se considera autosómica dominante con penetrancia incompleta, con expresión variable relacionada con la edad. Las mutaciones afectan principalmente a las proteínas de los discos intercalares13. Las variantes autosómicas recesivas son raras, pero reconocidas en las formas cardiocutáneas como la enfermedad de Naxos, caracterizada por la queratosis palmoplantar y el pelo lanoso, esta fue la primera variante en proporcionar evidencia del origen genético al demostrar la aparición de las afecciones con la deleción de plakoglobina. Posteriormente, se han descrito otros genes implicados como aquellos que codifican para las proteínas desmoplakina, plakofilina-2 desmogleina-2 desmocolina-2 y plakoglobina para formas dominantes14. Aunque la DAVD se considera principalmente una enfermedad de los discos intercalares, también hay descripciones de mutaciones en las proteínas que no participan en las uniones entre cardiomiocitos como el receptor cardiaco rianodina-2 o el factor de crecimiento y transformación β3.
Desde el punto de vista histológico, la enfermedad se caracteriza por el reemplazo progresivo de los miocitos por tejido fibroadiposo que típicamente comienza en el epicardio hasta lograr un compromiso transmural. En la mayoría de los casos la localización de las lesiones se presenta en una región comprendida entre el tracto de salida del ventrículo derecho, la región inferolateral del anillo tricuspídeo y el ápex del ventrículo derecho, conocida como el triángulo de la displasia. En estadios avanzados las áreas afectadas se convierten en zonas atróficas, con extensa infiltración adiposa propensa a desarrollar aneurismas15. Existen varias hipótesis que explican la aparición de los cambios histológicos, entre ellas los defectos del desmosoma por disrupción del disco intercalar, la apoptosis/necrosis de los miocitos y la persistencia de un proceso inflamatorio severo que genera una transdiferenciación de los miocitos son las más aceptadas13.
DiagnósticoHacer un diagnóstico temprano así como definir el mejor momento para realizar intervenciones avanzadas es la base de un manejo adecuado. Actualmente, la base esencial del diagnóstico de la DAVD consiste en aplicar los criterios diagnósticos propuestos por el Task Force de 2010 (tabla 1). En este, se modificaron los criterios originales de 1994 con la finalidad de mejorar la sensibilidad e identificar los casos desde estadios iniciales. Estos criterios combinan los parámetros electrocardiográficos, los histológicos, los familiares, los estructurales y los genéticos, pero es de reconocer que hoy en día no se cuenta con una prueba diagnóstica única para confirmar DAVD. Hoy en día, el diagnóstico se establece por la presencia de: dos criterios mayores, un criterio mayor y dos menores, o cuatro criterios menores de diferentes categorías.
Criterios del Task force del 2010 para el diagnóstico de la displasia arritmogénica del ventrículo derecho
| I. Disfunciones globales o regionales y alteraciones estructurales |
| Mayores |
| Por ecocardiograma bidimensional: |
| Acinesia, discinesia o aneurisma regionales del ventrículo derecho |
| Una de los siguientes en telediástole: |
| PELP TSVD ≥ 32mm (corregido por tamaño corporal [PELP/ASC] ≥ 19mm/m2) |
| PELP TSVD ≥ 36mm (corregido por tamaño corporal [PELP/ASC] ≥ 21mm/m2) |
| O cambio del área fraccional ≤ 33% |
| Por resonancia magnética (RM): |
| Acinesia o discinesia regionales del VD o contracción disincrónica del VD |
| Y 1 de las siguientes: |
| Cociente de volumen telediastólico del VD respecto a ASC ≥ 110ml/m2 (varones) o ≥ 100ml/m2 (mujeres) |
| O fracción de eyección del VD ≤ 40% |
| Por angiografía del ventrículo derecho: acinesia, discinesia o aneurisma regionales del VD |
| Menores: |
| Por ecocardiograma bidimensional: |
| Acinesia o discinesia regionales del ventrículo derecho |
| y una de las siguientes en telediástole: |
| PELP TSVD ≥ 29 a<32mm (corregido por tamaño corporal [PELP/ASC] ≥16 a<19mm/m2) |
| PECP TSVD ≥ 32 a<36mm (corregido por tamaño corporal [PECP/ASC] ≥ 18 a<21mm/m2) |
| O cambio del área fraccional>33 a 40% |
| Por resonancia magnética |
| Acinesia o discinesia regionales del VD o contracción disincrónica del VD |
| y una de las siguientes: |
| Cociente de volumen telediastólico del VD respecto a ASC ≥ 100 a<110ml/m2 (varones) o ≥ 90 a<100ml/m2 (mujeres) |
| O fracción de eyección del VD>40 a ≤ 45% |
| II. Caracterización del tejido de la pared |
| Mayores |
| Miocitos residuales<60% mediante análisis morfométrico (o<50% si se han estimado), con sustitución fibrosa del miocardio de la pared libre del VD en ≥ a una muestra, con o sin sustitución adiposa del tejido en la biopsia endomiocárdica |
| Menores |
| Miocitos residuales del 60 al 75% mediante análisis morfométrico (o del 50 al 65% si se han estimado), con remplazo fibroso del miocardio de la pared libre del VD en ≥ a una muestra, con o sin sustitución adiposa del tejido en la biopsia endomiocárdica |
| III. Anomalías de la repolarización |
| Mayores: |
| Ondas T invertidas en las derivaciones precordiales derechas (V1, V2 y V3) o más allá en individuos>de 14 años de edad (en ausencia de bloqueo de rama derecha del haz [BRDH] con QRS ≥ 120 ms) |
| Menores |
| Ondas T invertidas en las derivaciones V1 y V2 en individuos>14 años de edad (en ausencia de BRDH completo) o en V4, V5 o V6 |
| Ondas T invertidas en las derivaciones V1, V2, V3 y V4 en individuos >14 años de edad en presencia de un BRDH completo |
| IV. Anormalidades de despolarización/conducción |
| Mayores |
| Onda épsilon (señales de baja amplitud reproducibles entre el final del complejo QRS y el inicio de la onda T) en las derivaciones precordiales derechas(V1 a V3) |
| Menores |
| Potenciales tardíos mediante SAECG ≥ 1 de 3 parámetros en la ausencia de una duración del QRS≥ 110 ms en el ECG estándar |
| Duración del QRS filtrado (fQRS) ≥ 114ms |
| Duración del QRS terminal<40μV (duración de señal de baja amplitud) ≥ 38 ms |
| Raíz de la media de los cuadrados de los voltajes de los 40 ms terminales ≤ 20μV |
| Duración de la activación terminal del QRS ≥ 55 ms medida desde el mínimo de la onda S hasta el final del QRS, incluyendo R’, en V1, V2 o V3, en ausencia de BRDH completo |
| V. Arritmias |
| Mayores |
| Taquicardia ventricular no sostenida o sostenida con morfología de BRIH con eje superior (QRS negativo o indeterminado en las derivaciones II, III, aVF; y positivo en aVL) |
| Menores |
| Taquicardia ventricular no sostenida o sostenida de configuración de TSVD, con morfología de BRIH con eje inferior (QRS positivo en las derivaciones II,III y aVF y negativo en aVL) o de eje desconocido |
| > 500 extrasístoles ventriculares por 24h (Holter) |
| VI. Antecedentes familiares |
| Mayores. |
| M/DAVD corroborada en un familiar de primer grado que cumpla los criterios actuales de la Task Force |
| M/DAVD corroborada anatomopatológicamente en la autopsia o la intervención quirúrgica en un familiar de primer grado |
| Identificación de una mutación patogénica clasificada como asociada o probablemente asociada a la M/DAVD en el paciente examinado |
| Menores |
| Antecedentes de M/DAVD en un familiar de primer grado en el que no es factible determinar si cumple los criterios actuales de la Task Force |
| Muerte súbita prematura (< 35 años de edad) causada a presunta M/DAVD en un familiar de primer grado |
| M/DAVD corroborada anatomopatológicamente o mediante los criterios actuales de la Task Force en un familiar de segundo grado |
ASC: área de superficie corporal; BRDH: bloqueo de rama derecha del haz; BRIH: bloqueo de rama izquierda del haz; ECG: electrocardiograma; M/DAVD: miocardiopatía/displasia arritmogénica ventricular derecha; PECP: proyección de eje corto paraesternal; PELP: proyección de eje largo paraesternal; RM: resonancia magnética; SAECG: electrocardiograma de promediación de señal; TSVD: tracto de salida del ventrículo derecho; VD: ventrículo derecho.
La lista de patologías que entran en el diagnóstico diferencial para esta enfermedad es amplia e incluye patologías prevalentes en diferentes regiones. Probablemente, las que ameritan atención son: las taquicardias idiopáticas del tracto de salida del ventrículo derecho, la miocarditis, la sarcoidosis y la cardiopatía chagásica.
Se debe tener en cuenta que la afección es más prevalente en hombres que en mujeres con una relación de 2:1. Generalmente, los síntomas se presentan entre la segunda y la cuarta década de la vida. Los principales motivos de consulta en este grupo de edad son: las palpitaciones, el síncope o la muerte súbita.
El electrocardiograma por tratarse de una prueba no invasiva, de bajo coste y accesible debe considerarse como de primera línea. Los hallazgos más frecuentes incluyen: la prolongación del QRS >110ms con morfología de bloqueo de la rama derecha como consecuencia de una alteración de la conducción intraventricular, por él; la onda Epsilon que se produce como consecuencia de zonas con conducción lenta y activación retrasada en el VD. Se trata de una onda de baja amplitud que aparece posterior a la porción final del QRS, la descripción original de este hallazgo exige que sea reproducible e identificable en las precordiales derechas, la onda S con una duración>55ms, la presencia de extrasístoles ventriculares con morfología de tracto de salida. En caso de sospecha de DAVD se debe solicitar un estudio holter para evaluar la carga de extrasístoles en 24 horas, encontrar inversión de la onda T de V1-V3 en personas con una edad superior a los 14 años constituye la alteración electrocardiográfica más frecuente en DAVD, si la inversión de la onda T alcanza las precordiales medias o se observa en V5 y V6, sugiere compromiso del ventrículo izquierdo.
Las pruebas de imagen son un elemento importante en el diagnóstico de la DAVD. El ecocardiograma es de gran utilidad. Igualmente, las imágenes de resonancia magnética cardiaca pueden ser de gran ayuda para aclarar el diagnóstico. Los siguientes hallazgos de imagen cardiaca son en orden de frecuencia las alteraciones que más se relacionan con esta patología: la dilatación del tracto de salida del VD, las alteraciones segmentarias de la contractilidad, las saculaciones y el aneurisma de la pared libre del VD. Es importante mencionar que en los estadios tempranos estos hallazgos pueden estar ausentes.
La biopsia endomiocárdiaca por tratarse de un método invasivo se recomienda para centros de referencia con amplia experiencia. Su principal limitación es su baja sensibilidad debido a que las muestras son tomadas del séptum, una zona con afectación poco frecuente.
La principal indicación de los test genéticos es la confirmación del caso índice que cumple con los criterios diagnósticos revisados y el screening de familiares. Se debe tener precaución en utilizarlo para confirmar un diagnóstico en un caso con baja probabilidad de tener la enfermedad.
Estratificación del riesgoLa utilidad del desfibrilador después de una muerte súbita recuperada o de TV sostenida está plenamente demostrada, sin embargo, sigue siendo un desafío definir la utilidad de estos dispositivos en prevención primaria. Existe una serie de factores de riesgo que se asocian al desarrollo de arritmias malignas en los pacientes con DAVD. Entre ellos, el antecedente de síncope es el predictor más robusto de muerte súbita cardiovascular16,17. Otros factores de riesgo conocidos son: la dilatación severa del ventrículo derecho, el compromiso del ventrículo izquierdo, la existencia de aneurismas del VD, la presencia de insuficiencia tricuspídea severa, el inicio de los síntomas antes de los 35 años2,17, o la mutación del Locus 1q42-43. Existen criterios en los que está demostrado que tienen una baja capacidad de predecir arritmias malignas como la inducción de TV en un estudio electrofisiológico5 y el antecedente familiar de MSC en pacientes asintomáticos17.
TratamientoAunque la supervivencia de los pacientes con DAVD y alto riesgo de arritmias letales ha mejorado desde el uso del desfibrilador, esta terapia no está libre de complicaciones, las más frecuentes son la dificultad para el emplazamiento del electrodo durante el implante del dispositivo (18,4%), la disfunción y desplazamiento de electrodos durante el seguimiento (9,8%), la infección del sistema (1,4%)18. Por otra parte, durante el seguimiento se pueden identificar pacientes que presentan terapias apropiadas y frecuentes del generador. Los antiarrítmicos más utilizados para evitar terapias apropiadas son la amiodarona y el sotalol, sin embargo, son conocidos los efectos secundarios del uso de ambos medicamentos.
Las guías de práctica clínica para el manejo de taquicardia ventricular y la prevención de muerte súbita AHA/ACC/ESC 2006 hacen una recomendación grado I para realizar ablación por radiofrecuencia en pacientes con shocks recurrentes refractarios al manejo médico óptimo que incluye antiarrítmicos y que no pueden ser manejados con reprogramación de generador16. Además, la guía de ablación de taquicardia ventricular EHRA/HRS 2009 recomienda la ablación para pacientes con taquicardia ventricular monomorfa sostenida sintomática incluidas las TV terminadas por desfibriladores que recurren después del uso adecuado de antiarrítmicos o cuando estos no son tolerados o no son deseados por el paciente, también está indicada en el control de taquicardia ventricular monomorfa sostenida incesante o tormenta arrítmica que no es secundaria a causas reversibles y para quienes presentan extrasístoles ventriculares prematuras frecuentes y TVNS o TV que se presume como causa de disfunción ventricular, finalmente en personas que tienen taquicardias ventriculares polimorfas o fibrilación ventricular en donde se sospecha un desencadenante que puede ser tratado con ablación19. Estudios recientes concluyen que la ablación por radiofrecuencia es un opción de tratamiento en pacientes con latidos prematuros ventriculares y alta carga en las pruebas holter de 24 horas>13% del total de los latidos en donde la carga de extrasistolia podría representar un factor precipitante o agravante de dilatación por taquicardiomiopatía20. No está demostrado el beneficio de la ablación profiláctica en esta patología.
Otras medidas terapéuticas son la restricción de la actividad física competitiva, el uso de inhibidores de la enzima convertidora de angiotensina, los betabloqueantes y los antagonistas de la aldosterona en los casos con insuficiencia cardiaca. Finalmente, el trasplante cardiaco es una opción en pacientes con tormenta arrítmica refractaria a fármacos y ablación y en casos con insuficiencia cardiaca avanzada refractaria a tratamiento médico.
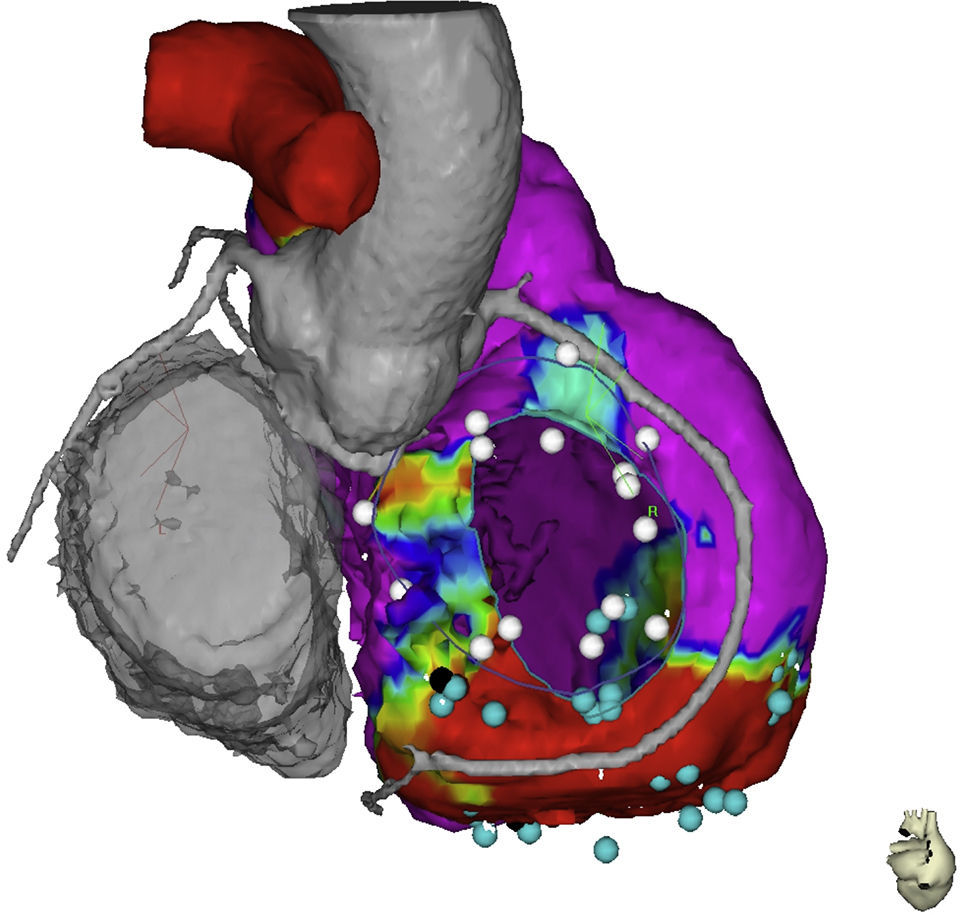
TécnicaActualmente el mecanismo electrofisiológico de las taquicardias ventriculares relacionadas con escaras en DAVD consiste en el mantenimiento de circuitos de reentrada, estos requieren de un istmo crítico, zonas de conducción lenta compuestas de miocardio intacto dentro de escaras densas de tejido fibroso. El objetivo de la ablación de TV consiste en la eliminación o aislamiento de esos sitios críticos para el mantenimiento de los circuitos que producen y mantienen la taquicardia. La técnica de descanalización es una técnica de ablación de arritmias ventriculares que comienza con la obtención de mapas de voltaje de alta densidad durante el ritmo sinusal estable. Estos mapas de voltaje se fusionan con las imágenes obtenidas mediante tomografía y/o resonancia cardiaca con realce tardío del contraste (fig. 2). Estas imágenes adquieren importancia en el momento de realizar aplicaciones de radiofrecuencia epicárdicas en sitios cercanos al trayecto de las arterias coronarias (fig. 3). El mapa de voltaje permite identificar tres zonas bien diferenciadas: el córe o núcleo de la escara que se define por valores con un punto de corte menor de 0,5mV, la border zone que comprende áreas entre 0,5mV y 1,5mV, y el tejido eléctricamente sano con electrogramas mayores de 1,5mV. Es con estas definiciones como se crea el concepto de canal de voltaje, que comprende la existencia de una zona con activación retrasada durante el ritmo sinusal que trascurren por las zonas de border zone y que se pueden presentar de tres maneras: entre dos escaras (interescara), entre una escara y el anillo tricuspídeo/mitral y en el interior de una sola escara (intraescara). Estos canales constituyen el primer objetivo de la ablación. En muchas ocasiones se identifican canales de conducción enlentecidas que no corresponden a canales verdaderos de voltaje, sino que son observados por la existencia de un patrón de activación secuencial del componente retrasado del electrograma local. Estos canales son también diana de ablación y se abordan mediante la aplicación de radiofrecuencia a nivel de las entradas de los mismos, identificadas por la existencia de un componente retrasado precoz. Una vez identificados claramente los objetivos de la ablación se procede a la aplicación de radiofrecuencia, utilizando catéteres de irrigación externa de 3,5mm; el límite de temperatura es de 45 grados centígrados y el límite de poder son 40 watts; la manipulación endocárdica y epicárdica se optimiza con una vaina deflectable para alcanzar los puntos de más difícil accesibilidad, por último, la irrigación se hace a una velocidad de 26ml/min para el endocardio y 17ml/min en el epicardio.
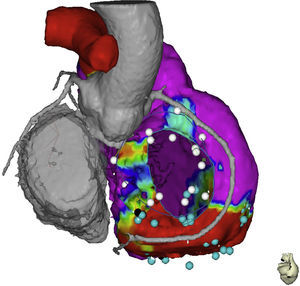
Imagen fusionada de tomografía computarizada y mapa electroanatómico, se muestran las relaciones anatómicas del anillo tricuspídeo, el trayecto de la coronaria derecha, la aorta ascendente y la región basal del ventrículo derecho. El punto negro muestra el sitio de entrada al canal dentro de la escara. El color de esta figura solo puede apreciarse en la versión electrónica del artículo.
Con base en el resultado de los estudios publicados la técnica de ablación es vital para evitar recurrencias, la combinación de ablación endo/epicárdica ha demostrado ser superior a las técnicas que se realizan en la ablación endocárdica sola, el buen resultado obtenido a corto y mediano plazo con la técnica endo/epicardio sugiere que el éxito depende de la técnica en sí misma y no del carácter progresivo de la enfermedad8, otro hallazgo de importancia clínica durante la realización de los mapas epicárdicos es la presencia de escaras de mayor tamaño y un número superior de los canales en el epicardio, esto la convierte en una técnica de primera línea en los casos donde la ablación está indicada. La ablación de los sitios teóricos de entrada a los canales de voltaje y los de potenciales retrasados es metodológica y clínicamente segura y eficaz para aislar eléctricamente las escaras y evitar que estas terminen por convertirse en el sustrato de taquicardias ventriculares por episodios de reentrada. El tratamiento con ablación por radiofrecuencia del sustrato anatomopatológico con base en hallazgos electrofisiológicos, sumado a la obtención de imágenes por tomografía y resonancia cardiaca son un área de la electrofisiología en crecimiento, la combinación de métodos imagenológicos y electrofisiológicos ha demostrado aumentar la seguridad y disminuir las complicaciones del procedimiento (fig. 3).
ConclusionesEl tratamiento de las taquicardias ventriculares asociadas a displasia arritmogénica del ventrículo derecho incluye tanto medidas farmacológicas, como la utilización de dispositivos implantables, sin embargo, la ablación por radiofrecuencia de los sustratos arritmogénicos debe considerarse como una medida de primera línea en el tratamiento de arritmias ventriculares que producen choques apropiados recurrentes, está demostrado que se trata de un procedimiento seguro, con baja tasa de complicaciones realizado por personal entrenado, puede disminuir las descargas apropiadas de los desfibriladores y evitar síntomas relacionados, mejorar la calidad de vida de los pacientes y disminuir la necesidad de uso de medicamentos antiarrítmicos; los resultados actuales son susceptibles de mejorar a fin de disminuir las tasas de recurrencia de taquicardia ventricular.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.