establecer la prevalencia de resultados positivos en el rastreo posterapia empírica; determinar valores de corte para tiroglobulina estimulada y suprimida que predijeron el resultado del rastreo posterapia empírica y describir factores clínicos e histopatológicos asociados con rastreos positivos.
Métodosse revisaron historias clínicas de pacientes, del Instituto Nacional de Cancerología (INC) entre 2003 y 2009, con cáncer diferenciado de tiroides y que tuvieron una tiroglobulina estimulada ≥ 10 ng/ml en ausencia de enfermedad estructural identificable por ecografía de cuello y por otras imágenes diagnósticas obtenidas a discreción de los médicos tratantes. Se les practicó un rastreo posterapia después de recibir 100-200 mCi de I-131.
Resultadosse incluyeron 40 pacientes (34 mujeres) con cáncer diferenciado de tiroides, de 14 a 74 años de edad, la mayoría con invasión local o compromiso de ganglios cervicales. El rastreo posterapia fue positivo en 24 pacientes. Los valores de corte de tiroglobulina suprimida y estimulada que mejor predijeron los resultados del rastreo posterapia fueron 1,89 ng/ml y 25 ng/ml, respectivamente. Factores como edad ≥ 45 años, sexo masculino, variantes agresivas y otras variables de mal pronóstico (tumor > 4cm, primera cirugía extrainstitucional, tiroglobulina postoperatoria > 30 ng/ml y respuesta estructural incompleta (80%)) fueron más frecuentes en los pacientes con rastreo positivo.
Conclusionesel rastreo posterapia empírica con I-131 es una estrategia diagnóstica que provee información localizadora, metabólica y pronóstica en la mayoría de los pacientes.
a) To establish the prevalence of positive post-therapeutic I-131 whole-body scan (PWBS) results in patients with elevated thyroglobulin (Tg) levels and with no structurally identifiable disease; b) to calculate stimulated and suppressed Tg cut-off values with the highest accuracy using ROC analyses; c) to describe positive PWBS-related clinical and histopathology factors.
MethodsA retrospective assessment is presented of PWBS results in 40 patients (34 female) between 14 and 74 years of age with differentiated thyroid cancer (DTC) who were treated with empirical radioiodine therapy at the Instituto Nacional de Cancerología between 2003 and 2009, and with a stimulated Tg ≥ 10 ng/ml with no structurally identifiable disease.
ResultsPWBS revealed a pathological uptake in 24 (60%) patients. The highest diagnostic accuracies of serum Tg for abnormal I-131 uptake in PWBS were 1.89 ng/ml for suppressed Tg and 25 ng/ml for stimulated Tg. Factors such as age ≥ 45 years, aggressive variants, and other poor outcome predictors, tumor size > 4cm, extra-institutional first surgery, postoperative thyroglobulin >30 ng/ml and structurally incomplete tumor response to initial treatment, were more frequently related to positive PWBS.
ConclusionPWBS is a diagnostic strategy that provides localizing, metabolic and prognostic information in most patients with elevated Tg levels and with no structurally identifiable disease.
La tiroidectomía, la terapia con I-131 y la supresión con hormona tiroidea son el eje del tratamiento del cáncer diferenciado de tiroides. El 95% de los pacientes sobrevive más de 5 años y el 92% sobrevive más de 20 años. Dependiendo del tratamiento inicial y de otras variables pronósticas, aproximadamente el 30% de los pacientes con cáncer diferenciado de tiroides experimentará recurrencias tumorales durante varias décadas y el 66% de ellas durante la primera década después del tratamiento inicial1.
La tiroglobulina sérica y la ecografía de cuello son las herramientas esenciales para el seguimiento posquirúrgico de los pacientes con cáncer diferenciado de tiroides2. En ausencia de anticuerpos antiroglobulina, un valor de tiroglobulina < 0,5 ng/ml bajo estimulación con TSH recombinante humana (rhTSH) tiene una probabilidad del 98%-99,5% para identificar pacientes libres de enfermedad3. Por el contrario, un valor de corte de 2 ng/ml para la tiroglobulina estimulada con rhTSH o con deprivación hormonal es altamente sensible para identificar pacientes con tumor persistente4.
La ecografía de cuello es la primera modalidad imaginológica que se practica en pacientes con tiroglobulina elevada porque la diseminación de la enfermedad casi siempre comienza con linfadenopatías cervicales5. Juntas, la tiroglobulina sérica y la ecografía tienen la mejor exactitud diagnóstica para detectar enfermedad persistente en el cuello6. La citología aspirativa con aguja fina (ACAF) bajo guía ecográfica de los nódulos sospechosos7 mejora la especificidad del método2. Sin embargo, los resultados de la ecografía y, en general, de las técnicas convencionales de imagen no son siempre concluyentes, especialmente en el cuello operado y particularmente en los pacientes cuya cirugía inicial no fue óptima o no fue practicada por manos expertas, o en quienes la terapia con I-131 no se administró bajo condiciones de preparación adecuadas. En estas circunstancias es difícil establecer si un valor detectable de tiroglobulina —a veces coexistente con cambios sutiles en la ecografía- representa enfermedad residual macro- o microscópica o si es el producto de residuos tiroideos normales8. Hasta 2/3 partes de los pacientes con niveles detectables de tiroglobulina estimulada un año después del tratamiento inicial sin otra evidencia de enfermedad tendrán valores normales en el siguiente control sin necesidad de tratamiento adicional9. Esto ocurre por la desaparición lenta de las células tiroideas irradiadas —tanto benignas como malignas—10. En los pacientes con enfermedad persistente la tiroglobulina se elevará gradualmente y la mayoría requerirá tratamiento adicional11. Cuando la tiroglobulina estimulada alcanza o supera los 10 ng/ml en ausencia de enfermedad estructuralmente identificable hay que considerar la administración empírica de una actividad terapéutica de I-131 (100-200 mCi) puesto que en el 62% de los casos la carga tumoral será suficiente para ser detectada en el rastreo posterapia12. El pronóstico de los pacientes con enfermedad metastásica mejora si la enfermedad se detecta y se trata tempranamente13–15 antes de que se desarrollen macrometástasis16,17.
La terapia empírica con I-131 puede potenciar el rendimiento diagnóstico del rastreo con I-131, proveer información localizadora útil para establecer la mejor estrategia de manejo, caracterizar la integridad del mecanismo de captación y metabolismo del I-131 en las lesiones (funcionalidad y desdiferenciación del tumor), proveer (potencialmente) un efecto terapéutico en algunos pacientes.
Los objetivos del presente estudio fueron: establecer la prevalencia de resultados positivos en el rastreo posterapia empírica obtenido en una serie de pacientes con cáncer de tiroides con valores de tiroglobulina estimulada ≥ 10 ng/ml en ausencia de enfermedad estructuralmente identificable; determinar los valores de corte de tiroglobulina estimulada y suprimida que mejor predijeron el resultado del rastreo posterapia empírica, y describir los factores clínicos e histopatológicos asociados a rastreos positivos.
MétodosSe revisaron las historias clínicas de los pacientes con diagnóstico histológico de cáncer diferenciado de tiroides bajo seguimiento en el INC que recibieron terapia empírica con I-131 entre el 2003 y el 2009. Se incluyeron pacientes de cualquier edad y género tratados con tiroidectomía total/casi total y ablación/terapia adyuvante con I-131 a quienes en cualquier momento del seguimiento se les detectó un valor de tiroglobulina estimulada ≥ 10 ng/ml en ausencia de enfermedad estructural identificable o con hallazgos sospechosos o indeterminados en la ecografía de cuello con ACAF negativo para tumor. Los controles repetitivos y estudios imaginológicos adicionales se hicieron a discreción de los médicos tratantes. Se excluyeron pacientes con cirugía incompleta o metástasis a distancia o sin tratamiento complementario con I-131 o sin revisión de patología en el INC. Los pacientes con anticuerpos antitiroglobulina > 60 ng/ml fueron excluidos de los análisis cuantitativos. Antes del tratamiento se cuantificaron los valores de TSH, tiroglobulina y anticuerpos antitiroglobulina.
Se administraron entre 100 y 200 mCi de I-131 después de un período de deprivación hormonal suficiente para obtener una TSH ≥ 25-30 mU/L (generalmente 2-4 semanas). A todos los pacientes se les prescribió dieta baja en yodo y se les hizo rastreo corporal según el protocolo institucional18. Se interpretaron como anormales las captaciones diferentes a la distribución fisiológica del trazador y se localizaron topográficamente en lecho, cuello, mediastino, pulmones u otras. No se empleó SPECT/CT.
Se cuantificó la frecuencia de resultados positivos en los rastreos posterapia obtenidos en la población de estudio y se hizo un análisis de curvas ROC para establecer los valores de corte de tiroglobulina suprimida y estimulada que mejor discriminaron los resultados del rastreo posterapia. Se hicieron tablas con las principales variables clínicas y socio-demográficas de los pacientes y se cuantificaron valores de estadística descriptiva.
Para la cuantificación de la tiroglobulina sérica en el laboratorio institucional se utilizó un método de quimioluminiscencia (Immulite 2000 Thyroglobulin; Diagnostic Products, Los Angeles, California) con una sensibilidad de detección de 0,2 ng/ml.
El estudio se condujo bajo aprobación del Comité de Ética en Investigación del INC.
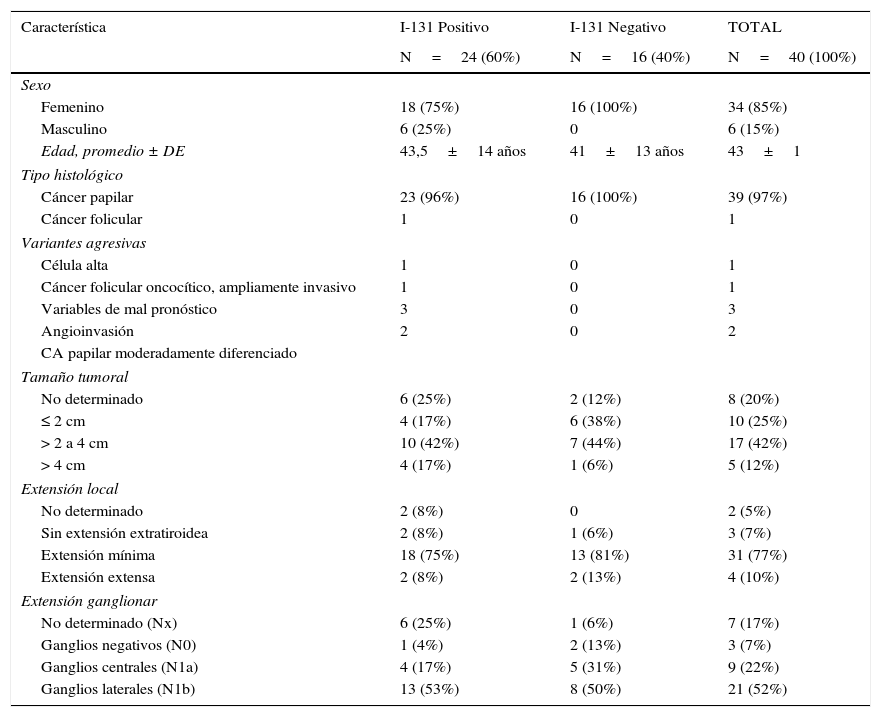
ResultadosPacientesSe identificaron 40 pacientes (34 mujeres) entre 14 y 74 años de edad (prom±DE, 42,5±13,5 años) que cumplieron los criterios de inclusión. A excepción de un caso de cáncer folicular oncocítico ampliamente invasivo, todos los pacientes tenían cáncer papilar de tiroides. La tabla 1 describe las características de los pacientes.
Datos clínicos y patológicos de los pacientes
| Característica | I-131 Positivo | I-131 Negativo | TOTAL |
|---|---|---|---|
| N=24 (60%) | N=16 (40%) | N=40 (100%) | |
| Sexo | |||
| Femenino | 18 (75%) | 16 (100%) | 34 (85%) |
| Masculino | 6 (25%) | 0 | 6 (15%) |
| Edad, promedio ± DE | 43,5±14 años | 41±13 años | 43±1 |
| Tipo histológico | |||
| Cáncer papilar | 23 (96%) | 16 (100%) | 39 (97%) |
| Cáncer folicular | 1 | 0 | 1 |
| Variantes agresivas | |||
| Célula alta | 1 | 0 | 1 |
| Cáncer folicular oncocítico, ampliamente invasivo | 1 | 0 | 1 |
| Variables de mal pronóstico | 3 | 0 | 3 |
| Angioinvasión | 2 | 0 | 2 |
| CA papilar moderadamente diferenciado | |||
| Tamaño tumoral | |||
| No determinado | 6 (25%) | 2 (12%) | 8 (20%) |
| ≤ 2 cm | 4 (17%) | 6 (38%) | 10 (25%) |
| > 2 a 4 cm | 10 (42%) | 7 (44%) | 17 (42%) |
| > 4 cm | 4 (17%) | 1 (6%) | 5 (12%) |
| Extensión local | |||
| No determinado | 2 (8%) | 0 | 2 (5%) |
| Sin extensión extratiroidea | 2 (8%) | 1 (6%) | 3 (7%) |
| Extensión mínima | 18 (75%) | 13 (81%) | 31 (77%) |
| Extensión extensa | 2 (8%) | 2 (13%) | 4 (10%) |
| Extensión ganglionar | |||
| No determinado (Nx) | 6 (25%) | 1 (6%) | 7 (17%) |
| Ganglios negativos (N0) | 1 (4%) | 2 (13%) | 3 (7%) |
| Ganglios centrales (N1a) | 4 (17%) | 5 (31%) | 9 (22%) |
| Ganglios laterales (N1b) | 13 (53%) | 8 (50%) | 21 (52%) |
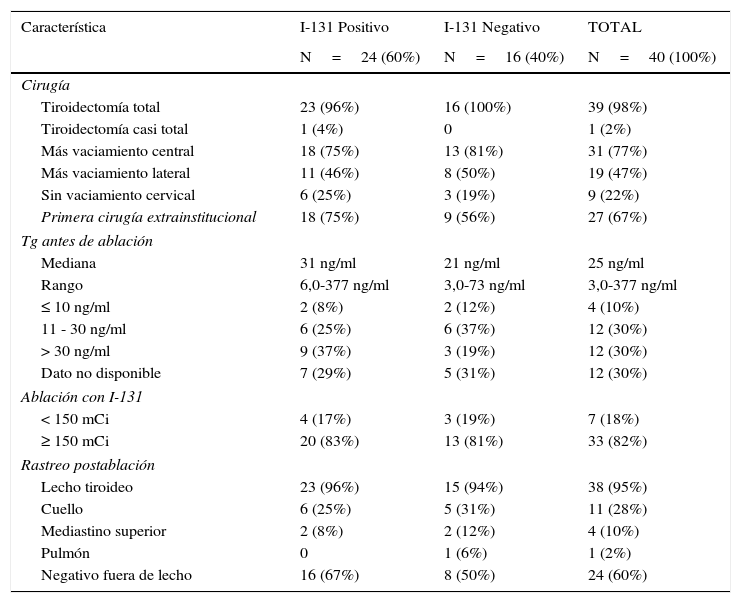
Todos los pacientes fueron inicialmente tratados con tiroidectomía total/casi total y ablación/terapia adyuvante con I-131. Se hizo vaciamiento central profiláctico en el 77%. El 47% requirió vaciamiento radical modificado ipsilateral o contralateral, generalmente en un segundo tiempo quirúrgico. La primera cirugía fue extrainstitucional en 27 pacientes (67%). Dieciséis (40%) pacientes fueron reintervenidos inmediatamente antes (N=12) o después (N=4) de la ablación con I-131 para asegurar el control loco-regional de la enfermedad. La tabla 2 resume los resultados de la tiroglobulina cuantificada al momento de la ablación y hallazgos del rastreo postablación.
Descripción del tratamiento inicial
| Característica | I-131 Positivo | I-131 Negativo | TOTAL |
|---|---|---|---|
| N=24 (60%) | N=16 (40%) | N=40 (100%) | |
| Cirugía | |||
| Tiroidectomía total | 23 (96%) | 16 (100%) | 39 (98%) |
| Tiroidectomía casi total | 1 (4%) | 0 | 1 (2%) |
| Más vaciamiento central | 18 (75%) | 13 (81%) | 31 (77%) |
| Más vaciamiento lateral | 11 (46%) | 8 (50%) | 19 (47%) |
| Sin vaciamiento cervical | 6 (25%) | 3 (19%) | 9 (22%) |
| Primera cirugía extrainstitucional | 18 (75%) | 9 (56%) | 27 (67%) |
| Tg antes de ablación | |||
| Mediana | 31 ng/ml | 21 ng/ml | 25 ng/ml |
| Rango | 6,0-377 ng/ml | 3,0-73 ng/ml | 3,0-377 ng/ml |
| ≤ 10 ng/ml | 2 (8%) | 2 (12%) | 4 (10%) |
| 11 - 30 ng/ml | 6 (25%) | 6 (37%) | 12 (30%) |
| > 30 ng/ml | 9 (37%) | 3 (19%) | 12 (30%) |
| Dato no disponible | 7 (29%) | 5 (31%) | 12 (30%) |
| Ablación con I-131 | |||
| < 150 mCi | 4 (17%) | 3 (19%) | 7 (18%) |
| ≥ 150 mCi | 20 (83%) | 13 (81%) | 33 (82%) |
| Rastreo postablación | |||
| Lecho tiroideo | 23 (96%) | 15 (94%) | 38 (95%) |
| Cuello | 6 (25%) | 5 (31%) | 11 (28%) |
| Mediastino superior | 2 (8%) | 2 (12%) | 4 (10%) |
| Pulmón | 0 | 1 (6%) | 1 (2%) |
| Negativo fuera de lecho | 16 (67%) | 8 (50%) | 24 (60%) |
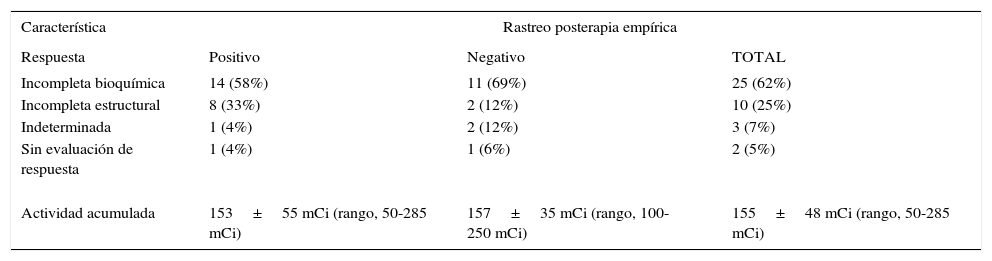
El protocolo del INC18 contempla que aproximadamente un año después del tratamiento inicial con cirugía y ablación o terapia adyuvante con I-131 se obtengan, como mínimo, un valor de tiroglobulina bajo deprivación hormonal, una ecografía de cuello con ACAF de lesiones sospechosas y un rastreo diagnóstico con 5 mCi de I-131. Se aplicaron los criterios del Memorial Sloan-Kettering Cancer Center19,20 para describir la respuesta al tratamiento inicial: 25 pacientes tuvieron una respuesta bioquímica incompleta (62%), 10 pacientes tuvieron una respuesta estructural incompleta (25%) y no se halló información suficiente para hacer una evaluación de la respuesta terapéutica para los dos pacientes restantes (5%). La tabla 3 resume los resultados del análisis de respuesta al tratamiento inicial.
Respuesta al tratamiento inicial
| Característica | Rastreo posterapia empírica | ||
|---|---|---|---|
| Respuesta | Positivo | Negativo | TOTAL |
| Incompleta bioquímica | 14 (58%) | 11 (69%) | 25 (62%) |
| Incompleta estructural | 8 (33%) | 2 (12%) | 10 (25%) |
| Indeterminada | 1 (4%) | 2 (12%) | 3 (7%) |
| Sin evaluación de respuesta | 1 (4%) | 1 (6%) | 2 (5%) |
| Actividad acumulada | 153±55 mCi (rango, 50-285 mCi) | 157±35 mCi (rango, 100-250 mCi) | 155±48 mCi (rango, 50-285 mCi) |
El rastreo posterapia fue interpretado como positivo en 24 pacientes (60%) (tabla 4) cuyos resultados de tiroglobulina suprimida y estimulada (mediana) fueron 2,3 ng/ml (rango, 0,54-12 ng/ml) y 31 ng/ml (rango, 10-298 ng/ml), respectivamente. Asimismo, el rastreo posterapia se interpretó como negativo para enfermedad tumoral ávida por I-131 en 16 pacientes cuyos resultados de tiroglobulina suprimida y estimulada (mediana) fueron 0,97 ng/ml (rango, 0,2-1,7 ng/ml) y 17 ng/ml (rango, 11-59 ng/ml), respectivamente. Nueve pacientes con tiroglobulina suprimida > 2 ng/ml y 10 de los 11 pacientes con tiroglobulina estimulada > 30 ng/ml tuvieron rastreos positivos. El rastreo fue negativo en 9 (64%) de los 14 pacientes con tiroglobulina suprimida ≤ 1 ng/ml.
Características de los pacientes al momento de la terapia empírica con I-131
| Característica | Rastreo positivo | Rastreo negativo |
|---|---|---|
| N=24 (60%) | N=16 (40%) | |
| Tiempo entre la ablación y la terapia empírica (meses) | ||
| Promedio ± DE | 51±43 | 40±38 |
| Mediana | 38 | 21 |
| Rango | 14-168 | 13-121 |
| Tg suprimida (ng/ml)* | ||
| Mediana | 2,30 | 0,97 |
| Rango | 0,54-12 | 0,20-1,70 |
| ≤ 1 ng/ml | 5 (21%) | 9 (56%) |
| > 1 ng/ml a 2 ng/ml | 2 (8%) | 1 (6%) |
| > 2 ng/ml | 9 (38%) | 0 |
| Dato no disponible | 8 (33%) | 6 (38%) |
| Tg estimulada (ng/ml)** | ||
| Mediana | 31 | 17 |
| Rango | 10-298 | 11-59 |
| 11 - 30 ng/ml | 10 (42%) | 13 (81%) |
| > 30 ng/ml | 10 (42%) | 1 (6%) |
| Dato no disponible | 4 (16%) | 2 (13%) |
| Actividad de I-131 para terapia empírica | ||
| Mediana | 150 mCi | 150 mCi |
| Rango | 100-200 mCi | 100-200 mCi |
| Captaciones anormales en el rastreo posterapia empírica | ||
| Negativo | 0 | 16 |
| Lecho | 6 (25%) | 0 |
| Cuello | 17 (71%) | 0 |
| Tórax | 10 (42%) | 0 |
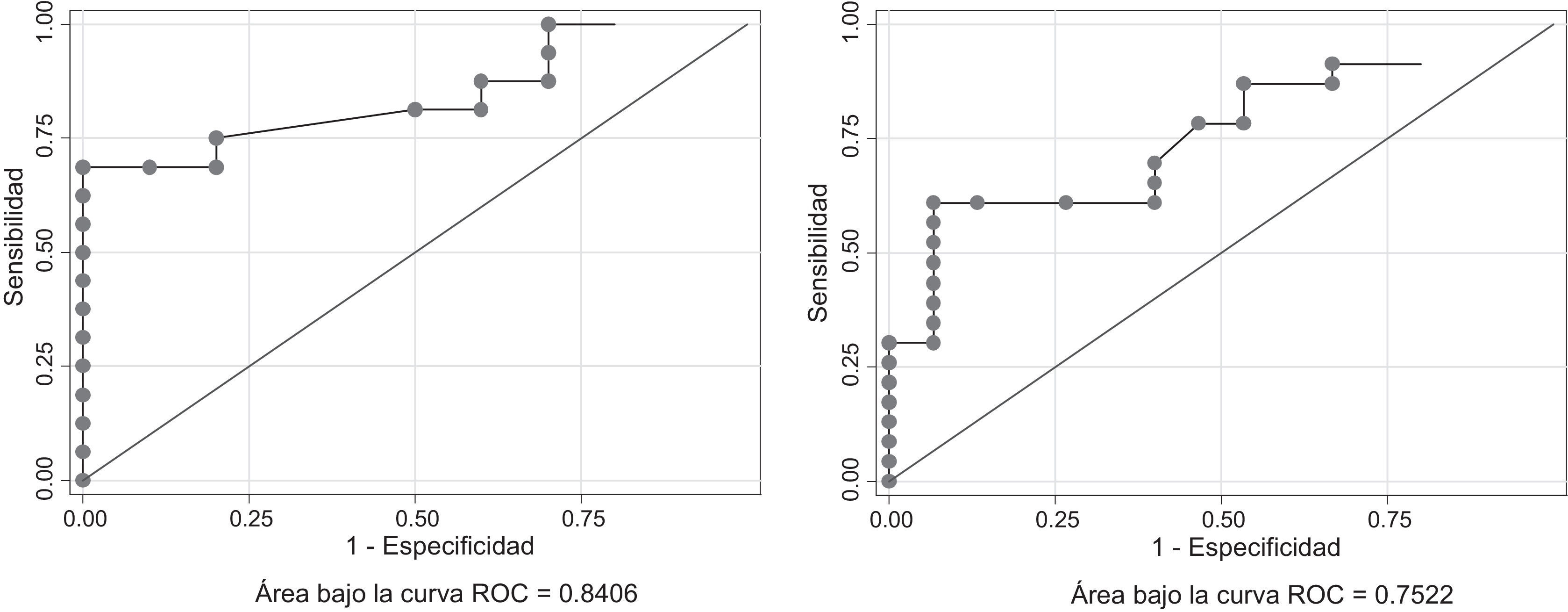
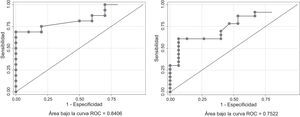
Para el análisis con curvas ROC se excluyeron los valores de tiroglobulina suprimida que no fueron obtenidos con una TSH ≤ 0,1 UI/ml y los valores de tiroglobulina estimulada obtenidos con rhTSH. También se excluyeron los valores de tiroglobulina obtenidos en pacientes con anticuerpos antitiroglobulina > 60 ng/ml (identificados en la tabla 4 como datos no disponibles). El valor de corte para la tiroglobulina suprimida fue 1,89 ng/ml y discriminó correctamente al 84% de los pacientes con una sensibilidad del 68,75% y una especificidad del 100%, mientras que para la tiroglobulina estimulada el valor de corte fue 25 ng/ml y discriminó correctamente al 75% de los pacientes con una sensibilidad del 60,87% y una especificidad del 93% (fig. 1).
Tendencias de los pacientes con rastreo posterapia empírica positivoEl rastreo posterapia fue positivo: en 13 de 19 (68%) pacientes con edad ≥ 45 años; en todos los pacientes de sexo masculino (n=6); en todos los pacientes con variantes agresivas y otras variables de mal pronóstico (n=7); en 4 de 5 pacientes con tumor primario > 4 cm; en 18 de 27 (67%) de los pacientes inicialmente operados en otros hospitales; en 9 de 12 (75%) pacientes con tiroglobulina postoperatoria > 30 ng/ml, y en 8 de 10 (80%) pacientes con respuesta estructural incompleta.
DiscusiónLa concentración sérica de tiroglobulina refleja la carga presente de tejido tiroideo diferenciado21–23 el grado de estimulación del receptor de tirotropina y la habilidad intrínseca del tumor para sintetizar y secretar tiroglobulina24. Su detección en pacientes con ablación total del tejido tiroideo significa enfermedad persistente o recurrente25. Cuando el rastreo diagnóstico con I-131 es negativo y la tiroglobulina sérica está elevada, se pueden administrar 100 - 200 mCi de I-131 empíricamente seguidos de un rastreo posterapia. El tratamiento se puede repetir cada 6-12 meses hasta obtener un rastreo posterapia negativo26. Bajo este criterio, la terapia empírica casi nunca es exitosa para lesiones > 1cm (macrometástasis) porque raramente concentran suficiente I-13116,17. Se emplean técnicas convencionales de imaginología diagnóstica antes de la terapia empírica para establecer si existe sustrato anatómico para una cirugía potencialmente curativa27,28. La ecografía cervical con ACAF de lesiones sospechosas es la modalidad de elección para evaluar el lecho tiroideo y los ganglios regionales, sitios en donde se asientan la mayoría de las metástasis27–29. La tomografía computarizada (TC) es útil para la detección de metástasis a distancia30, particularmente las pulmonares que pueden pasar desapercibidas al rastreo con I-131 y a la FDG-PET por la menor resolución espacial de estas modalidades31.
Actualmente, la sensibilidad diagnóstica de la tiroglobulina estimulada es tal que permite identificar pacientes sin evidencia de enfermedad estructural. Una tiroglobulina estimulada > 2 ng/ml es altamente sensible para identificar enfermedad persistente4 pero se requieren controles periódicos con ecografía de cuello y TC de tórax para poder localizar las lesiones. Si bien esto generalmente se interpreta como enfermedad persistente de muy bajo volumen y significa un fracaso del tratamiento inicial, supuestamente llevado a cabo con la mejor resección quirúrgica y la ablación con I-1318, se ha descrito que valores de tiroglobulina persistentemente detectables después de la ablación con I-131 pueden indicar presencia de células irradiadas que la continúan produciendo durante meses o años antes de desaparecer9,10,32. Al administrar terapia empírica en estos pacientes se pueden interpretar erróneamente los descensos subsecuentes de la tiroglobulina como evidencia de respuesta exitosa9.
En los pacientes que experimentan recurrencias la tiroglobulina se incrementa o permanece constante33. Las imágenes convencionales pueden ser particularmente difíciles de interpretar y no concluyentes si el tratamiento inicial se ha hecho de manera tórpida. Cuando la tiroglobulina estimulada alcanza o supera 10 ng/ml sin lesiones estructurales identificables o con imágenes no conclusivas se debe considerar la terapia empírica con I-131 como un recurso diagnóstico y terapéutico34. La mayoría de estos pacientes tendrán lesiones < 1cm en ecografía o TC (micrometástasis) que únicamente serán detectables con 100-200 mCi de I-131 y no con los 2-10 mCi que se utilizan para el rastreo diagnóstico. El rastreo posterapia con I-131 es el único método capaz de confirmar si una lesión capta I-131. Adicionalmente, estos son los pacientes con mayor probabilidad de obtener un beneficio terapéutico16. La identificación de enfermedad nueva o persistente en las imágenes de medicina nuclear actualmente se interpreta como respuesta estructural incompleta19, en parte gracias al surgimiento del I-131 SPECT/CT, una técnica diagnóstica formidable capaz de detectar y localizar anatómicamente las lesiones que previamente no se identificaron en las imágenes diagnósticas convencionales35–38.
Los falsos negativos del rastreo posterapia pueden deberse a factores técnicos como: interferencia por yodo exógeno, pobre instrumentación y elevación inadecuada de la TSH39, variables que en el INC están controladas y protocolizadas18. También pueden ocurrir por una captación de I-131 demasiado baja para ser visible, sea porque el tejido neoplásico tiene un mecanismo de captación de yodo defectuoso, porque ha ocurrido pérdida de la diferenciación o porque la masa de las lesiones es demasiado pequeña40. En estos casos puede ser útil la FDG-PET/CT, especialmente si la tendencia de la tiroglobulina se mantiene en aumento41,42. La captación de FDG se asocia con resistencia al tratamiento con I-131, peor pronóstico y comportamiento agresivo del tumor43.
Existen factores del tratamiento inicial que son determinantes para obtener una respuesta completa como: la resección completa del tumor primario44; la integridad de la resección quirúrgica proporcional a la extensión local y regional de la enfermedad45; la dieta baja en yodo46; la estimulación de la TSH antes de la ablación con I-13146, y la correcta interpretación de los rastreos con I-1312,47. Tuttle y cols20 reportaron persistencia bioquímica en 18% de sus pacientes después del tratamiento inicial y en apenas el 34% la tiroglobulina estimulada descendió por debajo de 1 ng/ml a los dos años. En parte, le atribuyeron este desenlace al hecho de que muchos pacientes de su cohorte fueron inicialmente operados en otras instituciones antes de su remisión al Memorial Sloan-Kettering Cancer Center para el seguimiento. En este nuestro estudio 27 pacientes (67%) fueron inicialmente manejados en otras instituciones. Esto implica un rigor heterogéneo para controlar aspectos que son críticos para la efectividad del manejo inicial. En efecto, 16 pacientes (40%) requirieron cirugía adicional antes de la ablación con I-131 o inmediatamente después de ella por enfermedad residual en los ganglios cervicales. El tiempo transcurrido entre la primera cirugía y la ablación con I-131 fue superior a 3 meses (mediana, 3,5 meses; rango, 1-12 meses) en 21 (52%) pacientes. En 28 pacientes con resultados disponibles la tiroglobulina postoperatoria fue < 10 ng/ml en apenas 4 (14%). Según un metaanálisis reciente este sería un factor favorable48. En 15 pacientes (40%) el rastreo postablación mostró captaciones fuera del lecho tiroideo. Trámites administrativos dispendiosos, listas de espera y demoras en la remisión de los pacientes pudieron alterar el pronóstico al incrementar el lapso entre el diagnóstico y la cirugía inicial, y entre la cirugía inicial y la administración del I-1311,49. En 35 pacientes con datos disponibles la respuesta al tratamiento inicial fue incompleta en todos: bioquímicamente en 25 y estructuralmente en 10, según los criterios del Memorial Sloan-Kettering Cancer Center19,20.
No hay consenso acerca del nivel de tiroglobulina que debería precipitar el tratamiento con I-131, especialmente por la variabilidad interensayo y la pobre reproducibilidad entre laboratorios50. Tres factores merecen consideración: entre mayor sea el valor de tiroglobulina mayor será la probabilidad de obtener un rastreo positivo34; la tendencia al aumento en mediciones consecutivas del valor de tiroglobulina es un indicador más confiable que un valor aislado10,33,51 pero es posible interpretar valores aislados si son muy altos52, y la variabilidad de la prueba justifica que cada hospital defina su propio valor de corte9. En el análisis correspondiente a este estudio, en las curvas ROC los valores de corte que mejor predijeron resultados positivos en el rastreo posterapia empírica fueron de 1,89 ng/ml para la tiroglobulina suprimida y de 25 ng/ml para la estimulada. El rastreo posterapia empírica mostró captaciones anormales en 24 (60%) pacientes con tiroglobulina estimulada ≥ 10 ng/ml. Las características más frecuentes en los pacientes con rastreo positivo fueron: sexo masculino (25% vs 0% en pacientes con rastreo negativo); edad al diagnóstico (mediana, 46 años vs 38 años); variantes agresivas u otras variables de mal pronóstico (7 casos vs 0), tumor primario > 4cm (17% vs 6%); valor de tiroglobulina posquirúrgica (mediana, 31 ng/ml vs 21 ng/ml); respuesta estructuralmente incompleta al tratamiento inicial (33% vs 12%); tiroglobulina suprimida > 2 ng/ml al momento de la terapia empírica (38% vs 0); tiroglobulina estimulada > 30 ng/ml al momento de la terapia empírica (42% vs 6%); mediana de tiroglobulina suprimida al momento de la terapia empírica (2,3 ng/ml vs 0,97 ng/ml); mediana de tiroglobulina estimulada al momento de la terapia empírica (31 ng/ml vs 17 ng/ml); cirugía inicial extrainstitucional (75% vs 56%), y tiempo entre la cirugía inicial y la terapia empírica (mediana, 38 meses vs 21 meses). Los resultados están resumidos en las tablas 1-4.
Todos los pacientes con tiroglobulina estimulada > 30 ng/ml —a excepción de uno— y todos los pacientes con tiroglobulina suprimida > 2 ng/ml tuvieron resultados positivos en el rastreo posterapia empírica (tabla 4). Todos los pacientes con rastreo negativo tuvieron tiroglobulina suprimida < 2 ng/ml, e incluso en 11 pacientes el grado de supresión fue ≤ 1 ng/ml, una peculiaridad que según Vural y cols53 debería incluirse en la definición de resultados verdaderos negativos. Se ha descrito que la tiroglobulina se hace detectable después de estimularla con rhTSH en el 15%-20% de los pacientes. Posteriormente los niveles descienden a lo largo de meses o años hasta hacerse indetectables en 2/3 de estos pacientes54.
En conclusión, la terapia empírica es una estrategia diagnóstica útil en pacientes con tiroglobulina elevada sin evidencia de enfermedad estructural identificable que tengan alto riesgo de enfermedad persistente o recurrente.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A los médicos especialistas de la junta de cáncer de tiroides del Instituto Nacional de Cancerología por ser una fuente permanente de conocimientos, ideas y preguntas de investigación. Al Dr. Ricardo Sánchez del Grupo de Epidemiología Clínica por ayudarnos con el análisis estadístico de la información del estudio.