Describir las características sociodemográficas y clínicas de un grupo de pacientes con cáncer de recto localmente avanzado, tratados con quimiorradioterapia neoadyuvante, y realizar un diagnóstico situacional del manejo.
MétodosSe realizó un estudio tipo series de casos, con la información clínica de 41 pacientes atendidos durante el 2010 en el Instituto Nacional de Cancerología.
ResultadosLa edad promedio de los pacientes observados fue de 61 años, con un el 61% de hombres; el estado funcional por Karnofsky fue igual o mayor que el 70%. El esquema neoadyuvante más utilizado fue 5 fluorouracilo y leucovorín en bolos, concomitante con radioterapia. De los pacientes, 30 completaron el tratamiento con buena tolerancia; 21 fueron llevados a cirugía, con preservación del esfínter en 10 de ellos; 18 lograron respuesta patológica; 14, parcial y 4, completa.
ConclusiónLos pacientes con cáncer de recto localmente avanzado que recibieron tratamiento neoadyuvante con quimiorradioterapia en el Instituto Nacional de Cancerología durante 2010 fueron, en su mayoría, hombres con buen estado funcional; el principal esquema de quimioterapia empleado fue 5 fluorouracilo y leucovorín en bolos, gracias a lo cual se logró resecabilidad del tumor, preservación del esfínter y respuesta patológica en aproximadamente la mitad de los pacientes.
To describe the sociodemographic and clinical characteristics of a group of patients with locally advanced rectal cancer treated with neoadjuvant chemo-radiotherapy, and to make a situational diagnosis of the management.
MethodsA case series study was conducted using the clinical information of 41 patients treated in the Instituto Nacional de Cancerología during the year 2010.
ResultsThe mean age of the patients studied was 61 years, and 60% were male. The Karnofsky functional state was equal or greater than 70%. The neoadjuvant scheme most used was 5-fluorouracil and leucovorin in boluses, concomitant with radiotherapy. Of the 41 patients, 30 completed the treatment with good tolerance; 21 required surgery, with preservation of the sphincter in 10 of them; 18 achieved a pathological response; 14, partial and 4, complete.
ConclusionThe patients with locally advanced rectal cancer who received neoadjuvant treatment with chemo-radiotherapy in the Instituto Nacional de Cancerología during the year 2010 were, mainly males with a good functional state. The principal chemotherapy scheme employed was 5-fluorouracil and leucovorin in boluses, due to which resectability of the tumour, preservation of the sphincter, and a pathological response in approximately half of the patients, was achieved.
La incidencia estimada por Globocan de cáncer colorrectal para ambos sexos en Colombia durante 2008 fue de 10,6 por cada 100.000 habitantes, con un registro de 4.107 nuevos casos y una mortalidad estimada en 6,2 por cada 100.000 habitantes, con un registro de 2.388 muertes por esta causa1.
Según datos del Registro Poblacional de Cali, a lo largo del período 2003–2007, el cáncer colorrectal ocupa en Colombia el cuarto puesto en incidencia y mortalidad en hombres y mujeres2. En el Instituto Nacional de Cancerología (INC), durante 2010 se presentaron 134 casos nuevos de cáncer de recto: 79 en hombres y 55 en mujeres3.
Actualmente, la terapia multimodal con cirugía, que incluye escisión total del mesorrecto, radioterapia y quimioterapia, es la estrategia de manejo recomendada para pacientes con cáncer rectal en estadios II y III; el tratamiento neoadyuvante con quimiorradioterapia basado en fluoropirimidinas es el esquema estándar4.
El tratamiento neoadyuvante busca mejorar el control local, inducir el downstaging tumoral (para aumentar la probabilidad de resecabilidad), preservar el esfínter anal, disminuir la toxicidad aguda y tardía por radioterapia y evaluar la biología tumoral4,5 por determinación de la respuesta patológica, según la escala de Mandard, que se muestra en la6tabla 1.
Por lo menos 19 estudios aleatorizados evidenciaron que la radioterapia neoadyuvante lograba una disminución significativa en las tasas de recurrencia local4; sin embargo, solo un estudio, el Swedish Rectal Cancer Trial7, demostró beneficio en la supervivencia global a 5 años, que fue del 58% en el grupo de radioterapia neoadyuvante más cirugía, y del 48% en el grupo de cirugía sola (P=0,004).
Los estudios EORTC 229218, FFCD 92039, GRECCAR 110, y el estudio del Polish Colorectal Study Group11, demostraron que la quimioterapia concomitante con radioterapia neoadyuvante aumenta de forma significativa la respuesta patológica, el control local y el downstaging del tumor, cuando se comparó con la radioterapia neoadyuvante sola. Un metanálisis documentó, por su parte, que la quimiorradioterapia concomitante neoadyuvante, comparada con la radioterapia neoadyuvante, no ofrecía beneficio en la supervivencia libre de progresión ni en la supervivencia global a 5 años, pero sí aumentaba significativamente la toxicidad aguda grados 3 y 4: odds ratio 1,68–10; P=0,00212.
Los estudios que evaluaron la eficacia y la seguridad del uso de quimiorradioterapia concomitante neoadyuvante frente a quimiorradioterapia adyuvante son: el Intergroup trial 0147, o RTOG 94-015, el NSABP RO-0313 y el estudio alemán CAO/ARO/AI O 9414. Sin embargo, los estudios RTOG 94-01 y NSABP 03, hechos en Estados Unidos, se cerraron prematuramente, debido al pobre reclutamiento.
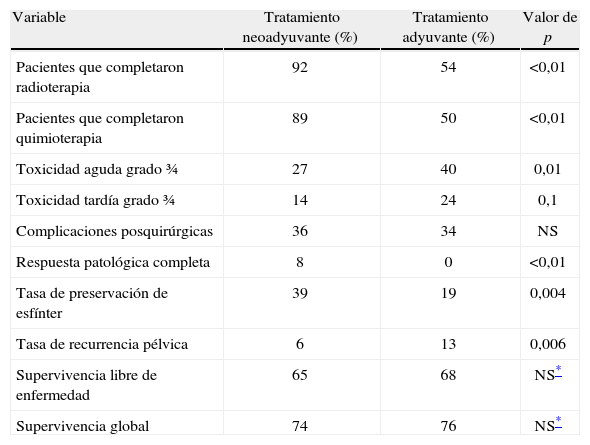
El estudio CAO/ARO/AIO 9414 incluyó a 803 pacientes que fueron aleatorizados para recibir quimiorradioterapia concomitante con 5 fluorouracilo infusional neoadyuvante frente a adyuvante. Los resultados del estudio se muestran en la tabla 2. El mismo estudio demostró que los pacientes en manejo con quimiorradioterapia concomitante neoadyuvante presentaron una mayor adherencia al tratamiento, beneficio en la tasa de respuesta patológica completa, preservación de esfínter, tasa de recurrencia pélvica y menor toxicidad aguda y crónica; sin embargo, no mostró beneficio en la supervivencia14.
Resultados del estudio CAR/ARO/AIO 94.
| Variable | Tratamiento neoadyuvante (%) | Tratamiento adyuvante (%) | Valor de p |
| Pacientes que completaron radioterapia | 92 | 54 | <0,01 |
| Pacientes que completaron quimioterapia | 89 | 50 | <0,01 |
| Toxicidad aguda grado ¾ | 27 | 40 | 0,01 |
| Toxicidad tardía grado ¾ | 14 | 24 | 0,1 |
| Complicaciones posquirúrgicas | 36 | 34 | NS |
| Respuesta patológica completa | 8 | 0 | <0,01 |
| Tasa de preservación de esfínter | 39 | 19 | 0,004 |
| Tasa de recurrencia pélvica | 6 | 13 | 0,006 |
| Supervivencia libre de enfermedad | 65 | 68 | NS* |
| Supervivencia global | 74 | 76 | NS* |
Inicialmente, varios estudios fases I y II mostraron que la capecitabina concomitante con radioterapia era una opción de tratamiento neoadyuvante, con eficacia y tolerabilidad similares a las del 5 fluorouracilo infusional para los pacientes con cáncer rectal localmente avanzado15. Posteriormente, un estudio fase III con 401 pacientes demostró que la capecitabina no era inferior al 5 fluorouracilo infusional en supervivencia libre de progresión, ni en supervivencia global a 5 años, cuando se empleaba en neoadyuvancia o en adyuvancia en pacientes con cáncer de recto localmente avanzado16. Adicionalmente, el estudio NSABP R04 también demostró que la capecitabina era equivalente al 5 fluorouracilo en el tratamiento neoadyuvante del cáncer de recto localmente avanzado, en cuanto a la tasa de respuesta patológica completa y la tasa de cirugía preservadora de esfínter y downstaging tumoral17.
Con base en lo anterior, el manejo estándar neoadyuvante para pacientes con cáncer de recto localmente avanzado es la quimiorradioterapia concomitante basada en fluoropirimidinas18,19, la cual puede administrarse así:
- •
Cinco fluorouracilo 1.000mg/m2/día en infusión de 5 días, administrado la primera y la última semana de la radioterapia (50,4 Gy).
- •
Cinco fluorouracilo 400mg/m2/día en bolo asociado con leucovorín 20mg/m2/día, en bolo durante 4 días, administrado la primera y la última semana de la radioterapia (50,4 Gy).
- •
Capecitabina oral 825mg/m2, 2 veces al día, continua por 5 semanas, concomitante con radioterapia 50,4 Gy.
- •
Realización de cirugía transabdominal (resección abdominoperineal o resección anterior baja), 5 a 10 semanas después de terminar el tratamiento neoadyuvante. Es obligatoria la resección del tumor primario con adecuados márgenes quirúrgicos, con remoción total del mesorrecto y disección ganglionar18.
El uso del oxaliplatino fue evaluado en los 3 estudios: NSABP R0417, STAR 0120 y ACCORD 12/0405-Prodige 221, los cuales no demostraron beneficio en adicionarlo a la quimiorradioterapia basada en fluoropirimidinas en la tasa de respuesta patológica completa ni en la tasa de cirugía conservadora de esfínter, aunque sí aumentaba la toxicidad grados 3 y 4.
Actualmente, se investiga el grado de seguridad y la eficacia de varios agentes de quimioterapia y terapia target en el tratamiento neoadyuvante del cáncer de recto localmente avanzado: irinotecán, gefitinib, bevacizumab y cetuximab22.
MétodosEl presente es un estudio observacional descriptivo, retrospectivo, tipo serie de casos, con la información de pacientes que tuvieron diagnóstico de cáncer de recto localmente avanzado, atendidos en el servicio de oncología clínica del INC durante 2010, quienes recibieron tratamiento neoadyuvante con quimiorradioterapia.
Previa aprobación del Comité de Ética del INC, se hizo una búsqueda retrospectiva en el sistema de información SAP, teniendo en cuenta como criterios de inclusión a los pacientes con diagnóstico de carcinoma de recto que fueron atendidos en el servicio de oncología clínica a lo largo de 2010.
Se evaluaron las historias clínicas, y se seleccionó a los pacientes mayores de 18 años que fueron estadificados como carcinoma de recto localmente avanzado, a quienes por tal razón se les ordenó manejo con quimiorradioterapia neoadyuvante. Posteriormente, se eligió a los pacientes que recibieron el tratamiento en el INC. Se excluyó a los pacientes que presentaran una neoplasia sincrónica en el momento del diagnóstico de cáncer de recto, así como a los pacientes con enfermedad metastásica a distancia, en la evaluación clínica previa al inicio del tratamiento.
Los pacientes fueron manejados con uno de los esquemas que se enuncian a continuación (la elección del esquema de quimioterapia dependió del criterio del oncólogo clínico; la dosis total de radioterapia fue establecida por el radioterapeuta oncólogo [el fraccionamiento fue de 1,8 Gy]): 5 fluorouracilo 400mg/m2/día en bolo asociado con leucovorín 20mg/m2/día, en bolo durante 4 días, administrado la primera y la última semana de la radioterapia (50,4 Gy); o bien, capecitabina oral 825mg/m2, 2 veces al día, continua por 5 semanas, concomitante con radioterapia 50,4 Gy.
Se recopiló la información de cada paciente incluido en un formato de reporte de caso diseñado para tal fin; se extrajeron los datos sobre las características demográficas, el tipo de tratamiento recibido, el cumplimiento de este, la toxicidad, la determinación de resecabilidad (realizada, a su vez, por el servicio de cirugía gastroenterológica), el manejo quirúrgico, los hallazgos patológicos, la respuesta a la neoadyuvancia, el tratamiento posquirúrgico y la evolución a los 6 meses posteriores a la cirugía.
La calidad de los datos consignados en los formatos de recolección de casos fue verificada por el sistema de monitoría institucional. Posteriormente, la información fue organizada en una base de datos.
Finalmente, bajo la supervisión y la colaboración del grupo de investigación clínica, la información fue analizada y presentada de forma descriptiva y gráfica. El análisis estadístico, tipo descriptivo, del grupo de pacientes que recibieron el tratamiento neoadyuvante con quimiorradioterapia, se realizó mediante el cálculo de medidas de tendencia central para las variables cuantitativas y el cálculo de proporciones para las variables cualitativas mediante STATA.
El presente estudio describe las características demográficas, clínicas e histológicas, y la evolución de los pacientes con cáncer de recto localmente avanzado que recibieron manejo neoadyuvante con quimiorradioterapia en el INC a lo largo de 2010, por ser este el centro de referencia en cáncer más importante de Colombia, pues no hay estudios que muestren las principales variables del cáncer de recto localmente avanzado ni cuáles son la respuesta y la toxicidad del manejo neoadyuvante con quimiorradioterapia en el medio colombiano.
ResultadosSe eligió a 41 pacientes; de ellos, fueron excluidos 8 por las siguientes razones:
- •
Un paciente, por recibir tratamiento neoadyuvante solo con radioterapia y tener una neoplasia sincrónica.
- •
Un paciente, por presentar enfermedad con estadio uT2.
- •
Un paciente, por presentar diagnóstico de carcinoma de canal anal.
- •
Un paciente, por presentar enfermedad metastásica y tener una neoplasia sincrónica.
- •
Cuatro pacientes, por presentar enfermedad metastásica.
Por lo anterior, el análisis está basado en la información de 33 pacientes con cáncer de recto localmente avanzado, que recibieron tratamiento neoadyuvante con quimiorradioterapia.
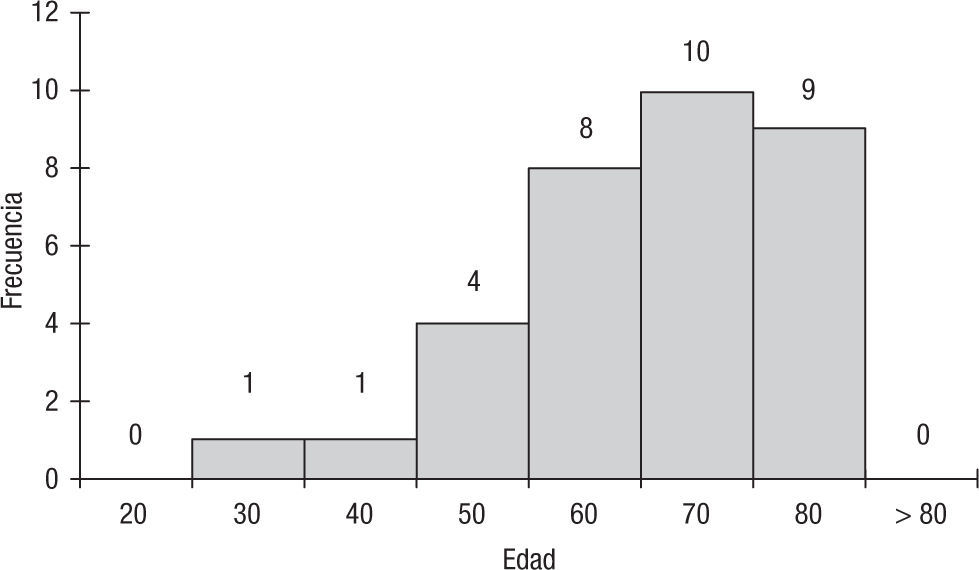
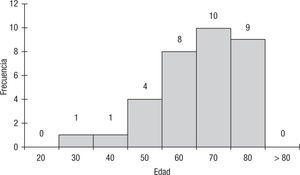
El promedio de edad de los pacientes fue de 61 años, con un rango entre los 29 y los 79 años (fig. 1). El 39% de los pacientes fueron mujeres, y el 61%, hombres. El estado funcional en el momento del diagnóstico fue bueno en la mayoría de los pacientes, según la escala de Karnofsky: 6 pacientes tuvieron un puntaje de 70; 7 pacientes, 80; 13 pacientes, 90, y 7 pacientes, 100.
En cuanto a la diferenciación histológica, los tumores eran bien diferenciados en 17 pacientes; moderadamente diferenciados en 11; mal diferenciados en 3, y no se reportó grado de diferenciación histológica en 2 tumores.
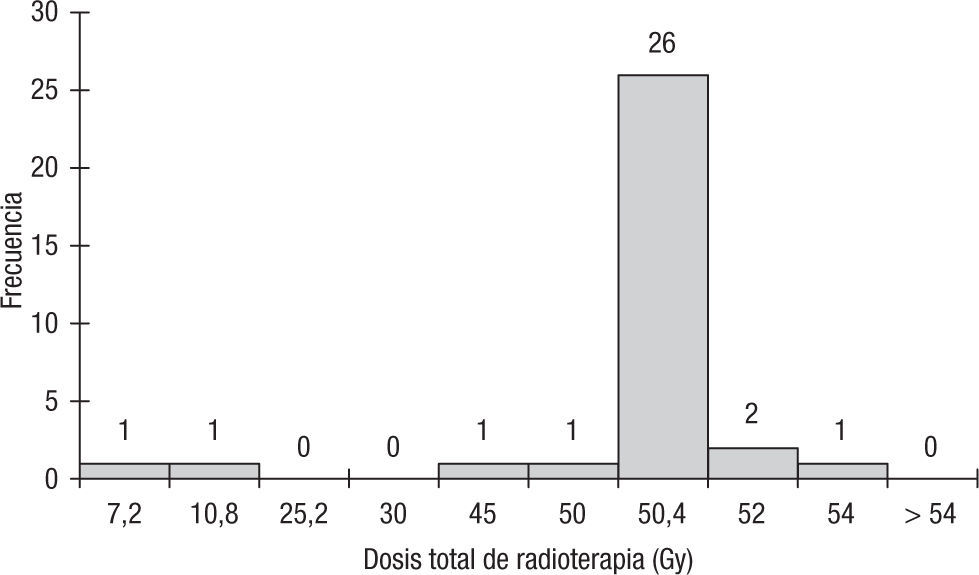
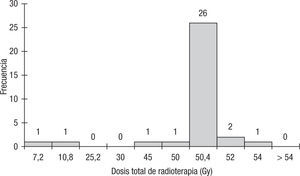
El tratamiento neoadyuvante que recibieron los pacientes con cáncer de recto localmente avanzado se basó en fluoropirimidinas concomitantes con radioterapia. El principal esquema de quimioterapia empleado fue 5 fluorouracilo y leucovorín en bolo la primera y la quinta semanas de la radioterapia, el cual fue administrado a 32 de los 33 pacientes; solo un paciente recibió tratamiento con capecitabina. La dosis de radioterapia administrada a los pacientes estuvo en un rango entre 7,2 y 54 Gy; el 78% (26/33) de los pacientes recibieron una dosis total de 50,4 Gy (fig. 2).
La adherencia al tratamiento fue buena: 30 de los 33 pacientes completaron el esquema de tratamiento neoadyuvante con quimiorradioterapia; el esquema se consideró completo cuando el paciente recibió las dosis totales de quimioterapia y de radioterapia indicadas por el oncólogo clínico y el oncólogo radioterapeuta tratante.
En cuanto a la evaluación de la toxicidad del tratamiento, en el presente estudio solo se tuvieron en cuenta los efectos adversos grado 3 o mayores, los cuales se presentaron en 5 pacientes (13,8%): 3 pacientes con radiodermitis grado III, 1 paciente con diarrea grado III y 1 muerte al terminar la primera semana de tratamiento, por perforación intestinal, peritonitis y choque séptico. Se encontró que 19 de los 33 pacientes (61%) requirieron la realización de colostomía previamente al inicio del tratamiento neoadyuvante o durante la cirugía de resección tumoral.
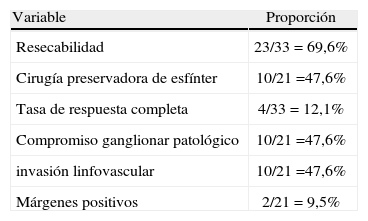
Con el tratamiento neoadyuvante se logró que se consideraran resecables los tumores de 23 de los 33 pacientes. Las razones para considerar como no candidatos para cirugía a 10 pacientes fueron: persistencia tumoral con masa fija a pelvis (2 pacientes); progresión de la enfermedad (un paciente por compromiso peritoneal, y uno, por compromiso pulmonar y hepático); deterioro funcional hasta ECOG 3 (2 pacientes); alto riesgo quirúrgico por comorbilidades cardíacas o pulmonares (3 pacientes) y muerte (1 paciente, tras la primera semana de tratamiento, por perforación intestinal). Sin embargo, solo a 21 pacientes se les realizó cirugía, pues 2 de los 23 considerados resecables no asistieron a la intervención quirúrgica.
El tiempo entre la finalización de la neoadyuvancia y la realización de cirugía fue entre 6 y 10 semanas para 7 pacientes (33%) y 14 pacientes (67%) fueron operados en un tiempo igual o mayor a 12 semanas. Se logró preservación del esfínter anal en 10 pacientes. El tipo de intervención quirúrgica que se realizó fue: resección abdominoperineal en 11 pacientes, resección anterior baja en 9 pacientes y resección endoscópica transanal en 1 paciente.
La respuesta patológica al tratamiento neoadyuvante se determinó en el espécimen quirúrgico; se clasificó como completa, parcial y sin respuesta. En acuerdo con el servicio de patología, se hizo una conversión de la escala de Mandard, considerando que: grado I es respuesta completa; grados II, III y IV, respuesta parcial, y grado V, sin respuesta. Con base en lo anterior, se halló en los 21 pacientes llevados a cirugía: respuesta completa en 4 pacientes, respuesta parcial en 14 pacientes y 3 pacientes sin respuesta. Los resultados clínicos y los hallazgos patológicos obtenidos con la quimiorradioterapia neoadyuvante se muestran en la tabla 3.
A los 21 pacientes que después del tratamiento neoadyuvante fueron llevados a cirugía se les evaluó su condición clínica 6 meses después de la intervención quirúrgica. Los hallazgos se describen en la tabla 4.
Condición clínica después de 6 meses en los pacientes llevados a cirugía.
| Estado de paciente a los 6 meses de cirugía* | Pacientes |
| Sin enfermedad | 13 |
| Recaída local y a distancia | 4 |
| Pérdida | 4 |
| Recaída a distancia | 0 |
| Recaída local | 0 |
| Muerte | 0 |
| Total | 21 |
En cuanto a los 12 pacientes que no fueron llevados a cirugía, se desconoce la evolución clínica de la mayoría de ellos, pues no continuaron tratamiento o seguimiento clínico en el INC: 8 pacientes no fueron localizados durante el seguimiento (2 pacientes con tumores considerados resecables y 6 pacientes con tumores considerados irresecables), 1 paciente recibió quimioterapia paliativa y 3 pacientes fallecieron.
Las causas de las muertes que se documentaron en el grupo de 33 pacientes fueron:
- •
Una muerte relacionada con el cáncer, al terminar la primera semana de tratamiento neoadyuvante, debido a perforación intestinal, peritonitis y choque séptico.
- •
Dos muertes no relacionadas con el cáncer: 1 por fascitis necrotizante y 1 por úlcera sacra necrótica e infectada; ambos casos con choque séptico.
Las pérdidas durante el seguimiento fueron del 36% (12/33 pacientes): 4 de los pacientes llevados a cirugía y 8 pacientes no llevados a cirugía.
DiscusiónEn Colombia, solo un estudio de cohorte, realizado en Medellín, había descrito el beneficio de la neoadyuvancia con quimiorradioterapia concomitante con 5 fluorouracilo y leucovorín en 40 pacientes con cáncer de recto localmente avanzado. 4 pacientes lograron respuesta patológica completa (10%), y en ellos el tratamiento fue bien tolerado, sin aumento de la morbilidad postoperatoria y permitiendo un mayor número de procedimientos preservadores del esfínter anal; a 8 pacientes se les realizó resección abdominoperineal, y a 29, resección anterior baja23.
Respecto a las características demográficas de los pacientes, la edad promedio, de 61 años, y el predominio del sexo masculino es similar a lo descrito en los estudios NSABP RO-0313 y el estudio alemán CAO/ARO/AIO 9414. Aunque las guías National Comprehensive Cancer Network18 recomiendan el uso de la ultrasonografía endorrectal en la estadificación de los pacientes con cáncer rectal, esta no se realizó en ninguno de los 33 pacientes incluidos en el análisis.
Las dosis y los esquemas de quimioterapia y de radioterapia utilizados como tratamiento neoadyuvante en la presente serie son acordes con lo establecido por las guías de manejo18,19; sin embargo, es llamativa la mínima utilización de capecitabina, lo cual puede deberse a que dicho medicamento no está incluido en el Plan Obligatorio de Salud para el manejo del cáncer de recto, lo cual habría podido generar retrasos en el tratamiento, por demoras en la autorización y la entrega del fármaco.
Aunque el intervalo óptimo entre la finalización de la neoadyuvancia y la realización de la cirugía no está claro, las guías National Comprehensive Cancer Network18 recomiendan que sea entre 5 y 10 semanas. Sin embargo, se ha descrito que la realización de la cirugía en cáncer rectal localmente avanzado en un intervalo entre 7 y 12 semanas después de terminado el tratamiento neoadyuvante con quimiorradioterapia puede mejorar la tasa de respuesta patológica y el downstaging tumoral21, y disminuir morbilidad posquirúrgica, como filtración de la anastomosis y alteración de la cicatrización de las heridas24, sin aumentar la tasa de recaída local ni a distancia ni afectar adversamente la supervivencia libre de progresión, como tampoco la supervivencia global a 5 años25,26.
En esta serie de casos, solo 7 de los 21 llevados a cirugía (33%) fueron operados en un período entre 6 y 10 semanas luego de finalizar el tratamiento neoadyuvante, lo que podría deberse a demoras en la autorización o en la oportunidad para la valoración por el servicio de cirugía gastrointestinal, dificultades en la autorización y la realización de estudios complementarios para determinar la resecabilidad del paciente, o falta de disponibilidad de turno en la sala de operaciones.
El 61% de los pacientes requirió colostomía, porque presentaban previamente, al inicio del tratamiento neoadyuvante, estenosis rectal severa, con riesgo de obstrucción, y otros pacientes, porque el cirujano lo consideró necesario durante la resección tumoral; principalmente, por no lograr preservación del esfínter anal.
La tasa de preservación del esfínter, del 46%, es similar a lo reportado en la literatura. En el estudio NSABP R0313 fue del 47%, y en el estudio CAO/ARO/AIO 9414, del 39%. La respuesta patológica al tratamiento neoadyuvante, del 12%, está dentro de lo esperado: en el estudio hecho previamente en Colombia fue del 10%23; en el estudio NSABP R0313, del 15%, y en el estudio CAO/ARO/AIO 9414, del 8%.
Varios autores han evaluado cuál es la significancia pronóstica de la respuesta patológica en pacientes con cáncer rectal manejados con quimiorradioterapia neoadyuvante, y hallaron que es un factor pronóstico de recurrencia y supervivencia libre de progresión27,28.
Un pool de análisis de datos individuales que incluyó 27 estudios con 3.105 pacientes con cáncer de recto localmente avanzado, manejados con quimiorradioterapia neoadyuvante, encontró que los 484 pacientes que lograron respuesta patológica completa tuvieron menor posibilidad de recurrencia local o a distancia hazard ratio 0,54 y mejor supervivencia libre de progresión a 5 años del 83% frente a 65% HR 0,44 (intervalo de confianza 95% 0,34–0,57) p<0,000129.
En esta serie de casos, al evaluar la condición de los pacientes 6 meses después de la cirugía, no se documentaron recurrencias en los pacientes con respuesta patológica completa, y en total, 13 de los 21 pacientes llevados a cirugía estaban libres de enfermedad.
Otros factores pronósticos independientes que se han descrito en pacientes con cáncer rectal localmente avanzado manejados con tratamiento neoadyuvante son: el estadio patológico tumoral, el compromiso nodal, el compromiso del margen circunferencial y la invasión linfovascular, los cuales deben tenerse en cuenta para elegir el esquema y la duración del tratamiento adyuvante21,28,30.
La toxicidad aguda del tratamiento neoadyuvante es, principalmente, gastrointestinal, e incluye diarrea, sangrado, dolor abdominal, obstrucción debida a estenosis o adhesiones, necrosis, perforación intestinal y fístulas4,5,14,26, cuya frecuencia es similar a la encontrada en esta serie de casos. También, se reportan síntomas genitourinarios; principalmente, tenesmo vesical, sangrado y disuria, además de síntomas ginecológicos, como resequedad vaginal y dispareunia26, los cuales no se documentaron en los registros clínicos de los 33 pacientes incluidos.
Las pérdidas fueron elevadas; posiblemente, no por falta de adherencia de los pacientes al tratamiento y al seguimiento, sino por el traslado a otros centros médicos de atención oncológica cuando así lo disponía la empresa prestadora de servicios de salud a la cual estaba afiliado el paciente.
Esta serie de casos describe las características sociodemográficas y clínicas de los pacientes con cáncer de recto localmente avanzado atendidos en el Servicio de Oncología del INC durante 2010, quienes fueron tratados, principalmente, con el esquema de quimiorradioterapia basado en 5 fluorouracilo y leucovorín en bolos, con alta adherencia y aceptable toxicidad.
Se logró resecabilidad del tumor, preservación del esfínter y respuesta patológica en, aproximadamente, la mitad de los pacientes; además, el 60% de los pacientes llevados a cirugía (13/21) estaban libres de enfermedad 6 meses después de la intervención quirúrgica.
Las limitaciones del presente estudio son: el tamaño de la muestra, el seguimiento corto, la alta tasa de pérdidas (36%), la no evaluación de la morbilidad quirúrgica y su carácter retrospectivo; sin embargo, los resultados son acordes con lo reportado en la literatura, y la información obtenida sirve como punto de partida para mejorar la atención integral de los pacientes con cáncer de recto localmente avanzado, y para desarrollar estudios prospectivos sobre esta patología en el país.
Con el fin de optimizar la atención integral de los pacientes con cáncer de recto localmente avanzado en el INC, se plantea hacer una valoración inicial multidisciplinaria, con la participación de oncología clínica, radioterapia, patología, radiología y cirugía gastroenterológica, para establecer el plan de manejo acorde con las guías National Comprehensive Cancer Network; implementar el uso de ultrasonografía endorrectal, con el fin de mejorar la estadificación; aumentar el uso de capecitabina concomitante con radioterapia; evaluar de forma minuciosa la toxicidad del tratamiento y realizar la intervención quirúrgica de resección tumoral de forma más oportuna; establecer un sistema de seguimiento del paciente que incluya el diseño de una base de datos y un plan de llamado telefónico, para recordar al paciente las citas a valoraciones, la realización de estudios diagnósticos, la fecha y hora de aplicación de quimioterapia y la administración de radioterapia.
Adicionalmente, se debe entregar esta información por escrito al paciente, en un carné, con el fin de incentivar la adherencia del paciente y el cumplimiento del plan de manejo, además de conocer su evolución, aunque no continúe su tratamiento y su valoración en el INC. También, intervenir administrativamente cuando exista un problema que altere el curso del tratamiento, con el apoyo de trabajo social, la asociación de pacientes y usuarios del INC, y la oficina jurídica; realizar, semestral o anualmente, una evaluación multidisciplinaria de los desenlaces clínicos de los pacientes con cáncer de recto localmente avanzado, que permita identificar falencias en el modelo de atención y plantear soluciones que mejoren los esquemas de tratamiento, con menor toxicidad, mayores tasas de respuesta y preservación de esfínter, buscando, a su vez, mejorar la supervivencia y la calidad de vida. Finalmente, generar información para futuras publicaciones.
Se necesitan futuros experimentos aleatorizados para determinar y validar nuevos biomarcadores que sean predictores de respuesta patológica completa, en pro de conocer nuevas combinaciones y formas de administración de quimioterapia, terapia target y radioterapia que sean efectivas y bien toleradas como tratamiento neoadyuvante, los cuales lleven a optimizar los resultados en cáncer rectal localmente avanzado.
Al grupo de Monitoría de Estudios Clínicos del INC.