Describir las características clínicas y epidemiológicas de los pacientes con osteosarcoma de extremidad de alto grado tratados entre 2007 y 2010 con los protocolos Rizzoli 2 o Rizzoli 4 en el Instituto Nacional de Cancerología.
Materiales y métodosSe analizaron las historias clínicas de pacientes con osteosarcoma de extremidad que recibieron tratamiento con los regímenes Rizzoli 2 o Rizzoli 4. Se utilizaron técnicas de estadística descriptiva y se estimaron funciones de supervivencia para mortalidad y recaída.
ResultadosSe encontraron un total de 18 pacientes que recibieron protocolo Rizzoli. Con edad promedio de 25 años (DE=10,2) y localización anatómica más frecuente en el fémur. 15 de los 18 pacientes que recibieron quimioterapia preoperatoria fueron llevados a cirugía, lográndose la preservación de la extremidad en 9 de ellos (60%); los demás requirieron amputación. Entre los 15 pacientes operados, se encontró buena respuesta patológica (viabilidad tumoral ≤ 10%) en 5 (33,33%). Luego de un seguimiento de 2 años, el 57% de los pacientes se encontraban vivos. El evento adverso no hematológico más frecuente fue la elevación de transaminasas grado 3. La toxicidad hematológica más frecuente fue la leucopenia grado 2 y neutropenia grado 3.
De los 18 pacientes, 7 abandonaron el tratamiento (2 durante la neoadyuvancia y 5 en la adyuvancia).
ConclusionesEl uso de los protocolos Rizzoli 2 y 4 en la población incluida dio como resultado tasas de respuesta, preservación de extremidad y supervivencia global menores que las reportadas en las publicaciones originales.
To describe the clinical and epidemiological characteristics of patients with osteosarcoma high grade limb osteosarcoma treated between 2007 and 2010 using Rizzoli 2 or Rizzoli 4 protocols in the National Cancer Institute, Colombia.
Materials and methodsAn analysis was made of the medical histories of patients with limb osteosarcoma who had received treatment with the Rizzoli 2 or Rizzoli 4 protocol. Descriptive statistics were used and survival and recurrence rates were estimated.
ResultsA total of 18 patients were found that had received treatment using the Rizzoli protocol. The mean age was 25 years (SD=10.2) and the most frequent anatomical location was in the femur. Surgery was performed on 15 of the 18 patients who received pre-operative chemotherapy, with limb salvage being achieved in 9 (60%) of them, and the remainder required amputation. A good pathological response was observed in the 15 patients who received surgery (tumor viability ≤ 10%) in 5 (33.33%). In the follow up at 2 years, 57% of the patients were still alive. The most frequent non-hematological adverse event was a grade 3 increase in transaminases. The most frequent hematology event was grade 2 leukopenia and grade 3 neutropenia
Of the 18 patients, 7 of them dropped out of the treatment (2 during neoadjuvant and 5 during adjuvant).
ConclusionsThe use of the Rizzoli 2 and 4 protocols in this population gave lower response, limb salvage, and overall survival rates than those reported in other publications.
El osteosarcoma es, después del mieloma múltiple, la neoplasia primaria del hueso más frecuente1. Los hombres son los más afectados, en una relación 1,2–1,5:1 1,2 y con una tasa de mortalidad cercana a 0,15/100.000 habitantes/año3.
Tiene un pico de presentación en la segunda década de la vida (14 a 20 años), por lo cual la mayoría de los estudios involucran niños, mientras que los datos en población adulta son escasos2,3.
Los osteosarcomas se han clasificado según la profundidad del compromiso inicial (superficial vs central), según el grado y el subtipo histológico, de la siguiente forma4:
- 1)
Osteosarcomas de superficie: abarcan el osteosarcoma parostal de bajo grado, el osteosarcoma perióstico y el osteosarcoma de superficie de alto grado.
- 2)
Osteosarcoma central (intramedular): usualmente de alto grado, es la forma más común de osteosarcoma e histológicamente se subdivide en: osteoblástico (45%), condroblástico (27%), fibroblástico (9%), anaplásico (17%), telangiectásico (1%), de célula pequeña (1%), y otros tipos (1%). Los tipos osteoblásticos, fibroblásticos y condroblásticos en conjunto, son llamados osteosarcomas convencionales. Los casos de osteosarcomas intramedulares de bajo grado son anecdóticos5.
Hay dos sistemas de estadificación aceptados para el osteosarcoma (ver tabla 1). El primero es el sistema quirúrgico propuesto por Enneking y adoptado posteriormente por la Musculoskeletal Tumor Society (MTS)6,7. El segundo es el de la Unión Internacional Contra el Cáncer (UICC) y el American Joint Cancer Commitee (AJCC) de acuerdo al concepto TNM8. En la práctica clínica se aconseja utilizar ambos sistemas9.
Sistemas de estadificación de osteosarcoma
| Sistemas de estadificación de osteosarcoma | ||||
| Enneking | ||||
| Estadio | Grado | Sitio | Metástasis | |
| IA | Bajo (G1) | Intracompartimental (T1) | No metástasis (M0) | |
| IB | Bajo (G1) | Extracompartimental (T2) | No metástasis (M0) | |
| IIA | Alto (G2) | Intracompartimental (T1) | No metástasis (M0) | |
| IIB | Alto (G2) | Extracompartimental (T2) | No metástasis (M0) | |
| III | Cualquier grado | Cualquier T | Metástasis regional o a distancia (M1) | |
| UICC – AJCC | ||||
| Categorías de estadificación | ||||
| Tumor Primario(T) | TX: tumor primario no puede ser evaluado.T0: no evidencia de tumor primario.T1: tumor ≤ 8 cms en su dimensión mayor.T2: tumor > 8 cms en su dimensión mayor.T3: tumores discontinuos en el hueso del tumor primario. | |||
| Ganglios (N) | NX: ganglios linfáticos regionales no pueden ser evaluados.N0: no metástasis ganglionares regionales.N1: metástasis a ganglios linfáticos regionales. | |||
| Metástasis (M) | M0: no metástasis a distancia.M1: metástasis a distancia.M1a: pulmón.M1b: otros sitios distantes. | |||
| Grado (G) | GX: grado histológico no puede ser evaluado.G1, G2: bajo grado.G3, G4: alto grado. | |||
| Agrupación en estadios | ||||
| T | N | M | G | |
| Estadio IA | T1 | N0 | M0 | G1, G2, bajo grado, GX |
| Estadio IB | T2 | N0 | M0 | G1, G2, bajo grado, GX |
| T3 | N0 | M0 | G1, G2, bajo grado, GX | |
| Estadio IIA | T1 | N0 | M0 | G3, G4, alto grado |
| Estadio IIB | T2 | N0 | M0 | G3, G4, alto grado |
| Estadio III | T3 | N0 | M0 | G3, G4 |
| Estadio IVA | Cualquier T | N0 | M1a | Cualquier G |
| Estadio IVB | Cualquier T | N1 | Cualquier M | Cualquier G |
| Cualquier T | Cualquier N | M1b | Cualquier G | |
El manejo quirúrgico es la piedra angular del tratamiento locorregional, pero usado como modalidad terapéutica exclusiva falla en 80 a 90% de los casos debido a frecuentes micrometástasis tempranas1,10.
Inicialmente se brindaba a los pacientes manejo quirúrgico radical (amputación), pero posteriormente se desarrollaron técnicas que permitían la resección curativa y preservar la extremidad, lo que permite mantener la funcionalidad y una mejor calidad de vida, y por tal motivo deben intentarse siempre que sea posible11–15.
Estudios que evalúan la radioterapia adyuvante no han mostrado impacto en supervivencia 16,17, por lo que esta modalidad de tratamiento debe reservarse para pacientes que no acepten manejo quirúrgico o que tengan tumores irresecables y para aquellos llevados a cirugía con bordes macro o microscópicamente comprometidos que no puedan ser re-operados18.
La quimioterapia es un pilar importante del tratamiento del osteosarcoma que administrada de forma pre y postoperatoria ha logrado tasas de curación de 60 a 70% y tasas de preservación de extremidad entre 70 y 95%19. Los agentes de quimioterapia más activos para esta enfermedad son: antraciclinas, platinos, ifosfamida, ciclofosfamida, metotrexate, etopósido y alcaloides de la vinca. Estos se pueden administrar en variedad de combinaciones, sin existir un estándar aceptado.
Un ensayo clínico fase III publicado en 1992 mostró que un régimen de quimioterapia de cisplatino y doxorrubicina obtiene desenlaces de eficacia similares y menor toxicidad que un régimen de 3 medicamentos que además de las anteriores incluyó metotrexate20, por lo que se usó en el Instituto Nacional de Cancerología hasta los primeros años de la década del 2000.
Desde las descripciones tempranas de Huvos et al21, varios estudios han demostrado que tasas de respuesta patológica buenas (definida como viabilidad tumoral ≤ 10% o necrosis ≥ 90% después de quimioterapia neoadyuvante) se correlacionan con mejor supervivencia global22–27. Estudios posteriores evaluaron combinaciones de múltiples agentes de quimioterapia con el objetivo de mejorar las tasas de respuesta patológica, la probabilidad de preservación de extremidad y la supervivencia.
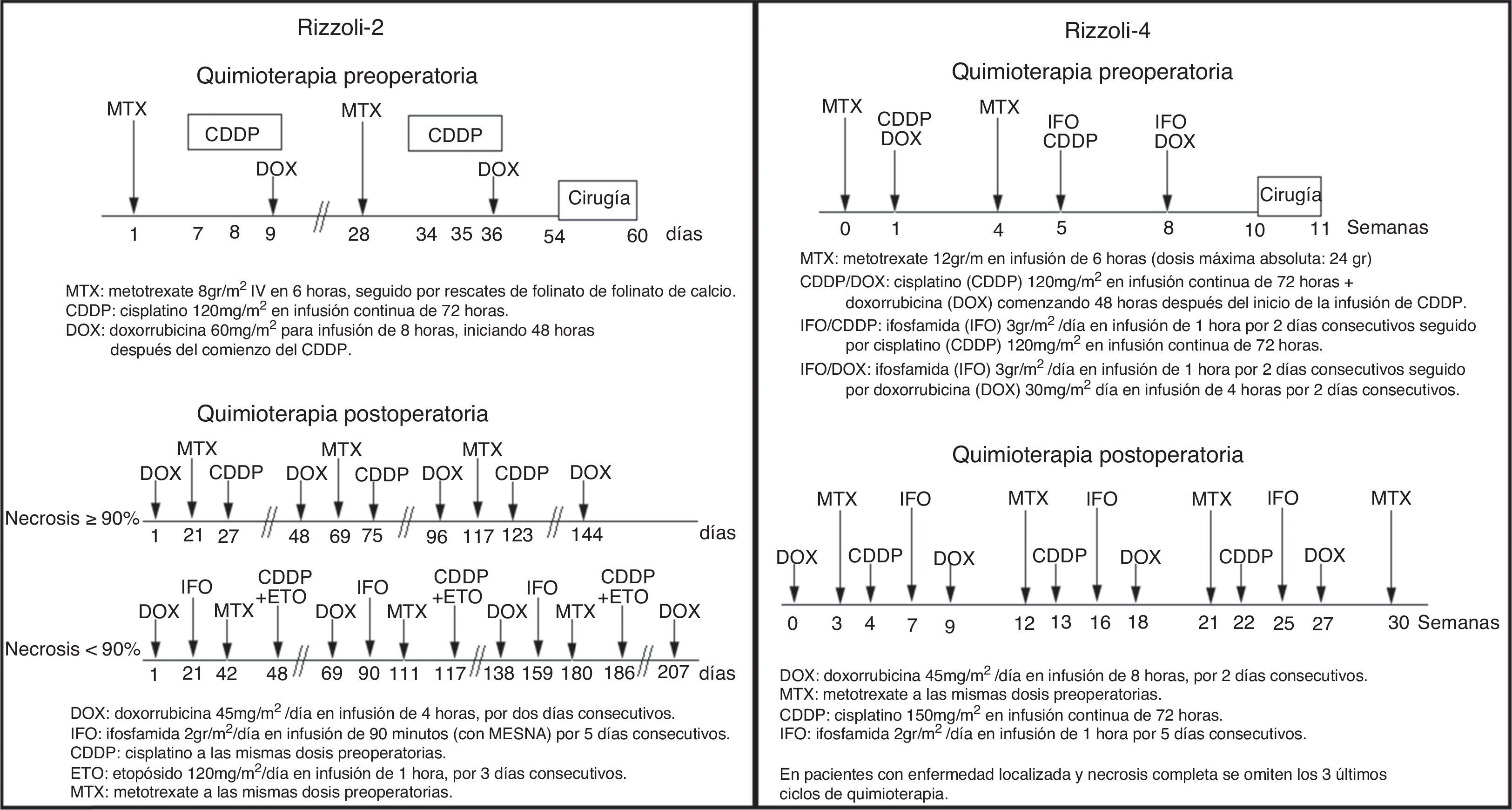
Desde 2007 se implementaron los protocolos de quimioterapia utilizados en el Instituto Ortopédico Rizzoli de Bologna en el servicio de oncología clínica del Instituto Nacional de Cancerología de Bogotá. Específicamente se aplicó el protocolo Rizzoli-2 que incluyó pacientes con osteosarcoma intramedular no metastásico sin tratamiento previo y les brindó quimioterapia neoadyuvante con metotrexate (MTX), doxorrubicina (DOX) y cisplatino (CDDP) durante 54 días, seguido por cirugía y posteriormente quimioterapia adyuvante cuya duración dependía de la respuesta histológica (144 días adicionales en buenos respondedores y 207 días, con inclusión de etopósido (ETO) e ifosfamida (IFO) a los malos respondedores). En este estudio se reportan tasas de supervivencia global y libre de progresión a 2, 5 y 10 años de: 93%, 75%, 70% y de 78%, 63% y 59%, respectivamente y tasas de preservación de la enfermedad del 82%28.
El protocolo Rizzoli-4 para pacientes con enfermedad metastásica o sin ella29 con supevivencia de 94%. El protocolo Rizzoli-4 utiliza MTX, DOX, CDDP e IFO durante 8 semanas en la fase preoperatoria, luego se sigue por cirugía entre las semanas 10 y 11, y finalmente quimioterapia postoperatoria con los mismos medicamentos durante 30 semanas. En los pacientes con enfermedad localizada se logró cirugía de preservación de extremidad en el 94% de pacientes, buena respuesta histológica en 77%, supervivencia global a 5 años del 71% y supervivencia libre de enfermedad del 56% 29.
En la figura 1 se presentan los regímenes de tratamiento de los protocolos Rizzoli-2 y Rizzoli-4.
El presente trabajo describe las características clínicas y epidemiológicas de los pacientes con osteosarcoma de extremidad tratados con los protocolos Rizzoli 2 o Rizzoli 4 en el Instituto Nacional de Cancerología entre 2007 y 2010.
MetodologíaEste fue un estudio de tipo serie de casos, en el que se incluyeron pacientes con osteosarcoma de extremidad de alto grado confirmado histológicamente, mayores o igual a 18 años y que habían recibido al menos una dosis de tratamiento de los protocolos Rizzoli-2 o Rizzoli-4 en el Instituto Nacional de Cancerología entre 2007 y 2010. Se excluyeron casos de: osteosarcoma axial, osteosarcomas secundarios (radioinducidos y los secundarios a enfermedad de Paget) y pacientes con otras neoplasias previas o concurrentes.
Los pacientes fueron identificados en el sistema de base de datos del Instituto y luego, de verificados los criterios de elegibilidad, se registraron las variables del estudio en un instrumento de recolección de datos que comprendía dos formularios: el primero contenía información sobre características demográficas y clínicas de los pacientes; el segundo fue utilizado para recoger la información sobre los eventos adversos presentados en cada ciclo de quimioterapia según los Criterios de Terminología Común Para Eventos Adversos (CTCAE) versión 3.030.
Para el análisis estadístico se utilizaron herramientas descriptivas (medias o medianas junto con sus correspondientes medidas de dispersión en el caso de variables continuas, o porcentajes para variables discretas), y se estimaron funciones de supervivencia de Kaplan-Meier y tasas de mortalidad que incorporaron en el denominador el tiempo de seguimiento aportado por cada paciente, contabilizado como el transcurrido entre la fecha de terminación o retiro del protocolo y fecha del último seguimiento. Los análisis se realizaron con el programa estadístico STATA 11. Los estimadores fueron presentados junto con sus intervalos de confianza del 95%.
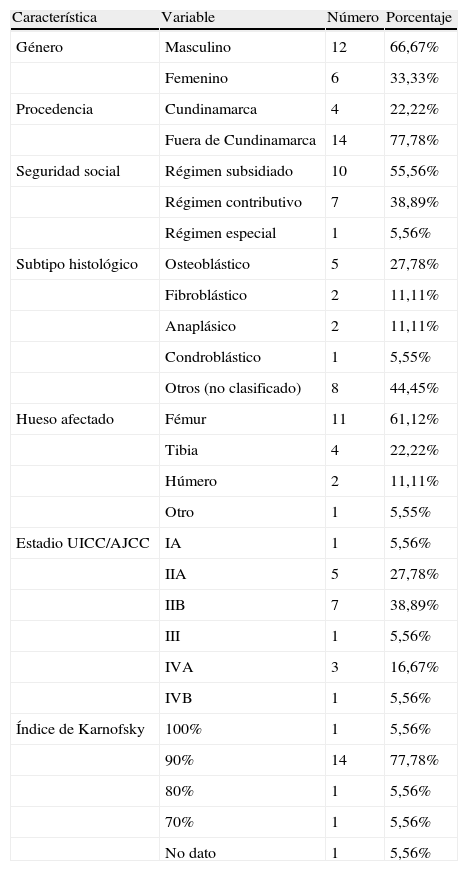
ResultadosDieciocho pacientes cumplieron los criterios de elegibilidad del estudio. En la tabla 2 se presentan las principales características demográficas y clínicas de los pacientes incluidos.
Características demográficas y clínico-patológicas de los pacientes incluidos
| Característica | Variable | Número | Porcentaje |
| Género | Masculino | 12 | 66,67% |
| Femenino | 6 | 33,33% | |
| Procedencia | Cundinamarca | 4 | 22,22% |
| Fuera de Cundinamarca | 14 | 77,78% | |
| Seguridad social | Régimen subsidiado | 10 | 55,56% |
| Régimen contributivo | 7 | 38,89% | |
| Régimen especial | 1 | 5,56% | |
| Subtipo histológico | Osteoblástico | 5 | 27,78% |
| Fibroblástico | 2 | 11,11% | |
| Anaplásico | 2 | 11,11% | |
| Condroblástico | 1 | 5,55% | |
| Otros (no clasificado) | 8 | 44,45% | |
| Hueso afectado | Fémur | 11 | 61,12% |
| Tibia | 4 | 22,22% | |
| Húmero | 2 | 11,11% | |
| Otro | 1 | 5,55% | |
| Estadio UICC/AJCC | IA | 1 | 5,56% |
| IIA | 5 | 27,78% | |
| IIB | 7 | 38,89% | |
| III | 1 | 5,56% | |
| IVA | 3 | 16,67% | |
| IVB | 1 | 5,56% | |
| Índice de Karnofsky | 100% | 1 | 5,56% |
| 90% | 14 | 77,78% | |
| 80% | 1 | 5,56% | |
| 70% | 1 | 5,56% | |
| No dato | 1 | 5,56% |
Se encontró predominancia del género masculino (66.67%) y el promedio de edad de los pacientes fue de 25 años (desviación estándar de 10.2 años) con un rango de 18 a 56 años. El subtipo histológico no fue reportado en 8 de los 18 pacientes y en quienes se clasificó el subtipo predominante era el osteoblástico.
Todos los tumores eran de alto grado histológico y el hueso más afectado fue el fémur. El estadio predominante según criterios AJCC fue el IIB, seguido por estadios II-A y IV-A. Únicamente dos de los pacientes tenían compromiso ganglionar y cuatro (22.2%) tenían enfermedad metastásica distante en pulmón o hueso. La mayoría de los pacientes tenía un adecuado estado funcional al comienzo del tratamiento, con un índice de Karnofsky predominante del 90%.
En 14 pacientes (77.78%) se utilizó el protocolo de quimioterapia Rizzoli-4 y en 4 pacientes (22.22%) el protocolo Rizzoli 2.
En cuanto al cumplimiento del tratamiento neoadyuvante, nueve (64.28%) de los pacientes que recibieron Rizzoli-4 y la totalidad de los pacientes del Rizzoli-2 completaron la quimioterapia preoperatoria programada.
En el grupo que recibió Rizzoli-4, cinco pacientes no completaron la neoadyuvancia; dos por abandono (uno no regresó a la institución y se desconoce su condición; el otro paciente decidió no continuar con la quimioterapia preoperatoria por lo que fue llevado a cirugía y posteriormente tuvo demoras en regresar a la consulta de oncología, considerándose que por el tiempo transcurrido ya no se beneficiaba con la quimioterapia adyuvante y se dejó en observación, encontrándose en el último control de febrero de 2012 libre de enfermedad). Dos pacientes fallecieron durante el tratamiento, uno de ellos por progresión de la enfermedad y otro por sepsis severa y neutropenia febril. Otro paciente no completó la neoadyuvancia porque presentó fractura patológica y toxicidad hepática y hematológica, por lo que se decidió llevar a cirugía sin completar la neoadyuvancia.
Quince de los pacientes (83.34%) fueron llevados a cirugía. De los tres pacientes no operados, uno decidió abandonar el tratamiento y el seguimiento, desconociéndose su estado actual. El segundo paciente falleció por toxicidad y el tercer paciente falleció por progresión de la enfermedad después de culminada la quimioterapia preoperatoria.
De los 15 pacientes llevados a cirugía, a nueve (60%) se les realizó cirugía con preservación de extremidad, mientras que los 6 restantes requirieron amputación.
Cinco (33.33%) de los pacientes operados tuvieron buena respuesta histológica a la quimioterapia preoperatoria (viabilidad tumoral ≤ 10%).
En catorce de los pacientes operados (93.33%) los bordes de resección fueron negativos, y quedaron comprometidos en un paciente.
Luego de la cirugía, 11 de los 15 pacientes operados continuaron recibiendo adyuvancia de acuerdo a los protocolos Rizzoli-2 (N 3) y Rizzoli-4 (N 8). Uno de los pacientes del protocolo Rizzoli-2 no inició adyuvancia por progresión de la enfermedad, y tres de los pacientes del Rizzoli-4 no iniciaron adyuvancia, uno por progresión de la enfermedad, uno por decisión propia y otro por cambio en el régimen de quimioterapia según criterio de su oncólogo tratante.
Entre los pacientes que iniciaron quimioterapia postoperatoria, sólo uno de los tres pacientes del Rizzoli-2 y tres de los ocho del Rizzoli-4 completaron todos los ciclos programados.
Cuando se analizaron las causas de no cumplimiento de la quimioterapia postoperatoria se encontró que: cuatro pacientes abandonaron el tratamiento luego de haber iniciado la adyuvancia; dos pacientes presentaron toxicidad inaceptable que obligó al retiro y un paciente falleció.
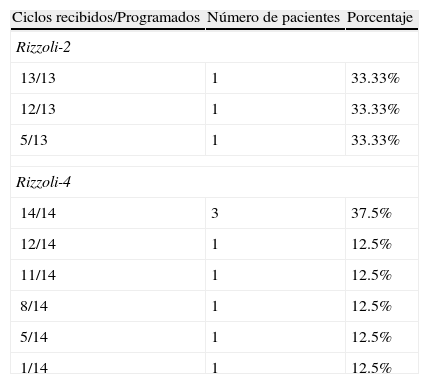
En cuanto a la relación entre los ciclos recibidos y los programados en la neoadyuvancia, se observó que el 72.2% de los sujetos recibió todos los ciclos preoperatorios, pero el 16.7% recibió un 60% o menos de la quimioterapia neoadyuvante programada.
En el tratamiento postoperatorio, de los tres pacientes que iniciaron Rizzoli-2 adyuvante, un paciente completó los 13 ciclos programados, un paciente recibió 12 ciclos y un paciente recibió 5 ciclos. En el grupo que inició adyuvancia Rizzoli-4, 3 pacientes (37.5%) completaron los 14 ciclos programados, en tanto que 2 pacientes (25%) recibieron menos del 50% de la quimioterapia adyuvante. Ver tabla 3.
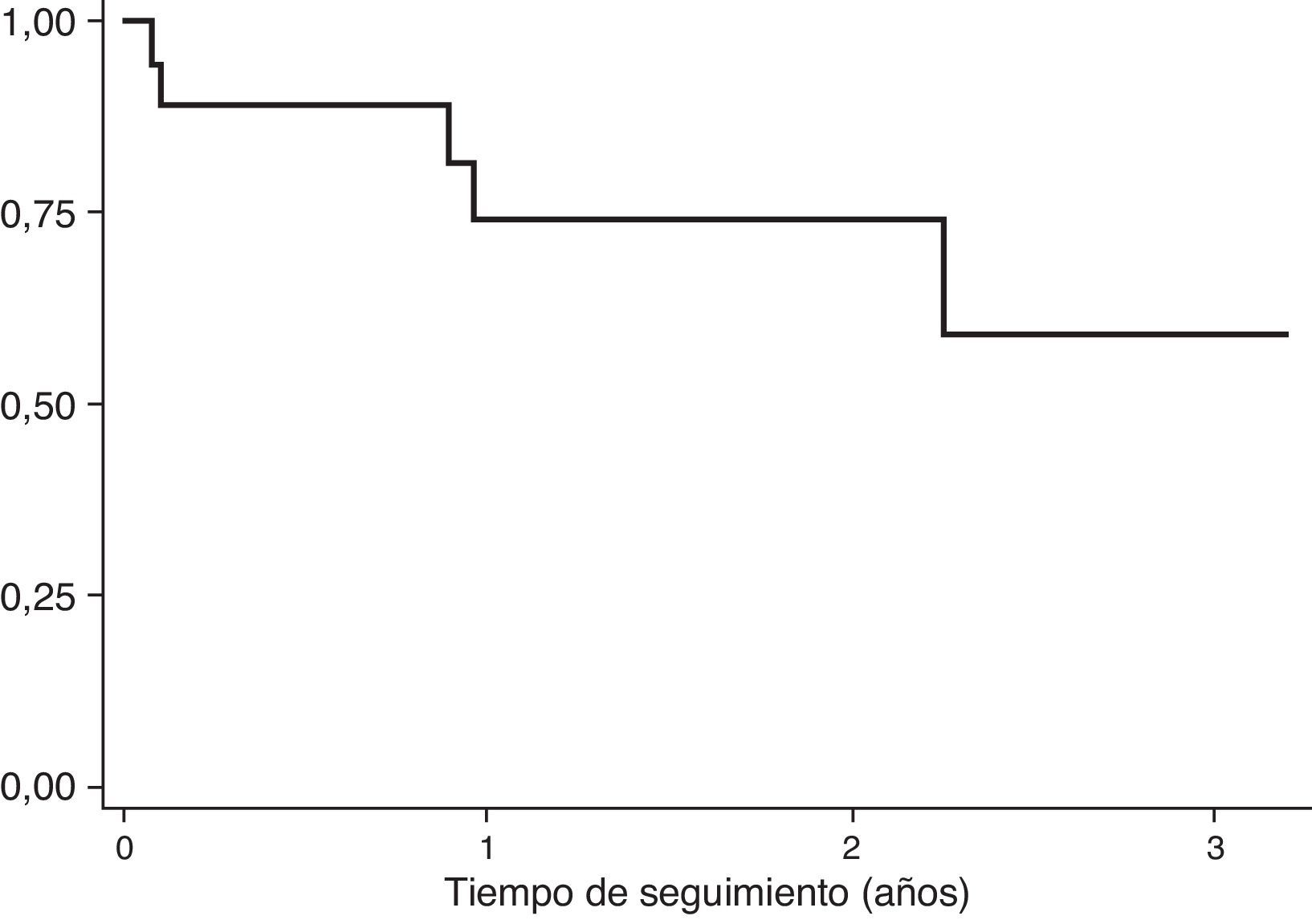
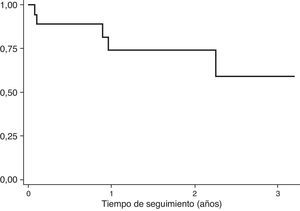
Durante el tiempo de seguimiento, 8 de 14 pacientes (57.14%) se encontraban vivos sin evidencia de recaída.
La tasa de mortalidad estimada en los pacientes incluidos fue de 20.05 muertes por 100 pacientes/año (IC95%: 8.34-48.17).
En la figura 2 se muestra la función de supervivencia luego de 2 años de seguimiento. Se observa que en esta muestra no se ha alcanzado aún la mediana de supervivencia.
Doce de los pacientes fueron considerados curados de la enfermedad y tres de ellos (25%) presentaron recaída tumoral para el momento de realizar el análisis. De los pacientes con enfermedad metastásica al inicio del tratamiento, el 20% presentó recaída/progresión. Se estimó una tasa de recaída tumoral de 24.65 por 100 pacientes/año (IC 95% 6.09-43.23).
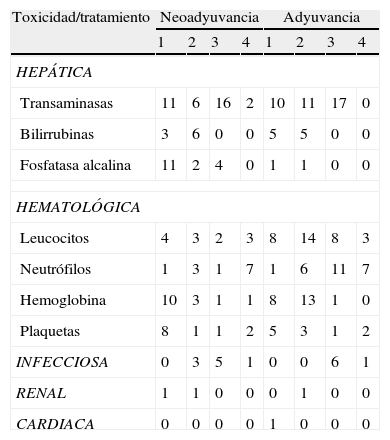
En cuanto a la toxicidad por quimioterapia, se observaron 113 episodios de eventos adversos, de los cuales el 45.13% se presentaron durante el tratamiento preoperatorio.
Cuando se analizan los eventos adversos presentados en neoadyuvancia, se observó que la mayoría de estos (80.39%) se presentaron en los tres primeros ciclos de tratamiento programados, mientras que en la adyuvancia los eventos adversos se presentaron en todos los ciclos de una forma más o menos similar entre ellos.
Se presentaron 79 episodios de toxicidad hepática, repartida de forma similar en neoadyuvancia (39 casos, correspondiente al 49.3%) y en la adyuvancia (40 casos, correspondiente al 50.63%); se observó una elevación de transaminasas en 73 casos, siendo en su mayoría toxicidad grado 3, tanto en neoadyuvancia como en adyuvancia. En cuanto a las bilirrubinas se observan 19 casos de toxicidad predominantemente grado 2 que se presenta de forma similar en la neoadyuvancia y la adyuvancia.
La toxicidad hematológica se presentó en el 34.85% de los ciclos y en adyuvancia en un 65.15%, la mayoria de los eventos fueron grado 2-3. La toxicidad infecciosa se presentó en 9 oportunidades en la neoadyuvancia y 7 veces en la adyuvancia. Esta toxicidad fue predominantemente grado 2 y grado 3. Entre las toxicidades infecciosas se encontró: un cuadro de neumonía (durante adyuvancia); tres infecciones urinarias (todas en neoadyuvancia); tres bacteremias asociadas al catéter para cada periodo de tratamiento; toxicidad gastrointestinal en una oportunidad (durante neoadyuvancia) y en una oportunidad se presentó neutropenia febril, tanto en neoadyuvancia como en adyuvancia. La toxicidad renal y cardiaca fue poco frecuente en este estudio y los pocos casos tuvieron una toxicidad máxima grado 2. Ver tabla 4.
Toxicidad por quimioterapia durante neoadyuvancia y adyuvancia
| Toxicidad/tratamiento | Neoadyuvancia | Adyuvancia | ||||||
| 1 | 2 | 3 | 4 | 1 | 2 | 3 | 4 | |
| HEPÁTICA | ||||||||
| Transaminasas | 11 | 6 | 16 | 2 | 10 | 11 | 17 | 0 |
| Bilirrubinas | 3 | 6 | 0 | 0 | 5 | 5 | 0 | 0 |
| Fosfatasa alcalina | 11 | 2 | 4 | 0 | 1 | 1 | 0 | 0 |
| HEMATOLÓGICA | ||||||||
| Leucocitos | 4 | 3 | 2 | 3 | 8 | 14 | 8 | 3 |
| Neutrófilos | 1 | 3 | 1 | 7 | 1 | 6 | 11 | 7 |
| Hemoglobina | 10 | 3 | 1 | 1 | 8 | 13 | 1 | 0 |
| Plaquetas | 8 | 1 | 1 | 2 | 5 | 3 | 1 | 2 |
| INFECCIOSA | 0 | 3 | 5 | 1 | 0 | 0 | 6 | 1 |
| RENAL | 1 | 1 | 0 | 0 | 0 | 1 | 0 | 0 |
| CARDIACA | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 |
El osteosarcoma es una de las neoplasias primarias óseas más frecuentes, y tiene un comportamiento agresivo y elevada morbilidad, por lo que se han realizado enormes esfuerzos terapéuticos como son el desarrollo de múltiples protocolos de quimioterapia neoadyuvante y adyuvante para mejorar la supervivencia global y la posibilidad de preservar la extremidad afectada.
Su pico de incidencia ocurre en la niñez y adolescencia, por lo que la mayoría de estudios se ha realizado en estos grupos etáreos. Al ser escasa la evidencia en adultos, los tratamientos para esta población se han extrapolado de los estudios pediátricos.
Desde 2007, en el servicio de oncología de adultos del Instituto Nacional de Cancerología se han utilizado los protocolos de quimioterapia Rizzoli-2 y Rizzoli-4 debido a las altas tasas de preservación de extremidad y de supervivencia reportadas28,29.
En el presente estudio se expuso la experiencia con la implementación de dichos protocolos en pacientes adultos con osteosarcoma de extremidad de alto grado tratados en el Instituto Nacional de Cancerología entre 2007 y 2010. Esta se constituyó como la serie más grande de pacientes adultos con osteosarscoma en Colombia, hasta el momento.
Como limitaciones para el análisis se reconoce tanto la naturaleza retrospectiva del estudio y el bajo número de casos incluidos. Sin embargo, al ser una patología poco frecuente en adultos, se considera que este número es importante.
En la serie de casos no fue posible reproducir los resultados reportados en los artículos originales de los protocolos Rizzoli-2 y Rizzoli-4. Se obtuvo buena respuesta histológica a quimioterapia neoadyuvante en 33.33% de los pacientes operados, lo cual contrasta con el 71% reportado en el reporte original del Rizzoli-2 (28) y el 77% en el Rizzoli-429.
Se logró cirugía de preservación de extremidad en 60% de los pacientes, mientras que en el Rizzoli-2 se logró preservación en el 82%28 y en el Rizzoli-4 en el 94%29.
La supervivencia encontrada fue menor que la informada en los reportes originales, sin embargo no puede hacerse una comparación adecuada por el tiempo corto de seguimiento.
Es importante reconocer que la mayoría de los pacientes no completaron el tratamiento programado, con una tasa de abandono (38,8%) y de eventos adversos limitantes de dosis (27.7%), cifras mayores que las reportadas en los estudios originales28,29.
Los pacientes incluidos en el estudio presentaban en la mayoría de ciclos de quimioterapia eventos adversos, siendo notoria la hipertransaminasemia asociada a metotrexate y la toxicidad hematológica.
Las bajas tasas de preservación de extremidad y de respuesta patológica a la quimioterapia podrían explicarse por: la alta tasa de abandono del tratamiento; la inclusión de un número importante de pacientes con tumores voluminosos y en estado avanzado (en nuestra serie 22% de pacientes tenían enfermedad metastásica), la alta frecuencia de toxicidad hepática y hematológica limitantes de dosis, y el fenómeno propio de una curva de aprendizaje al implementar un nuevo protocolo de tratamiento.
Se cree que la frecuencia de abandono se debe principalmente a la toxicidad presentada y a la duración prolongada del tratamiento (de 29 a 38 semanas en el Rizzoli-2 y 43 semanas en el Rizzoli-4).
Se considera que el número de muertes tóxicas en esta serie es inaceptablemente alto y razón suficiente para suspender el uso de estos regímenes en el servicio de oncología clínica de adultos del Instituto Nacional de Cancerología.
Inicialmente se consideró que pacientes adultos no podrían tolerar la intensidad de los protocolos pediátricos31, sin embargo datos recientes sugieren que pacientes adultos pueden tener menor toxicidad hematológica que niños y adolescentes. En el metaanálisis de Collins et al. que incluyó 24 estudios prospectivos en osteosarcoma se reporta que adultos y adolescentes tienen menos neutropenia y trombocitopenia grados 3 y 4 que los niños (P < 0,001), sin diferencia estadísticamente significativa en el riesgo de muerte por toxicidad (P= 0,11), en tanto que las tasas de buena respuesta histológica a la quimioterapia neoadyuvante es mejor en niños que en adultos (59,3% vs 44,9%; P < 0,001)32. Un estudio italiano también mostró que la toxicidad hematológica (neutropenia, trombocitopenia) fue menor en adultos, pero en estos se documentó una excreción retardada del metotrexate que podría explicar otras toxicidades, como la hepática33.
Aunque inicialmente se pensó que incluir más agentes de quimioterapia en la neoadyuvancia podría incrementar la posibilidad de buena respuesta histológica, la evidencia nos dice que esto no es necesariamente cierto.
El uso de ifosfamida desde la neoadyuvancia es controvertido dado que el ensayo clínico aleatorizado ISG/OS-1 de Ferrari et al. demostró que no es necesario su uso en la neoadyuvancia y que su uso en la adyuvancia se puede reservar solo para pacientes que no obtienen buena respuesta histológica a la quimioterapia preoperatoria34. El ensayo clínico EURAMOS busca dilucidar el beneficio de la adición de la ifosfamida y del interferón a un régimen con metotrexate, doxorrubicina y cisplatino, aunque ya completó la aleatorización, sus resultados definitivos están pendientes35–37.
En cuanto a las dosis altas de metotrexate, su utilidad y seguridad también está controvertida en adultos. Una revisión sistemática que incluyó estudios aleatorizados y no aleatorizados mostró que un régimen de 3 medicamentos de quimioterapia (usualmente el tercer medicamento es metotrexate) se asocia a mejor supervivencia global que un régimen de 2 medicamentos (HR 0,792, IC95% 0,677 – 0,926), en tanto que un régimen de 4 o más medicamentos no es mejor que un régimen de 338. Sin embargo, debe recordarse que el Primer Estudio del Intergrupo Europeo de Osteosarcoma, siendo un ensayo clínico aleatorizado, mostró que un régimen de 3 medicamentos (doxorrubicina, cisplatino y metotrexate en altas dosis) comparado con un régimen de dos medicamentos (doxorrubicina y cisplatino) tuvo menor supervivencia libre de enfermedad a 5 años (41% vs 57%, P= 0,02), con supervivencia global similar (50% vs 64%, P= 0,10)20.
El estado del arte en osteosarcoma sugiere que un régimen de tres medicamentos (DOX, CDDP, MTX a dosis altas) es el régimen estándar39, aunque en adultos un régimen de dos medicamentos (DOX, CDDP) es una alternativa válida20.
En caso de utilizar dosis altas de metotrexate en población adulta colombiana, se sugiere una dosis inicial de 8gr/m2, que se podría escalar según tolerancia, a los 12gr/m2 que reportan la mayoría de estudios.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Protección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran que no existe ningún conflicto de interés.