Como revisamos en la primera parte1 hay algunos conceptos que deben ser considerados para el adecuado manejo médico por parte del equipo clínico que recibe el reporte de patología, de esta misma manera existen aspectos por parte del patólogo que este debe conocer, los cuales tienen impacto terapéutico.
En esta segunda parte queremos revisar algunos conceptos que son de importancia por parte del patólogo que aplican directamente sobre la interpretación del clínico, como: procesamiento macroscópico; estudio de la citología por aspiración con aguja fina (FNA) vs. biopsia trucut, utilidad de la biopsia por congelación y de la inmunohistoquímica, así como los métodos e imágenes diagnósticas.
As was reviewed in the first part, there are some concepts that should be considered for the appropriate medical management by the medical team that receives the pathology report. Similarly, there are some aspects that the pathologist should know, such as those that can have therapeutic impact.
In this second part, a short review is presented on some of the concepts that are of importance to the pathologist that apply directly to the interpretation by the clinician, such as the macroscopic processing, the cytology study of the fine-needle aspirate (FNA) vs. “tru-cut” biopsy, the usefulness of the frozen biopsy, and immunohistochemistry, as well as diagnostic methods and diagnostic images.
El aumento de la incidencia de cáncer de tiroides ha hecho que el patólogo tenga mayor comprensión de la importancia de realizar el diagnóstico histopatológico de forma clara de modo que pueda ser contributivo para el clínico en sus decisiones terapéuticas. Sin embargo, a pesar de su relativa baja complejidad diagnóstica las lesiones tiroideas en ocasiones son evaluadas de una forma no muy profunda, probablemente debido al desconocimiento de su verdadero impacto en la evolución de la enfermedad.
De hecho, en el centro de referencia nacional de cáncer de Colombia, frecuentemente vemos que los reportes de patología enviados para revisión o segundo concepto, muestran dificultades o falencias en algunos conceptos que aparentemente son claros en los textos básicos de histopatología y que tienen implicaciones en el diagnóstico y el pronóstico del paciente. Considerando lo anterior, el objetivo de esta segunda parte es revisar los temas que son de importancia por parte del patólogo que aplican directamente sobre la interpretación del clínico así como la utilidad de los diferentes métodos e imágenes diagnósticas.
Procesamiento macroscópico de la glándula tiroides: ¿cómo se debe muestrear el tejido?El procesamiento macroscópico por parte del patólogo es fundamental para realizar un diagnóstico adecuado y completo de modo que sea interpretable de forma clara para el médico tratante. Pese a que la glándula tiroides tiene una anatomía relativamente simple existen algunos casos donde la anatomía está totalmente alterada dificultando la orientación de la pieza quirúrgica, por lo tanto es importante que esta sea orientada por parte del cirujano, específicamente estableciendo la lateralidad de los lóbulos.
Durante el procesamiento macroscópico el medico patólogo debe pesar, medir y describir el color, la consistencia, la forma, la simetría y los contornos del espécimen. Además, debe reconocer la presencia de tejido extratiroideo, particularmente en la cara anterior fragmentos de musculo esquelético, en la cara posterior la presencia de glándulas paratiroides y/o ganglios linfáticos y a nivel del borde inferior la presencia de tejidos blandos que incluyan los ganglios linfáticos del vaciamiento central2,3.
Antes de reconocer la presencia de lesiones tumorales debe pintarse el espécimen (tinta china) para conocer si la lesión de interés está comprometiendo dicha localización (Ver artículo de la Parte I, Borde de sección y marcación con tinta china. ¿Cuál es su importancia?). Los cortes deben realizarse de 4-5mm de forma transversal en el plano sagital2,3, para tanto conocer la relación de la lesión con la cápsula y el borde entintado como identificar la presencia de alteraciones histopatológicas de las células C que podrían tener relevancia clínica. Es importante recordar que estas células secretan calcitonina y se encuentran dispersas individualmente o en pequeños grupos a lo largo de la glándula tiroides, pero son más numerosas en la unión del tercio superior y medio de los lóbulos laterales. Por lo general son poco visibles en los estudios con coloraciones de rutina, sin embargo en caso de hiperplasia pueden ser identificables asociado con técnicas de inmunohistoquímica3.
Una vez se ha realizado los cortes seriados del espécimen se debe identificar las lesiones macroscópicas y deben describirse en número, color, tamaño (medido en tres dimensiones), apariencia (¿quístico?, ¿calcificado?, ¿hemorrágico?, ¿necrótico?, encapsulado, etc.), y localización (lóbulo derecho, izquierdo, accesorio y/o istmo)2,3. Los cortes de las lesiones, siempre que se pueda, deben realizarse en relación al borde pintado con tinta. Para los tumores encapsulados que miden hasta 5cm de diámetro debe realizarse el corte a toda la circunferencia, y de esta manera observar a nivel microscópico el tumor, la interface del tumor, cápsula y parénquima sano. Para los tumores encapsulados que miden más de 5cm debe realizarse un bloque adicional por cada centímetro de diámetro; los cortes deben mostrar el tumor, la cápsula y el parénquima sano. En los tumores no encapsulados debe realizarse tres bloques del tumor con presencia de parénquima sano, en la enfermedad multinodular un bloque por cada nódulo hasta cinco incluyendo parénquima sano, y en la enfermedad inflamatoria tres bloques representativos por cada lóbulo y un bloque del istmo2,3.
Estudio citológico de la biopsia con aspiración con aguja fina vs. biopsia con aguja trucut de la glándula tiroides: ¿es mejor la biopsia que el aspirado?La biopsia aspiración con aguja fina (FNA) es actualmente el examen inicial para la evaluación preoperatoria de un nódulo tiroideo solitario por su gran eficiencia y costo efectividad, tanto para determinar si un nódulo es una verdadera neoplasia así como para establecer su malignidad4–6. Esto asociado a las ventajas que establece ser un procedimiento mínimamente invasivo y altamente seguro. Las sensibilidades del FNA varían entre 65% y 98%, con especificidades entre 52% y 100% y si adicionalmente la guía ecográfica y punción es realizada por un radiólogo experto, el rendimiento mejora ostensiblemente con sensibilidades y especificidades que llegan hasta en un 100%7. Así mismo el grado de exactitud de esta técnica está en concordancia con la experticia del patólogo, la cual se estima hasta de un 95%-98%, con falsos negativos y falsos positivos entre 1%-3%7.
La biopsia cortante con aguja trucut aporta un mayor volumen de tejido pero no necesariamente un mayor muestreo comparado con las punciones repetidas y en diferentes direcciones que si se realiza cuando la punción es realizada con una aguja fina, lo que implica que haya mayor probabilidad de error en la representación de la potencial lesión en la toma debido no solo al calibre de las agujas utilizadas sino también al potencial mayor riesgo de complicaciones asociadas8.
Adicionalmente, la biopsia por trucut no muestra una mayor aproximación en definir el comportamiento biológico de una neoplasia de células foliculares ya que al igual, que la citología por FNA, no es posible establecer la obvia invasión vascular o capsular lo que hace que no varíe la conducta quirúrgica a seguir. Series internacionales y algunos estudios nacionales han mostrado la baja concordancia en este tipo de lesiones categorizadas como sospechosas de neoplasia de células foliculares, debido a que como ellos mismos refieren “son métodos no intercambiables, y teniendo en cuenta la comparación de los reportes de cada método con los del espécimen quirúrgico; la biopsia FNA demostró mejor concordancia”9.
El estudio citológico del FNA sigue siendo el estudio ideal para la evaluación de los pacientes con lesiones con nódulo tiroideo palpable asociado a un contexto integral que incluya: una adecuada historia clínica, el ultrasonido, el examen físico y la cuantificación de la TSH10. Esta afirmación apoyada en múltiples estudios de literatura donde se reporta un mayor rendimiento diagnóstico de la biopsia con FNA que con aguja TRUCUT (93% frente a 52%)11.
Utilidad de la biopsia por congelación en patología tiroidea: ¿hay indicación real de estudio intraoperatorio por congelación de la glándula?La biopsia por congelación intraoperatoria (BC) es una herramienta que se realiza de rutina en los servicios de patología y tiene como fin brindar al cirujano información diagnóstica de utilidad para que pueda determinar modificaciones en la conducta intraoperatoria, pese a que es un procedimiento difícil tanto en su realización como en su interpretación. Además, la información aportada por la biopsia por congelación nunca sustituye o es superior a la que pueda evidenciarse en los cortes definitivos de hematoxilina-eosina12.
Las múltiples series muestran una buena correlación de la biopsia por congelación con los cortes definitivos de parafina que oscila entre un 94% y 97%, y el porcentaje de discrepancia aceptado es del 3%13. Estos porcentajes son válidos cuando se valoran márgenes de resección o metástasis ganglionares, sin embargo, cuando se evalúan lesiones primarias o de origen desconocido la correlación desciende hasta un 83%. Las tres indicaciones adecuadas por consenso para solicitar una BC son: establecer la presencia y naturaleza de una lesión; determinar el estado de los borde de sección, y establecer si el tejido enviado contiene material diagnosticable (es decir si la muestra es representativa de la potencial lesión problema)13.
De ninguna forma y bajo ningún pretexto este tipo de estudio se debe utilizar para satisfacer la curiosidad del médico tratante o el interés por un diagnóstico expedito14. Adicionalmente se debe recordar que no es una técnica de precisión diagnóstica absoluta ya que puede darse la situación en que el diagnóstico de la BC puede variar con el diagnóstico definitivo, no implicando esto un error diagnóstico porque puede suceder que en la muestra inicial haya ausencia de tejido para diagnóstico debido a que no se muestreó intraoperatoriamente de forma adecuada la lesión (31,4%) o por ausencia de lesión en la BC pero presencia de esta en el material ya totalmente procesado e incluido en la parafina (30%)15.
En el contexto del cáncer tiroideo la biopsia por congelación es controvertida, quizás es más clara su poca utilidad para los patólogos pese a que para los cirujanos continua siendo un examen frecuentemente solicitado16,17. En pacientes con un adecuado diagnóstico citológico categorizado por la clasificación de Bethesda18 no es necesario realizar biopsia por congelación, ya que la categoría diagnóstica define por sí misma la conducta quirúrgica y por lo tanto no hay necesidad de cambio en la decisión intraoperatoria, que es el principal objetivo de realizar una BC. Las lesiones categorizadas como sospechosas de neoplasia folicular o neoplasia folicular correspondientes a la categoría IV de Bethesda para su categorización definitiva (es decir para definir su comportamiento biológico), requieren una detallada y completa evaluación de la cápsula para demostrar la infiltración de la misma así como la determinación de la potencial invasión vascular la cual no solo es imposible sino impráctica intentar realizarla en un corte por congelación19. El 87% de las lesiones tiroideas enviadas para BC es necesario diferirlas para diagnóstico definitivo en tejido incluido en parafina y tan solo el 3,3% de las BC para tiroides modifican la conducta quirúrgica20.
En conclusión, la BC es de valor diagnóstico mínimo para lesiones tiroideas foliculares ya que no modifica en un porcentaje significativo la necesidad de cambio de la conducta quirúrgica y sí prolonga el tiempo quirúrgico, aumenta los costos, y da lugar a intervenciones equivocadas constituyéndose en un procedimiento no rentable desde el punto de vista costo efectivo17–19. Quizás la única indicación de BC sería en el contexto de estando en cirugía con una citología diagnóstica como II o V se encuentra una lesión extratiroidea (ganglio linfático) sospechosa de compromiso metastásico17,21,22 que en caso de resultar positiva al estudio intraoperatorio sí modificaría la conducta quirúrgica.
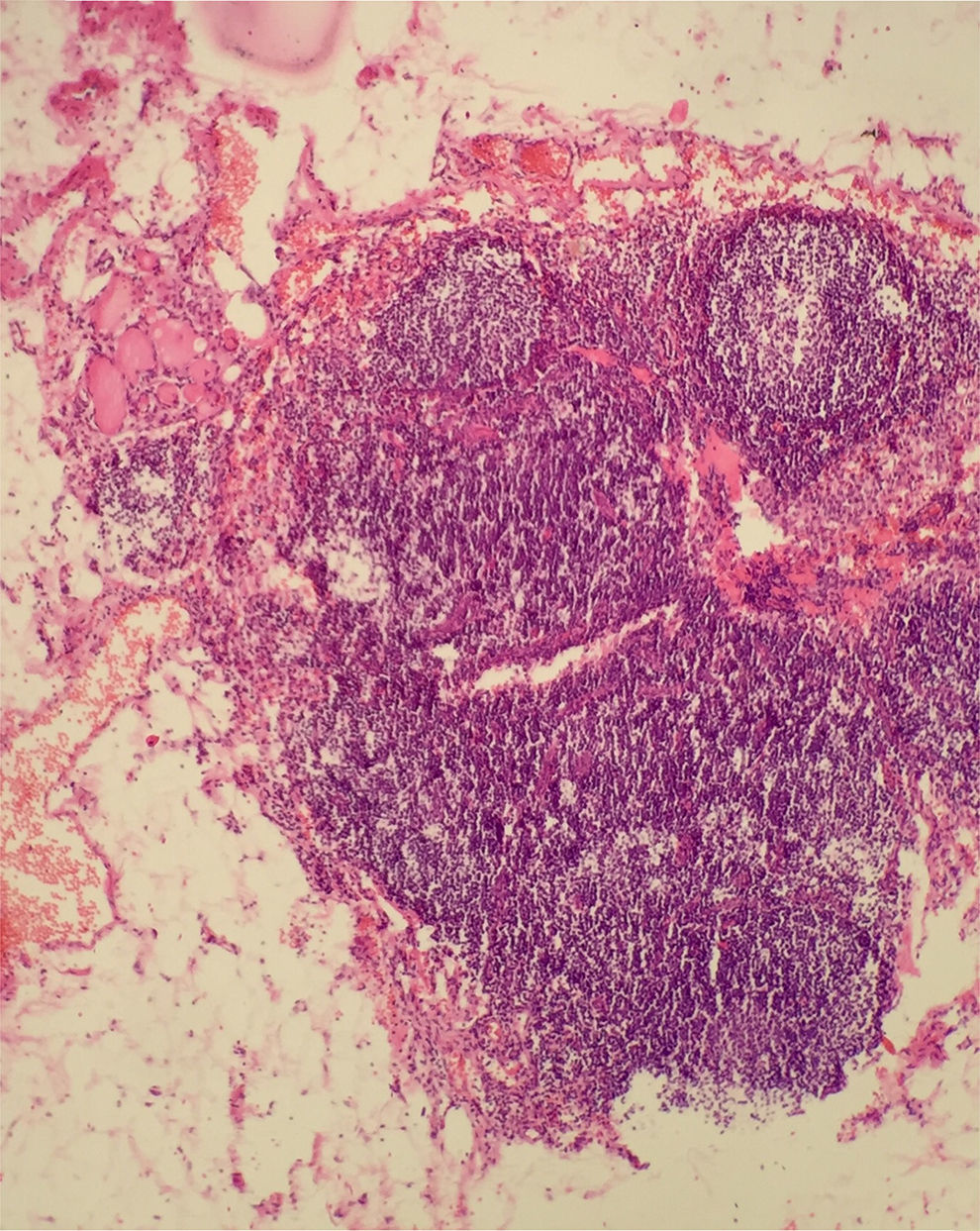
Inclusiones tiroideas benignas en ganglio linfático: ¿son verdaderas metástasis ganglionares?Inicialmente para el médico clínico no patólogo todo tejido tiroideo que se encuentre por fuera de la glándula tiroides (con excepción quizás del quiste del conducto tirogloso y el Struma Ovarii en el contexto de un teratoma) se considera maligno. Sin embargo, desde el punto de vista histopatológico esta consideración no es necesariamente cierta, ya que tejido tiroideo ectópico puede encontrarse en: las ectopias verdaderas tiroideas (la región submandibular, la tráquea, el esófago, los pulmones, la vesícula biliar, el páncreas, la glándula suprarrenal, la glándula parótida, la silla turca, la hipófisis, etc.)23–27; el denominado tejido tiroideo lateral aberrante28; en el nódulo parásito10, y en las inclusiones tiroideas en los ganglios linfáticos (ITB). Quizás esta última localización corresponde a unas de las entidades que más genera controversia entre los clínicos y los patólogos.
Las ITB se define con la presencia de tejido tiroideo benigno (sin características citológicas de CPT) que son encontrados en un ganglio linfático, en general asociado a un procedimiento quirúrgico benigno de la glándula tiroides (por ejemplo un bocio) o no relacionado con el tiroides29,30. Considerando la dificultad para evidenciar que el tejido tiroideo sea encontrado dentro de un ganglio linfático y no sean metástasis, las inclusiones tiroideas benignas se explican siguiendo el mismo principio como cuando se encuentran células névicas o de tejido salival en ganglio linfático10. Adicionalmente, estudios moleculares del gen HUMARA (X-chromosome-linked human androgen) han mostrado policlonalidad del tejido concluyendo que estas ITB corresponden más a tejido tiroideo ectópico que a carcinoma tiroideo metastásico31.
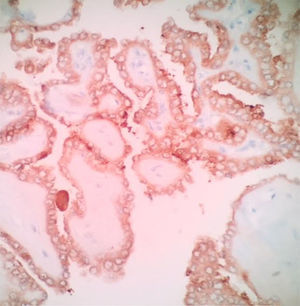
Los criterios establecidos para definir una ITB en un ganglio linfático incluyen: que sea una hallazgo microscópico; que está limitado a un solo ganglio de localización medial a la vena yugular; que el compromiso del ganglio sea intracapsular o inmediatamente subcapsular; que las células formen folículos bien definidos en los cuales los núcleos sean homogéneos en tamaño; que inequívocamente no se documenten hallazgos citológicos de CPT (fig. 1); que no haya ni reacción estromal ni la presencia de cuerpos de psammoma; que el estudio de inmunohistoquímica sea negativo para Galectina-3 y para HBME-1(Héctor Battifora Mesothelial cell -1), y que los estudios moleculares confirmen ausencia de alteraciones asociados a los genes del BRAF, RET/PTC o RAS32.
Lesiones metastásicas a la glándula tiroides: ¿se pueden diagnosticar en FNA?EL compromiso metastásico de la glándula tiroides es una entidad poco frecuente. En algunas series representa aproximadamente entre el 0,02% al 1,4% del total de tiroidectomías y se ha observado en pacientes entre 24 y 94 años (media 63,8)32–34. El compromiso tiroideo puede ser causado por tumores primarios de cabeza y cuello (laringe, tráquea, faringe, esófago, tejidos blandos, mediastino y ganglios linfáticos) que pueden infiltrarla por vecindad, o por metástasis de tumores primarios de sitios distantes, los cuales se diseminan por vía linfática o hematógena32. Los tumores que con mayor frecuencia metastatizan a la glándula tiroides son: el carcinoma renal de células claras; los carcinomas primarios pulmonares y de glándula mamaria; el melanoma, y los tumores del tracto gastrointestinal (esófago, estómago y colon)32.
Existen casos aún más raros, como la presencia de un tumor metastásico a la glándula tiroides comprometida por otro tumor primario (en inglés se conoce como tumor-to-tumor metastasis) y en la literatura médica se ha descrito la presencia de carcinoma papilar y folicular en la glándula tiroides como tumor primario asociado a tumores metastásicos como: carcinoma renal de células claras35; carcinoma de glándula mamaria; carcinoma de pulmón de célula pequeña; carcinoma neuroendocrino de probable origen pancreático; melanoma, y tumores de cabeza y cuello36,37.
El diagnóstico clínico-patológico puede ser difícil si no se conoce el antecedente médico. En la ecografía se pueden observar hallazgos atípicos al que se observa en el tumor maligno primario tiroideo, por lo que en estos casos es necesario realizar estudios para tipificar la lesión, como por ejemplo FNA, y en estos casos si está recomendado realizar biopsias con aguja trucut y de hecho se ha visto que tiene mejor rendimiento diagnóstico comparado con la FNA38.
En los casos de tiroidectomía total, la multifocalidad tumoral, el patrón sinusoidal de la vascularización y la reacción tisular (desmoplasia, inflamación o cambio mixoide) son hallazgos que pueden sugerir la presencia de una lesión metastásica37,39. Sin embargo, al igual que los casos de biopsia con aguja trucut y FNA es necesario realizar estudios de inmunohistoquímica para confirmar o descartar la presencia de una lesión metastásica, e intentar orientar el potencial origen primario; en casos que no lo conozcamos. En los casos que no es conclusivo los estudios de inmunohistoquímica se recomienda realizar estudios moleculares32.
Uso de inmunohistoquímica en las neoplasias tiroideas: ¿es de utilidad la inmunohistoquímica en tumores tiroideos originados en la célula folicular?El diagnóstico de tumores malignos de la glándula tiroides generalmente se realiza con el examen histológico convencional (coloración de hematoxilina y eosina), esta sigue siendo la recomendación universal. En algunos casos el uso de la inmunohistoquímica (IHQ) puede tener utilidad, como por ejemplo, para establecer en el tumor primario si es de origen en células foliculares o parafoliculares (célulasC) en los casos en los cuales la morfología (en especial por el patrón de crecimiento) no permiten hacer esta diferencia, como son la tiroglobulina y la calcitonina31.
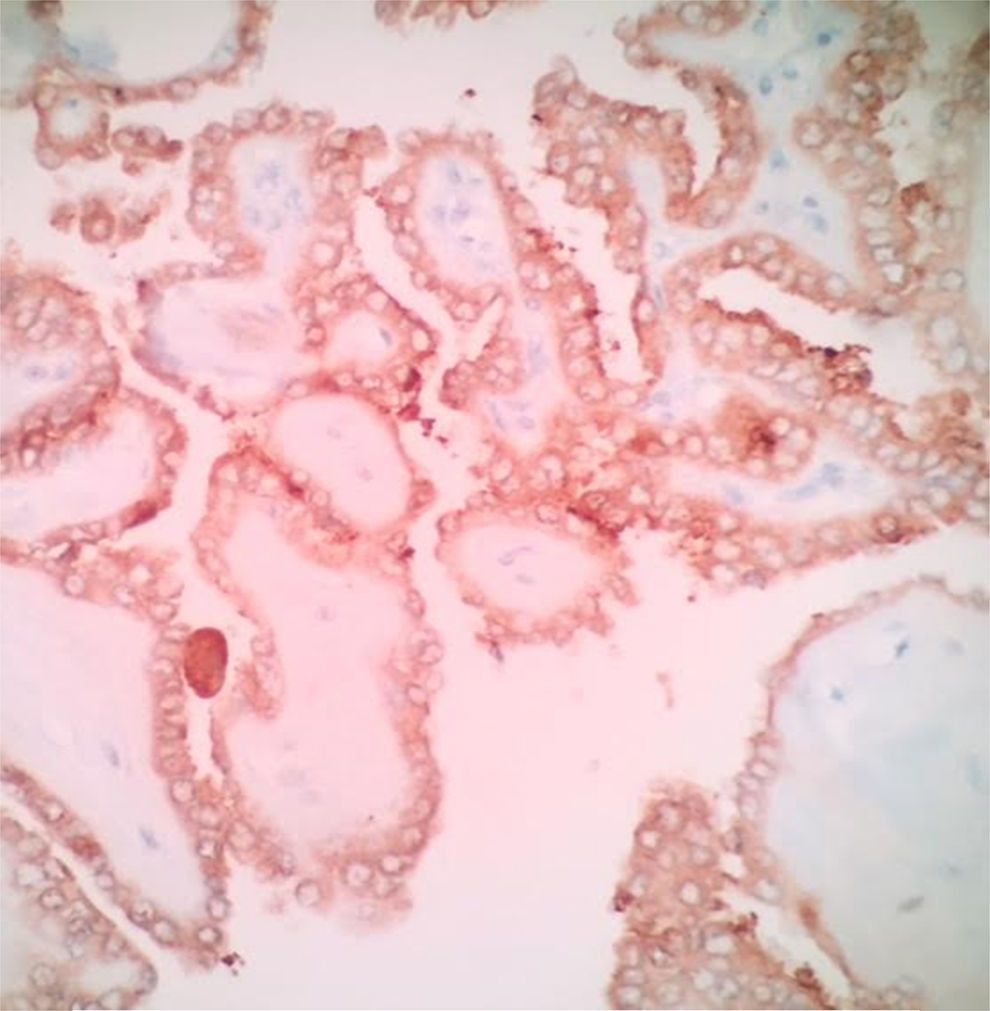
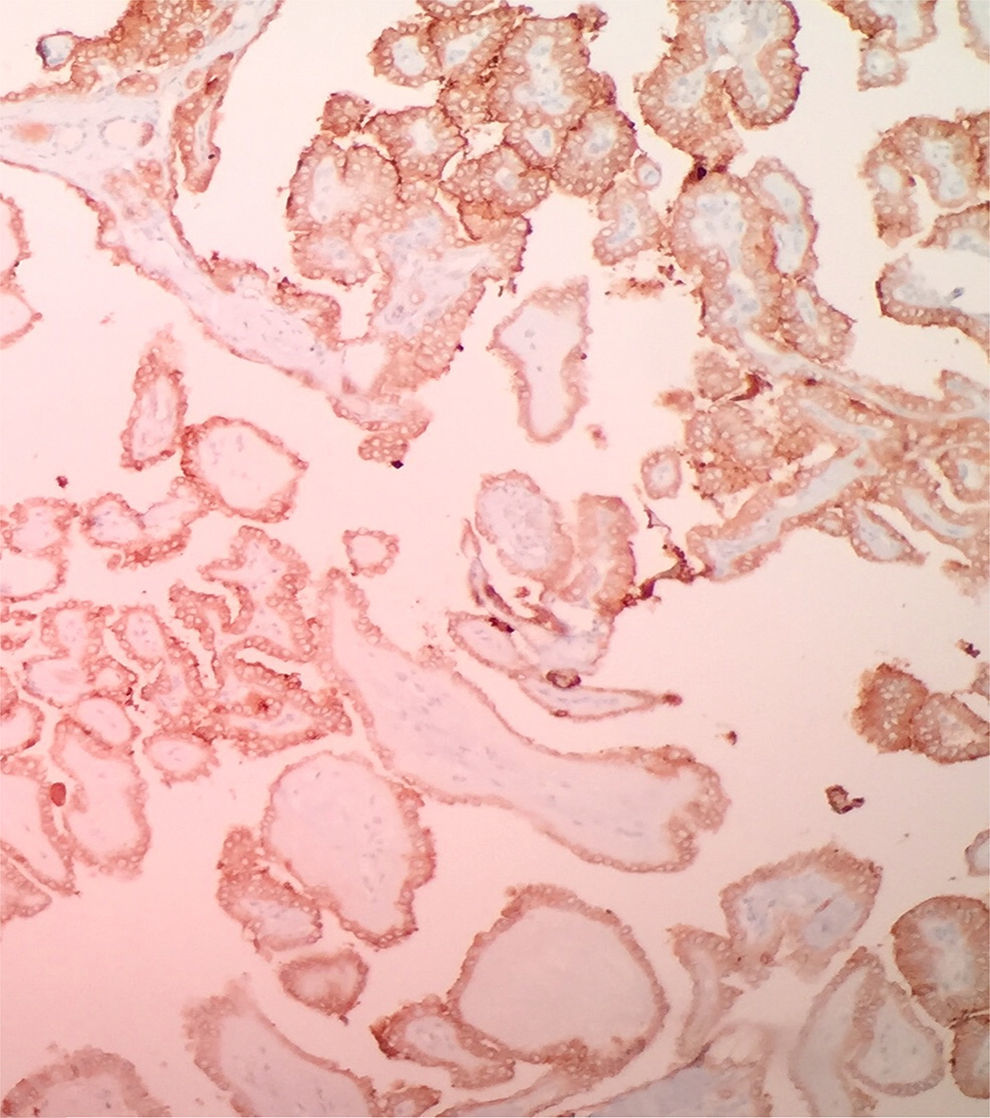
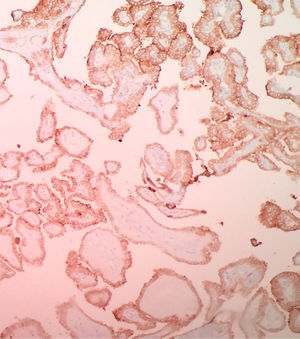
Se ha observado que algunos marcadores de inmunohistoquímica pueden ayudar en tratar de discriminar la benignidad o la malignidad de un tumor originado en células foliculares o en las lesiones limítrofes, en asociación con una excelente valoración morfológica a las coloraciones convencionales. Sin embargo, con el advenimiento de las técnicas moleculares, el uso de la inmunohistoquímica puede traer baja especificidad. Dentro de los marcadores que se ha observado que tiene alta sensibilidad en el CPT son la galectina-3 (fig. 2), HBME-1 (fig. 3), CITED1, y la queratina-1931. De estos marcadores el que tiene mejor sensibilidad de malignidad es la galectina-3 y la pérdida de la expresión del CD56 es el marcador que ha mostrado mejor especificidad de malignidad. La sensibilidad y la especificidad reportada de los marcadores de inmunohistoquímica para discriminar lesiones malignas de lesiones benignas son: galectina-3 (S: 88,5%. E: 64,56%), HBME-1 (S: 71,3%. E: 85%), CD56 (S: 58,2%. E: 92,4%) y CK19 (S: 75,4%. E: 70,9%). Realizar una combinación de estos marcadores puede tener una especificidad hasta del 99%40. De estos marcadores el único que se ha visto que podría tener utilidad para diferenciar adenomas de carcinoma de células de Hurthle es la galectina-3 (p=0,041)40.
Determinación de la mutación del gen BRAFV600E: ¿se debe realizar de rutina?La detección de la mutación del gen BRAFV600E en CPT como factor pronóstico permanece aún con dudas, en su mayoría debido a los datos disímiles de los diferentes estudios41–43, lo que hace que su valor clínico y terapéutico no sea tan útil como lo deseado para una técnica molecular. Pese a esto, se ha encontrado que su determinación puede ser altamente sensible en determinar cuáles carcinomas tiroideos son probablemente refractarios al tratamiento de yodoterapia44. Quizás la mayor utilidad de establecer el estado del BRAFV600E es en el estudio citológico de los aspirados con aguja fina, especialmente en la categoría III de Bethesda (Atipias en células foliculares de significado indeterminado) donde se ha evidenciado que contribuye enormemente en precisar el diagnóstico de CPT y definir tratamientos complementarios como la extensión del vaciamiento ganglionar del compartimiento central45.
Utilidad e indicaciones de la tomografía por emisión de positrones/tomografía computada (PET/CT) en patología tiroidea: ¿cuáles son sus indicaciones y cuándo se debe solicitar en patología tiroidea?El PET/CT asociado a la 18 fluordeoxiglucosa (18FDG PET/CT) tiene utilidad en la evaluación de los diferentes tipos de cáncer de tiroides. El riesgo de malignidad de los nódulos tiroideos que se detectan incidentalmente porque captan 18FDG oscila entre 24% y 36%45. Pese a lo anterior, la 18FDG PET/CT no está recomendada para la evaluación de pacientes con nódulos tiroideos46,47.
La indicación primaria de la 18FDG PET/CT en pacientes con cáncer diferenciado de tiroides es la búsqueda de lesiones tumorales en pacientes de alto riesgo que tienen valores elevados de tiroglobulina no estimulada (generalmente>10ng/mL) sin evidencia de lesiones en el rastreo con yodo radiactivo (131I)47. Entre los factores que influyen en la sensibilidad de la prueba se incluyen: los subtipos histológicos agresivos (variantes de célula alta y de células de Hürthle); la desdiferenciación tumoral; la alta carga tumoral y, en menor proporción, la estimulación con TSH.
La sensibilidad y la especificidad de la 18FDG-PET/CT en pacientes con cáncer diferenciado de tiroides sin avidez por 131I han sido reportadas en 83% (rango, 50%-100%) y 84% (rango, 42%-100%), respectivamente48. La 18FDG-PET/CT también puede ser útil en otros escenarios:
- •
La estadificación inicial del cáncer de tiroides pobremente diferenciado y del carcinoma invasivo de células de Hürthle.
- •
La estratificación del pronóstico en pacientes con enfermedad metastásica dado que la captación de 18FDG es un factor pronóstico independiente para supervivencia49,50.
- •
Las lesiones con alta captación de 18FDG tienen mayor riesgo de progresión rápida y pobre respuesta al tratamiento con 131I. Incluso, en un contexto de metástasis ávidas por 131I se pueden identificar algunas lesiones hipermetabólicas (e.d., que captan 18FDG) que no captaron el 131I. El grado de agresividad es proporcional a la intensidad de captación de 18FDG (e.d., al máximo valor estándar de captación [SUVmax]).
- •
La evaluación de la respuesta después de terapia local o sistémica para enfermedad localmente invasiva o metastásica47.
Debe entenderse que la avidez por 18FDG no constituye evidencia de malignidad. La frecuencia de falsos positivos de la 18FDG PET/CT en pacientes con cáncer de tiroides varía entre el 0% y el 39% en diferentes series, por lo cual está justificada la citología por FNA en algunas lesiones, especialmente cuando se esté planificando una cirugía47. La 18FDG PET/CT es más sensible que la ecografía de cuello para explorar algunas localizaciones como el espacio retrofaríngeo y la región supraclavicular51. Por último, es vital comprender que la mayoría de los tumores que captan 131I no captan 18FDG y por lo tanto la 18FDG PET/CT no puede reemplazar completamente al rastreo corporal con 131I, ni debe recomendarse para la búsqueda rutinaria de enfermedad recurrente o metastásica.
Para determinar las ventajas, las desventajas, las fortalezas y las limitaciones en el manejo de los pacientes con patología tiroidea el médico tratante debe tener conocimiento tanto del procesamiento patológico de la glándula tiroides como de las técnicas diagnósticas y de las técnicas de apoyo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.