En pacientes con leucemia aguda y neutropenia febril, describir el comportamiento de varias citoquinas y su relación con la presencia de bacteriemia mediante la medición de interleuquinas 1β, 6, 8, 10, 12p70 y factor de necrosis tumoral (TNF) en cuatro tiempos.
MétodosSe almacenaron muestras de plasma obtenidas al momento del diagnóstico de la neutropenia, al inicio de la fiebre y a las 24 y 48 horas posteriores, las cuales se conservaron a -70°C y luego se descongelaron para su procesamiento mediante citometría de flujo. Se utilizaron medianas junto con sus correspondientes medidas de dispersión.
ResultadosNo hubo ningún reporte de muerte al egreso. La tasa de hemocultivos positivos fue 25% similar a lo revisado en la literatura, con predominio del aislamiento de gérmenes Gram negativos. Las IL10 y 6 mostraron mayor porcentaje de variación durante el momento de la fiebre, comparando el grupo de bacteriémicos con el de no bacteriémicos. Las IL1, IL12p70 y TNFα arrojaron niveles séricos por debajo del límite de detección de la prueba.
ConclusionesLas citoquinas podrían cumplir un papel promisorio en el seguimiento de los pacientes neutropénicos febriles, dada la potencial asociación con presencia de bacteriemia, desenlace bien conocido como predictor de morbilidad y mortalidad en esta población. Sin embargo, se requieren más estudios con mayor población para definir una recomendación clara en las guías de manejo de neutropenia febril postquimioterapia.
To describe the properties of several cytokines and their relationship with the presence of bacteraemia by measuring interleukins 1β, 6, 8, 10, 12p70, and tumour necrosis factor (TNFα) at four different times in patients with acute leukaemia and febrile neutropenia.
MethodsPlasma samples were obtained on diagnosis of neutropenia, at the onset of fever, and at 24hours and 48hours thereafter. They were stored at -70° C and then thawed for processing by flow cytometry. Medians were used along with their corresponding dispersion measurements.
ResultsThere were no reports of death at discharge. The rate of positive blood cultures was 25%, which was similar to that reviewed in the literature, with predominance of the isolation of Gram negative bacteria. Interleukins 10 and 6 showed a higher percentage of variation during the time of fever on comparing the bacteraemia group with the non- bacteraemia group. IL1, IL12p70, and TNFα±showed serum levels below the detection limit of the test.
ConclusionsCytokines could play a promising role in the monitoring of febrile neutropenic patients, given the potential association with the presence of bacteraemia, an outcome well known as a predictor of morbidity and mortality in this population. However, more studies with a larger population are required to define a clear recommendation in the management guidelines for febrile neutropenia after chemotherapy.
Más del 80% de los pacientes con malignidades hematológicas presentan neutropenia febril durante la quimioterapia de inducción y pueden presentar más de un episodio durante los siguientes ciclos de quimioterapia1, constituyéndose esta en un factor de riesgo para el desarrollo de infecciones graves, las cuales generan una alta morbimortalidad, estancia y costos hospitalarios2.
A pesar de que se conocen los factores que impactan en la susceptibilidad a la infección y que se han diseñado escalas de predicción de riesgo3,4, es difícil discriminar entre infecciones severas y episodios febriles de bajo riesgo. La presencia de bacteriemia por gérmenes Gram negativos se ha relacionado con desenlaces clínicos adversos, a diferencia del subgrupo de pacientes en que no se documenta un foco infeccioso claro o el agente microbiológico causal, población en la cual la resolución de la fiebre suele ser más rápida y con menor tasa de complicaciones5. Dentro del grupo de pacientes con neoplasias hematológicas hospitalizados para recibir quimioterapia y que desarrollan neutropenia febril, se han documentado episodios de bacteriemia entre el 206 y el 43%7 de los casos con predominio de los aislamientos de bacterias Gram negativas con tasas de hasta el 60,3%7,8.
Dadas las limitaciones en la evaluación clínica de estos pacientes, se ha tratado de acceder a biomarcadores para el diagnóstico y seguimiento de episodios de neutropenia febril de alto riesgo. El biomarcador ideal debería ser rápido, específico, costo-efectivo y que permita predecir de forma temprana la presencia de bacteriemia. Desde hace algunos años se han evaluado proteínas de fase aguda, citoquinas, moléculas de adhesión solubles y procalcitonina como marcadores que contribuyan a identificar infecciones fúngicas o bacterianas; sin embargo, el número de estudios que incluyen pacientes neutropénicos en el contexto postquimioterapia es pequeño con resultados que difieren ampliamente9.
Los pacientes neutropénicos mantienen la liberación plasmática de citoquinas independiente del conteo de leucocitos6 y se ha propuesto que gérmenes Gram positivos y Gram negativos provocan diferentes patrones de concentraciones séricas de citoquinas. Para investigar en qué medida los perfiles de citoquinas varían en respuesta a diferentes gérmenes se han diseñado estudios con ELISA (Enzyme Linked Immunoabsorbent Assay) y con citometría de flujo en modelos animales y en monocitos humanos10.
Un estudio7 expone la diferenciación entre episodios de bacteriemia y no bacteriemia en pacientes con neutropenia febril, estableciendo mediante la curva ROC un AUC (área bajo la curva) de 0,73 para los niveles de IL6 en el día 2, correspondiente al episodio febril, con un punto de corte de 297pg/mL, lo que establece una sensibilidad del 72%, una especificidad del 62% y un valor predictivo negativo del 70%. Este mismo estudio establece diferencias, aunque no estadísticamente significativas, entre la inducción en la liberación de esta citoquina por gérmenes Gram negativos y Gram positivos. Datos similares se encontraron al evaluarse IL6 en la discriminación de grupos de pacientes con neutropenia febril de alto riesgo, definida como aquella que se asocia a infección bacteriana, no particularmente hemocultivos, encontrando una sensibilidad del 70% con un punto de corte de 17pg/mL11
Los resultados con otras citoquinas del perfil TH1 en relación con la presencia de bacteriemia han mostrado asociación también con IL8 (87% de sensibilidad)12, IL10 (71% de sensibilidad)13 y TNF14 (89% de sensibilidad), mientras que para IL1 e IL12 no se han documentado reportes de sensibilidad para detección de bacteriemia en estudios clínicos.
En cuanto al tipo de técnica para su medición, las ventajas que suponen las técnicas de matrices múltiples como la citometría de flujo sobre el ELISA incluyen alto rendimiento, necesidad de menor volumen de muestra, eficiencia en términos de tiempo y costo, y principalmente la capacidad de medir múltiples citoquinas con una alícuota de muestra dada, factor que influyó principalmente en escoger este método15.
Con el interés de conocer el comportamiento de varias citoquinas en un grupo de pacientes con leucemias agudas y neutropenia febril postquimioterapia en el Instituto Nacional de Cancerología, se plantea medirlas a través de la técnica de citometría de flujo e identificar su potencial relación con el desarrollo de bacteriemia. Dado que aún no existe un modelo in vivo que logre describir su cinética en este escenario clínico, se propone realizar la medición de interleuquinas 1, 6, 8, 10, 12p70 y factor de necrosis tumoral (TNF) al inicio de la neutropenia, en el momento de aparición de la fiebre y a las 24 y 48 horas posteriores, y compararlas con la cinética de procalcitonina medida en un estudio previo.
MétodosPoblación de pacientes y supervisión del estudioEl protocolo de investigación fue aprobado por los comités de ética institucionales de la Facultad de Medicina de la Universidad Nacional de Colombia, código DIB Hermes 28447, y del Instituto Nacional de Cancerología ESE. Todas las muestras analizadas contaron con el consentimiento informado por cada uno de los pacientes que ingresaron al estudio16, en relación con la aceptación voluntaria de donar las muestras de suero para usos futuros. Adicionalmente, el estudio contó con la monitoría del Instituto Nacional de Cancerología para verificar que este se desarrollara de acuerdo con las normas de buenas prácticas clínicas en investigación. Se analizaron 44 episodios de neutropenia febril ocurridos en 35 pacientes (11 pacientes presentaron más de un episodio febril) mayores de 18 años con leucemia aguda, en tratamiento con poliquimioterapia aplasiante, y neutropenia febril postquimioterapia hospitalizados en el Instituto Nacional de Cancerología entre mayo de 2013 y mayo de 2014 durante la ejecución del estudio16.
Criterios de exclusión: Pacientes con neutropenia febril no relacionada con quimioterapia, aquellos que ingresaron remitidos de otra institución, los pacientes con infección por VIH/sida, aquellos en los que, por sus comorbilidades o refractariedad al tratamiento (o por otras razones), el servicio tratante contraindicara el tratamiento activo de su neoplasia, gestantes, pacientes con enfermedad renal avanzada con depuración calculada de creatinina inferior a 30mL/min, pacientes con procesos infecciosos al momento de la toma de la primera muestra de suero y aquellos que estuvieran recibiendo antibioticoterapia por más de 24 horas previas al inicio de la neutropenia febril.
DefinicionesPara este estudio se usaron las definiciones propuestas por la Sociedad Americana de Enfermedades Infecciosas, IDSA por sus siglas en inglés17:
Fiebre: Se definió como una medida única oral de temperatura ≥38,3°C (101°F) o una temperatura de ≥38,0°C (100,4°F) sostenida durante una hora. El uso de la temperatura oral registrada mediante termómetro de mercurio fue la tomada como referencia de acuerdo con protocolos institucionales de enfermería para la toma de signos vitales y el protocolo institucional de neutropenia febril en el Instituto Nacional de Cancerología. Las mediciones de la temperatura rectal (y exámenes rectales) se evitan durante la neutropenia para prevenir la colonización de organismos intestinales entre en la mucosa circundante y los tejidos blandos.
Neutropenia: Se definió como un CAN (conteo absoluto de neutrófilos) de <500 células/mm3 o un CAN que se espera que disminuya a <500 células/mm3 durante las próximas 48 horas.
Neutropenia febril: Se definió como aquel paciente con neutropenia que presentó una temperatura aislada oral mayor o igual a 38,3°C, o de 38°C que se mantuvo por lo menos durante una hora, asociado a neutropenia tal y como fue definida arriba.
Bacteriemia: Aislamiento de bacterias cultivables en el torrente sanguíneo que nunca son contaminantes, entre las cuales se encuentran las enterobacterias, bacterias Gram negativas no fermentadoras y cocos Gram positivos, como S. aureus, S. pneumoniae, S. pyogenes, S. agalactiae y Streptococcus del grupo B y C18.
Protocolo del estudioAnálisis de citoquinas proinflamatorias por citometría de flujoDe los pacientes incluidos en el estudio16, se almacenaron muestras de plasma obtenidas al momento del diagnóstico de la neutropenia, al inicio de la fiebre y a las 24 horas y 48 horas posteriores. Se obtuvieron entre 2 y 3ml de plasma de cada muestra de sangre y se almacenaron a -70°C en el congelador Revco® Ultima Plus del Banco Nacional de Tumores Terry Fox del Instituto Nacional de Cancerología ESE.
Estas muestras, en total 176, fueron descongeladas durante un periodo de 24 horas a una temperatura de 4°C y posteriormente procesadas para la medición de interleuquinas 1, 6, 8, 10, 12p70 y factor de necrosis tumoral (TNF) mediante citometría de flujo. Se utilizó un citómetro de flujo BD FACSCanto II, propiedad del Instituto Nacional de Cancerología, y el kit comercial Human Inflammatory Cytokines Kit: Cytometric Bead Array–CBA, donado por BD Biosciences™. Este método permite capturar en un medio soluble una proteína de tamaño conocido mediante fluorescencia; cada perla de captura en este sistema tiene una fluorescencia distinta y es recubierto con un anticuerpo de captura específico para cada citoquina. Los datos arrojados por la prueba (mediante la matriz comercial Software Matriz FCAP, propiedad de BD Biosciences™) fueron posteriormente analizados por el grupo de investigadores.
Los niveles séricos normales descritos para las citoquinas por estudiar corresponden a: IL1: <5pg/mL19; IL6: <4,30pg/mL20; IL10: <13,68pg/mL20; IL8: 12,35±7,0pg/mL21; TNF-α: 6,11±3,3pg/mL21; IL12p70 (subunidad biológicamente activa): indetectable en sueros de sujetos sanos22.
Análisis estadísticoPara el componente descriptivo se utilizaron medianas junto con sus correspondientes medidas de dispersión (rango intercuartílico). En el caso de variables discretas, la descripción se efectuó utilizando proporciones y porcentajes. Los análisis estadísticos se realizaron con el programa STATA 11 y se empleó la prueba no paramétrica de suma de rangos (prueba U de Mann Whitney).
ResultadosSe analizaron 44 episodios de neutropenia febril en 35 pacientes; 65,8% fueron mujeres, con una mediana de edad de 36 años. Diez de estos pacientes presentaron dos episodios de neutropenia febril y uno presentó tres episodios; la mediana entre dos eventos de neutropenia febril fue de 65,5 días. La mediana de estancia hospitalaria fueron 27 días y de la duración de la neutropenia 15 días. Doce pacientes (27,2%) tenían acceso venoso central. Tres pacientes tenían hipertensión arterial y solo uno diabetes mellitus. Las características clínicas de los pacientes se describen en la tabla 1. Las variables demográficas (sexo, edad, diagnóstico) se analizan sobre 35 pacientes, mientras que las variables relacionadas con el estado de la leucemia, el uso de factor estimulante de colonias de granulocitos humanos (G-SCF) y el esquema de la quimioterapia se analizan sobre los 44 eventos de neutropenia febril.
Características clínicas de los pacientes incluidos en el estudio
| Característica | n (44 episodios de neutropenia febril - 35 pacientes) |
|---|---|
| Edad | |
| Mediana | 36 |
| Rango | 18-56 |
| Sexo n.° | |
| Masculino | 12 (34%) |
| Femenino | 23 (66%) |
| Diagnóstico oncológico | |
| Leucemia mieloide aguda | 22 (62,8%) |
| Leucemia linfoide aguda | 11 (34,2%) |
| Leucemia promielocítica aguda | 1 (2,8%) |
| G-CSF | |
| Sí | 37 (84%) |
| No | 7 (6%) |
| Estado de la leucemia | |
| De novo | 8 (18,8%) |
| Recaída | 13 (29,5%) |
| Remisión | 17 (38,6%) |
| Refractaria | 6 (13,6%) |
| Ciclo de quimioterapia | |
| Consolidación | 17 (38,6%) |
| Inducción | 8 (18,8%) |
| Reinducción | 6 (13,6%) |
| Rescate | 13 (29,5%) |
| Quimioterapia recibida | |
| Hypercvad: 17 (38,6) | 17 (38,6%) |
| Hidac: 10 (2,72) | 10 (2,72%) |
| IDA-Flag: 5 (1,1) | 5 (1,1%) |
| 7×3: 4 (0,9) | 4 (0,9%) |
| 5×3: 3 (0,68) | 3 (0,68%) |
| POMP: 1 (0,22) | 1 (0,22%) |
| PETHEMA: 1 (0,22) | 1 (0,22%) |
| AME: 1 (0,22) | 1 (0,22%) |
| CALBG: 1 (0,22) | 1 (0,22%) |
| Larson+Dasatinib: 1 (0,22) | 1 (0,22%) |
G-SCF: Factor estimulante de colonias de granulocitos humanos.
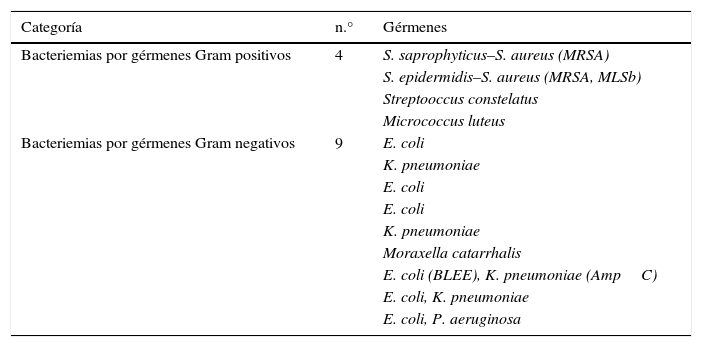
Se documentaron 13 casos de bacteriemias, representando 25% de positividad de los hemocultivos. Los aislamientos microbiológicos de los hemocultivos se reportan en la tabla 2.
Aislamientos microbiológicos en hemocultivos presentadas en los 44 episodios de neutropenia febril
| Categoría | n.° | Gérmenes |
|---|---|---|
| Bacteriemias por gérmenes Gram positivos | 4 | S. saprophyticus–S. aureus (MRSA) |
| S. epidermidis–S. aureus (MRSA, MLSb) | ||
| Streptooccus constelatus | ||
| Micrococcus luteus | ||
| Bacteriemias por gérmenes Gram negativos | 9 | E. coli |
| K. pneumoniae | ||
| E. coli | ||
| E. coli | ||
| K. pneumoniae | ||
| Moraxella catarrhalis | ||
| E. coli (BLEE), K. pneumoniae (AmpC) | ||
| E. coli, K. pneumoniae | ||
| E. coli, P. aeruginosa |
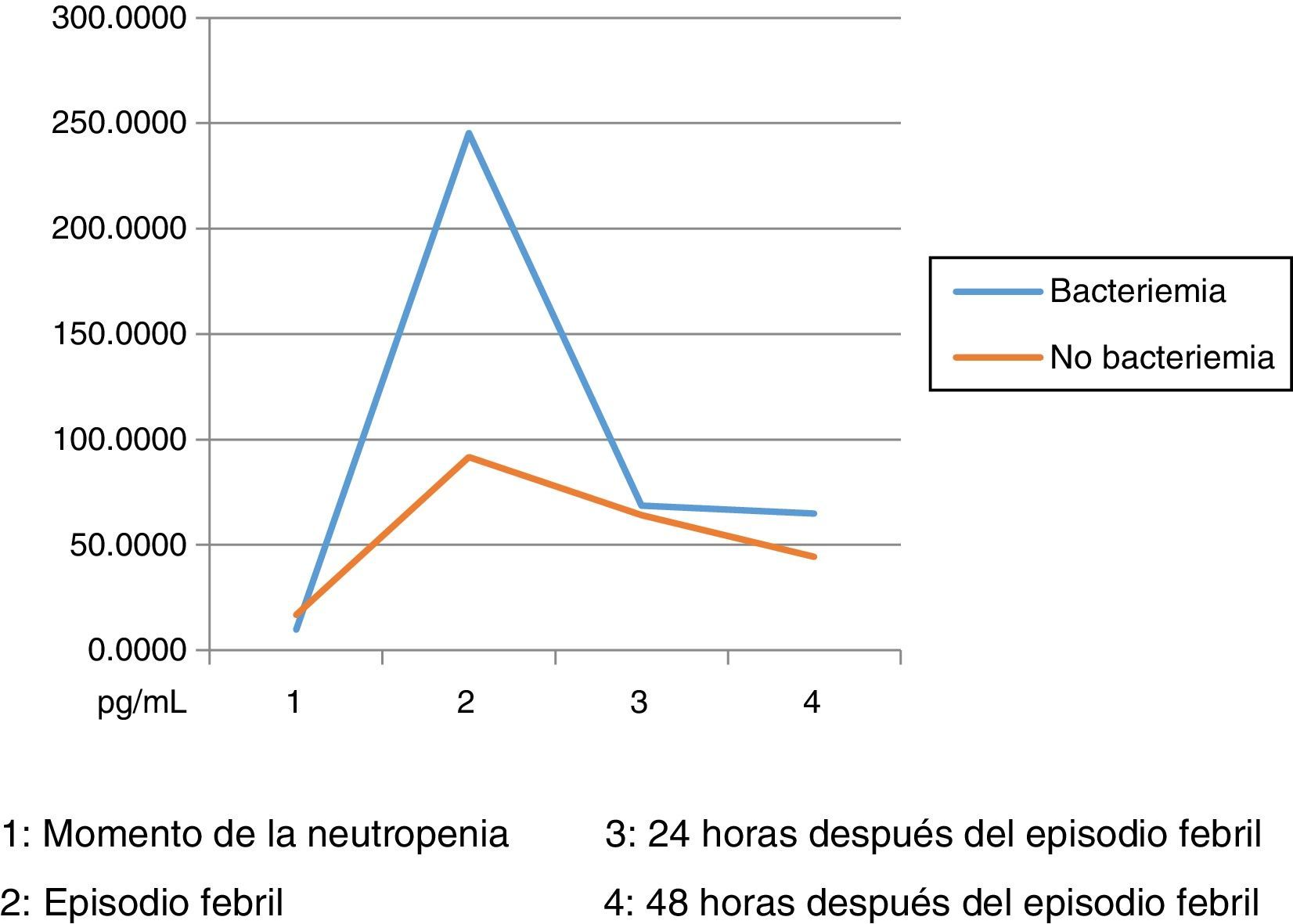
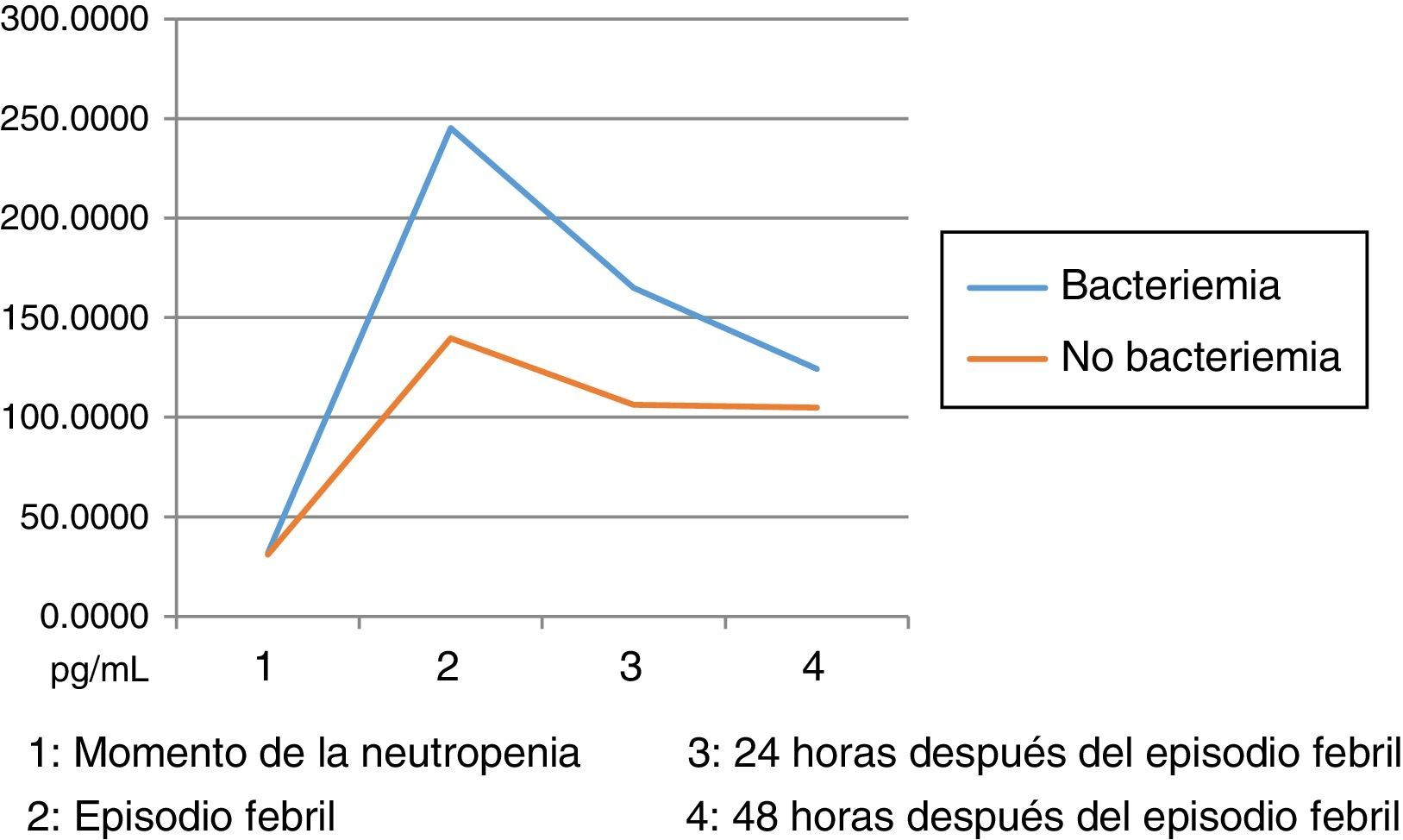
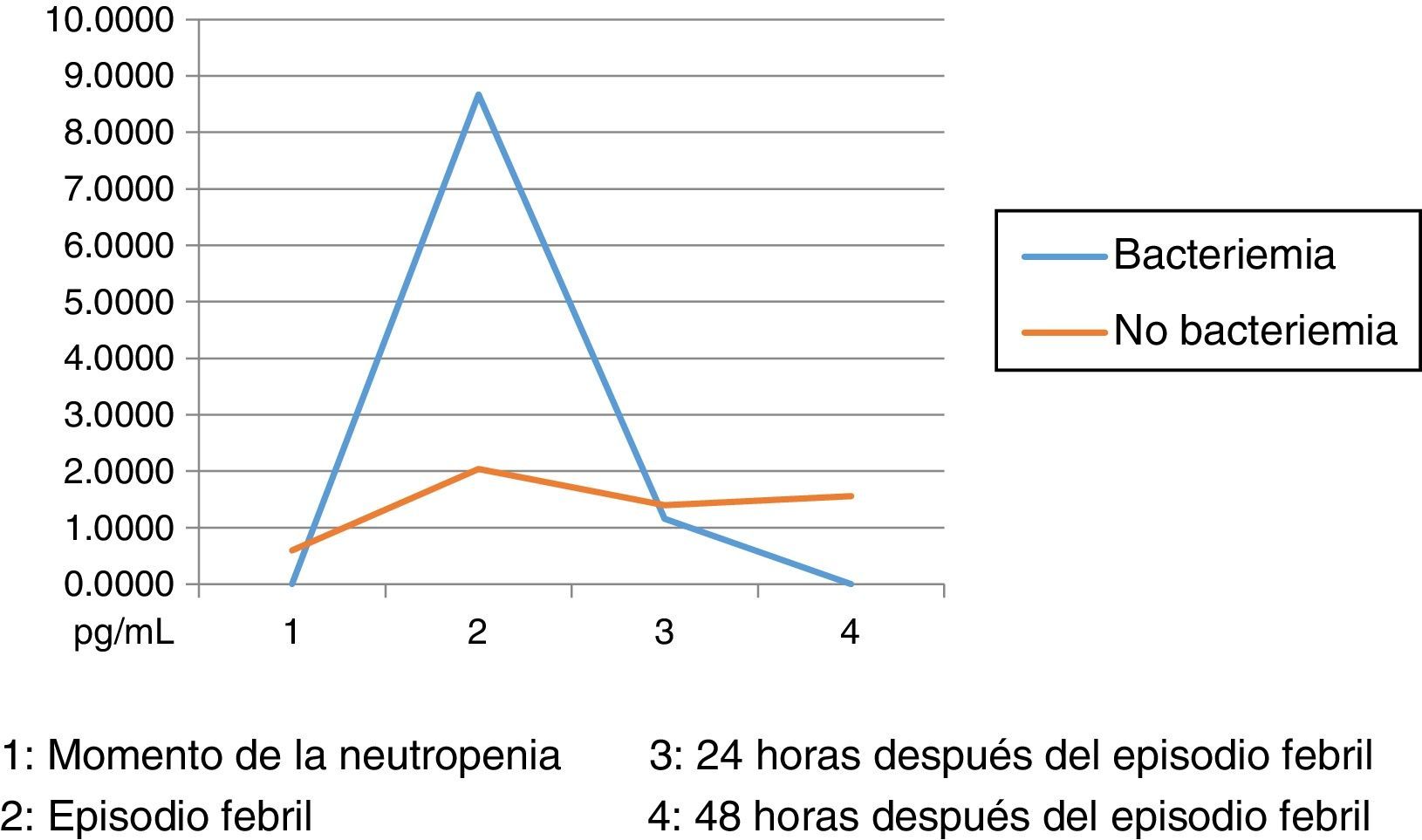
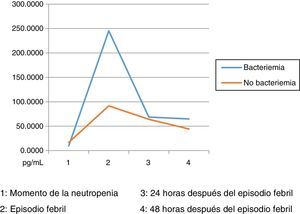
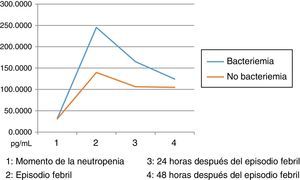
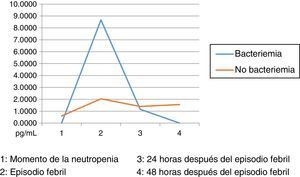
Los niveles de citoquinas IL6, IL8 e IL10 mostraron diferencias en la concentración sérica y su relación con la presencia o no de bacteriemia. La diferencia se observó en la segunda muestra correspondiente al episodio febril. Los resultados se establecieron a través de medianas y rangos intercuartílicos (RIQ) calculados para las cuatro muestras, correspondientes al momento de diagnóstico de la neutropenia, el momento de aparición de la fiebre y las 24 y 48 horas posteriores. Mediante la prueba no paramétrica de suma de rangos (Prueba U de Mann Whitney), se evaluó la significancia de esta observación (Ho: Variación de los niveles en el tiempo 2 se presenta al azar. Ha: Los niveles en el tiempo 2 son mayores en bacteriémicos) y se encontró que solo con IL10 esta distribución fue estadísticamente significativa (Z=0,0278). IL6 e IL8 mostraron significancia limítrofe en este mismo momento (Z=0,0656 y 0,0840, respectivamente).
Las IL1, IL12p70 y TNF reflejaron niveles séricos indetectables para los estándares de la prueba, razón por la cual no se presentan sus resultados. Las figura 1, figura 2 y figura 3 esquematizan los datos mencionados y en las tabla 3, tabla 4 y tabla 5 se presentan las medianas de concentraciones de IL6, IL8 e IL10.
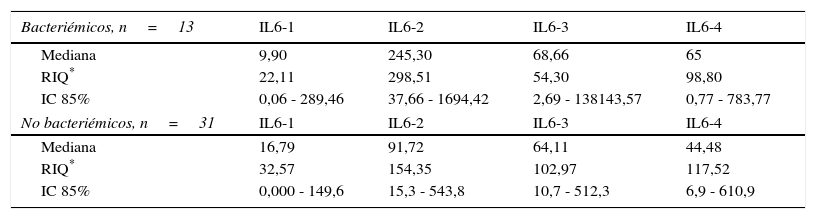
Niveles séricos de IL6 (pg/mL) distribuidos por medianas según la presencia o no de bacteriemia
| Bacteriémicos, n=13 | IL6-1 | IL6-2 | IL6-3 | IL6-4 |
|---|---|---|---|---|
| Mediana | 9,90 | 245,30 | 68,66 | 65 |
| RIQ* | 22,11 | 298,51 | 54,30 | 98,80 |
| IC 85% | 0,06 - 289,46 | 37,66 - 1694,42 | 2,69 - 138143,57 | 0,77 - 783,77 |
| No bacteriémicos, n=31 | IL6-1 | IL6-2 | IL6-3 | IL6-4 |
| Mediana | 16,79 | 91,72 | 64,11 | 44,48 |
| RIQ* | 32,57 | 154,35 | 102,97 | 117,52 |
| IC 85% | 0,000 - 149,6 | 15,3 - 543,8 | 10,7 - 512,3 | 6,9 - 610,9 |
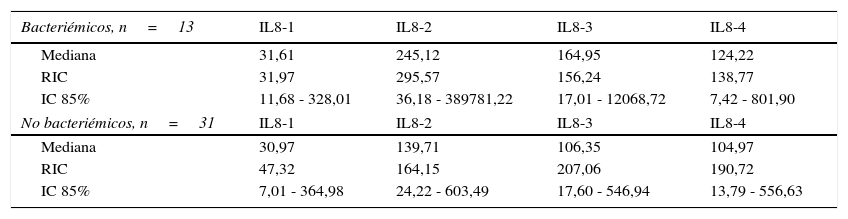
Niveles séricos de IL8 (pg/mL) distribuidos por medianas según la presencia o ausencia de bacteriemia
| Bacteriémicos, n=13 | IL8-1 | IL8-2 | IL8-3 | IL8-4 |
|---|---|---|---|---|
| Mediana | 31,61 | 245,12 | 164,95 | 124,22 |
| RIC | 31,97 | 295,57 | 156,24 | 138,77 |
| IC 85% | 11,68 - 328,01 | 36,18 - 389781,22 | 17,01 - 12068,72 | 7,42 - 801,90 |
| No bacteriémicos, n=31 | IL8-1 | IL8-2 | IL8-3 | IL8-4 |
| Mediana | 30,97 | 139,71 | 106,35 | 104,97 |
| RIC | 47,32 | 164,15 | 207,06 | 190,72 |
| IC 85% | 7,01 - 364,98 | 24,22 - 603,49 | 17,60 - 546,94 | 13,79 - 556,63 |
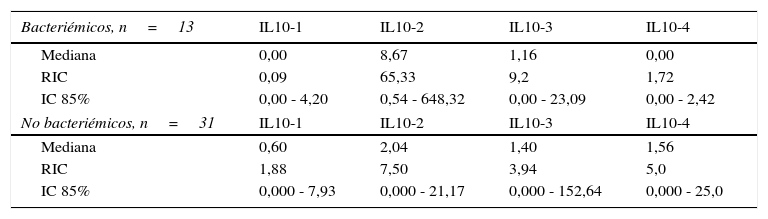
Niveles séricos de IL10 (pg/mL) distribuidos por medianas según la presencia o no de bacteriemia
| Bacteriémicos, n=13 | IL10-1 | IL10-2 | IL10-3 | IL10-4 |
|---|---|---|---|---|
| Mediana | 0,00 | 8,67 | 1,16 | 0,00 |
| RIC | 0,09 | 65,33 | 9,2 | 1,72 |
| IC 85% | 0,00 - 4,20 | 0,54 - 648,32 | 0,00 - 23,09 | 0,00 - 2,42 |
| No bacteriémicos, n=31 | IL10-1 | IL10-2 | IL10-3 | IL10-4 |
| Mediana | 0,60 | 2,04 | 1,40 | 1,56 |
| RIC | 1,88 | 7,50 | 3,94 | 5,0 |
| IC 85% | 0,000 - 7,93 | 0,000 - 21,17 | 0,000 - 152,64 | 0,000 - 25,0 |
Está bien descrita la relación entre el grado de neutropenia y el riesgo de infecciones bacterianas y fúngicas en pacientes con neoplasias hematológicas en quimioterapia. Hace cuatro décadas, Bodey et al.2 realizaron una descripción detallada de las complicaciones infecciosas en 52 pacientes tratados con citotóxicos para el tratamiento contra la leucemia aguda. Ellos determinaron que, de acuerdo con la disminución de los granulocitos, la frecuencia, la duración y gravedad de las infecciones aumentaban de manera notable. Esto se presentó especialmente cuando el recuento de neutrófilos cayó por debajo de 500 células/mm3. En la actualidad, se reconoce no solo el conteo absoluto de neutrófilos como factor de riesgo de mortalidad, sino que esta también se relaciona con la enfermedad subyacente y la potencia de la quimioterapia. A pesar del mayor conocimiento de la patología y de los avances técnico-científicos, la morbilidad y la mortalidad por complicaciones infecciosas después de quimioterapia agresiva y potencialmente curativa en pacientes con neoplasias hematológicas sigue siendo un problema clínico, con tasas de mortalidad reportadas en nuestro medio entre 7,2% y 11,6%23,24. En nuestro estudio en el que se reportaron 13 bacteriemias, no se documentó ninguna muerte al egreso hospitalario, como se muestra en la tabla 1; sin embargo, en este estudio no se planteó como objetivo analizar las causas relacionadas con mortalidad, por lo tanto, no se puede establecer alguna conclusión al respecto.
En la mayoría de los episodios de neutropenia febril, los agentes infecciosos causales no se pueden identificar. Rintala et al.4, evaluaron las características de 554 episodios febriles en 126 pacientes con cáncer hematológico durante un periodo de seis años. Los hemocultivos fueron positivos en el 19% de los episodios febriles. Un estudio más reciente25 evidencia aislamientos microbiológicos en hemocultivos en el 43% de los episodios de neutropenia febril en 116 pacientes hospitalizados para la administración de quimioterapia aplasiante. Otro estudio retrospectivo26 analizó los resultados de cultivos obtenidos en 95 pacientes neutropénicos con fiebre y encontró que un 63% de los pacientes tenía hemocultivos positivos, con 43% de aislamientos de gérmenes Gram negativos, 29,8% de Gram positivos, 3,2% fue polimicrobiano y solo un hemocultivo documentó hongos. En nuestro estudio se logró una tasa de hemocultivos positivos del 25% similar a lo revisado en la literatura, con mayor frecuencia de aislamientos de gérmenes Gram negativos (69%) y con la presencia de bacteriemias polimicrobianas en el 38% de los casos.
Recientes estudios en pacientes inmunocomprometidos con neutropenia febril han demostrado que estos pacientes también son capaces de producir niveles plasmáticos elevados de citoquinas, así como de procalcitonina y proteína C reactiva27–30. En el contexto de neutropenia febril postquimioterapia, un estudio prospectivo compara diversos métodos (procalcitonina, PCR y citoquinas: IL6 e IL8)31, mostrando una especificidad de 80% con un valor predictivo negativo de 85% en los pacientes neutropénicos febriles sin bacteriemia. Encontró que ninguno de los marcadores analizados fue superior en términos de sensibilidad, especificidad, valor predictivo positivo y valor predictivo negativo para bacteriemia. Sin embargo, las IL6 e IL8 permitieron una detección más precoz de procesos infecciosos severos (10 horas) comparadas con procalcitonina y PCR.
Dentro de las limitaciones del presente estudio, infortunadamente y por circunstancias ajenas a los investigadores, no se pudo disponer de todas las muestras del proyecto, por lo cual los datos difieren de los presentados en el estudio16 y no se lograron establecer valores predictivos para la documentación de bacteriemia con los marcadores medidos; sin embargo, se pudo perfilar la cinética de los mismos, encontrando mayor grado de variación durante el momento de la fiebre (muestra 2) al comparar el grupo de bacteriémicos con el de no bacteriémicos. Esta información permitiría establecer una mayor utilidad de la IL10 en la detección precoz de los episodios febriles de alto riesgo. Aunque las IL6 y 8 no mostraron en este estudio resultados estadísticamente significativos, se evidenció el mismo comportamiento cinético al momento del episodio febril, tal como se describe en la referencia antes mencionada31.
Dado el amplio rango de concentraciones de estas citoquinas, se trataron de establecer los puntos de corte en el momento del episodio febril relacionados con la presencia de bacteriemia: IL6: 174,015pg/mL (S: 69%, E: 75%, AUC 0,72). IL8: 216, 745pg/mL (S: 62%, E: 78%, AUC 0,70). IL10: 5,39pg/mL (S: 62%, E: 69%, AUC 0,65). Estos son resultados con poca significancia estadística que deberán corroborarse en estudios posteriores con un tamaño de muestra mayor. Llamativamente, las IL1, IL12p70 y TNF arrojaron niveles por debajo de los estándares de la prueba, situación no esperada según los datos reportados por la literatura. Esta situación podría explicarse por la vida media tan corta de estas citoquinas y por factores relacionados con la toma y procesamiento de las muestras, aspectos críticos en las variaciones interensayo32.
Las muestras deben mantenerse refrigeradas hasta su procesamiento, pues se han encontrado diferencias en mediciones de citoquinas entre las que se mantienen a temperatura ambiente y -4°C. Las muestras pueden permanecer congeladas a -70°C hasta por dos años, manteniéndose estables los niveles de citoquinas. Resulta fundamental evitar ciclos múltiples de congelación-descongelación.
Durante la ejecución de la prueba, se acataron estrictamente estas recomendaciones, manteniendo la cadena de frío durante todo el proceso, llevando a cabo una descongelación gradual de las muestras y efectuando la lectura de citometría en un mismo tiempo para los 176 tubos33.
Para concluir, en el contexto de neutropenia febril, el inicio de terapia antibiótica está claramente indicado y, si bien la medición de biomarcadores no influirá en esta decisión, sí se podrían convertir para el clínico en una herramienta útil para definir el tiempo de la antibioticoterapia en situaciones clínicas complejas, como lo es la fiebre de origen desconocido, con impacto en estancia hospitalaria, resistencia antimicrobiana, calidad de vida y costos. Las citoquinas podrían cumplir un papel promisorio en el seguimiento de los pacientes neutropénicos febriles dada la potencial asociación con presencia de bacteriemia, desenlace bien conocido como predictor de morbimortalidad en esta población. Sin embargo, se requieren más estudios con mayor población para definir una recomendación clara en las guías de manejo de neutropenia febril postquimioterapia.
FinanciaciónEl Instituto Nacional de Cancerología ESE aprobó este proyecto para su ejecución, código C41030610-898. Este proyecto de investigación contó con financiación de la Dirección de Investigación Sede Bogotá (DIB) de la Universidad Nacional de Colombia, código Hermes 28447.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A la Universidad Nacional de Colombia porque financió este proyecto, lo que permitió contratar a la bacterióloga Ana María Montañez para realizar la parte administrativa y operativa del proyecto de investigación y a la bacterióloga Luisa Fernanda Barajas quien, como monitora del Grupo de Investigación Institucional, brindó su apoyo y supervisión al grupo de investigadores. A Becton Dickinson™ por la valiosa colaboración brindada en cuanto a la donación de los kit y el procesamiento de las muestras.