El índice de monitorización biespectral (BIS) fue introducido en Norteamérica en 1994 y aprobado por la FDA en 1996 con el objetivo de medir el nivel de conciencia realizando un análisis algorítmico del electroencefalograma durante la anestesia general.
Esta novedad permitió que tanto el cirujano como el anestesiólogo tuvieran una percepción más objetiva de la profundidad anestésica. El algoritmo está basado en diferentes parámetros del electroencefalograma, incluyendo tiempo, frecuencia y onda espectral. Esto provee un número no dimensional, que varía desde 0 hasta 100, siendo los niveles óptimos entre 40 y 60.
ObjetivosRealizar un análisis de las ventajas y limitaciones del manejo anestésico con el monitor de análisis biespectral, específicamente en el manejo y prevención del despertar intraoperatorio.
MetodologíaSe realizó una revisión no sistemática de la literatura disponible en PubMed entre los años 2001-2015, utilizando palabras clave como «BIS», «bispectral monitoring», monitorización cerebral, despertar intraoperatorio, «recall» e «intraoperative awareness».
ResultadosSe encontraron un total de 2.526 artículos, de los cuales solo se tomaron en cuenta aquellos que contenían información tanto de monitorización biespectral como de despertar intraoperatorio. Un total de 68 artículos fueron utilizados para esta revisión.
ConclusiónEn la anestesia guiada por BIS se han documentado menores complicaciones postoperatorias inmediatas, como la incidencia de náuseas/vómitos, dolor y delirium, además de prevenir el despertar intraoperatorio y sus complicaciones.
the bispectral index monitoring system (BIS) was introduced in the United States in 1994 and approved by the FDA in 1996 with the objective of measuring the level of consciousness through an algorithm analysis of the electroencephalogram during general anesthesia.
This novelty allowed both the surgeon and the anesthesiologist to have a more objective perception of anesthesia depth. The algorithm is based on different electroencephalogram parameters, including time, frequency, and spectral wave. This provides a non-dimensional number, which varies from zero to 100; with optimal levels being between 40 and 60.
ObjectivesPerform an analysis of the advantages and limitations of the anesthetic management with the bispectral index monitoring, specifically for the management and prevention of intraoperative awareness.
MethodologyA non-systematic review was made from literature available in PubMed between the years 2001-2015, using keywords such as “BIS”, “bispectral monitoring”, monitorización cerebral, despertar intraoperatorio, “recall” and “intraoperative awareness”.
ResultsA total of 2526 articles were found, from which only the ones containing both bispectral monitoring and intraoperative awareness information were taken into consideration. A total of 68 articles were used for this review.
ConclusionBIS guided anesthesia has documented less immediate postoperative complications such as incidence of postoperative nausea/vomit, pain and delirium. It also prevents intraoperative awareness and its complications.
La medición de la profundidad anestésica siempre ha sido una necesidad sustancial, incluso desde los inicios de la anestesia con éter, en 1847.
Actualmente el índice biespectral (BIS) es el equipo de monitorización de la profundidad anestésica utilizado con mayor frecuencia. Tiene como objetivo, basado en un algoritmo matemático, medir el nivel de conciencia por medio del electroencefalograma (EEG) del paciente durante la anestesia general, para así evaluar sus efectos directos a nivel cerebral1.
Entre las ventajas de su uso está la titulación anestésica basada en la actividad cerebral, con la cual se disminuye la incidencia de despertar intraoperatorio (DI) y el consumo anestésico; lo que conlleva una rápida recuperación2,3.
Los valores del BIS se relacionan con la actividad EEG; la onda beta (β) se relaciona con despertar y BIS entre 100 a 80, en el estado de sedación con anestesia general el rango está entre 60 a 40, la anestesia profunda se refleja con ondas delta (δ) y un rango de 40 a 20 en el monitor BIS, la supresión de descargas en un rango de 0 a 20 y una línea isoeléctrica del encefalograma da un valor de 0 en el monitor4–7.
En el metaanálisis realizado por Punjasawadwong et al. se comparó el uso del BIS con el cuidado anestésico estándar, a fin de determinar si había una reducción en el consumo de anestésicos, tiempo de recuperación, incidencia de DI y costos hospitalarios. Se tomaron en cuenta 12 estudios, 4.056 pacientes, y se demostró que el uso del BIS disminuye el nivel de propofol en 1,3mg/kg/h, la concentración alveolar mínima (CAM) en 0,17, el tiempo de extubación en 3,05min, el tiempo de recuperación en la unidad de cuidados postanestésicos en 6,83min y el DI en un 65,4%8. Posteriormente, en la actualización de este estudio, se obtuvo como resultado una equivalencia en la reducción de DI, al comparar la profundidad anestésica guiada por la monitorización por BIS con la guiada por la concentración de gas anestésico al final del volumen corriente9.
Monk et al. investigaron la relación entre el manejo de la anestesia y la mortalidad a un año después de la cirugía no-cardiovascular, descubriendo un aumento del 24,4% en la mortalidad por cada hora en la cual los valores del BIS eran menores a 45 (p=0,0121)10. Así mismo, Leslie et al., en el estudio «B-Aware», demostraron que cuando los valores del BIS no disminuían a menos de 40 por más de 5min existía un aumento en la supervivencia a los 30 días11. La importancia de la monitorización de la profundidad anestésica con BIS no ha sido muy explorada. En estudios como «B-Unaware» y «BAG-RECALL», realizados en pacientes que fueron sometidos a cirugía cardiaca, se demostró una probable asociación entre valores bajos de BIS y la mortalidad a mediano plazo, pero esto no estaba asociado con un aumento de la dosis total de anestésicos12,13.
Uno de los estudios retrospectivos más importantes en Estados Unidos fue desarrollado por Sessler et al., en el cual se investigó la relación entre la duración de la estancia hospitalaria y la mortalidad en 30 días en pacientes que presentaban una «triple baja», en valores de presión arterial media (<75mmHg), BIS (<45) y CAM (<0,8).
De 24.120 pacientes incluidos en el estudio un 6% presento «triple baja» durante la cirugía. Dichos pacientes tuvieron una hospitalización prolongada y aumentó 2 veces la mortalidad, concluyendo que la mortalidad a los 30 días aumentaba cuando la duración de la «triple baja» era mayor de 30min14. Aunque posteriormente los resultados de este estudio fueron cuestionados por Kertai et al.15, la «triple baja» continúa siendo motivo de discusión16–18.
En cirugías cardiovasculares la monitorización de la profundidad anestésica es un reto para el anestesiólogo. El uso del bypass cardiopulmonar (BCP) predispone al paciente a presentar DI por diferentes razones: durante el BCP la presión arterial es determinada por la bomba de circulación extracorpórea y el paciente carece de frecuencia cardiaca, por lo que la profundidad anestésica es difícil de correlacionar19.
La profundidad anestésica monitorizada con BIS durante la cirugía cardiaca no parece tener un impacto significativo en reducción de los tiempos de extubación, estancia en UCI y estancia hospitalaria20,21. De igual manera, el uso de la anestesia total intravenosa (TIVA) produce cambios en la farmacocinética, aumentando el riesgo de complicaciones. El uso de monitores de la actividad cerebral se vuelve imprescindible en estas circunstancias22.
Otra de las ventajas al utilizar BIS es la posible reducción del delirio y deterioro cognitivo postoperatorio, tanto inmediato (una semana) como tardío (3 meses)23–25.
ObjetivosRealizar un análisis de las ventajas y limitaciones del manejo anestésico con el monitor de análisis biespectral, específicamente en el manejo y prevención del despertar intraoperatorio.
MetodologíaSe realizó una revisión no sistemática de la literatura disponible en PubMed entre los años 2001-2015, utilizando palabras clave como «BIS», «bispectral monitoring», monitorización cerebral, despertar intraoperatorio, «recall» e «intraoperative awareness».
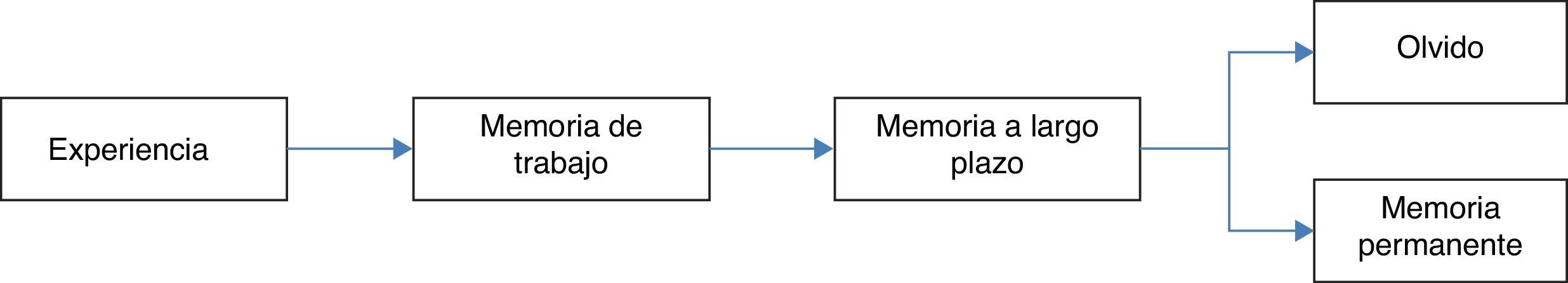
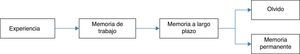
Despertar intraoperatorioMemoria es la capacidad de retener y revivir impresiones, o de reconocer experiencias previas. Se caracteriza por presentar 4 etapas: codificación, consolidación, almacenamiento y recuperación. En orden temporal los estímulos sensoriales son convertidos en memoria (codificación), seguido por la transferencia de memoria de corto plazo a una memoria de largo plazo, más estable antes de su ingreso en áreas neocorticales (consolidación), posteriormente la memoria está representada por una red de neuronas interconectadas a través de la neocorteza, uniéndose para almacenar, y finalmente su recuperación26,27.
Existen 2 tipos de memoria, las cuales han sido estudiadas ampliamente: la memoria explícita (también conocida como memoria controlada o declarativa), la cual requiere de estructuras en el lóbulo medio temporal, como el hipocampo y estructuras corticales, esenciales para la formación, reorganización, consolidación y almacenamiento28–30.
Por otro lado, la memoria implícita (también llamada automática o no-declarativa), que se refiere a los cambios de comportamiento o de la respuesta a estímulos sin conocimiento o recuerdo del contexto en el que se presentaron28,29. Comprende múltiples áreas cerebrales: cerebelo, estriado y mesencéfalo. La amígdala modula el aprendizaje emocional en la corteza y el hipocampo, siendo necesaria para el almacenamiento y recuperación de recuerdos (fig. 1)26,31.
Los anestésicos no afectan a la memoria implícita, pero se cree que influyen en la memoria explícita durante la anestesia general, usualmente ocasionado por un nivel anestésico inadecuado32. El mecanismo molecular por el cual los anestésicos afectan a la memoria y al aprendizaje aún es un tema de estudio, su efecto a nivel de los receptores γ-aminobutírico tipo A (GABAA) parece inhibir y bloquear el proceso normal de la memoria26,33.
El DI se define como la experiencia y el recuerdo específico de una percepción sensorial durante la cirugía34. Los pacientes pueden recordar eventos intraoperatorios espontáneamente o posterior a preguntas específicas sobre el evento, y este recuerdo puede ocurrir inmediatamente después de la cirugía o días después de la cirugía35. El primer caso documentado fue en 1950 por Winterbottom36,37. La incidencia actual es motivo de debate, debido a diferencias metodológicas en los estudios realizados y a la amplia variedad de percepciones reportadas por pacientes38,39. Sin embargo, la incidencia presentada en el 5.° Proyecto Nacional de Auditoria del Colegio Real de Anestesiólogos del Reino Unido (NAP5) es de 1:19.00040.
En pacientes con alto riesgo de DI, así como en pacientes sometidos a TIVA, la incidencia puede ser tan alta como del 1%41,42. La anestesia obstétrica es la subespecialidad con mayor incidencia de DI, algunos de los factores de riesgo atribuidos a esto son: uso de tiopental, la inducción rápida, la dificultad en el manejo de la vía aérea, la obesidad, los casos urgentes y los casos realizados por personal en entrenamiento, entre otros43,44.
El DI representa el 2% de las demandas de la base de datos Closed Claims de la Sociedad Americana de Anestesia (ASA)45. En una serie de entrevistas se demostró que más del 50% de los pacientes expresaron temor de «despertar durante la cirugía», el 65% de los que experimentaron esta complicación no se lo expresaron a su anestesiólogo o no tuvieron la oportunidad de hacerlo46,47.
Pandit et al. estudiaron 153 casos de DI durante anestesia general. El 47% de los casos se presentaron durante la inducción anestésica, el 30% durante la cirugía y el 23% antes de la recuperación48. Las percepciones sensoriales más comúnmente reportadas son auditivas (70%) y táctiles (72%), mientras que las reacciones emocionales se presentaron en un 65% de los casos (p<0,05)47. El DI puede dejar como consecuencia un trastorno de estrés postraumático hasta en un 71% de la población, presentándose entre 2h o 30 días luego del evento49,50.
Causas principalesEntre las causas más importantes de DI se encuentran:
1) Subdosificación anestésica a las necesidades del paciente34,51. La incidencia de DI es del 0,10% en ausencia de relajantes neuromusculares, comparada con 0,18% en presencia de estos52. Esto se relaciona con una dosis anestésica inadecuada, ya que los pacientes pueden permanecer paralizados, pero conscientes, ya que la concentración anestésica necesaria para bloquear la respuesta motora es mucho mayor a la requerida para bloquear la memoria explícita30,53. Sin embargo, su eliminación muchas veces no resulta factible, ya que la relajación muscular es importante para el proceso quirúrgico54.
2) La resistencia del paciente a la anestesia, la edad, el uso de tabaco, la obesidad, el uso crónico de anfetaminas, el alcohol y los opioides pueden hacer que el paciente requiera un aumento de la dosis de anestésicos51,55.
3) Problemas mecánicos que resulten en una entrega de anestésico inadecuada: bloqueo de la vía endovenosa, un cilindro de gas vacío o atrapamiento de aire en el ventilador55.
4) Pacientes con baja reserva fisiológica y bajo requerimiento anestésico.
El uso de medicamentos como benzodiacepinas preoperatorias podría ayudar, al inhibir la formación de memoria anterógrada56. Su uso aún debe ser estudiado29.
DiagnósticoEncuestas y entrevistas como el «protocolo de Brice modificado» (PBM) evalúan las características de los eventos que ocurren antes, durante y después de la anestesia y son útiles para el diagnóstico del DI57. Diferentes estudios han encontrado una incidencia de DI de 79%, entre el 33-50% y 28% en la unidad de cuidado postanestésico, 7 y 14 días después del procedimiento respectivamente, resaltando la importancia de su evaluación, incluso semanas después del evento anestésico.
El diagnóstico de DI se puede subdividir en 6 categorías (tabla 1). Su clasificación es importante para prevenir secuelas a largo plazo, como el trastorno de estrés postraumático, que se manifiesta usualmente como alteraciones en el patrón de sueño, pesadillas recurrentes, flashbacks y ansiedad49,58,59.
Clasificación del despertar intraoperatorio según Mashour
| Clase | Significado |
|---|---|
| 0 | No despertar intraoperatorio |
| 1 | Percepciones auditivas aisladas |
| 2 | Percepciones táctiles (manipulación quirúrgica, tubo endotraqueal) |
| 3 | Dolor |
| 4 | Parálisis (sensación de incapacidad para moverse, hablar o respirar) |
| 5 | Parálisis y dolor |
| D | Distrés (ansiedad, sofocación, sensación de fatalidad o muerte inminente) |
Fuente: autor.
Existen diferentes características que pueden hacer a un determinado individuo más susceptible al DI: el sexo femenino, el uso de medicamentos anticonvulsivantes, ASA≥4, fracción de eyección>40%, historia previa de DI, difícil intubación, cirugía cardiovascular, tabaquismo y consumo de alcohol (tabla 2)13,34,35. Avidan et al. seleccionaron pacientes con estos factores de riesgo, posteriormente aleatorizados a anestesia guiada por BIS o CAM. El DI fue evaluado con el PBM, a las 72h y a los 30 días postextubación. Sus resultados demostraron que más pacientes del grupo BIS mostraron DI, pero estas diferencias no fueron clínicamente significativas (p=0,98)13.
Factores de riesgo para despertar intraoperatorio
| Error o fallo en la administración de la anestesia | Error humano (anestesiólogo) |
| Error en el uso del equipos | |
| Error del equipo | |
| Intubación difícil | |
| Hipovolemia | |
| Tipo de cirugíaCardiacaObstétricaTraumatológica | |
| Uso de bloqueadores neuromusculares | Mala interpretación de los cambios producidos en el BIS |
| Abolición de signos fisiológicos de DI (movimiento) | |
| Aumento de los requerimientos anestésicos | Paciente femenino |
| Paciente joven o pediátrico | |
| Obesidad | |
| Uso crónico de alcohol | |
| Abuso de opioides o benzodiacepinas | |
| Tabaquismo | |
| Uso de inductores del citocromo P450 3AEfavirenzNevirapineBarbitúricosCarbamazepinaGlucocorticoidesFenitoínaRifampicinaHierba de San Juan | |
| Antecedente de despertar intraoperatorio | SecuelasEstrés postraumático |
| TIVA | Inadecuada monitorización de la actividad cerebral |
| Inadecuada monitorización de la concentración plasmática de anestésico | |
| Error en la administración de los anestésicosOclusión o infiltración del acceso venoso |
Fuente: autor.
El estudio «B-aware» («estar consciente») también estudió pacientes con alto riesgo de presentar DI. El cuidado perioperatorio y el uso de anestésicos no fue modificado. Los pacientes podían ser monitorizados con BIS durante la cirugía, o según el protocolo estándar de cada hospital. Un cuestionario previamente estructurado se ejecutó a las 2-6h, 24-36h y 30 días posquirúrgicos60. Una reducción del 82,2% (IC 95%: 17-98%) de DI se observó en los pacientes con anestesia guiada por BIS. De los 2 pacientes que tuvieron DI los rangos registrados en el monitor variaron entre 55-82, por lo que se concluyó que la vigilancia constante del monitor es vital60.
En contraste con los resultados anteriores, el estudio B-Unaware no encontró ninguna diferencia en la incidencia de DI en 1.941 pacientes con alto riesgo de presentarlo12.
Muchos otros estudios se han realizado proponiendo el mismo tipo de abordaje con el PBM, en los cuales no se ha demostrado diferencia entre el grupo de anestesia guiada por BIS y el manejado con el protocolo estándar61. A pesar de ello, lograron demostrar que el PBM, como herramienta para el diagnóstico de DI es superior a cualquier otra medida (p<0,0001)62.
La incidencia de DI durante TIVA también ha sido estudiada56,63. En diversos estudios la profundidad de la anestesia guiada por el valor de la CAM ha demostrado tener una baja incidencia de DI13,34. Por el contrario, en TIVA la concentración plasmática a la cual el 50% de los pacientes no responde a la incisión quirúrgica en la piel (CP50) no es práctica clínicamente, y no puede efectuarse en tiempo real9,64. Esta es cuantificada por modelos farmacológicos, mediante bombas de infusión, aplicaciones para dispositivos móviles o nomogramas. Al comparar BIS (grupo A) con el manejo estándar (grupo B) y realizar el PBM al primer y cuarto día postoperatorio 4 pacientes del grupo A presentaron DI (0,14%), mientras que 15 pacientes del grupo B presentaron DI (0,65%). La TIVA guiada por BIS presentó una disminución de la incidencia de DI en un 78%65.
PrevenciónExisten 3 aspectos básicos necesarios para prevenir el DI:a) observar al paciente: los signos clínicos como algún tipo de movimiento, sudoración, lagrimeo, etc.; b) la monitorización intraoperatoria convencional: los signos vitales y su relación con el sistema nervioso simpático traduciéndose en un aumento de la presión arterial y la frecuencia cardiaca; y c) la monitorización de la función cerebral66.
Existen también múltiples sugerencias para disminuir significativamente el DI:
1) Premedicar a los pacientes con fármacos que posean efecto sedativo y que ayuden a disminuir su incidencia (por ejemplo benzodiacepinas), en particular con anestesia superficial o de poca duración. Estos medicamentos bloquean la memoria anterógrada y los procesos cognitivos de manera proporcional a la dosis y velocidad de administración. Una dosis oral de 0,2-0,3mg/kg1h antes de la cirugía puede dar estos resultados29,40.
2) Dar dosis anestésicas adecuadas en el momento de la inducción, inmediatamente después de la intubación endotraqueal, e incluso cuando se realiza la primera incisión quirúrgica.
3) Evitar o reducir el uso de bloqueadores neuromusculares, para lograr valorar de manera objetiva el área motora del paciente40.
4) Durante el mantenimiento de la anestesia general con agentes volátiles se sugiere mantener una CAM mayor o igual a 0,7%34.
5) En pacientes obstétricas, con traumatismo severo o de difícil intubación el uso de medicamentos amnésicos y opioides deberá ser considerado40,67.
6) Debe realizarse un chequeo periódico de los equipos utilizados para la administración de anestesia, así como la permeabilidad de los accesos venosos40,68.
7) Discutir con el paciente de la posibilidad de presentar DI, sobre todo si tiene más de un factor de riesgo, evitando problemas legales en el futuro40,68.
8) Conocer la farmacocinética, farmacodinamia y el proceso de biodisponibilidad del anestésico con el que se está trabajando68.
ConclusionesLa controversia que existe en los múltiples estudios que se han realizado deja aún mucho campo por ser estudiado en cuanto a este complejo tema de la monitorización intraoperatoria. Lo que es cierto es que se ha visto un claro avance en el campo de la medicina al introducir este método para guiar anestesia, el cual no solo ayuda al paciente como individuo, mejora sus resultados y minimiza sus complicaciones postoperatorias, sino también da un claro avance en la maximización de recursos en las redes hospitalarias, aminora gastos y disminuye tasas de morbimortalidad por intervenciones quirúrgicas.
Es de tomar en cuenta a la hora de hacer las evaluaciones pre anestésicas todos los factores de riesgo que presenta un individuo que lo hacen más susceptible al DI, o si ha experimentado dicho acontecimiento anteriormente para tomar medidas preventivas y efectivas con miras a evitar esta complicación.
FinanciamientoLos autores no recibieron patrocinio para llevar a cabo este artículo.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.