El síndrome de apnea-hipopnea obstructiva del sueño es un trastorno cada vez más prevalente en la población, que compromete seriamente la calidad de vida de quienes lo padecen. Aunque la presión positiva continua en la vía aérea es la modalidad terapéutica más utilizada, su poca adherencia y relativa insuficiencia han promovido diferentes investigaciones para desarrollar nuevas alternativas de tratamiento.
ObjetivoRevisar las estrategias más recientes e innovadoras que la evidencia científica propone para el tratamiento del síndrome de apnea-hipopnea obstructiva del sueño con base en sus mecanismos anatómicos y fisiológicos.
Materiales y métodosSe realizó una revisión bibliográfica a partir de artículos en idioma inglés, tomados de las bases de datos PubMed, ScienceDirect, Springer, LILACS y PEDro, publicados entre 2005 y 2015.
ResultadosEl síndrome de apnea-hipopnea obstructiva del sueño es la oclusión intermitente y repetitiva de la vía aérea superior durante el sueño, causada principalmente por desbalance en la sinergia muscular respiratoria. Para su tratamiento, recientemente se han descrito modalidades como los dispositivos orales, las terapias de presión, el Pillar, el Night Shift, la cirugía bariátrica y la estimulación del nervio hipogloso.
ConclusionesAunque aún no se cuenta con un tratamiento totalmente eficaz, la combinación de estrategias desde una perspectiva interdisciplinar puede mejorar la calidad de vida de estos pacientes. Se espera que durante los próximos años, los avances en ciencia y tecnología permitan implementar el protocolo de tratamiento que logre abordar directamente los procesos etiológicos de la enfermedad para poder reducir su prevalencia.
Obstructive sleep apnea-hypopnea syndrome is an increasingly prevalent disorder in the population, which seriously compromises the quality of life of sufferers. Although continuous positive airway pressure remains the most commonly used treatment modality, its poor adhesion and relative failure have promoted realization various research to develop more convenient and effective alternatives in treating this condition.
ObjectiveTo review the most effective, recent and innovative strategies that scientific evidence suggests for the treatment of obstructive sleep apnea-hypopnea syndrome from anatomical and physiological mechanisms involved.
Materials and methodsA literature review was performed from ítems taken from PubMed, ScienceDirect, Springer, LILACS and PEDro database, published between 2005 and 2015 in English.
ResultsObstructive sleep apnea-hypopnea syndrome is intermittent and repetitive obstruction of the upper airway during sleep, caused mainly by respiratory muscle imbalance in synergy. For treatment, the scientific literature has recently described methods such as oral devices, oral and nasal pressure therapies, Pillar, the Night Shift, bariatric surgery and stimulation of the hypoglossal nerve.
ConclusionsAlthough not yet have a fully effective treatment, a combination of strategies from an interdisciplinary perspective can enhance the quality of life of patients. It is expected that in the coming years, the scientific and technological advances allow implementing the treatment protocol that achieves directly address the etiological processes to reduce their prevalence.
El síndrome de apnea-hipopnea obstructiva del sueño (SAHOS) es desde finales del siglo XX un problema relevante de salud pública en Colombia, debido al rápido incremento de su prevalencia tanto en la población adulta como pediátrica1,2. Las manifestaciones clínicas propias de esta condición y las múltiples comorbilidades que suelen aparecer a largo plazo, hacen que la calidad de vida de los pacientes con SAHOS se vea afectada considerablemente, pues incluso puede provocar la muerte3,4.
Se han empleado diversas alternativas terapéuticas que, si bien logran atenuar los síntomas y las alteraciones multisistémicas derivadas del SAHOS, no brindan soluciones definitivas para suprimir sus causas. Muchos de estos tratamientos tienen poca adherencia por parte de los pacientes o generan efectos adversos a corto y/o a largo plazo5–7. Tales limitaciones han motivado a realizar investigaciones más exhaustivas sobre la patogénesis del SAHOS para desarrollar nuevas opciones de tratamiento desde distintos enfoques de intervención.
ObjetivoExponer las estrategias más eficaces, recientes e innovadoras que la evidencia científica propone para el tratamiento del SAHOS a partir de los mecanismos anatómicos y fisiológicos implicados.
Materiales y métodosPara realizar esta revisión, se recolectó información mediante la búsqueda de artículos en las bases de datos PubMed, ScienceDirect, Springer, LILACS y PEDro, utilizando los términos Mesh: sleep apnea, obstructive; airway obstruction; obesity; sleep apnea and death; cardiovascular diseases; cognitive disorders; mental disorders; kidney diseases; endocrine system disease; metabolic syndrome X; comorbidity; therapeutics; continuos positive airway pressure; mandibular advancement; hypoglossal nerve and electric stimulation. Se consideraron metaanálisis, revisiones sistemáticas, ensayos clínicos, estudios de cohorte y artículos de revisión, publicados entre los años 2005 y 2015 en idioma inglés. Se excluyeron metaanálisis, revisiones sistemáticas y artículos de revisión que tuvieran menos de 10 fuentes primarias, ensayos clínicos y estudios de cohorte con tamaños de muestra inferiores a 10, y publicaciones a las cuales no fue posible tener acceso al texto completo en la red.
ResultadosCon la estrategia de búsqueda referida, inicialmente se encontraron 311 artículos, de los cuales resultaron 276 cuando se limitó por idioma; luego, 128 cuando se restringió por metaanálisis, revisiones sistemáticas, ensayos clínicos y artículos de revisión; y finalmente, quedaron 40 documentos en texto completo que cumplían con los criterios de número de referencias mencionados. Se presentan los resultados en varios apartados: definición, fisiopatología, alteraciones neuromusculares y anatómicas, obesidad, tratamiento y conclusiones.
DefiniciónEl SAHOS es el trastorno causado por la oclusión intermitente y repetitiva de la vía aérea superior (VAS) durante el sueño, que resulta en la interrupción parcial (hipopnea) o completa (apnea) del flujo aéreo. Como consecuencia, se produce desaturación arterial de oxígeno y microalertamientos transitorios y subconscientes que fragmentan el ciclo circadiano, haciendo que el sueño no sea reparador y que se manifieste hipersomnolencia diurna, principal síntoma presente en la mayoría de los pacientes con SAHOS. El cuadro clínico también incluye ronquidos cíclicos de intensidad variable y pausas de apnea referidas por el cónyuge o la familia del paciente8.
La American Academy of Sleep Medicine9 define «apnea» como la disminución del flujo aéreo ≥ 90% durante al menos 10 segundos, e «hipopnea» como la disminución del flujo aéreo ≥ 30% durante al menos 10 segundos con desaturación arterial ≥ 3%. La severidad del SAHOS se determina mediante el índice de apnea-hipopnea (IAH), que señala la cantidad de apneas e hipopneas registradas en el lapso de una hora de sueño9,10.
FisiopatologíaLa faringe, estructura única y compleja rodeada de numerosos músculos y tejidos blandos, permite la fonación, el habla, la deglución y la respiración. Aunque se apoya en estructuras óseas y cartilaginosas en sus extremos, carece de soporte rígido en su porción transversal, lo que le confiere la capacidad de modificar el tamaño de su luz. Esta característica es esencial para cumplir con sus funciones, pero también la predispone al colapso durante el sueño11,12. Se ha reportado que los sitios más comunes de obstrucción en la VAS se registran a nivel de la región retropalatina, la base de la lengua y la hipofaringe12–14; el lugar y la extensión del colapso dependerán de la conformación anatómica de cada sujeto.
Alteraciones neuromuscularesLa permeabilidad de la VAS depende en gran parte del trabajo muscular coordinado entre los músculos dilatadores de la faringe (MDF) y los músculos inspiratorios, que ejercen presión negativa intraluminal para permitir la entrada del flujo aéreo15. La actividad de los MDF está mediada por estimulación vagal, quimiorreceptores, mecanorreceptores y barorreceptores que detectan todo tipo de cambio dentro de la VAS12,16,17. Los MDF más importantes son el geniogloso (principalmente fásico) y el tensor del velo del paladar (principalmente tónico)18,19.
El tensor del velo del paladar es el encargado de estabilizar la VAS durante el ciclo respiratorio, en tanto que el geniogloso es el principal músculo dilatador de la VAS durante la inspiración17,18. Al inicio del sueño, se registra una caída en la actividad de los MDF debido a una reducción en el impulso respiratorio central. Durante la fase N (no movimientos oculares rápidos), la actividad fásica se incrementa mientras que la actividad tónica sigue decreciendo hasta la fase R (movimientos oculares rápidos), donde se produce hipotonía de toda la musculatura esquelética, exceptuando el diafragma. En los pacientes con SAHOS, hay mayor reducción en la actividad muscular de los MDF al inicio del sueño (más de lo fisiológicamente esperado), que predispone al colapso de la VAS cuando se alcanza la fase R17–20. Durante la vigilia, los pacientes con SAHOS no suelen mostrar problemas con la permeabilidad de la VAS; por el contrario, se ha demostrado que la actividad de los MDF es más elevada en sujetos con SAHOS que en sujetos sanos, siendo esto un mecanismo neuromuscular compensatorio17,21.
Durante el episodio de apnea, el incremento de la presión parcial de dióxido de carbono (PCO2) y del esfuerzo ventilatorio, hacen que se estimule el sistema de activación reticular y se generen los microalertamientos para activar la contracción de los MDF (primordialmente el geniogloso) y así reanudar la circulación de aire por la VAS12,22. Sin embargo, algunas investigaciones refieren que los microalertamientos no tienen una relación directa con la reapertura de la VAS, pues se ha visto que un episodio de apnea puede terminarse mediante otros mecanismos, como sincronizaciones respiratorias23,24. En algunos casos, la apertura abrupta de la VAS a causa de un microalertamiento, provoca hiperventilación con subsiguiente hipocapnia, llevando a una descenso de la actividad de los MDF y a un mayor colapso de la VAS23,25,26.
Alteraciones anatómicasEn sujetos sanos, la relación de masa de los tejidos blandos es desproporcionadamente alta para el espacio puesto a disposición por las estructuras óseas que rodean la VAS18. Así, cualquier condición traumática o patológica que suponga un exceso de tejido blando y/o una pequeña caja ósea, provocará una reducción del espacio de la VAS y la hará susceptible al colapso durante el sueño (tabla 1)15,18,27–29.
Alteraciones anatómicas más frecuentes en el SAHOS
| Alteraciones óseas | Alteraciones en tejidos blandos |
|---|---|
| Desplazamiento caudal del hueso hioides | Macroglosia |
| Hipertrofia amigdalar | |
| Engrosamiento de las paredes faríngeas laterales | |
| Hipoplasia y/o retrodesplazamiento maxilar o mandibular | Engrosamiento del velo del paladar e hipertrofia uvular |
| Paladar ojival | |
| Aumento en la longitud de la faringe | Desviación del tabique nasal |
| Depósito de grasa en el cuello |
Fuente: autores.
Constituye el mayor factor predisponente para el SAHOS11,30,31. Una distribución de grasa central (abdomen y cuello) está más estrechamente relacionada con la obstrucción de la VAS que una distribución de grasa periférica (muslos y caderas). En 2014, Wosu et al., observaron que los sujetos con alto riesgo de SAHOS tenían mayores probabilidades de obesidad general (OR 9,96; IC del 95%: 4,42 a 22,45) que de obesidad central (OR 2,78; IC del 95%: 1,43 a 5,40), apoyando una fuerte asociación positiva de alto riesgo de SAHOS con la obesidad32. Habitualmente, los hombres presentan un patrón de distribución central (obesidad androide) mientras que las mujeres presentan un patrón de distribución periférico (obesidad ginoide)33, lo que constituye una de las razones por las cuales los hombres obesos tienen de 2 a 4 veces mayor riesgo de desarrollar SAHOS que las mujeres obesas11,34.
Los depósitos de grasa en el cuello disminuyen el área transversal de la VAS19,35. Los ubicados en el tórax y el abdomen ascienden el diafragma y reducen el tamaño y la distensibilidad de los pulmones, sobre todo en la posición supina35,36. Estas alteraciones conllevan a un descenso de los volúmenes y capacidades pulmonares, particularmente de la capacidad residual funcional (CRF)19,35,37.
El calibre de la VAS depende y varía con el volumen de los pulmones, aumentando durante la inspiración y disminuyendo durante la espiración38,39; en los pacientes con SAHOS, esta relación parece incrementarse38. El fundamento mecánico que explica la influencia del volumen de los pulmones sobre el tamaño de la VAS se encuentra en la tracción longitudinal de la tráquea. El desplazamiento caudal de la carina, generado en el momento de la inspiración, ejerce una fuerza de tracción longitudinal sobre la tráquea que se transmite hasta las paredes faríngeas a través de sus conexiones anatómicas con la VAS39. El descenso de la CRF induce la disminución de la tracción de la tráquea, lo que hace que a nivel de la VAS, se requiera menos Pextraluminal para alcanzar el colapso40. Así, en un obeso con grasa central, la cantidad de tejido adiposo en su cuello puede ser la suficiente para ocasionar el colapso.
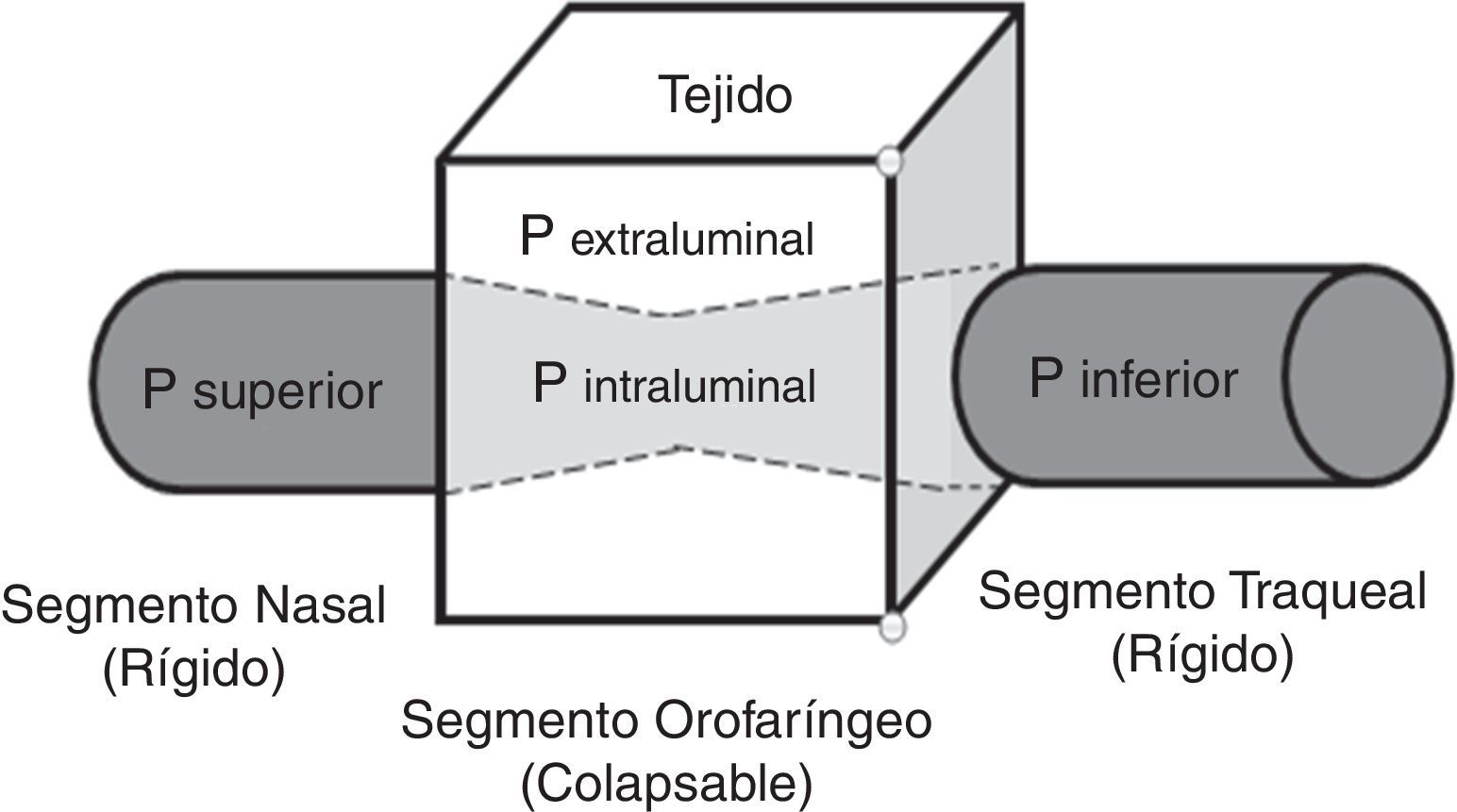
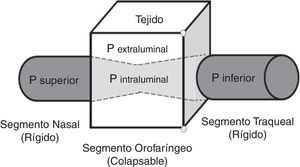
TratamientoContinuous positive airway pressurePresión positiva continua en la vía aérea (CPAP). Es el tratamiento de primera línea para los pacientes con SAHOS moderada y severa41. Consiste en una férula neumática que proporciona flujo de aire con presión positiva (presión supraatmosférica)41,42, en razón a que cuando aumenta la presión crítica de cierre (entendida como el punto de presión en la que la VAS comienza a colapsarse debido al aumento de la presión que ejerce el tejido circundante sobre la porción orofaríngea), sobrepasa a la presión superior (presión dentro de la porción nasal y nasofaríngea), alterándose la relación normal Psuperior>Pcrit la cual permite la entrada del flujo de aire por la VAS; es así como ocurre la oclusión12,19 (fig. 1). La presión positiva suministrada por el CPAP restablece dicha relación para reanudar la apertura de la VAS.
Se ha comprobado que el CPAP es un método eficaz en el tratamiento del SAHOS, pues disminuye los síntomas y los factores de riesgo asociados a comorbilidades43–47; no obstante, muchas personas muestran baja tolerancia y poca adherencia a este tipo de tratamiento48. La eficacia del CPAP se consigue al utilizarlo por siquiera cuatro h durante el sueño en cinco noches por semana49, pero se ha visto que entre el 23 y el 83% de los pacientes lo emplea menos de este tiempo50, y del 8 al 15% de las personas a quienes se les formula el CPAP no inicia el tratamiento51.
Hay numerosos predictores para determinar si un sujeto puede o no adherirse al uso del CPAP, entre los que se destacan: la interfaz (tipo de máscara), las características propias del paciente (edad, género, estado civil), la gravedad de los síntomas y comorbilidades, el método de iniciación al CPAP, los efectos secundarios y factores tanto psicosociales como socioeconómicos48,52. Así, se han implementado diversas estrategias para aumentar la adherencia al CPAP, como programas de información y educación, terapias conductuales y acompañamiento por tiempo prolongado53–55.
De los efectos secundarios, aún no se realizan investigaciones para evaluar las consecuencias a largo plazo del uso prolongado de CPAP en los pacientes con SAHOS. Solo se han referido efectos inmediatos relacionados principalmente con la interfaz y la máquina de CPAP: erosiones cutáneas locales, resequedad en nariz y boca, conjuntivitis, irritación de la VAS, rinorrea, congestión, sangrado nasal, sordera transitoria, cefalea e insomnio51,56. También puede manifestarse distensión gástrica e intestinal por entrada de flujo de aire al tracto digestivo57.
Nasal expiratory positive airway pressurePresión positiva espiratoria nasal en la vía aérea (nEPAP). Es un sistema adaptado para proporcionar baja resistencia durante la inspiración y alta resistencia durante la espiración, mediante pequeñas válvulas mecánicas colocadas con adhesivo en cada fosa nasal58. La fase espiratoria final tiene el mayor riesgo de oclusión de la VAS, pues no hay ni presión positiva ni activación fásica de los MDF que garantice la permeabilidad de la vía. La elevada resistencia espiratoria que proporcionan las válvulas nasales genera presión positiva que reduce el riesgo de colapso durante la posterior inspiración58,59.
Otros mecanismos de acción mediante los cuales la nEPAP puede reducir la colapsabilidad de la VAS, pueden ser: induciendo la hiperinflación pulmonar (lo que aumenta la CRF y la tracción traqueal longitudinal) o por vía de la hipercapnia producida por hipoventilación, que incrementa la actividad respiratoria en la VAS60,61.
Algunas investigaciones reportan que la nEPAP mejora la percepción subjetiva de la hipersomnolencia diurna, desciende 80% el IAH y reduce los ronquidos después de un año de tratamiento58,62. Además, parece tener mayor adherencia que el CPAP58,63,64.
Terapia de presión oralConsiste en una interfaz oral conectada a una bomba de succión que aplica presión negativa continua hacia la cavidad oral para traer el paladar blando hacia adelante y así estabilizar la lengua. El uso de este dispositivo se ha asociado con reducciones en el IAH, desaturación nocturna e hipersomnolencia diurna. Hasta el momento, los únicos efectos secundarios percibidos han sido irritación y molestias en boca y faringe65–67.
Dispositivos oralesIntegran la principal alternativa para los pacientes con SAHOS leve a moderado y para quienes no toleran ni se adhieren al CPAP. Están diseñados para mejorar la configuración de la VAS y prevenir el colapso a través de la reposición de la mandíbula y la lengua68. Los más utilizados son los dispositivos de avance mandibular (DAM), que aumentan el tamaño de la VAS mediante la protrusión de la mandíbula durante el sueño. Este ajuste mandibular causa desplazamiento superior del hueso hioides, desplazamiento lateral de las almohadillas de grasa parafaríngeas y movimiento anterior de los músculos de la base de la lengua. Tales modificaciones se asocian con disminución de la Pextraluminal y aumento en la activación neuromuscular de la VAS69,70. Por medio de resonancia magnética y tomografía computarizada cone beam, se ha observado que los sitios de mayor ensanchamiento son la región retroglosal y la velofaringe69,71.
Aunque el CPAP se ha catalogado como el método más eficaz para el tratamiento del SAHOS, la eficacia del DAM puede llegar a ser similar debido a su mayor adherencia69,72. Se ha demostrado como la mejor opción para pacientes con las siguientes características: jóvenes, mujeres, personas de cuello pequeño, SAHOS posicional, cuando el IAH aumenta el doble en posición supina36, mandíbula retrognática y bajo índice de masa corporal73. Puede causar alteraciones como síndrome témporo-mandibular, dolor dental y miofacial, salivación excesiva, resequedad de la mucosa oral, sobremordida y reducción del resalte 3,74.
Recientemente, se ha venido desarrollando un tipo de DAM que cuenta con microimplantes de ortodoncia conectados a una mascarilla de anclaje extraoral. Aunque aún no está determinada su eficacia, este tipo de equipamiento podría ser empleado en pacientes con escasos dientes, reflejo nauseoso exagerado o intolerancia a los clásicos DAM75.
PillarEs un implante utilizado para el tratamiento del ronquido y del SAHOS leve y moderado. Consiste en tres piezas de polietileno de aproximadamente 18mm cada una que se insertan paralelamente en el paladar blando con anestesia local. Estas piezas ocasionan una respuesta inflamatoria crónica que crea una cápsula fibrosa alrededor para añadir soporte estructural, endurecer el paladar blando y disminuir su vibración76,77.
Su uso se ha asociado con reducciones en el IAH, la intensidad de los ronquidos y la percepción de la hipersomnolencia diurna78. Sin embargo, solo es efectivo cuando los pacientes no tienen obstrucción retropalatal79.
La principal ventaja de este implante es que no se requiere de la eliminación o destrucción del tejido blando de la VAS para su colocación, por lo que disminuye el riesgo de complicaciones postoperatorias y otras morbilidades que sí se manifiestan con los procedimientos quirúrgicos tradicionales (como uvulopalatofaringoplastia o amigdalectomía)80,81.
Síndrome de apnea-hipopnea obstructiva del sueño y cirugía bariátricaEn los pacientes con obesidad mórbida, el uso del CPAP, los dispositivos orales y las cirugías de la VAS resultan ser ineficaces por sí solos para el tratamiento del SAHOS82, dado que la obesidad es el principal factor de riesgo para esta condición. La cirugía bariátrica (CB) se presenta como la alternativa óptima para conseguir pérdida de peso considerable en personas con un índice de masa corporal ≥ 40 y con comorbilidades importantes, en los que otras opciones para bajar de peso han fracasado83,84.
Existen diferentes procedimientos de CB: la banda gástrica ajustable, la manga gástrica, el bypass gástrico y la derivación biliopancreática. La evidencia ha demostrado que, sin importar el tipo de operación practicada, la CB es coadyuvante en el tratamiento del SAHOS, logrando reducir su severidad hasta en el 75% de los casos83; la tasa de remisión para el SAHOS dos años después de la CB en relación con la cantidad de peso perdido, alcanza a ser del 40%84.
La CB merma la circunferencia del cuello y del abdomen, lo que causa aumento de los volúmenes pulmonares y disminución del IAH en posición supina, mejorando la arquitectura del sueño, aumentando la saturación de oxígeno y disminuyendo los requerimientos de CPAP85–87. Paralelamente, se ha visto que aproximadamente el 40% de los pacientes sometidos a CB, siguen presentado SAHOS residual uno o dos años después de ser intervenidos, pero esto ocurre principalmente porque las personas suelen suspender totalmente, por criterio propio, el uso del CPAP posterior a la cirugía84,88.
Night ShiftEs un reciente dispositivo recomendado únicamente para pacientes con SAHOS posicional. Se trata de un pequeño monitor electrónico que se sujeta en la parte posterior del cuello al momento de dormir. Cuando el usuario adopta la posición supina, 10 segundos después el Night Shift comienza a emitir leves vibraciones que aumentan progresivamente hasta que detecte un cambio de posición89.
En los estudios realizados hasta ahora, este dispositivo ha mostrado mayor reducción del IAH y mejoría de la arquitectura del sueño comparado con otros tipos de terapia posicional, como la fijación de una pelota de tenis en el cuello o la higiene del sueño90–92. Su uso puede combinarse con el CPAP o con cualquier dispositivo oral90.
Estimulación eléctricaEs la única estrategia terapéutica «diana» para la eliminación del SAHOS y sus comorbilidades. Consiste en la electroestimulación del músculo geniogloso para mantener la permeabilidad de la VAS durante el sueño.
La electroestimulación directa del geniogloso mediante electrodos intraorales, intramusculares o submentonianos, logra dilatar la VAS, disminuir la PCrit e incrementar el flujo aéreo, pero solo reduce parcialmente el IAH. Además, induce estimulación sensitiva que genera despertares constantes durante la noche haciendo que la hipersomnolencia diurna persista y que se dificulte su uso a largo plazo93,94. Con el fin de disminuir estas limitaciones y establecer un método más eficaz, se ha venido implementado un sistema de electroestimulación para el nervio hipogloso, par craneal encargado de inervar el geniogloso.
El sistema más reciente está compuesto por un generador de impulsos programable implantable (IPG), dos sensores de respiración y un electrodo de estimulación. Los sensores detectan el esfuerzo inspiratorio del tórax y transmiten la señal al IPG que envía impulsos eléctricos al nervio hipogloso a través del electrodo. Un algoritmo de software regula el IPG, de tal manera que emite estimulación solo entre el final de una fase espiratoria y el comienzo de la siguiente fase espiratoria de cada ciclo respiratorio. Algunos comandos del sistema como «iniciar», «detener» y «pausar» pueden ser controlados mediante un dispositivo de mano95,96.
Respecto al electrodo, generalmente está hecho de platino/iridio, tiene un diseño tripolar que distribuye uniformemente la corriente y limita la presión de contacto para evitar posibles lesiones en el nervio95–97. Todo el sistema se implanta de manera subdérmica bajo anestesia general. Se realizan 3 incisiones: la primera, a nivel del borde inferior de la glándula submandibular para exponer el tronco principal del nervio, donde se coloca el electrodo; la segunda, horizontalmente en la cuarta región intercostal, donde se abre un túnel de 5cm para colocar los sensores; y la tercera, a 2cm por debajo de la clavícula, donde se crea un «bolsillo» con el músculo pectoral mayor para acomodar el IPG95–97.
Diferentes investigaciones han confirmado la eficacia de la electroestimulación del nervio hipogloso, aumentando el flujo de aire inspiratorio con la consiguiente reducción del IAH, sin estimulación sensitiva ni despertares asociados95,96. Mediante imágenes fluoroscópicas, se ha podido observar desplazamiento anterior de la base de la lengua, apertura de las regiones retroglosal y retropalatal y desplazamiento anterior del hioides durante la estimulación98.
Algunos efectos adversos relacionados con la intervención quirúrgica y con la electroestimulación prolongada son: depresión respiratoria, obstrucción de la VAS, infección de heridas quirúrgicas, hematomas y parálisis del nervio, fatiga muscular, abrasiones en el tejido blando, cambios en el tipo de fibra e hipertrofia de la musculatura lingual. Todas estas alteraciones aún no han sido bien caracterizadas, por lo que se requieren más estudios a largo plazo para poder corroborarlas99.
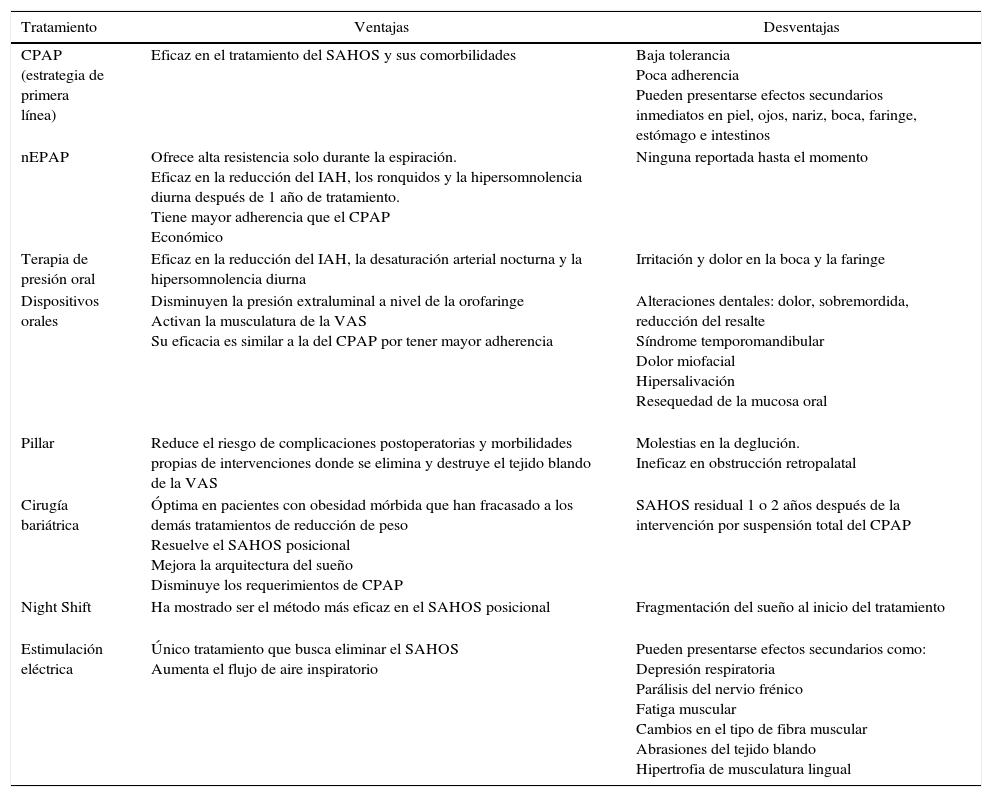
ConclusionesLas diversas investigaciones realizadas desde la medicina del sueño durante los últimos años han permitido comprender la complejidad de los mecanismos fisiopatológicos que conducen a la aparición del SAHOS. Gracias a ello, se han desarrollado e implementado nuevas alternativas de tratamiento que buscan abarcar la heterogeneidad de esta condición, como se observa en la tabla 2. Aunque todavía no se cuenta con un tratamiento totalmente eficaz, la combinación de varias estrategias terapéuticas, la prevención de factores de riesgo modificables como la obesidad y sobre todo, la intervención de un equipo interdisciplinar, pueden alcanzar un notable mejoramiento de la calidad de vida de los pacientes con SAHOS. Se espera que los avances en la ciencia y la tecnología, puedan brindar las herramientas necesarias para seguir trabajando desde los diferentes campos del saber en la búsqueda de un protocolo de tratamiento que logre abordar directamente los procesos etiológicos de la enfermedad para reducir su prevalencia.
Cuadro de conclusiones para el tratamiento del SAHOS
| Tratamiento | Ventajas | Desventajas |
|---|---|---|
| CPAP (estrategia de primera línea) | Eficaz en el tratamiento del SAHOS y sus comorbilidades | Baja tolerancia Poca adherencia Pueden presentarse efectos secundarios inmediatos en piel, ojos, nariz, boca, faringe, estómago e intestinos |
| nEPAP | Ofrece alta resistencia solo durante la espiración. Eficaz en la reducción del IAH, los ronquidos y la hipersomnolencia diurna después de 1 año de tratamiento. Tiene mayor adherencia que el CPAP Económico | Ninguna reportada hasta el momento |
| Terapia de presión oral | Eficaz en la reducción del IAH, la desaturación arterial nocturna y la hipersomnolencia diurna | Irritación y dolor en la boca y la faringe |
| Dispositivos orales | Disminuyen la presión extraluminal a nivel de la orofaringe Activan la musculatura de la VAS Su eficacia es similar a la del CPAP por tener mayor adherencia | Alteraciones dentales: dolor, sobremordida, reducción del resalte Síndrome temporomandibular Dolor miofacial Hipersalivación Resequedad de la mucosa oral |
| Pillar | Reduce el riesgo de complicaciones postoperatorias y morbilidades propias de intervenciones donde se elimina y destruye el tejido blando de la VAS | Molestias en la deglución. Ineficaz en obstrucción retropalatal |
| Cirugía bariátrica | Óptima en pacientes con obesidad mórbida que han fracasado a los demás tratamientos de reducción de peso Resuelve el SAHOS posicional Mejora la arquitectura del sueño Disminuye los requerimientos de CPAP | SAHOS residual 1 o 2 años después de la intervención por suspensión total del CPAP |
| Night Shift | Ha mostrado ser el método más eficaz en el SAHOS posicional | Fragmentación del sueño al inicio del tratamiento |
| Estimulación eléctrica | Único tratamiento que busca eliminar el SAHOS Aumenta el flujo de aire inspiratorio | Pueden presentarse efectos secundarios como: Depresión respiratoria Parálisis del nervio frénico Fatiga muscular Cambios en el tipo de fibra muscular Abrasiones del tejido blando Hipertrofia de musculatura lingual |
Fuente: autores.
Los autores no recibieron patrocinio para llevar a cabo este artículo.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.