La tromboelastografía se emplea para la orientación en el manejo de la coagulación perioperatoria en el sitio de atención.
ObjetivoIdentificar un patrón de coagulación en niños sometidos a tiempos prolongados en circulación extracorpórea, así como su asociación con edad y peso.
Material y métodosRealizamos un estudio de cohorte en 62 pacientes sometidos a circulación extracorpórea prolongada. Excluimos pacientes con coagulopatía preexistente, empleo de medicamentos interfiriendo con la coagulación, hematocrito >60%, peso <3kg o con enfermedad hepática. El estudio de tromboelastografía fue realizado en el sitio de atención.
ResultadosLos valores para el tiempo de reacción basales y durante recalentamiento fueron: 8,24±6,35 y 7,66±2,15min, respectivamente (p=0,102). Los valores para el ángulo basales y durante recalentamiento fueron: 64,89±13,08 y 54,67±8,98grados (p<0,001). Los valores para amplitud máxima basales y durante recalentamiento fueron: 64,54±12,31 y 43,14±12,47mm, respectivamente (p=0,001). Dividiendo la cohorte en pacientes menores o mayores a 3años, o bien en menores o mayores a 10kg, se observó el mismo comportamiento.
DiscusiónEste estudio sugiere la existencia de un patrón tromboelastográfico independiente de la edad o peso en pacientes sometidos a cirugía cardiaca pediátrica con permanencia prolongada en circulación extracorpórea caracterizado por reducción en los valores de ángulo y amplitud máxima, sin modificación en el tiempo de reacción.
Point-of-care thromboelastography is used for guiding peri-operative haemostatic therapy.
ObjectiveTo identify a thromboelastographic pattern in children with prolonged cardiopulmonary bypass exposure, and their association with age and weight.
Material and methodsA cohort study of 62 patients undergoing prolonged cardiopulmonary bypass was performed. Patients with preexisting coagulopathy, use of drugs known to interfere with clotting, haematocrit >60%, weight <3kg, or hepatic disease were excluded. The thromboelastography study was conducted at the point of care.
ResultsBaseline and rewarming reaction time values were 8.24±6.35 and 7.66±2.15minutes, respectively (P=.102). Baseline and rewarming angle values were 64.88±13.08 and 54.67±8.98 degrees, respectively (P<.001). Baseline and rewarming maximum amplitude values were 64.54±12.31 and 43.14±12.47mm, respectively (P=.001). The same trend was observed when the cohort was divided into patients under and over 3years of age, and patients under and over 10kg of body weight.
DiscussionThis study suggests the existence of a thromboelastographic pattern independent of age or weight in patients undergoing paediatric cardiac surgery with prolonged cardiopulmonary bypass exposure, characterised by a reduction of angle and maximum amplitude values, with no change in reaction time.
El sangrado perioperatorio probablemente es la complicación más común en cirugía cardiaca pediátrica (CCP). Frecuentemente este evento se asocia con un incremento en la estancia hospitalaria o re-intervención quirúrgica en el periodo postoperatorio.
Uno de los principales factores asociados con incremento en el sangrado es la exposición prolongada a circulación extracorpórea (CEC), lo cual también está en relación con la complejidad de la cirugía requerida para la corrección de la enfermedad cardiaca; asimismo, otros factores asociados con mayor riesgo de sangrado son: edad menor a un año, nivel y duración de hipotermia y conteo plaquetario bajo preoperatorio1.
Con el objetivo de reducir el sangrado perioperatorio en diferentes escenarios, incluyendo CCP, se han propuesto varias estrategias sin que se haya alcanzado un consenso2; sin embargo, un grupo de expertos de la Sociedad Europea de Anestesiología, coordinados por Sibylle A. Kozek-Langeneker, han publicado guías de manejo para el control de sangrado masivo3.
Estas guías incluyen las siguientes recomendaciones:
- •
Recomendamos el empleo de algoritmos de transfusión incorporando detonantes de intervención predefinidos para guiar las intervenciones dirigidas al control del sangrado transoperatorio (Recomendación Nivel 1B).
- •
Recomendamos la aplicación de algoritmos de transfusión incorporando detonantes de intervención predefinidos basados en estudios de monitorización de la coagulación realizados en el sitio de atención para guiar las maniobras correctivas durante cirugía cardiovascular (Recomendación Nivel 1C).
Más recientemente, la Sociedad Americana de Anestesiología (ASA)4 ha publicado guías relacionadas con el manejo perioperatorio de los productos sanguíneos llegando a la misma conclusión que las publicadas por la Sociedad Europea, en el sentido de que el empleo de pruebas viscoelásticas para conformar algoritmos o protocolos de manejo en el ámbito perioperatorio reduce el uso perioperatorio de productos hemáticos.
En el Instituto Nacional de Pediatría (México) empleamos el concepto de diagnóstico en el sitio de atención, y en lo que se refiere a la coagulación utilizamos tromboelastografía (TEG) como monitor de las alteraciones de hemostasia, y con esos fines el objetivo de este estudio está orientado a investigar si existe un patrón de coagulación en niños sometidos a exposición prolongada a CEC, analizando igualmente el efecto del peso y la edad sobre el comportamiento de estas variables1,5.
Material y métodosTanto el comité de ética como el de investigación del Instituto Nacional de Pediatría otorgaron el número de registro 060/2012 el 17 de junio y el 20 de julio de 2012, respectivamente. Se obtuvo el consentimiento informado de los padres o representantes legales para la realización de los procedimientos anestésicos, quirúrgicos o para transfusión en caso necesario.
Este es un estudio de cohorte prospectivo, descriptivo y observacional que incluyó a todos los pacientes sometidos a CCP con el potencial de permanecer en CEC por más de 90min de febrero de 2013 a febrero de 2014. Definimos como exposición prolongada a CEC la mayor a 90min, basados en experiencias previamente reportadas1,5.
Los criterios de exclusión fueron: coagulopatía preexistente (primaria o secundaria), uso de medicamentos que interfirieran con la coagulación, hematocrito >60%, neonatos a término <3kg de peso o prematuros y enfermedad hepática conocida.
El riesgo quirúrgico fue determinado empleando la escala Risk Adjusted Classification for Congenital Heart Surgery (RACHS-1)6. En todos los casos se tomaron las pruebas convencionales de coagulación, que incluían: tiempo de protrombina, tiempo parcial de tromboplastina, INR y conteo plaquetario. No se obtuvieron niveles basales de fibrinógeno.
Para el análisis del sitio de atención empleamos un tromboelastógrafo (TEG Hemostasis Analyzer, Modelo 5000, Haemonetics Corporation, Braintree, Massachusetts, EE.UU.). El equipo se encuentra ubicado en una oficina junto a la sala de cirugía cardiovascular en el Instituto Nacional de Pediatría y es calibrado diariamente justo antes de cada evento quirúrgico. Los datos de cada paciente son almacenados en el ordenador, que cuenta con el programa de análisis.
A la llegada del paciente a la sala de cirugía, antes de la incisión y después de la inducción anestésica, obtuvimos una muestra de sangre denominada «basal» de 1ml; la muestra fue procesada en una cubeta con capacidad de 360μl, agregando caolín como acelerador de la respuesta.
Hacia el final de la cirugía, aun durante la CEC e iniciando el recalentamiento a 32°C se obtuvo una segunda muestra de sangre que fue procesada en otra cubeta con 360μl de capacidad con heparinasa, nuevamente agregando caolín.
En todos los casos empleamos ácido tranexámico como antifibrinolítico después de la inducción, tanto para el paciente como para el cebado del circuito de la bomba de CEC. Las dosis de ácido tranexámico fueron: 10mg/kg como «bolo» intravenoso administrado en 5min y otros 10mg/kg para el cebado. Posteriormente se inició una infusión continua del medicamento a una tasa de 5mg/kg/h durante todo el procedimiento quirúrgico, misma que fue suspendida después de la administración de la protamina.
Para el cebado de la bomba de CEC en pacientes <10kg se empleó concentrado de hematíes; así mismo, plasma fresco en todos los casos.
Durante el recalentamiento, a los 32°C, se administraron 125ml de plasma fresco en el circuito, adicionando otros 125ml a los 36°C en todos los casos. Empleamos ultrafiltración continua durante el procedimiento.
Las muestras fueron procesadas por el equipo de perfusión, el cual fue previamente entrenado para la realización de la prueba; la lectura y la interpretación de las curvas de TEG fueron realizadas por los investigadores.
Análisis estadísticoLos resultados fueron expresados empleando porcentajes, medidas de tendencia central y dispersión.
Para establecer diferencias entre las variables de TEG (basal y recalentamiento) se empleó la prueba de la t de Student para datos apareados.
Se analizó la correlación entre la edad y el peso con el tiempo de CEC, empleando prueba de correlación de Pearson con un intervalo de confianza de 95%.
Todos los valores de p<0,05 fueron considerados significativos.
ResultadosFueron intervenidos quirúrgicamente un total de 183 pacientes durante el periodo de estudio; 63 pacientes cumplieron con los criterios de inclusión. No pudimos obtener información completa de un paciente, por lo que retiramos sus datos; por lo tanto, analizamos un total de 62 pacientes, de los cuales 28 fueron mujeres (45%) y 34 hombres (55%) La mediana de la edad fue de 3,71años (0,004-16) y la del peso, 13,53kg (3-51,5).
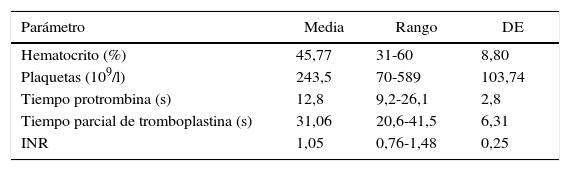
La tabla 1 muestra el perfil de coagulación convencional (tiempo de protrombina, parcial de tromboplastina, INR y conteo plaquetario). Los valores preoperatorios promedio de los estudios convencionales de coagulación se encontraron dentro de parámetros normales. Asimismo, el nivel basal del hematocrito fue de 45,77±8,80%, y después de CEC fue de 42,03±8,52% (p=0,07).
Parámetros preoperatorios de coagulación
| Parámetro | Media | Rango | DE |
|---|---|---|---|
| Hematocrito (%) | 45,77 | 31-60 | 8,80 |
| Plaquetas (109/l) | 243,5 | 70-589 | 103,74 |
| Tiempo protrombina (s) | 12,8 | 9,2-26,1 | 2,8 |
| Tiempo parcial de tromboplastina (s) | 31,06 | 20,6-41,5 | 6,31 |
| INR | 1,05 | 0,76-1,48 | 0,25 |
DE: desviación estándar; INR: International Normalized Ratio.
Fuente: autores.
La tabla 2 muestra el diagnóstico preoperatorio. El valor promedio en la escala RACHS-1 para la cohorte de acuerdo a los diagnósticos presentados fue de 2,6 (rango 1-6).
Diagnósticos preoperatorios
| Ventrículo único (RACHS 3) | 11 |
| Transposición de grandes arterias + comunicación interventricular (RACHS 4) | 10 |
| Tetralogía de Fallot (RACHS 2) | 8 |
| Estenosis aórtica (RACHS 3) | 6 |
| Drenaje anómalo total de venas pulmonares (RACHS 2) | 4 |
| Coartación e hipoplasia de arco aórtico (RACHS 4) | 4 |
| Comunicación interauricular + comunicación interventricular (RACHS 2) | 4 |
| Comunicación interventricular (RACHS 2) | 4 |
| Síndrome de ventrículo izquierdo hipoplásico (RACHS 6) | 3 |
| Tronco arterioso (RACHS 4) | 3 |
| Drenaje anómalo parcial de venas pulmonares (RACHS 1) | 2 |
| Anomalía de Ebstein (RACHS 3) | 2 |
| Canal auriculoventricular (RACHS 3) | 1 |
| Total | 62 |
RACHS: Risk Adjusted Congenital Heart Surgery Score6.
Fuente: autores.
En lo que se refiere a las características quirúrgicas, encontramos que la media de tiempo de CEC fue de 217±103,35min, la de pinzamiento aórtico fue de 128,03±76,80min y la de tiempo total de cirugía de 402,95±157,93min; la temperatura promedio durante la CEC fue de 24,02°C.
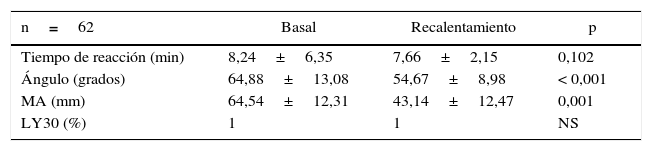
En la tabla 3 se muestra el comportamiento de los parámetros de TEG para la cohorte general. No observamos diferencias significativas ni para el tiempo de reacción (R) ni para lisis del coágulo a 30min tanto basal o durante el recalentamiento; sin embargo, observamos reducciones significativas tanto en los valores del ángulo como en los de amplitud máxima (MA), específicamente en el periodo de recalentamiento.
Características tromboelastográficas basales y durante recalentamiento
| n=62 | Basal | Recalentamiento | p |
|---|---|---|---|
| Tiempo de reacción (min) | 8,24±6,35 | 7,66±2,15 | 0,102 |
| Ángulo (grados) | 64,88±13,08 | 54,67±8,98 | < 0,001 |
| MA (mm) | 64,54±12,31 | 43,14±12,47 | 0,001 |
| LY30 (%) | 1 | 1 | NS |
LY30: lisis a los 30min; MA: amplitud máxima; NS: no significativo.
Se analizaron los niveles de significancia de los valores de tromboelastografía basales y durante recalentamiento en la población general. No se observaron diferencias significativas de los valores del tiempo de reacción y LY30.
Fuente: autores.
Por otra parte, analizamos la correlación entre los valores del ángulo y la MA con el tiempo de permanencia en la CEC. El índice de correlación (r) con respecto a la permanencia en CEC para el ángulo fue de −0,468 y para la MA fue de −0,667 (p=0,001 y<0,001, respectivamente).
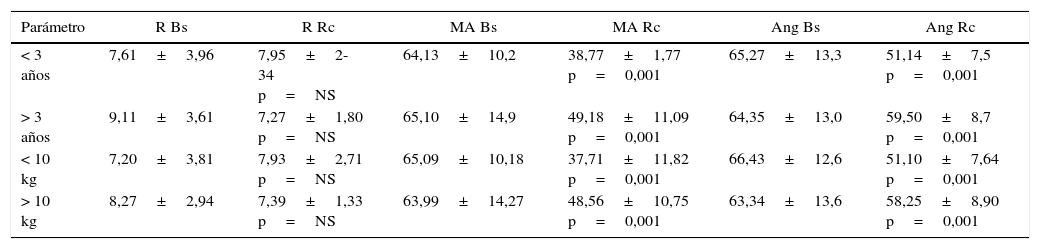
La cohorte fue dividida considerando la edad y el peso en <3años o >3años y <10kg o >10kg (n=31 y 31, respectivamente). Así agrupados, los valores de TEG se presentan en la tabla 4.
Comportamiento de los valores de tromboelastografía analizados por edad y peso
| Parámetro | R Bs | R Rc | MA Bs | MA Rc | Ang Bs | Ang Rc |
|---|---|---|---|---|---|---|
| < 3 años | 7,61±3,96 | 7,95±2-34 p=NS | 64,13±10,2 | 38,77±1,77 p=0,001 | 65,27±13,3 | 51,14±7,5 p=0,001 |
| > 3 años | 9,11±3,61 | 7,27±1,80 p=NS | 65,10±14,9 | 49,18±11,09 p=0,001 | 64,35±13,0 | 59,50±8,7 p=0,001 |
| < 10 kg | 7,20±3,81 | 7,93±2,71 p=NS | 65,09±10,18 | 37,71±11,82 p=0,001 | 66,43±12,6 | 51,10±7,64 p=0,001 |
| > 10 kg | 8,27±2,94 | 7,39±1,33 p=NS | 63,99±14,27 | 48,56±10,75 p=0,001 | 63,34±13,6 | 58,25±8,90 p=0,001 |
Ang: ángulo; Bs: basal; MA: máxima amplitud; NS: no significativo; Rc: recalentamiento.
Fuente: autores.
Destaca que el valor de R basal para niños <3años fue de 7,61±3,96min y durante el recalentamiento de 7,95±2,34min (p=0,36). El valor de R basal en pacientes >3años fue de 9,11±3,61min y durante el recalentamiento, de 8,27±1,80min (p=0,08).
Igualmente observamos una reducción significativa de los valores promedio del ángulo y de MA después del recalentamiento en los subgrupos correspondientes a edad y peso. Nuevamente, al analizar la correlación de estos parámetros con la permanencia en CEC observamos la misma tendencia que la descrita para la población general.
DiscusiónEl objetivo de nuestro estudio fue la identificación de un patrón de comportamiento tromboelastográfico realizado en el sitio de atención en población pediátrica sometida a estancia prolongada en CEC, ya que desde nuestro punto de vista no hay claridad en la definición del comportamiento de los parámetros tromboelastográficos en este grupo de pacientes durante el transoperatorio1,5.
La mayoría de los estudios que analizan el comportamiento de la TEG en CCP se enfocan predominantemente al análisis del sangrado en el postoperatorio (en la unidad de cuidados intensivos) sin hacer énfasis en el comportamiento durante la CEC o inmediatamente después de salir de la ella7,8.
Por otro lado, si bien se asume que la población pediátrica no difiere en cuanto a los valores normales de TEG de los descritos para adultos (considerando pacientes sanos), las diferencias de edad intrapoblacionales (por ejemplo, neonatos vs. lactantes) son factores que también deben ser analizados, ya que existen condiciones que diferencian el comportamiento general de la hemostasia entre los grupos (concentración de componentes del sistema hemostático, tasa de síntesis de los mismos componentes, capacidad total para generar y regular trombina y plasma)9. Por lo tanto, consideramos que realizar un análisis discriminando por edad puede aclarar el comportamiento tromboelastográfico.
En relación al peso, cabe mencionar que en nuestra población el 48,2% de los pacientes tiene desnutrición y el 1,8% está emaciado (fuente: Base de datos Institucional 2015. Base de datos procesada y auditada por el proyecto International Quality Improvement Collaborative [IQIC] con sede en el Boston Children's Hospital, EE.UU.). Existen publicaciones que analizan los cambios tromboelastográficos en pacientes desnutridos (incluyendo marasmo o kwashiorkor), y los cambios reportados son: trombocitopenia, pobre retracción del coágulo, pobre producción de trombina (curvaV) y, en general, tendencia a una pobre coagulación10; por ello, decidimos también analizar nuestra población en una subdivisión marcada por el peso.
Miller et al.11, en un estudio parteaguas en 1997, sugirieron que las pruebas convencionales de coagulación podrían no ser útiles para la predicción de sangrado postoperatorio. Este estudio sugiere que la TEG en el sitio de atención podría ser un método para analizar los trastornos de la coagulación en este grupo de pacientes. Considerando esto, presentamos los valores normales de TEG para los elementos analizados en este estudio de la curva de TEG: tiempo de reacción (R): 4-8 minutos; ángulo: 47-64 grados; MA: 54-72mm, y lisis a los 30min: 0-8%12.
Tomando en cuenta esos parámetros y pasando a nuestro análisis, los resultados de la muestra general arrojaron un patrón consistente: valores de lisis a los 30min y R sin alteraciones durante el recalentamiento, así como reducciones significativas en los valores del ángulo y MA en pacientes que permanecen por más de 90min en CEC. Al diferenciar por edad y peso encontramos el mismo patrón observado en la población general. Tres factores pueden influir en este hallazgo:
- •
El empleo de plasma fresco congelado para el cebado del circuito de la bomba de CEC.
- •
El uso de ultrafiltración continua (CUF por sus siglas en inglés) durante la cirugía.
- •
El empleo de ácido tranexámico durante todo el procedimiento.
El empleo del plasma para el cebado del circuito ha sido cuestionado, ya que se le asocia con hemodilución, lo cual eventualmente conduce a un incremento en el sangrado y la consecuente mortalidad; sin embargo, para nosotros el empleo de plasma en el cebado del circuito es una práctica regular, y creemos que nuestros resultados apoyan que esto podría tener un efecto benéfico, como lo reflejan los valores de R en la cohorte después de CEC. Más aún, también administramos una dosis de plasma a los 33 y 36°C todavía durante la CEC y tratamos de reducir la hemodilución empleando CUF como parte de la técnica de perfusión en todos los casos, y consideramos que esto pudo haber tenido un efecto en los resultados observados. Algunos investigadores han sugerido que la ultra filtración modificada (MUF por sus siglas en inglés) podría conferir menor hemodilución y a la vez reducir las consecuencias asociadas al empleo de plasma durante la derivación extracorpórea; sin embargo, el objetivo de este estudio no se centra en las estrategias de filtración, por lo que creemos que deben realizarse estudios diseñados para detectar diferencias entre los dos procedimientos (CUF y MUF)13-17.
Buscamos correlaciones entre el tiempo de exposición a CEC y el comportamiento de los valores de MA y ángulo, observando que a mayor tiempo de exposición de CEC existe un menor valor de MA y ángulo, lo cual está en concordancia con lo sugerido por otros autores11. Es importante destacar que las reducciones encontradas en los valores de MA (plaquetas) en el recalentamiento son significativas y por debajo de los valores de referencia; sin embargo, las reducciones en los niveles del ángulo (fibrinógeno) en el mismo periodo, si bien son significativas, se encuentran dentro de los parámetros normales. Si esto tiene o no una representación clínica deberá ser analizado por nuevos estudios.
Otras investigaciones han sugerido patrones de comportamiento semejantes al aquí presentado pero empleando otras pruebas viscoelásticas, como ROTEM en cirugías con tiempos de CEC superiores a 90min, y describen alteraciones en la formación y fortaleza del coágulo generadas por alteraciones plaquetarias como las aquí encontradas18.
En conclusión, describimos un patrón de coagulación obtenido mediante TEG realizado en el sitio de atención en pacientes sometidos a CCP con tiempos prolongados de permanencia en CEC. El patrón está caracterizado por una reducción significativa en los valores del ángulo y la MA sin modificaciones en los valores del tiempo de reacción (R) o lisis a los 30min durante el recalentamiento.
Consideramos que el efecto que tiene un tiempo prolongado de CEC, independientemente de la edad o el peso, es sobre las plaquetas (cantidad y/o adhesividad) y en menor medida sobre los niveles de fibrinógeno (representados por el ángulo). Sugerimos que la ausencia de modificaciones en los valores de R puede deberse al empleo de plasma en el cebado del circuito de CEC.
La correlación clínica de estos hallazgos deberá ser evaluada por nuevas investigaciones.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
FinanciamientoEl presente estudio fue financiado con recursos departamentales.
Conflicto de interesesNinguno.