La hipoxemia refractaria es una condición crítica potencialmente mortal si no se corrige rápidamente. El fenómeno de flujo está implicado en su desarrollo.
ObjetivosPresentación de un caso clínico y revisión no sistemática de la literatura sobre hipoxemia refractaria y el fenómeno de flujo; describimos su incidencia, etiología y fisiopatología.
Material y métodosCon autorización del comité de Ética de nuestra institución, presentamos un caso clínico de un paciente joven, quien consultó por disnea progresiva hasta clase funcional iv/iv. La búsqueda bibliográfica se realizó en Pub Med, Scielo y Bireme.
ResultadosSe ha despertado un creciente interés en el fenómeno fisiológico de flujo que conlleva al desarrollo de hipoxemia refractaria en ausencia de aumento de presión en las cavidades cardiacas. Se encuentran escasos reportes.
ConclusionesLa hipoxemia refractaria por el fenómeno de flujo debe ser sospechada como diagnóstico de exclusión en pacientes con masa mediastinal. Proponemos la ventilación en prono como terapia puente para revertir una condición potencialmente mortal.
Refractory hypoxaemia is a critical, life-threatening condition if not resolved promptly. The flow phenomenon is implicated in its development.
ObjectivesClinical case presentation and non-systematic review of the literature on refractory hypoxaemia and flow phenomenon. Incidence, aetiology and pathophysiology are described.
Material and methodsClinical case presentation authorised by the Ethics Committee of our institution of a young patient who presented with progressive dyspnea, reaching functional class iv/iv. A search of the literature was conducted in Pub Med, Scielo and Bireme.
ResultsThere is a growing interest in the physiological flow phenomenon leading to the development of refractory hypoxaemia in the absence of increased pressure in the cardiac cavities. Few reports are found.
ConclusionsFlow phenomenon-related refractory hypoxaemia must be suspected as an exclusion diagnosis in patients with a mediastinal mass. Prone ventilation is proposed as a bridging therapy in order to revert a life-threatening condition.
La hipoxemia se caracterizada por una presión parcial de oxígeno en sangre arterial menor de 60mmHg. En condiciones normales, los sistemas circulatorio y respiratorio trabajan de forma conjunta para mantenerlos en rangos adecuados. La falta de homeostasis de los sistemas para garantizar la normalidad del contenido arterial de oxígeno se denomina falla respiratoria hipoxémica y se explica por 5 mecanismos fisiopatológicos, que son: la reducción de la presión inspiratoria de oxígeno, el desarrollo de hipoventilación alveolar, los cortocircuitos (CC) de derecha a izquierda, los trastornos de la difusión en la membrana de intercambio alvéolo capilar y el desarrollo de espacio muerto. La rápida identificación de su etiología es la mejor estrategia para la instauración de una terapia efectiva1-4.
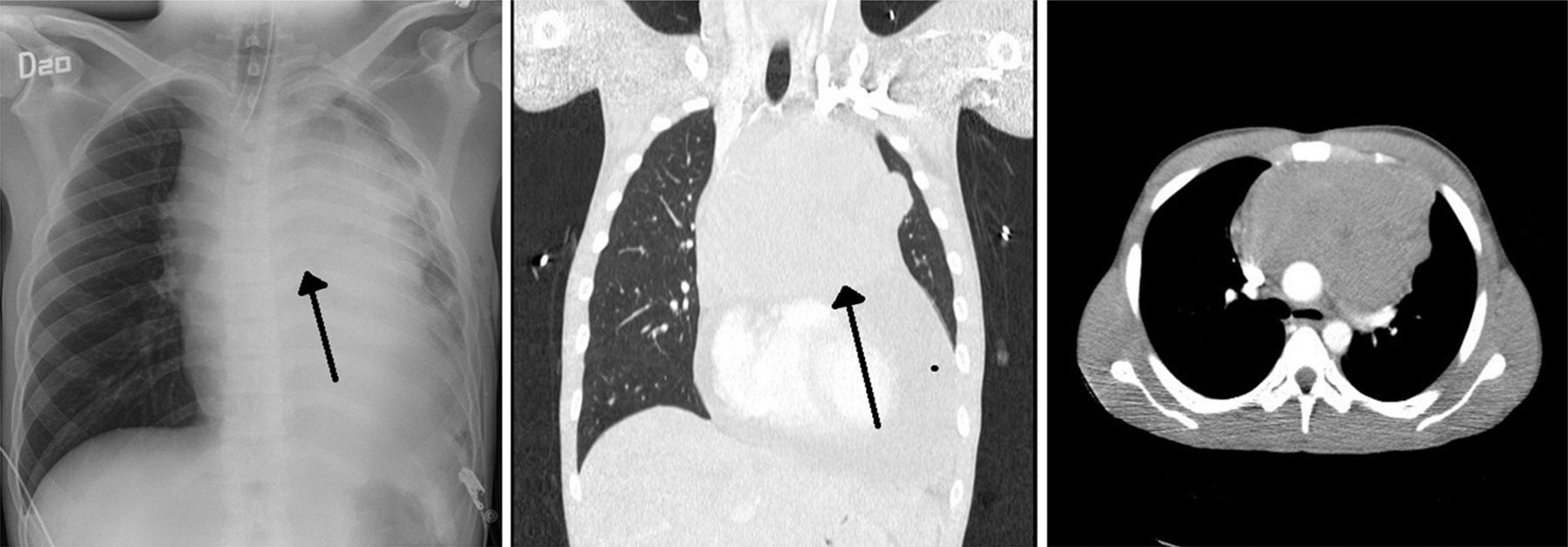
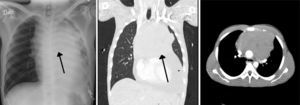
Descripción del casoPaciente masculino de 23 años de edad, trabajador de la construcción y origen étnico mestizo, considerado previamente sano. Ingresó a la institución por un cuadro de disnea progresiva de 30 días de evolución, dolor torácico izquierdo opresivo no exacerbado al ejercicio y una pérdida de peso aproximada de 2 kg en los últimos 3 meses. En el examen físico estaba con taquicardia y estabilidad hemodinámica; se documentó la presencia de frote pericárdico, hepatomegalia, esplenomegalia e ingurgitación yugular grado ii. En urgencias, la radiografía del tórax evidenció una silueta cardio-mediastínica muy ensanchada. El ecocardiograma evidenció un derrame pericárdico con función biventricular normal, cavidades sin dilataciones, sin signos de taponamiento e integridad de los septos. Ante la sospecha de una masa mediastinal anterior se realizó una tomografía axial del tórax, la cual confirmó su presencia con un tamaño de 15×11cm en sus diámetros mayores (fig. 1). Se le practicó una periocardiocentesis, extrayéndose 750 cc de líquido hemático, y se realizó biopsia de la masa mediastinal guiada por ultrasonido. Posteriormente, el paciente presentó un rápido deterioro clínico con dificultad respiratoria e hipoxemia; se sospechó un neumotórax. Valorado por cirugía general, que lo confirmó clínicamente y realizó una de toracostomía izquierda. Se trasladó a la Unidad de Cuidados Intensivos para monitorización hemodinámico. Estable durante las primeras horas, luego presentó signos de dificultad respiratoria, hipoxemia y fiebre. Se decidió inicio de soporte ventilatorio invasivo, intubación despierto por el riesgo de colapso de la vía aérea por compresión extrínseca, el control de los gases arteriales en equilibrio ácido base, con un trastorno moderado/severo de la oxigenación. Adicionalmente, se inició soporte vasopresor. El perfil hemodinámico, sus gases arteriales y los resultados de paraclínicos se pueden observar en las tablas 1 y 2, respectivamente (figs. 1 y 2).
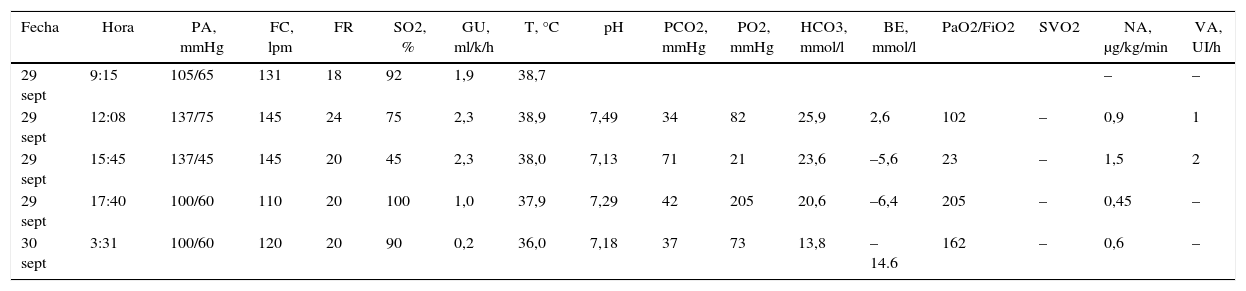
Perfil hemodinámico, gasometría arterial, venosa y soporte vasopresor
| Fecha | Hora | PA, mmHg | FC, lpm | FR | SO2, % | GU, ml/k/h | T, °C | pH | PCO2, mmHg | PO2, mmHg | HCO3, mmol/l | BE, mmol/l | PaO2/FiO2 | SVO2 | NA, μg/kg/min | VA, UI/h |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 29 sept | 9:15 | 105/65 | 131 | 18 | 92 | 1,9 | 38,7 | – | – | |||||||
| 29 sept | 12:08 | 137/75 | 145 | 24 | 75 | 2,3 | 38,9 | 7,49 | 34 | 82 | 25,9 | 2,6 | 102 | – | 0,9 | 1 |
| 29 sept | 15:45 | 137/45 | 145 | 20 | 45 | 2,3 | 38,0 | 7,13 | 71 | 21 | 23,6 | –5,6 | 23 | – | 1,5 | 2 |
| 29 sept | 17:40 | 100/60 | 110 | 20 | 100 | 1,0 | 37,9 | 7,29 | 42 | 205 | 20,6 | –6,4 | 205 | – | 0,45 | – |
| 30 sept | 3:31 | 100/60 | 120 | 20 | 90 | 0,2 | 36,0 | 7,18 | 37 | 73 | 13,8 | –14.6 | 162 | – | 0,6 | – |
BE: base exceso; FC: frecuencia cardiaca; GU: gasto urinario; NA: noradrenalina; ND: no disponible; PA: presión arterial; SO2: saturación arterial de oxígeno; SVO2: saturación venosa de oxígeno; T: temperatura; VA: vasopresina.
Fuente: autores.
Paraclínicos
| Fecha | PT | INR | Leuc | N, % | L, % | Plt | Hb, g/dl | Hcto, % | Cr, mg/dl | BUN, mg/dl | Bb T, mg/dl | Bb D, mg/dl | Bb I, mg/dl | Ca, mmol/l | Cl | K |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 22-23 sept | 17.,3/11,2 | 1,6 | 11.900 | 83,7 | 7,1 | 444.100 | 11,8 | 37,1 | 0,75 | 7,6 | 0,44 | 0,09 | 0,35 | 107 | 4,9 | |
| 29 sept | 19,4 | 92,7 | 3,26 | 427.300 | 11,8 | 36,2 | 0,72 | 6,6 | 7,5 | 101 | 4,1 | |||||
| 30 sept | 31/0,9 | 3 | 20,8 | 89,1 | 6,5 | 326.100 | 12,1 | 38,7 | 1,7 | 20.3 | 1,3 | 0,7 | 0,58 | 106 | 6,3 |
| Fecha | TGO, U/l | TGP, U/l | Fosfatasa alcalina | Na, mmol/l | Lactato, mmol/l | Fósforo | Magnesio | Ácido úrico |
|---|---|---|---|---|---|---|---|---|
| 22/23 sept | 22 | 13 | 51 | 135 | 1,2 | |||
| 29 sept | 132 | 6,5 | 2,0 | |||||
| 30 sept | 134 | 6,5 | 5,9 |
Bb: bilirrubina; BUN: nitrógeno ureico; Ca: calcio; Cl: cloro; Cr: creatinina; D: directa; Hb: hemoglobina; Hcto: hematocrito; I: indirecta; INR: International Normalized Ratio; K: potasio; L: linfocitos; Leuc: leucocitos; N: neutrófilos; Na: sodio; P: fósforo; Plt: plaquetas; Proc: procalcitonina; PT: tiempo de protrombina; Sept: septiembre; T: total; TGO: aspartato aminotransferasa; TGP: alanino aminotransferasa.
Fuente: autores.
El modo ventilatorio fue asistido controlado con fracción inspirada de oxígeno (FiO2) del 50% y presión positiva al final de la espiración (PEEP) de 8. Presentó mejoría inicial, alcanzando saturación mayor del 90%. Una hora después, reinició nuevamente con hipoxemia progresiva; se tituló la FiO2 al 100%, sin mejoría. Los gases arteriales en su momento mostraron un pH 7,31, PaO2 de 21mmHg, PaCO2 de 71mmHg y una base exceso de menos 5 con una razón PaO2/FiO2 de 23, la radiografía del tórax mostró una atelectasia parcial del lóbulo superior izquierdo, que no explicaba el cuadro actual; se realizó reclutamiento pulmonar con titulación del PEEP sin mejoría; ante la sospecha de un embolismo pulmonar agudo, se solicitó una angio-TAC, sin disponibilidad del recurso en el momento; dada la urgencia, se realizó una angiografía pulmonar, la cual fue normal. Por la presencia de fiebre con deterioro clínico se sospecha bacteriemia, iniciándose cubrimiento antibiótico.
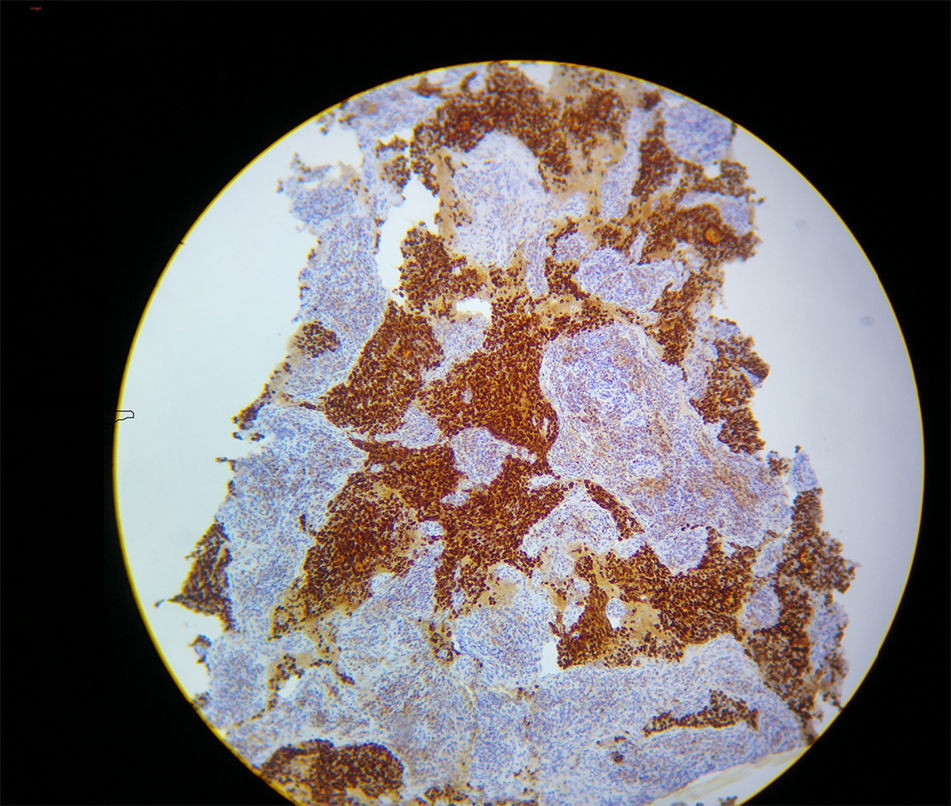
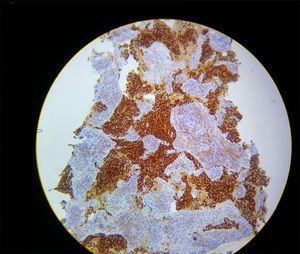
Ante la presencia de hipoxemia refractaria, agotados los recursos ventilatorios descritos, con adecuada sedación, pensando en una causa mecánica, se decide llevar a ventilación en posición en prono; la recuperación de la oxigenación fue de manera casi inmediata, con los siguientes gases arteriales un pH 7,29, PaO2 de 205mmHg, PaCO2 de 42mmHg y una base exceso de –6,9, con una razón PaO2/FiO2 de 205. Continuó la ventilación en prono; se estimó un tiempo de 2 h con hipoxemia severa. Posteriormente, se documenta hipercalemia, hipercalcemia e hiperfosfatemia, constituyendo un síndrome de lisis tumoral en choque progresivo refractario al manejo, que lo lleva a la muerte por disfunción orgánica múltiple. Los resultados finales de la patología evidenciaron la presencia de un adenocarcinoma de timo (fig. 2).
DiscusiónLa hipoxemia severa amenazante para la vida requiere de un rápido diagnóstico diferencial que permita instaurar un tratamiento efectivo y salvador1,2. Si pensamos en causas fisiopatológicas iniciales, como lo son una presión barométrica baja de oxígeno y el desarrollo de hipoventilación alveolar, no son concordantes con el contexto clínico descrito. El paciente se encuentra en un medio externo con adecuada presión inspirada de oxígeno (sin antecedentes de una inmersión u ahogamiento), y adicionalmente tampoco corresponde con una hipoventilación puesto que al momento de instaurar la ventilación mecánica persiste el problema, y se garantiza un volumen minuto evidenciado en los valores de PCO2 normales iniciales (tabla 1)3,4. Por lo anterior, tenemos aún 3 causas fisiopatológicas restantes que son el espacio muerto, los trastornos de la difusión en la membrana de intercambio y los CC de derecha a izquierda. Siguiendo entonces la aproximación diagnóstica, la radiografía del tórax encontró una atelectasia parcial del lóbulo superior izquierdo; se descarta la presencia de infiltrados alveolares y, por los antecedentes del paciente, en ausencia de fibrosis pulmonar, se hace improbable una anormalidad de la difusión en la membrana de intercambio5,6. Se pensó en espacio muerto agudo; las patologías causales de espacio muerto en un inicio son pocas y en el contexto del paciente, dado el antecedente de un tumor en progresión, la única causa relacionada es un tromboembolismo pulmonar7,8, descartado por angiografía pulmonar. El diagnóstico por exclusión más probable es un CC de derecha a izquierda, el cual fisiológicamente se caracteriza precisamente por la ausencia de respuesta al tratamiento con FiO2 elevadas. Pero, ¿cómo pudo este paciente tener un CC o agudo en presencia de un ecocardiograma previo normal? La literatura entonces ya ha descrito desde el año 2000 que no se necesitan presiones elevadas de las cavidades derechas para el desarrollo de CC9,10; de hecho, se describe el denominado «fenómeno de flujo», en el cual la persistencia de una valva de Eustaquio auricular remanente puede dirigir el flujo sanguíneo de la vena cava inferior hacia al remanente del foramen oval de forma preferencial, lo que en presencia de fenómenos físicos que cambian la posición relativa espacial del corazón en el mediastino pueden «estirar» el foramen oval, permitiendo su apertura parcial y el desarrollo del fenómeno11,12. La aparición de un neumotórax, la colocación de un tubo de tórax y la generación de atelectasias fueron fenómenos mecánicos que probablemente contribuyeron en la génesis del fenómeno. Lo anterior también está soportado en el hecho de que el trastorno se resuelve solo con los cambios de posición del paciente; en el momento de pasarlo a ventilación mecánica en prono se observa la resolución casi inmediata de la hipoxemia, alcanzando un nivel de PaO2/FiO2 de 20513-15. Este caso es por ello un reporte de la literatura que soporta la descripción de este fenómeno de flujo. No pudimos demostrar físicamente la presencia del CC; sin embargo la aproximación diagnóstica, creemos es lo suficientemente amplia como para dejarlo como un diagnóstico de exclusión. De manera importante, se muestra como una intervención terapéutica simple, que consiste en ventilar al paciente en posición de prono puede mejorar el trastorno crítico de oxigenación y se propone como terapia puente salvadora para el posterior manejo quirúrgico16,17.
ConclusionesLa hipoxemia refractaria por el fenómeno de flujo debe ser sospechada como diagnóstico de exclusión en pacientes con masa del mediastino. Proponemos la ventilación en prono como terapia puente para revertir una condición potencialmente mortal.
Perspectiva del pacienteLa familia del paciente manifestó haber recibido una atención médica adecuada.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
FinanciamientoLos autores no recibieron patrocinio para llevar a cabo este artículo.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.