Las interacciones farmacológicas constituyen los pilares de la tríada básica de la anestesia y su conocimiento contribuye a tener unas bases sólidas en la administración de medicamentos.
El presente artículo tiene como objetivo hacer una reflexión sobre las interacciones farmacológicas en anestesia: farmacéuticas (mezclar o no mezclar), farmacocinéticas (alteración en la distribución, metabolismo o eliminación), farmacodinámicas (sinergismo, adición) y termodinámicas (afinidad y actividad intrínseca).
La tríada básica de la anestesia es un concepto vigente y sus interacciones farmacológicas son los pilares de una anestesia segura. En la actualidad estas interacciones no se tienen en cuenta, razón por la cual es pertinente que el anestesiólogo las tenga presentes para hacer un ejercicio más seguro de los medicamentos que administra.
Drug interactions represent the cornerstone in the basic anesthetic triangle and knowledge about such interactions contributes to a solid foundation for administering medications.
This article dwells on the anesthetic drug interactions: pharmaceutical (mixing or not mixing), pharmacokinetic (alterations in distribution, metabolism, or clearance), pharmacodynamics (synergism, additive effect) and thermodynamic (affinity and intrinsic activity).
The basic anesthetic triangle is a current concept and drug interactions are the cornerstone for safe anesthesia. These interactions are currently neglected and hence the anesthetist should recognize any drug interactions for a safer practice of anesthesia.
Vivimos un hecho sin precedente en la anestesiología, estamos saliendo del oscurantismo, donde abrir o cerrar un vaporizador estaba sujeto a impulsos instintivos; donde un fármaco endovenoso era administrado por el principio del «poquito», «más o menos» o «no tanto» y la enseñanza de la anestesia se basaba en la experiencia del profesor con muchos años de ejercicio, donde por fin había encontrado la fórmula mágica para administrar un cóctel de medicamentos que dieran respuesta a las necesidades del cirujano1. Ahora hablamos de concentraciones, objetivos, probabilidades de no respuesta (PNR), sinergismo, etc., términos soportados en estudios científicos que fundamentan la enseñanza en la anestesia para ser reproducidos de generación en generación. Sin embargo, para comprender estos términos es fundamental conocer las bases de la administración de una anestesia segura, que en pocas palabras se resume en el término «interacciones».
El concepto de la anestesia con tres componentes básicos incorporado por Gray es la base fundamental para la administración de una adecuada técnica anestésica2,3. A través de los años estos componentes se han ampliado4,5; sin embargo, estos siguen girando en torno a los tres compontes fundamentales (hipnosis, analgesia, relajación). Poder comprender las interacciones de estos componentes básicos abre las puertas para dilucidar las diferentes gamas de respuestas que se presentan cuando administramos los anestésicos.
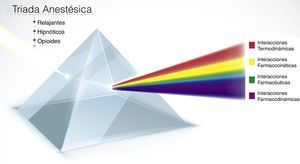
El concepto de la tríada de la anestesia (TA), más que un triángulo donde se representan los componentes principales de la anestesia, consistía, según el modelo inicial, en un prisma donde cada lado simbolizaba un componente y el baricentro del triángulo correspondía a las interacciones de dichos componentes6.
La primera interacción de los tres componentes de la anestesia que se postuló fue la farmacodinámica, la cual consistía en registrar el estado de depresión ventilatoria asociada a la interacción de opioide, hipnótico y relajante.
Cinco décadas después, la TA continúa vigente y el principio de interacciones que conforman dicha tríada se ha ido ampliando.
En el presente seguimos contando con los tres componentes básicos, pero la gama de sus interacciones ha pasado de considerar solo una (farmacodinámica) a tener en cuenta cuatro interacciones (farmacéuticas, farmacocinéticas, farmacodinámicas y termodinámicas).
En conclusión, tenemos tres componentes (opioide, hipnótico y relajante) que al estar presentes en el organismo pueden interaccionar de cuatro formas diferentes (farmacéuticas, farmacocinéticas, farmacodinámicas y termodinámicas).
Estas interacciones son la base de la tríada actual, y la claridad que tengamos de cada una de ellas va a permitir administrar una anestesia segura con un enfoque multimodal, más seguro y reproducible (fig. 1).
Interacciones farmacológicas de la triada de la anestesia. La imagen representa el concepto de la tríada de la anestesia (hipnosis, analgesia, relajación) y sus interacciones. Los medicamentos que ingresan al prisma pueden hacer diferentes interacciones: farmacéuticas, farmacocinéticas, farmacodinámicas y termodinámicas. Entre más medicamentos ingresen, la complejidad y el número de interacciones se pueden aumentar.
Fuente: autor.
Actualmente, para construir la TA se dispone de pocos medicamentos: remifentanilo, propofol y rocuronio, entre otros. Conocer las interacciones de este pequeño grupo de medicamentos es punto clave para administrar una anestesia multimodal segura con objetivo controlado (Target Controlled Anesthesia [TACAN])7. Adicional a estos medicamentos hay otros, que si bien no forman parte de la TA, hacen parte del día a día en salas de cirugía (dexametasona y midazolam, entre otros), por lo que conocer sus posibles interacciones es garantía de prevenir un evento adverso medicamentoso.
A continuación se describirán las interacciones farmacéuticas (IF), referidas a las incompatibilidades de tipo físico-químico que impiden mezclar dos o más fármacos en una misma solución; farmacocinéticas (IPK), interacción de los medicamentos en cuanto a su volumen de distribución, aclaramiento y metabolismo; farmacodinámicas (IPD), interacciones aditivas, supraaditivas e infraaditivas; y termodinámicas (IT), afinidad y actividad intrínseca.
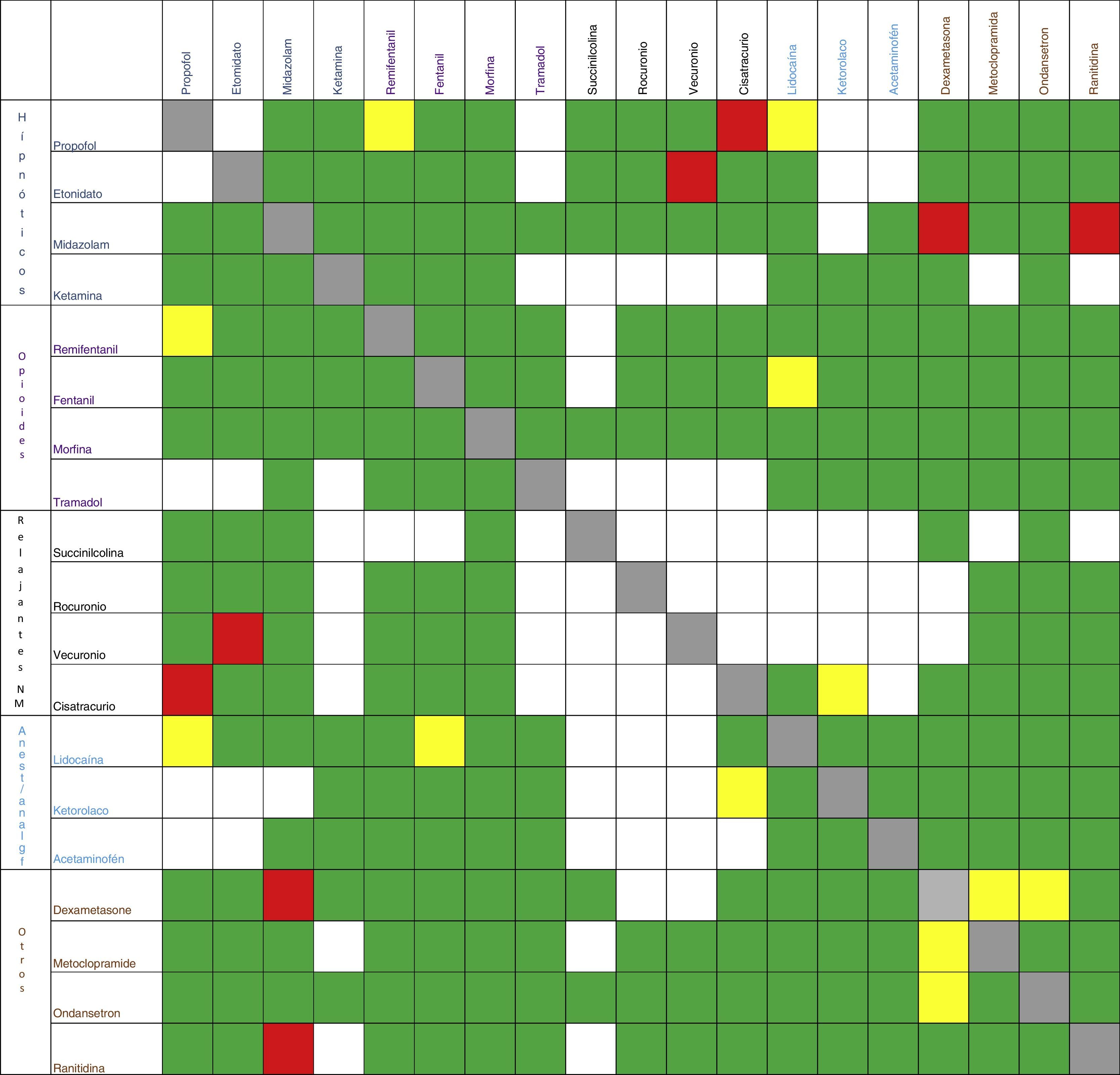
Interacciones farmacéuticasSe conoce como IF a la modificación de la estructura físico-química de un fármaco por la acción de otro cuando se encuentran en una misma solución, bien sea en una bolsa, en una jeringa o en un sistema de infusión en Y8,9. Este tipo de interacciones dan información sobre la estabilidad y la compatibilidad entre fármacos; los estudios clásicos para ver este tipo de estabilidad son los de cromatografía, y la fuente principal de información de este tipo de interacción es el Handbook on Injectable Drugs10. Las interacciones que no se encuentran reportadas en el libro se pueden buscar en internet con las palabras: Stability analysis, Mixture, Compatibility.
Cada vez que en una anestesia se mezclen dos o más medicamentos o vayan a compartir la misma vía de infusión, hay que hacernos la pregunta de si estos fármacos son compatibles. Es común la mezcla de hipnóticos con opioides u otros hipnóticos, sin considerar la compatibilidad o la posible inestabilidad a la hora de hacer esta combinación. Veamos dos ejemplos:
El uso de la mezcla de remifentanilo con propofol es común en algunos centros médicos11,12. Pero qué sucede con la IF, ¿es correcto hacer este tipo de mezcla? Si nos referimos al Handbook on Injectable Drugs, es poca la información que podemos obtener, pero si buscamos con las palabras «stability compatibility remifentanil-propofol» encontramos el estudio de Stewart, el cual concluye que la estabilidad de la mezcla de estos dos medicamentos dependió del tiempo, de la proporción remifentanilo-propofol y del continente. Basados en este estudio, se podría concluir que el remifentanilo se puede mezclar con el propofol siempre y cuando se tengan en cuenta las variables antes mencionadas; sin embargo, cualquier estudio de compatibilidad con propofol debe incluir un análisis de estabilidad de la emulsión13, dato del que hasta la fecha no se dispone en la literatura con remifentanilo.
El mecanismo por el cual el propofol produce dolor en el sitio de la inyección está mediado por la vía de la calicreína-quinina y la producción de bradiquinina; este proceso puede ser inhibido por la lidocaína14,15. Pero ¿se pueden mezclar el propofol y la lidocaína para prevenir este evento? ¿Son compatibles estos compuestos? Masaki et al.16 concluyeron que la adición de lidocaína al propofol incrementaba el diámetro de las vesículas oleosas y, por consiguiente, esta mezcla era fisicoquímicamente inestable en el tiempo y podía ser un riesgo para causar embolia pulmonar.
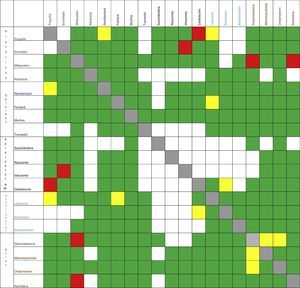
Este mismo ejercicio debe repetirse cada vez que los medicamentos vayan a compartir una misma vía de infusión, ya sea antibióticos, vasoactivos, antieméticos, etc.17-20. En la figura 2 se resumen algunas IF de los medicamentos más usados en anestesia.
Interacciones farmacocinéticasEste tipo de interacciones pocas veces suelen ser tenidas en cuenta, pero son las responsables del comportamiento atípico de algunos medicamentos21,22.
Es común que cuando estamos infundiendo remifentanilo y propofol, al administrar un bolo de propofol pareciera que hubiéramos dado una dosis extra de remifentanilo. ¿Cómo se explica este fenómeno? Bouillon et al.23, en un estudio donde determinó las IPK entre propofol y remifentanilo, concluyeron: a)que la farmacocinética del propofol no es modificada por el remifentanilo; b)que el propofol disminuye el volumen central de distribución (41%), el aclaramiento (41%) y la eliminación (15%) del remifentanilo, y c)que los requerimientos de las dosis de remifentanilo para alcanzar una concentración plasmática disminuyen con la coadministración de propofol en bolo, pero no cuando el propofol se administra en infusión. Este clásico estudio de IPK muestra que el propofol, al modificar el volumen de distribución del remifentanilo, hace que la dosis para alcanzar una concentración plasmática de este último sea menor, siendo este el factor responsable de los eventos adversos, como bradicardia e hipotensión extremas, al pasar estos medicamentos en bolo.
Pero quizás el medicamento que genera más IPK es el midazolam, un medicamento usado frecuentemente como sedante preoperatorio con comportamiento variable y con repercusiones en el metabolismo de otros medicamentos al inhibir la citocromo P4503A4. En el fentanilo, Labroo et al.24 demostraron que el midazolam disminuía la producción de norfentanilo casi en un 95%; en el propofol, Vuyk et al.25 documentaron que este alteraba su metabolismo, incrementando cerca de un 25% su concentración en sangre. Estas modificaciones en el metabolismo de los medicamentos conlleva muy probablemente a eventos como depresión, hipotensión y bradicardia26, eventos que probablemente no se presentarían si se tuvieran presentes estas interacciones. Otros medicamentos que afectan esta enzima y de uso frecuente son la dexametasona, la prednisolona, la ketamina, los antidepresivos y el alfentanilo, entre otros27.
Interacciones farmacodinámicasLa administración simultánea de los medicamentos anestésicos que actúan en diferentes receptores produce diferentes IPD, las cuales pueden ser sumatorias, sinérgicas o inhibitorias28,29.
Las interacciones aditivas se presentan cuando se administran de forma simultánea dos o más medicamentos con mecanismo de acción similar, y el efecto de dicha combinación es igual al que se espera por la simple sumatoria de sus efectos30. El comportamiento aditivo, es clásico de los hipnóticos y su uso simultáneo no contribuye más que a incrementar eventos adversos, debido a que no se está mejorando la acción de cada uno, solo se está reemplazando; este tipo de IPD se puede observar cuando se administra sevofluorano y propofol simultáneamente31.
Las interacciones sinérgicas se presentan cuando la combinación de los medicamentos produce un efecto mucho mayor que el anticipado para la sumatoria de los efectos32. Este tipo de interacción es el ideal en la práctica de la anestesia, ya que para obtener una respuesta con dos medicamentos que se administran simultáneamente se requiere menor dosis que cuando se infunden por separado, es decir, la acción de los medicamentos es mejor cuando están los dos.
Las interacciones sinérgicas se utilizan para construir los modelos de superficie, para establecer la PNR a un estímulo y para guiar una anestesia con objetivo controlado. En la actualidad los modelos de superficie más usados para establecer una PNR son el modelo de superficie remifentanilo-propofol y el modelo sevofluorano-remifentanilo33,34.
La condición sine qua non para construir un modelo de IPD sinérgico es que los medicamentos involucrados deben actuar en receptores diferentes y que dichos medicamentos deben suplir todo el espectro de la hipnosis en el caso de los hipnóticos o de la analgesia en el caso de los opioides. En este punto hay que resaltar el riesgo de usar fármacos con perfiles farmacodinámicos poco definidos para alcanzar el objetivo propuesto. Vemos un ejemplo: la dexmedetomidina, un agonista de los receptores α2, ha tenido un creciente interés en anestesiología y en cuidado crítico35: este medicamento que no tiene todas las propiedades de un hipnótico, ni todas las propiedades de un analgésico, no cumple el principio de versatilidad en cuanto a que no puede cubrir todo el espectro de la hipnosis ni todo el espectro de la analgesia. ¿Qué significa esto? Que si se desea construir un modelo de superficie entre dexmedetomidina y propofol o dexmedetomidina y remifentanilo, sería insuficiente poder alcanzar PNR altas. Esta es la razón por la cual la dexmedetomidina en anestesia no es capaz de estar en un vértice de la tríada y su uso se circunscribe a ser un coadyuvante con propiedades sedantes; en el evento llegado de requerir una hipnosis profunda, por su poca eficiencia, se tendría que anexar otro hipnótico; el mismo principio aplica para el componente analgésico.
La interacción antagónica o la inhibitoria se presentan cuando la combinación de los medicamentos produce un efecto menor que el anticipado para la sumatoria de los efectos36.
Interacciones termodinámicasEl análisis termodinámico ofrece potencialmente una visión de los eventos moleculares que subyacen a las interacciones fármaco-receptor37-40, es decir, las IT se refieren a los procesos de afinidad y actividad intrínseca.
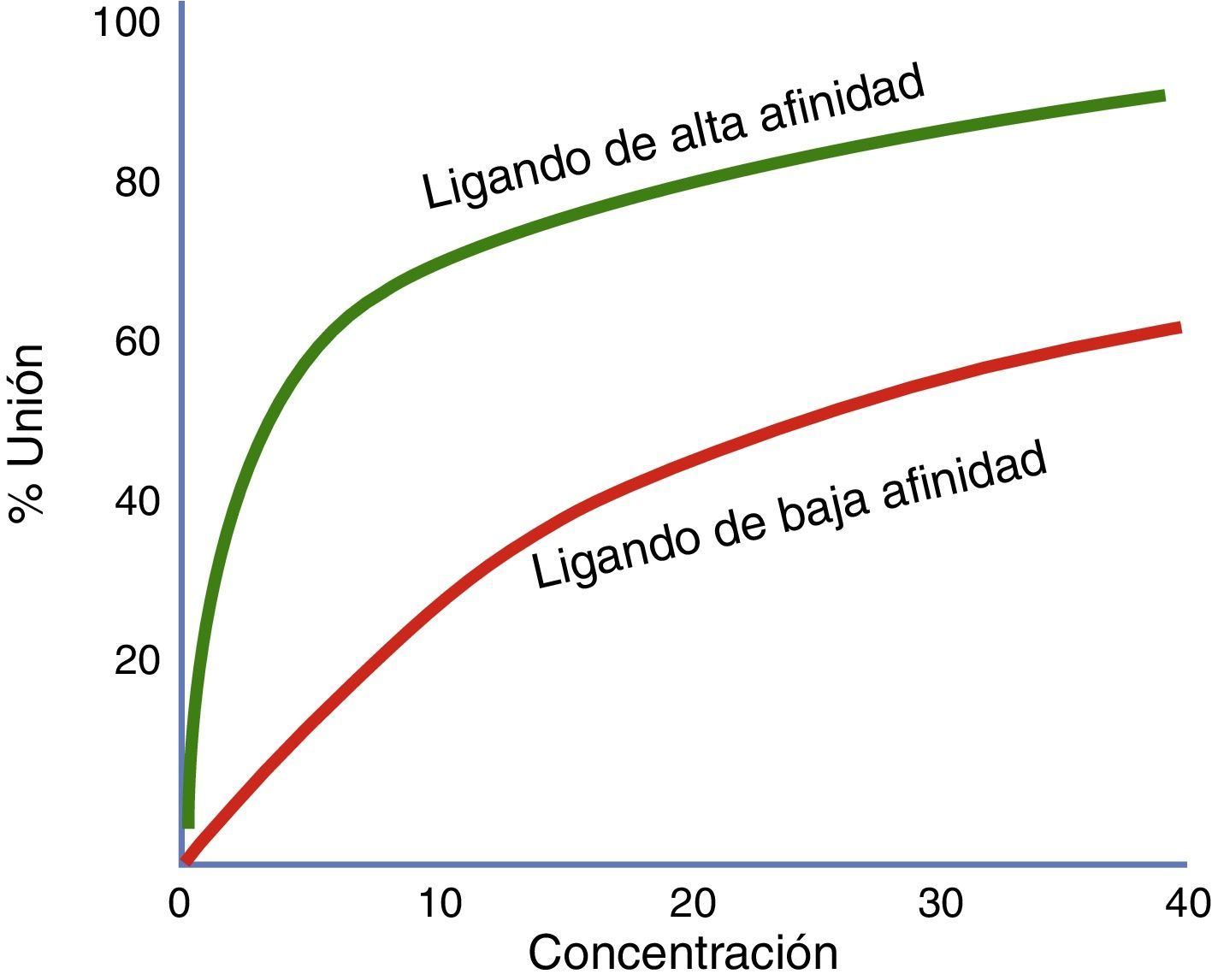
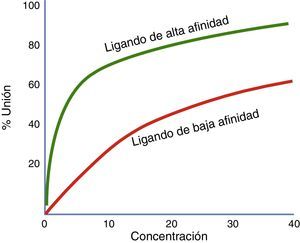
Afinidad y actividad intrínsecaLa fuerza con la que un fármaco se une a su receptor se denomina afinidad. El grado en que un fármaco activa sus receptores se denomina actividad intrínseca. Afinidad por un receptor y activación del receptor son dos cualidades diferentes de un medicamento41. Un medicamento puede tener alta afinidad por un receptor pero no activarlo (por ejemplo, un antagonista)42. En el contexto en que dos medicamentos actúen sobre un mismo receptor y se administren de forma simultánea, se deben contemplar los coeficientes de afinidad (Ki) para determinar cuál de ellos se unirá preferentemente al receptor, independientemente de la actividad intrínseca que este desencadene sobre el mismo (fig. 3).
Proporción de receptores unidos con dos agonistas diferentes a concentraciones variables. En esta gráfica se comparan un agonista de mayor afinidad (verde) y un agonista de menor afinidad (rojo). El ligando ilustrado por la curva verde tiene mayor afinidad que el ligando de la curva roja. Si estos dos ligandos están presentes al mismo tiempo, el ligando de más afinidad se unirá a los receptores disponibles.
Fuente: modificado de Wienken et al.42.
El concepto de afinidad es quizás el más importante para la administración de una anestesia multimodal. En la figura 4 se aprecia el caso hipotético de una célula con diferentes receptores, los cuales pueden ser bloqueados por diferentes ligandos. En el concepto de anestesia multimodal lo ideal sería bloquear nuestro objetivo desde diferentes puntos o de diferentes modos43, como se aprecia en la figura.
Concepto de anestesia multimodal. Izquierda: anestesia multimodal: diferentes fármacos buscan diferentes receptores (remifentanilo [R], propofol [P] y lidocaína [L]). Derecha: anestesia unimodal: muchos fármacos buscan un solo receptor (remifentanilo [R], fentanilo [F] y metadona [M]); el fármaco que se unirá al receptor será el que tenga mayor afinidad.
Fuente: autor.
Pero ¿qué sucedería si en lugar de utilizar tres modos diferentes se utilizaran más de dos fármacos que actúan sobre un mismo receptor (un solo modo), por ejemplo, utilizar solo fichas azules para bloquear la célula?
El uso de varios fármacos que actúan sobre un mismo receptor se aleja mucho del principio de la anestesia multimodal; sería como utilizar captopril y enalapril para bloquear la angiotensina o dos inhibidores de ADP para bloquear la plaqueta. Por lo tanto, utilizar dos fármacos que se unen a un mismo receptor implica conocer los coeficientes de afinidad para saber cuál de ellos se unirá preferentemente.
Para determinar los coeficientes de afinidad de los fármacos se llevan a cabo estudios de termodinámica en los que se libera un agonista muy afín marcado radioisotópicamente y luego se contabiliza la masa de otro medicamento capaz de desplazar el 50% del agonista marcado44. El concepto de afinidad se basa en el principio de fuerza donde la variable fundamental es la masa; así, entre más masa se necesita (Ki alto) para desplazar un ligando selectivo, menos afinidad tendrá este medicamento.
Los estudios realizados por Rimmel et al.45, Schmidtmayer y Ulbricht46 y Clarkson y Hondeghem47 comparando dos medicamentos que compiten por un solo sitio de unión indicaron que en ciertas condiciones la fracción de receptores bloqueada por la mezcla es menor que la fracción de receptores bloqueada por el agente con más afinidad. En condiciones, cuando las concentraciones de ambos medicamentos son altas, prevalecerá la saturación de los receptores por el medicamento con más afinidad (menor Ki).
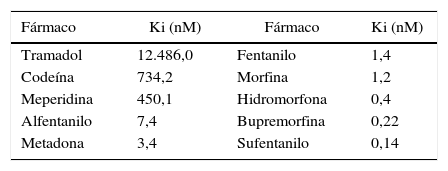
Para el caso de los opioides que se administran simultáneamente y que su mecanismo de analgesia prevalece sobre un mismo receptor, esta regla no puede ser omitida. En la tabla 1 se documentan los coeficientes de afinidad (Ki) de los diferentes opioides; dichos coeficientes se establecieron con un opioide sintético muy afín al receptor, llamado DAMGO; así, entre menos masa necesite un opioide para desplazar el 50% del DAMGO, más afín será por el receptor48.
Coeficiente de afinidad de los diferentes opioides
| Fármaco | Ki (nM) | Fármaco | Ki (nM) |
|---|---|---|---|
| Tramadol | 12.486,0 | Fentanilo | 1,4 |
| Codeína | 734,2 | Morfina | 1,2 |
| Meperidina | 450,1 | Hidromorfona | 0,4 |
| Alfentanilo | 7,4 | Bupremorfina | 0,22 |
| Metadona | 3,4 | Sufentanilo | 0,14 |
Entre menos masa necesite el opioide para desplazar un agonista, más afinidad tendrá. Para el caso de la analgesia entre metadona y morfina, la morfina desplazará a la metadona.
Fuente: modificado de Volpe et al.49.
En la tabla 1 el sufentanilo, por ejemplo, necesita solo una concentración de 0,14nM en comparación con el alfentanilo (7,4nM) para desplazar el 50% del agonista marcado, y si estuvieran los dos al mismo tiempo frente al receptor, el sufentanilo sería el opioide que se uniría al receptor por necesitar una masa menor (mayor afinidad)49.
La afinidad del remifentanilo, comparada con la de la morfina, por los receptores mu (μ) fue estudiada por Poisnel et al.50. El estudio documentó que la morfina es un agonista que no discrimina realmente entre los tres subtipos de receptores opioides, mostrando valores de Ki de 14,9±3,1 a 19,3±3,6nM. La afinidad del remifentanilo hacia los receptoresμ, que hasta el momento no se había caracterizado, mostró un perfil farmacológico con una Ki de 21,1±1,2nM, muy similar al de la morfina (Ki=17±1nM). Con base a los datos obtenidos donde se documentan los diferentes Ki de los tres opioides más usados en anestesia, se debe tener presente que la morfina es el opioide más afín a los receptoresμ, seguido del remifentanilo y el fentanilo, respectivamente. Así, en situaciones donde las concentraciones de estos medicamentos sean lo suficientemente altas para saturar los receptores μ, el opioide más afín será el que se una al receptor. En la anestesia multimodal, cuando se administran dos opioides con actividad intrínseca, como fentanilo y remifentanilo, de forma simultánea y a altas concentraciones, se debe prever que uno de ellos tiene más afinidad y conceptualmente se estaría en un sistema poco eficiente. Otros opioides, como la bupremorfina, con una afinidad alta por el receptorμ (Ki baja) y una actividad intrínseca precaria (pobre analgésico), es capaz de desplazar completamente la morfina, el fentanilo, el remifentanilo, la metadona y otros agonistas opioides51, cualidad que se utiliza como tratamiento para la desintoxicación por opiáceos52.
Otros casos donde es fundamental el principio de actividad intrínseca y afinidad en la práctica diaria son la depresión por opioides, donde se recomienda el uso de naloxona, un opioide con una afinidad muy alta (Ki bajo) pero con precaria actividad intrínseca53, o cuando utilizamos un relajante neuromuscular para desplazar la acetilcolina, el cual tiene una alta afinidad por el receptor pero su actividad intrínseca es nula.
ConclusiónLas interacciones farmacológicas son los pilares de la tríada de la anestesia, y conocerlas puede contribuir a una anestesia segura.
FinanciamientoPropio.
Conflicto de interesesNinguno.
A los doctores Diego Rincón y Vladimir Rivas, de la Universidad Surcolombiana, Neiva, Colombia.




![Concepto de anestesia multimodal. Izquierda: anestesia multimodal: diferentes fármacos buscan diferentes receptores (remifentanilo [R], propofol [P] y lidocaína [L]). Derecha: anestesia unimodal: muchos fármacos buscan un solo receptor (remifentanilo [R], fentanilo [F] y metadona [M]); el fármaco que se unirá al receptor será el que tenga mayor afinidad. Fuente: autor. Concepto de anestesia multimodal. Izquierda: anestesia multimodal: diferentes fármacos buscan diferentes receptores (remifentanilo [R], propofol [P] y lidocaína [L]). Derecha: anestesia unimodal: muchos fármacos buscan un solo receptor (remifentanilo [R], fentanilo [F] y metadona [M]); el fármaco que se unirá al receptor será el que tenga mayor afinidad. Fuente: autor.](https://static.elsevier.es/multimedia/01203347/0000004500000003/v4_201709020115/S0120334717300400/v4_201709020115/es/main.assets/thumbnail/gr4.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)
