Presentamos el caso de una gestante a término con síndrome antifosfolípido primario, trombosis portal crónica, esplenomegalia masiva, varices esofágicas y trombocitopenia. La paciente fue intervenida mediante una cesárea electiva bajo anestesia general para minimizar el riesgo de rotura del bazo y de las varices, con un resultado favorable para la madre y el neonato.
La trombosis portal crónica es una entidad poco frecuente, motivada por distintas causas, principalmente las diátesis trombóticas. Induce un aumento de la presión portal, con desarrollo de circulación colateral, esplenomegalia y trombocitopenia. La gestación en estas condiciones se considera de alto riesgo, pero no está contraindicada si la enfermedad está estabilizada. El manejo de estas pacientes debe ser multidisciplinar y su seguimiento, estrecho; el diagnóstico y tratamiento de las posibles varices esofágicas es esencial. La decisión sobre el modo de finalizar la gestación y el manejo anestésico deben individualizarse en cada caso, en función de factores obstétricos, de la presencia o no de varices y trombocitopenia, y de las comorbilidades asociadas.
We report the case of a pregnant woman at term with primary anti-phospholipid syndrome, portal vein thrombosis, massive splenomegaly, oesophageal varices and thrombocytopenia. The patient underwent an elective cesarean section under general anaesthesia to minimise the risk of spleen and variceal rupture, with a favourable outcome for both the mother and the newborn.
Chronic portal vein thrombosis is a rare condition, caused by various reasons, mainly thrombotic diathesis. It leads to increased portal pressure, with development of collateral circulation, splenomegaly and thrombocytopenia. Pregnancy in these conditions is considered high risk, but is not contraindicated if the underlying disorder is stabilised. The management of these patients should be multidisciplinary, under close monitoring; diagnosis and treatment of possible esophageal varices is essential. The decision about mode of delivery and anaesthetic management must be individualised, depending on obstetric factors, the presence or absence of varices and thrombocytopenia, and associated comorbidities.
Tras la aprobación por el Comité de Ética de nuestra institución, presentamos el caso de una gestante a término de 29 años y 74kg. Con motivo de un aborto espontáneo 3 años antes, se le había diagnosticado un síndrome antifosfolípido primario, con trombosis portal crónica, esplenomegalia masiva y trombocitopenia; dicha trombosis condicionaba una hipertensión portal con varices esofágicas, circulación colateral esplenorrenal y fístulas arterioportales. Tras el diagnóstico, se inició anticoagulación con acenocumarol, que se sustituyó por 60mg de enoxaparina y 100mg de ácido acetilsalicílico diarios cuando la paciente expresó su deseo de una nueva concepción; se realizó, además, una esófago-gastroscopia que descartó la existencia de lesiones varicosas susceptibles de tratamiento endoscópico. La gestación había transcurrido sin incidencias y se programó una cesárea electiva por el riesgo de rotura esplénica con el trabajo de parto.
La exploración no reveló hallazgos patológicos a nivel cardiorrespiratorio, ni tampoco ningún predictor de vía aérea difícil. El día de la cirugía, la paciente presentaba 56.000 plaquetas.mm-3 (tabla 1); la SaO2 era del 85%, sin disnea, trabajo respiratorio ni cianosis. Se premedicó a la paciente con 50mg de ranitidina, 10mg de metoclopramida y 2g de cefazolina intravenosos una hora antes de la intervención. A su llegada a quirófano, se canalizaron 2 vías venosas de calibre grueso y la arteria radial, y se colocó una sonda vesical; se inició entonces la transfusión de un pool de plaquetas. Tras una preoxigenación de 3 min, se procedió a la inducción anestésica de secuencia rápida con 1mg.kg-1 de rocuronio, 2mg.kg-1 de propofol, 1mcg.kg-1 de remifentanilo y maniobra de Sellick; la intubación se consiguió al primer intento sin variaciones sustanciales de la presión arterial. La extracción fetal se facilitó con una ventosa, sin comprimir el abdomen. Hasta ese momento, la anestesia se mantuvo con O2 al 100% y sevoflurano al 1%; posteriormente se redujo la FiO2 al 50%, se suspendió la administración de sevoflurano y se inició una perfusión de remifentanilo (para evitar incrementos superiores a un 20% de la presión arterial o de la frecuencia cardiaca) y otra de propofol (para un BIS entre 40 y 60). Antes del fin de la intervención, se administraron por vía intravenosa 1g de paracetamol, 2g de metamizol magnésico, 10mg de cloruro mórfico y 4mg de ondansetrón, así como 200mg de sugammadex antes del despertar y de la extubación, con recuperación completa del bloqueo neuromuscular. Tras la extracción de la placenta, se inició una perfusión de oxitocina según protocolo.
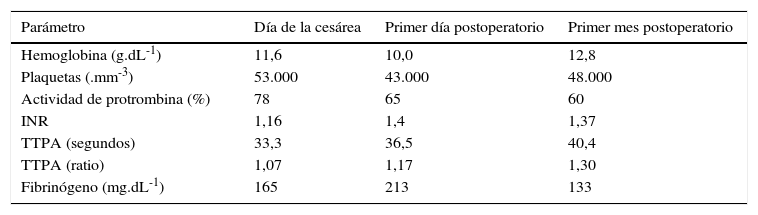
Determinaciones analíticas perioperatorias
| Parámetro | Día de la cesárea | Primer día postoperatorio | Primer mes postoperatorio |
|---|---|---|---|
| Hemoglobina (g.dL-1) | 11,6 | 10,0 | 12,8 |
| Plaquetas (.mm-3) | 53.000 | 43.000 | 48.000 |
| Actividad de protrombina (%) | 78 | 65 | 60 |
| INR | 1,16 | 1,4 | 1,37 |
| TTPA (segundos) | 33,3 | 36,5 | 40,4 |
| TTPA (ratio) | 1,07 | 1,17 | 1,30 |
| Fibrinógeno (mg.dL-1) | 165 | 213 | 133 |
Fuente: autores.
La cesárea transcurrió sin incidencias; nació una niña en buen estado que no precisó de reanimación (Apgar 9 al min y 10 a los 5-10 min). La evolución inmediata fue satisfactoria, sin sangrado anormal y sin transfusión de más plaquetas ni otros hemoderivados. En la analítica postoperatoria la paciente presentaba 43.000 plaquetas.mm-3 y una actividad de protrombina de 65%; el resto de la coagulación era normal (tabla 1). Se reanudó el tratamiento con enoxaparina 14 h después de la intervención, con 40mg/24 h, y posteriormente 60mg/24 h a partir del segundo día. El alta hospitalaria se produjo al quinto día, sin ninguna incidencia reseñable. Transcurrido un mes, se reanudó la anticoagulación oral y se suspendió la enoxaparina cuando el INR fue superior a 2; el puerperio transcurrió dentro de la normalidad. A los 6 meses, la paciente fue ingresada 2 veces en el hospital por dolor abdominal, uno por colelitiasis sintomática y otro atribuido a la gran esplenomegalia; dada la buena respuesta al tratamiento médico y el elevado riesgo anestésico-quirúrgico, se decidió el seguimiento periódico. En ese momento, la paciente presentaba una clase de Child-Pugh B7 y se inició tratamiento con propranolol para la profilaxis primaria de la hemorragia digestiva alta.
DiscusiónLa trombosis portal, en ausencia de cirrosis o tumores hepatobiliares, es una entidad poco frecuente, generalmente asociada a hipertensión portal e hiperesplenismo con trombocitopenia1,2. Las causas de esta entidad pueden ser varias: diátesis trombóticas2, onfalitis neonatal1 e infecciones3. La progresión de la trombosis hacia los vasos mesentéricos conlleva un elevado riesgo de isquemia intestinal, con una mortalidad que alcanza el 50%2. En ausencia de recanalización de la trombosis, se desarrolla circulación colateral (transformación cavernomatosa)1,2, con el consiguiente riesgo de sangrado digestivo.
En contra de lo publicado en los estudios más antiguos, se ha comprobado que durante el embarazo normal hay un incremento significativo del flujo portal. Se desconoce si dicho aumento se produce también en las pacientes con enfermedad vascular hepática; si así fuese, empeoraría la hipertensión portal4,5. Una gestación en estas circunstancias es de muy alto riesgo5,6; aun así, no existe una contraindicación absoluta en caso de trombosis portal estable2,6. Dada la escasa frecuencia de esta entidad, no existen muchas publicaciones al respecto y no hay unanimidad en cuanto al manejo de la gestación. Podríamos destacar 3 puntos esenciales: optimización del estado de las pacientes antes de llegar al término de la gestación, decisión sobre cómo terminarla (parto vaginal o cesárea electiva) y aspectos anestésicos relacionados (técnicas analgésicas y anestésicas).
Más del 43% de las pacientes obstétricas con hipertensión portal no cirrótica y varices esofágicas presentarán una hemorragia gastrointestinal alta, con una mortalidad perinatal del 35%1. Se ha propuesto la realización de una endoscopia digestiva para el tratamiento profiláctico de las varices previamente a la concepción1,2,5,7 o durante el segundo trimestre (cuando más se incrementa la presión portal)5,7, con lo que la frecuencia de sangrado se reduciría al 8,6%5. Tanto la escleroterapia como la ligadura se consideran seguras durante la gestación, si bien esta última es la técnica preferida5,7. Para la prevención del sangrado también se recomiendan los betabloqueantes (no selectivos, fundamentalmente el propranolol), cuyo uso se considera beneficioso a pesar de los potenciales efectos adversos fetales (retraso en el crecimiento intrauterino, bradicardia, hipoglucemia neonatal)5,7. En general, solo se recurre a los shunts portosistémicos en los casos de sangrado refractario al tratamiento médico y endoscópico5,7.
No existen guías para decidir el modo de terminar la gestación; la decisión debe ser individualizada en cada caso y tomada por un equipo multidisciplinar8. Algunos autores consideran que el parto vaginal es la mejor opción y reservan la cesárea para las indicaciones obstétricas1,2,5,7,8. Sería deseable que el expulsivo fuese corto e instrumentado, para evitar un incremento excesivo de la presión en el abdomen y las varices1,5,6,7,8. Otros autores son partidarios de realizar una cesárea en las pacientes con varices8 o con esplenomegalia masiva9, para evitar su rotura por aumento de la presión intraabdominal durante el trabajo de parto y los pujos. Hay que tener en cuenta que en estos casos el sangrado asociado a la cesárea puede ser mayor de lo habitual, debido a la trombocitopenia y a la presencia de varices en la pared abdominal1; también es mayor el riesgo tromboembólico2 y de descompensación de la situación clínica de la paciente (ascitis, encefalopatía)7. Se ha documentado el uso de ventosas para la extracción fetal, a fin de minimizar la compresión de la pared abdominal8.
En caso de parto vaginal, la analgesia debería instaurarse precozmente6. La ingurgitación venosa puede afectar también a los vasos epidurales y paraespinales, con desarrollo de colaterales y aumento del riesgo de sangrado y de reabsorción sistémica de los anestésicos locales al realizar técnicas neuroaxiales1; si se planea alguna de estas técnicas, sería deseable disponer de una resonancia magnética1. Las técnicas regionales con frecuencia se desestiman por la trombocitopenia asociada, aunque pueden ser preferibles a la anestesia general en determinadas situaciones10; en cada caso habrá que valorar el balance riesgo/beneficio11,12. Hasta ahora, ningún estudio tiene un número suficiente de pacientes que permita determinar la seguridad de estas técnicas en pacientes obstétricas con recuentos inferiores a 100.000 plaquetas.mm-3, si bien distintos autores consideran aceptables cifras de 75.000-80.00013,14. Considerando conjuntamente varios estudios11,12,15-17, un total de 661 pacientes obstétricas recibieron una técnica neuroaxial con menos de 100.000 plaquetas.mm-3, sin registrarse ningún caso de hematoma espinal; tampoco hay casos confirmados de hematoma en este tipo de pacientes en ausencia de signos clínicos de coagulopatía18. Beilin et al.11 recomiendan efectuar un recuento plaquetario lo más próximo posible a la realización de la técnica para descartar un descenso progresivo de las plaquetas; otros autores proponen efectuar un test de función plaquetaria como la tromboelastografía17,18. Una práctica relativamente común es la transfusión de plaquetas antes de la punción, aunque no existe una evidencia sólida al respecto19. Curiosamente, en el estudio de Hoekstra et al.2 los resultados adversos en la gestación se asociaron con los recuentos plaquetarios más altos en el momento del diagnóstico.
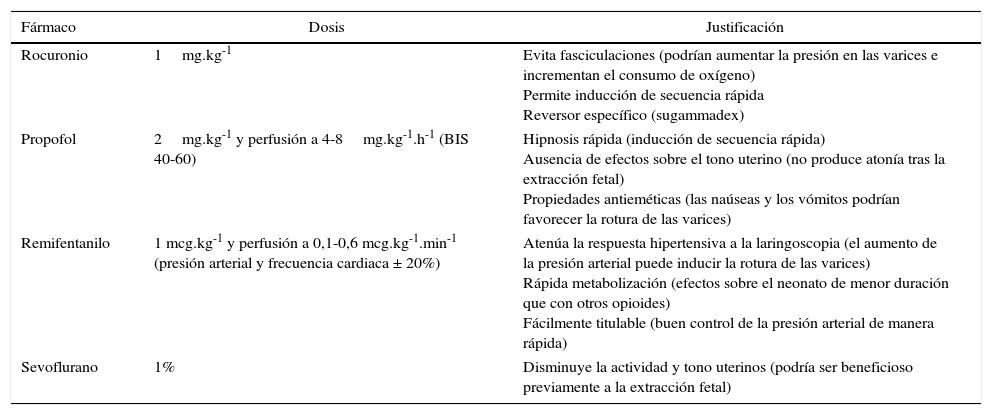
En caso de anestesia general, resulta vital lograr una profundidad anestésica adecuada para evitar situaciones de hipertensión y taquicardia, que podrían favorecer el sangrado de las varices; ello es especialmente importante en los momentos de mayor estimulación, como la laringoscopia y la intubación, las incisiones cutánea y uterina, y la extracción fetal6. Por sus propiedades farmacocinéticas, el remifentanilo sería muy útil6; se han empleado también con seguridad el tiopental y la succinilcolina6 (tabla 2). Hay que tener en cuenta que, en estas pacientes, los fármacos anestésicos pueden precipitar o empeorar una encefalopatía5.
Fármacos anestésicos empleados
| Fármaco | Dosis | Justificación |
|---|---|---|
| Rocuronio | 1mg.kg-1 | Evita fasciculaciones (podrían aumentar la presión en las varices e incrementan el consumo de oxígeno) Permite inducción de secuencia rápida Reversor específico (sugammadex) |
| Propofol | 2mg.kg-1 y perfusión a 4-8mg.kg-1.h-1 (BIS 40-60) | Hipnosis rápida (inducción de secuencia rápida) Ausencia de efectos sobre el tono uterino (no produce atonía tras la extracción fetal) Propiedades antieméticas (las naúseas y los vómitos podrían favorecer la rotura de las varices) |
| Remifentanilo | 1 mcg.kg-1 y perfusión a 0,1-0,6 mcg.kg-1.min-1 (presión arterial y frecuencia cardiaca ± 20%) | Atenúa la respuesta hipertensiva a la laringoscopia (el aumento de la presión arterial puede inducir la rotura de las varices) Rápida metabolización (efectos sobre el neonato de menor duración que con otros opioides) Fácilmente titulable (buen control de la presión arterial de manera rápida) |
| Sevoflurano | 1% | Disminuye la actividad y tono uterinos (podría ser beneficioso previamente a la extracción fetal) |
Fuente: autores.
Con independencia de cómo finalice la gestación, hay que vigilar estrechamente la hemorragia posparto, por su mayor incidencia5. Deben administrarse antibióticos sobre todo en casos de ascitis, para prevenir la peritonitis bacteriana espontánea5. Si está indicada la anticoagulación, debe reanudarse tan pronto como sea posible en ausencia de datos de sangrado, idealmente en las primeras 24 h7.
De todo lo expuesto podemos concluir que, aunque la gestación en los casos de trombosis portal debe considerarse de alto riesgo, no está contraindicada si la enfermedad está estabilizada. El manejo de estas pacientes debe ser multidisciplinar y su seguimiento estrecho; es imprescindible realizar una endoscopia digestiva para diagnosticar posibles varices esofágicas y tratarlas. La decisión sobre el modo de finalizar la gestación y las técnicas anestésicas empleables debe individualizarse en cada caso, en función de condicionantes obstétricos, de la presencia o no de varices o trombocitopenia y de las comorbilidades asociadas.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciamientoLos autores declaran no tener fuente de financiación.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.