La diabetes gestacional (DG) es una de las complicaciones médicas que más frecuentemente afectan a las mujeres embarazadas; algunos autores reportan una prevalencia entre el 9,7 y el 13,9%. La DG puede ser causa de efectos adversos como: nacimiento pretérmino, macrosomia, nacimiento por cesárea, hiperbilirrubinemia, hipertensión gestacional, así como la predisposición de desarrollar posteriormente diabetes mellitus tipo 2 y síndrome metabólico. La literatura señala la asociación entre los microorganismos presentes en el biofilm subgingival, etiológicos de la inflamación de los tejidos de soporte dentarios y diabetes mellitus. Uno de estos microorganismos, Porphyromonas gingivalis, expresa, entre otros factores de virulencia, una proteína llamada fimbrilina, la cual presenta variaciones genotípicas relacionadas con su capacidad de inducción en la expresión de mediadores inflamatorios; los genotipos fimA II y fimA IV se consideran con mayor capacidad de virulencia y su presencia se ha asociado con la resistencia a la insulina. En este estudio analizamos la prevalencia de los genotipos fimA II y fimA IV en un grupo de mujeres mexicanas de la región central de México con DG, en mujeres con embarazo sin diabetes y mujeres sin embarazo y sin diabetes. Los resultados encontrados muestran una elevada presencia del genotipo fimA II en mujeres con DG (p < 0,05).
Gestational diabetes (GD) is one of the most common complications in pregnant women, with some authors reporting prevalence between 9.7% and 13.9%. GD can lead to the following adverse effects: preterm birth, macrosomia, cesarean birth, hyperbilirubinemia, gestational hypertension, and predisposition to later develop diabetes mellitus type 2 and metabolic syndrome.
The literature shows an association between microorganisms in the subgingival biofilm, which produces inflammation of the dental support tissue, and diabetes mellitus. Porphyromonasgingivalis is one of these microorganisms, and among other virulence factors, it expresses a protein called fimbrilin which has genotypic variations related to its ability to induce expression of inflammatory mediators. Genotypes fimA II and fimA IV are considered to have a greater virulence and their presence has been associated with insulin resistance.
An analysis is made on the prevalence of genotypes fimA II and fimA IV in a group of women in central region of Mexico with GD, pregnant women without diabetes, and non-pregnant women without diabetes. The results show an elevated presence of genotype fimA II in women with GD (P <.05).
Antecedentes
La diabetes gestacional (DG) es una de las complicaciones más comunes durante el embarazo. Se caracteriza por una alteración en el grado de intolerancia a los carbohidratos, con diversos grados de severidad, y puede o no resolverse después del parto1. Se estima que en el ámbito mundial, la DG afecta entre el 2 y 14% de la población dependiendo del grupo étnico en estudio2. La DG es causa de efectos adversos tanto en la madre como en el neonato tales como la hipertensión gestacional, el nacimiento pretérmino, macrosomia e hiperbilirrubinemia del neonato, así como la predisposición de desarrollar posteriormente diabetes mellitus (DM) tipo 2 y síndrome metabólico3,4. En México, el Instituto Nacional de Perinatología ha reportado entre el 9,7 y 13,9% de prevalencia de DG según estadísticas de 20055.
Estudios recientes han demostrado una elevada prevalencia y asociación entre la DG y la inflamación de los tejidos de soporte de los dientes, atribuida esta a la presencia de flora patógena que se encuentra en el biofilm subgingival6,7.
Se ha sugerido que dichos microorganismos expresan factores de virulencia, los cuales estimulan las vías que conllevan inflamación sistémica y, por lo tanto, una reducción en la función y/o apoptosis de las células beta pancreáticas produciendo, finalmente, resistencia a la insulina tal y como sucede en la DM tipo 28,9.
Uno de los microorganismos del biofilm subgingival con mayor patogenicidad es la Porphyromonas gingivalis (P. gingivalis)7, una bacteria asacarolítica y anaerobia que produce una amplia gama de factores de virulencia entre los que se incluyen cisteín-proteasas, lipopolisacáridos, cápsulas y fimbrias, estas últimas codificadas por el gen fimA. Todos esos factores están encaminados a la obtención de hierro y péptidos de crecimiento como fuente de energía a partir de la hemina (hierroprotoporfirina IX), la cual la obtiene de la hemoglobina, haptoglobina, mioglobina, hemopexina, metahemoglobina, oxihemoglobina, lactoperoxidasaalbúmina, catalasa, y citocromo c, de los glóbulos rojos mediante su reclutamiento en el lugar de la invasión10,11.
Su éxito como colonizador se debe a su capacidad de adhesión a los diferentes tipos de células de los tejidos de la cavidad oral, con otras bacterias, con la matriz extracelular y con componentes salivales. Esta capacidad de adhesión es proporcionada por las fimbrias, componente que además ha sido asociado a su potencial patogénico; de hecho, la mayoría de pacientes con inflamación de los tejidos de soporte dentarios (periodontitis) presentan el genotipo fimA II seguido en frecuencia por el genotipo fimA IV, mientras que el genotipo fimA tipo I, III y V se detectan mayoritariamente en los adultos sanos con presencia de P. gingivalis11.
En este trabajo se realizó un análisis de la prevalencia de la P. gingivalis de los genotipos fimA II y IV mediante la reacción en cadena de la polimerasa (PCR) en mujeres con DG, pacientes gestantes sin diabetes y pacientes sin embarazo y sin diabetes (SESD).
Metodología
Población de estudio
El presente trabajo es un estudio transversal, observacional, descriptivo. Las muestras fueron obtenidas del Hospital de la Mujer ISSEA de la ciudad de Aguascalientes, México, el cual atiende a mujeres del estado y ciudades circunvecinas de los estados de Jalisco y Zacatecas.
La prevalencia de los genotipos fimA II y IV de P. gingivalis fue analizada en 120 pacientes divididas en 3 grupos: el primer grupo correspondió a 40 mujeres embarazadas con diagnóstico de DG según los criterios de Carpenter, señalado en la guías de práctica clínica12 que acudieron a cita de control al Servicio de Embarazo de Alto Riesgo. En el momento de la toma de la muestra todas las pacientes presentaron una hemoglobina glicosilada (HbA1c) ≤ 6,5%. El segundo grupo se conformó con 40 mujeres ESD. El tercer grupo correspondió a 40 mujeres SESD que acudieron a cita de revisión ginecológica de rutina. Las características de los grupos fueron similares en cuanto a antecedentes educativos, edad, ingreso familiar, antecedentes familiares para diabetes, así como número de embarazos; ninguna participante recibió atención periodontal previa al embarazo.
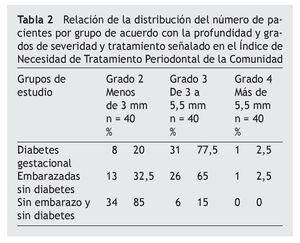
A las pacientes de los 3 grupos se les realizó el Índice de Necesidad de Tratamiento Periodontal de la Comunidad (INTPC), según el manual de la Organización Mundial de la Salud13, el cual consiste en registrar un promedio por grupo de necesidad de atención periodontal considerando parámetros tales como sangrado al sondeo, profundidad de sondeo y presencia de sarro. A los parámetros referidos se les asigna uno de las siguientes categorías: código 0: sin sangrado al sondeo ni cálculo dental; la profundidad es < 3,5 mm, no se requiere tratamiento; código 1: sangrado gingival al sondeo sin presencia de cálculo dental, la profundidad es < 3,5 mm y solo se necesita mejorar la higiene; código 2: presencia de sangrado y cálculo dental, la profundidad es < 3,5 mm y se necesita mejorar la higiene y detartraje; código 3: presenta los mismos signos que el anterior y una profundidad de 3,5 a 5,5 mm. Se requiere mejorar la higiene y raspado y alisado radicular, y código 4: lo mismo que el código anterior y una profundidad de 5,5 mm o más. Se requiere, además de raspado y alisado radicular, tratamiento quirúrgico. Finalmente, para la toma de la muestra, se consideró la cara mesial del 16; en caso de estar ausente, la cara mesial del 17. Este criterio se utilizó por ser además uno de los órganos dentales que erupciona a temprana edad (6 años), y, por ende, por tener una mayor probabilidad de encontrar alteraciones de los tejidos de soporte. Todas las pacientes fueron informadas acerca del procedimiento de la toma de muestra y el objetivo del estudio a fin de obtener su consentimiento informado.
Obtención de las muestras
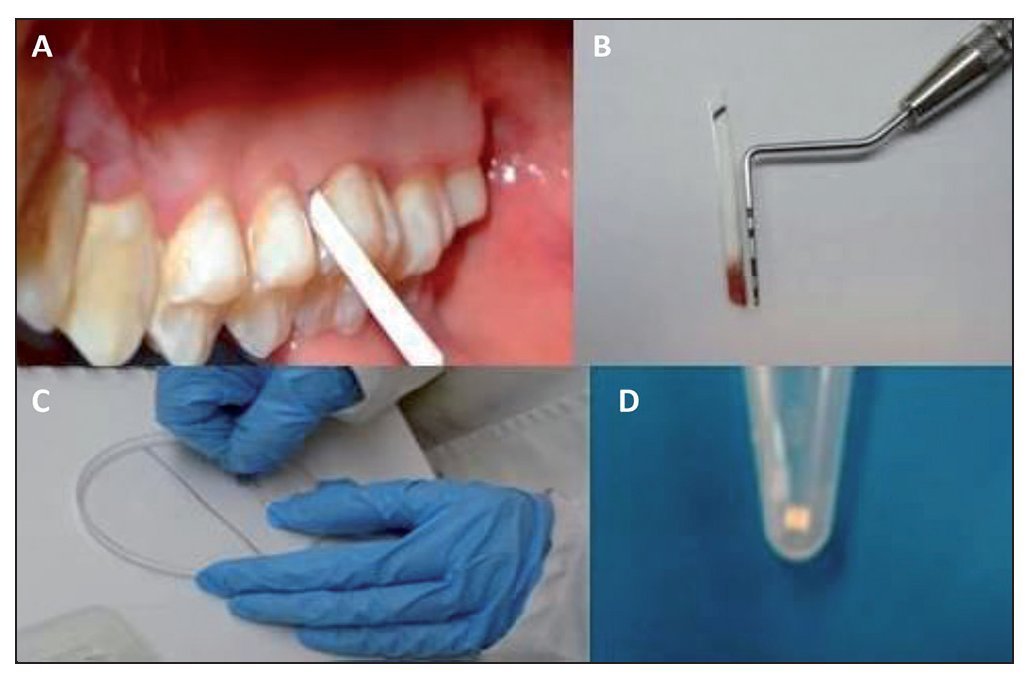
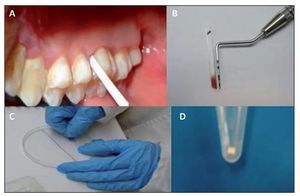
Se realizó aislado relativo y se secó con torunda de algodón la cara palatina del primer molar superior derecho o 16, y cuando este estaba ausente, en el 17. Las muestras se obtuvieron insertando una tira de papel FTA (Whatmann, Alemania; Buckinghamshire, Reino Unido) en 3 puntos. Las tiras tenían una medida de 1,5 mm de ancho por 12 mm de largo. Las tirillas de FTA se dejaron por espacio de 20 s, y posteriormente se depositaron en un microtubo donde fueron almacenadadas a 4 °C hasta su uso. Todas las muestras fueron tomadas por duplicado. El procedimiento nos permitió tanto medir la profundidad del surco gingival como analizar la presencia de los genotipos de P. gingivalis a través de PCR. Todos los procedimientos fueron realizados por 2 operadores.
Purificación de ácido ribonucleico
Los fragmentos de 1 mm del papel FTA fueron lavados y enjuagados de acuerdo con las especificaciones del proveedor (Whatmann, Alemania, Buckinghamshire, Reino Unido). Un fragmento de papel de 1 mm2 fue utilizado para cada reacción de PCR, analizando así toda la zona correspondiente a la bolsa periodontal.
Determinación de genotipos de Porphyromonas gingivalis por reacción en cadena de la polimerasa
La genotipificación de los genotipos II y IV de P. gingivalis fue llevada a cabo de acuerdo con los protocolos de Amano et al. (1999) con mínimas variaciones descritas más adelante. Los cebadores utilizados fueron: para fimA II F-5´ ACA ACT ATA CTP ATG ACA ATG G 3´ y R-5´ y F-5´ ACC AAC ACT CTC CTT GAC ATT G 3´ y R-5´ TAT TGG GAA GTG ACG ATC AGA G 3´. Las reacciones se llevaron a cabo en un volumen de 12,5 #ml, conteniendo 1,25 μl de buffer 10X (Invitrogen, Sao paulo, Brasil), 1,0 mM de MgCl2, 0,2 mM de dNTP's, 0,8μM de cada primer 2,5 U de Taq polimerasa recombinante (Invitrogen, Sao Paulo, Brasil). Para cada reacción, se utilizó como ADN molde un fragmento de 1 mm2 de papel FTA. La amplificación se llevó a cabo por 35 ciclos de desnaturalización a 94 °C por 30 s, un alineamiento a 60 °C por 30 s, y la extensión a 72 °C por 60 s. Fueron necesarias una predesnaturalización a 94 °C por 10 min y una extensión final a 72 °C por 7 min. La determinación de los genotipos se llevó a cabo de forma separada o a través de PCR multiplex para detectar los genotipos simultáneamente. Las reacciones se llevaron a cabo en un termociclador 9700 (Applied Byosistems, Foster City, CA, Estados Unidos). En el caso de las reacciones llevadas a cabo por separado, los productos fueron visualizados a través de electroforesis al 3% teñidos con EtBr. Asimismo, cuando se realizó la PCR multiplex, los productos fueron separados en un gen de acrilamida al 4% y teñidos con nitrato de plata. La razón de esto último es que los productos amplificados tienen un peso molecular de 257 pb para fimA II y 251 pb para fimA IV, lo cual dificulta observar la diferencia en la migración de ambos fragmentos en agarosa. Para todas las reacciones, se llevó a cabo una PCR, utilizando como control de reacción interna un fragmento de la b-globina usando los cebadores 5'-GGTTGGCCAATCTACTCCCAGG-3' y 5-GCTCACTCAGTGTGGCAAAG-3' con las siguientes condiciones: la mezcla de amplificación consistió en 50 mmol de KC1, 10 mmol/l de Tris-HCl (pH 8,3), 0,1 g/l de gelatina, 1,5 mmol/l de MgCl2, 100-200 ng de ADN genómico, 0,7 mmol/l de cada cebador (E91s y E136as), 200 mMol/l para cada trifosfato de desoxinucleótido y 1,25 U de Taq polimerasa (Invitrogen St. MO., Estados Unidos) en un volumen final de 50 μL. El programa de amplificación por PCR se realizó en un termociclador modelo 480 (Perkin-Elmer, Gouda, Holanda). Después de la desnaturalización a 94 °C durante 100 s, se llevaron a cabo 30 ciclos: desnaturalización a 94 °C durante 1 min, hibridación a 57 °C durante 1 min, y luego la extensión a 72 °C durante 2 min; la extensión final fue a 72 °C durante otros 10 min.
Análisis estadístico
La prevalencia de fimA II y fimA IV se calculó dividiendo el número de pacientes que lo presentaron (x) entre el número de integrantes de cada grupo (n). En cada grupo, se analizó mediante una prueba de χ2 para considerar la significancia estadística con un nivel de p < 0,05. Una vez establecida una diferencia estadísticamente significativa, se compararon las diferencias de prevalencia de los genotipos fimA II y fimA IV entre los grupos mediante una prueba de diferencia de proporciones con un intervalo de confianza de 95%. Para las diferencias de medias de índice de masa corporal (IMC), ingreso y edad, se empleó una prueba ANOVA, considerando una diferencia significativa de p < 0,05. Una vez establecida la diferencia, se compararon las variables mencionadas utilizando una prueba de t de Student para establecer una diferencia significativa entre las medias de los grupos. Se analizaron las proporciones de profundidad y antecedentes heredofamiliares (AHF) mediante una prueba de χ2, considerando significancia con un nivel de p < 0.05. Todos los cálculos se realizaron en Minitabv15 para el análisis de las pruebas.
Resultados
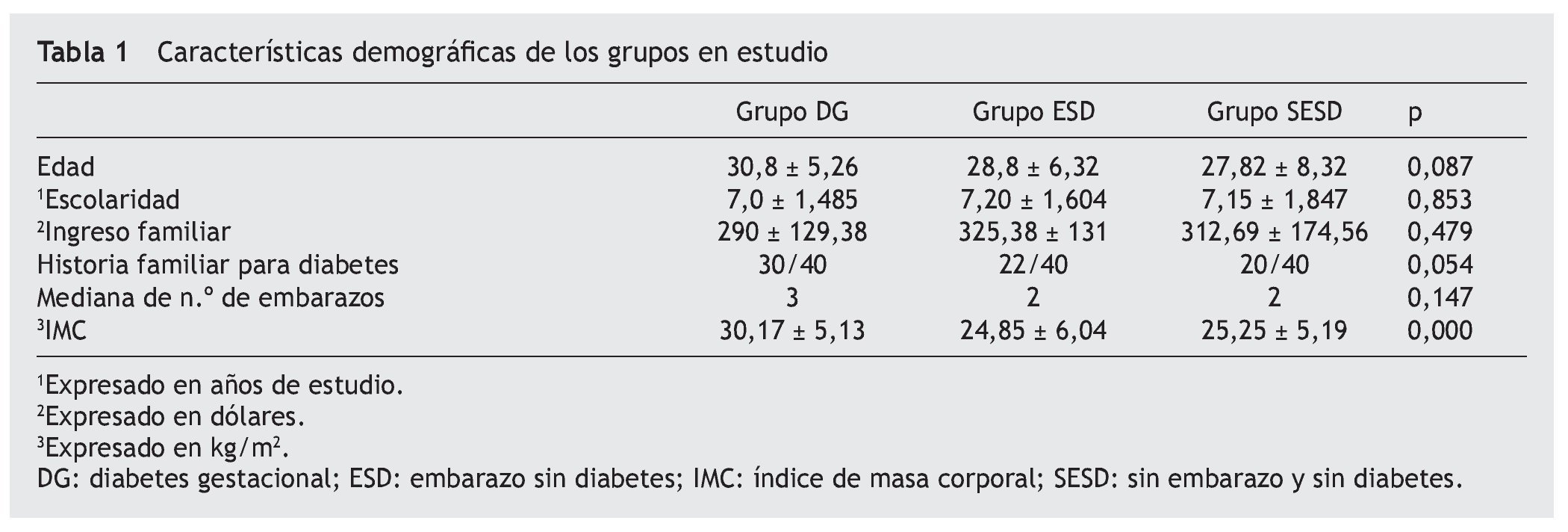
En un estudio transversal realizado en el Hospital de la Mujer ISSEA del estado de Aguascalientes, México, se determinó la prevalencia de los genotipos fimA II y fimA IV de P. gingivalis en mujeres con DG, mujeres embarazadas sin DG y mujeres SESD. Sin diferencias significativas en cuanto a la edad, escolaridad, ingreso familiar, número de embarazos y AHF para diabetes entre los diferentes grupos bajo estudio (p = 0,05) (tabla 1).
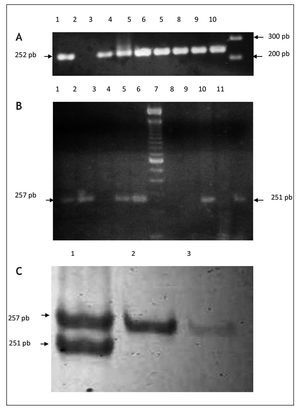
Para la detección molecular y la genotipificación de P. gingivalis, se optimizó un protocolo descrito por Amano et al. (1999). Se seleccionaron los genotipos fimA II y fimA IV por ser reportados en la literatura como más prevalentes y patogénicos14,15. Las muestras fueron tomadas a través de un novedoso método consistente en el uso de tirillas elaboradas con papel FTA. En cada fragmento de 1 mm2 (indicando este el nivel de profundidad), se analizó la presencia de ambos genotipos (fig. 1). Una comparación en la medición de la profundidad utilizando sonda periodontal y tirillas de papel FTA no mostró una diferencia significativa entre ambos métodos (desviación estándar ± 0,1 mm, datos no mostrados). La representación gráfica de los productos amplificados se muestra en la figura 2.
Figura 1. Colecta y procesamiento de muestras del surco gingival utilizando tirillas de papel FTA. Las muestras fueron obtenidas insertando el fragmento de papel FTA en la cara del mesial del 16; los fragmentos fueron cortados en fragmentos de un 1 mm y utilizados posteriormente en la PCR para la determinación de genotipos de P. gingivalis.
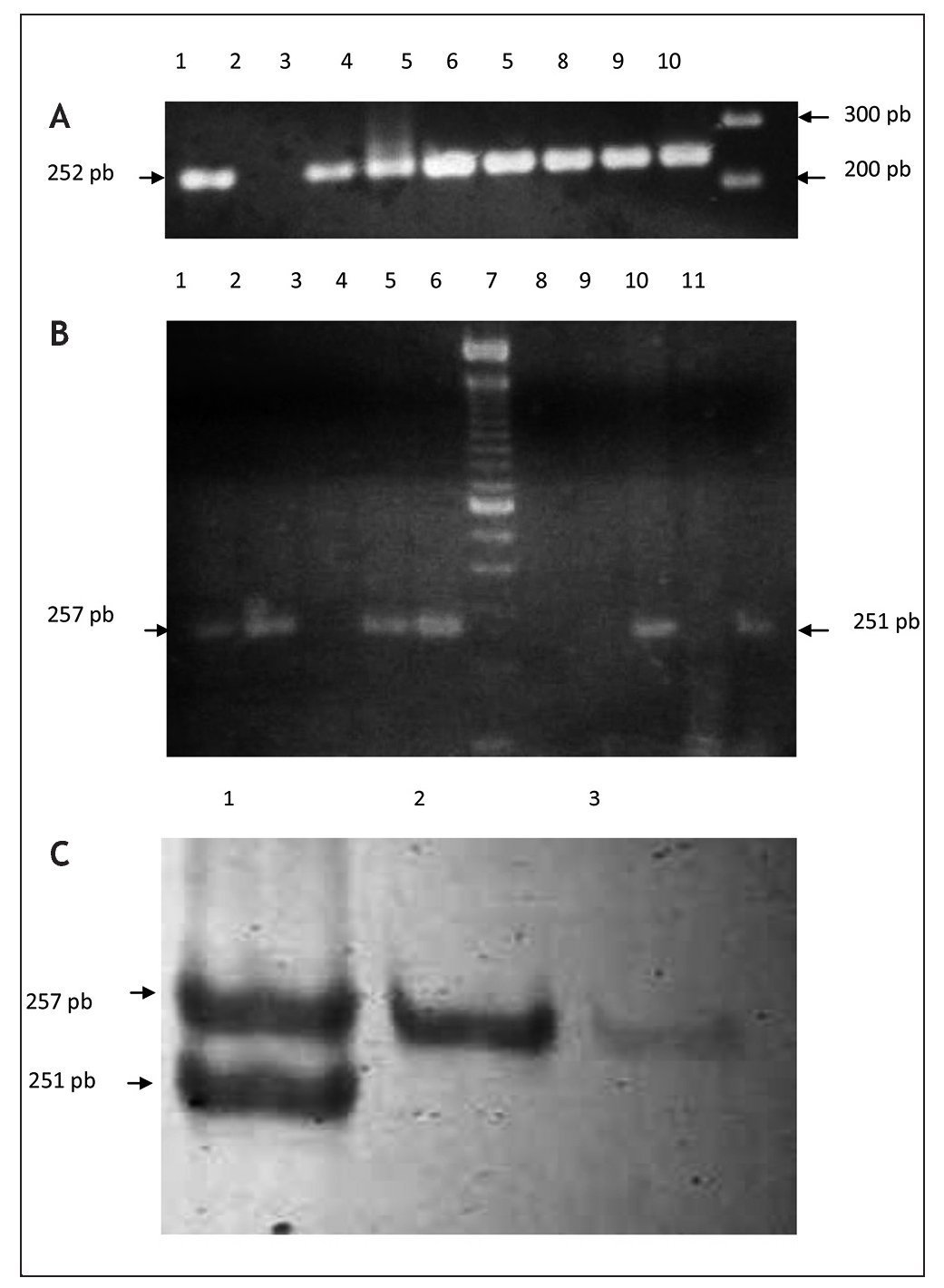
Figura 2. Separación electroforética de productos de PCR para la caracterización de genotipos fimA II y fim IV de P. gingivalis. Las muestras fueron amplificadas a partir de papel FTA introducido en el surco gingival de pacientes femeninas. Panel A: amplificación de fragmentos del gen de la b-globina como reacción de control interna. Carriles: 1) control positivo, ADN K 562, 2, control negativo (agua); carriles 3-9) muestras de pacientes; carril 10) marcador de peso molecular, 100 pb ladder. Panel B: caracterización de genotipos fimA II y fim IV de P. gingivalis en geles de agarosa al 2%. Carriles: 1-5) muestras de pacientes amplificadas con cebadores para fimA II; carril 6) marcador de peso molecular, 100 pb ladder; carriles 7-11) muestras de pacientes amplificadas con cebadores para fimA IV. Panel C: amplificación a través de PCR multiplex utilizando cebadores contra fimA II y fim IV. Los productos de amplificación fueron separados en geles de acrilamida al 3%. Carriles: 1) coinfección con fimA II y IV; 2-3) amplificación de genotipo fimA II.
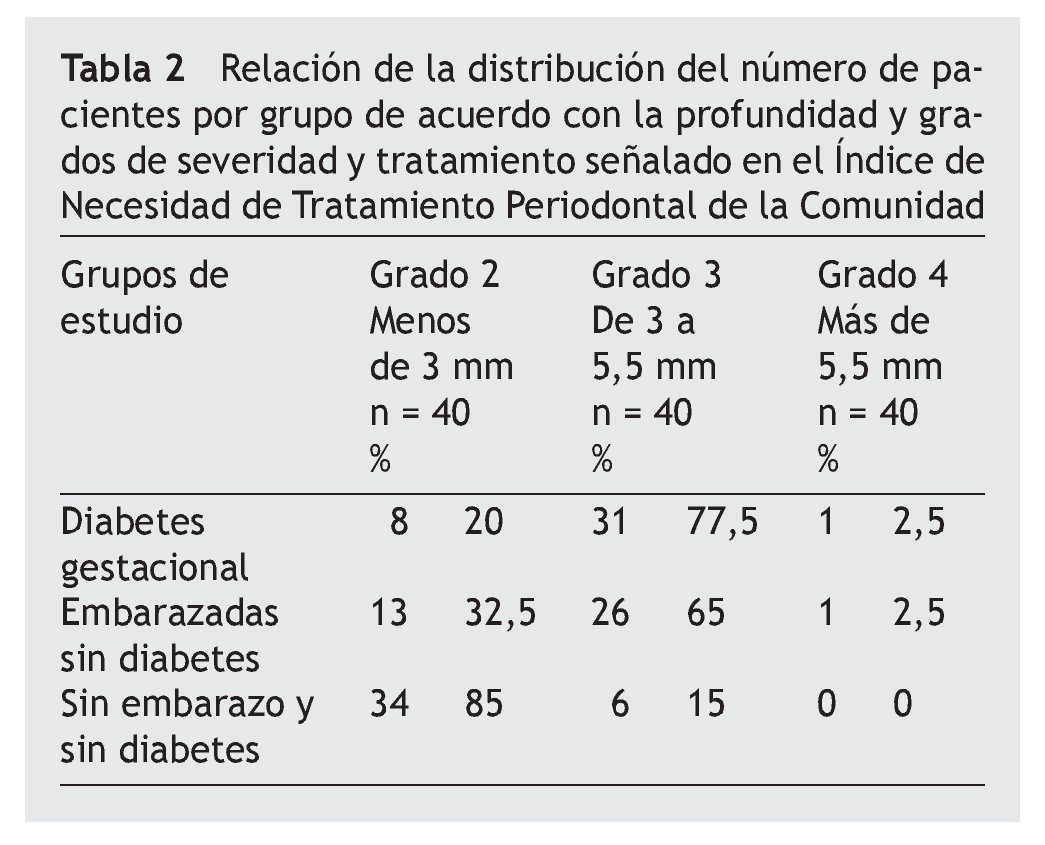
Al determinar el INTPC, se encontró que los grupos con DG y DG se ubicaron en el código 3, y el grupo SESD en el código 2 (tabla 2).
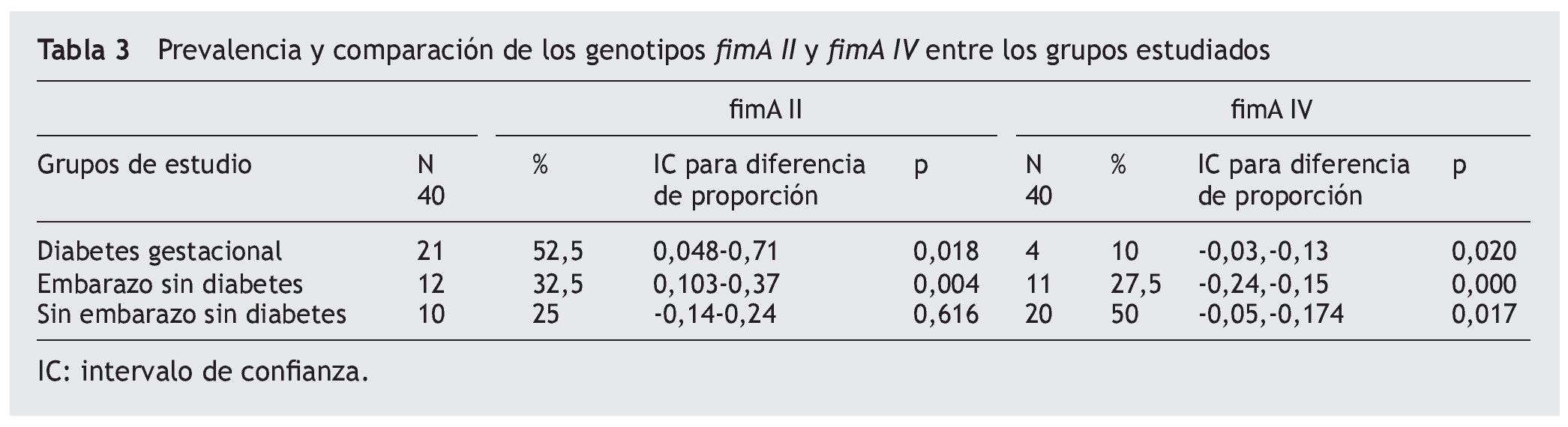
En relación con la profundidad establecida en el grado 3 (> 3 mm), encontramos para fimA II, que no existe diferencia significativa entre DG vs. embarazo sin diabetes (ESD) (p = 0,778), pero ambos presentan mayor profundidad que el grupo SESD (p = 0,000). Para fimA IV, el grupo DG presentó mayor proporción que el grupo ESD (p = 0,005) y que el grupo SESD (p = 0,000); sin diferencia significativa, el grupo ESD y el grupo SESD (p = 0,177). Para la proporción de genotipos de P. gingivalis encontrados por grupo de estudio, el genotipo fimA II fue más prevalente en mujeres con DG que en los demás grupos al estar en el 52,5% de las pacientes; mientras que el genotipo fimA IV tuvo mayor prevalencia en las mujeres que no presentaron embarazo ni diabetes con un 50%. Se encontraron diferencias significativas de prevalencia entre los grupos (χ2) tanto para fimA II (p = 0,024) como para fimA IV (p = 0,000) (tabla 3).
Asimismo, al comparar la prevalencia de fimA II mediante una prueba de comparación para 2 proporciones encontramos que para fimA II, el grupo DG fue mayor que el grupo ESD (p = 0,018), y al grupo SESD (p = 0,004), pero no se encontró diferencia significativa entre el grupo ESD y el grupo SESD (p = 0.616). Para el genotipo fimA IV, encontramos que la prevalencia en el grupo DG fue menor que en el grupo ESD (p = 0,020), y que en el grupo SESD (P = 0,000). Asimismo, en el grupo ESD, la prevalencia fue menor que el grupo SESD (p = 0,017) (tabla 3).
De acuerdo con lo sugerido por la Federación Europea de Periodontología/Asociación Americana de Periodontología16,17, para estudios en donde se analicen asociaciones de alteraciones periodontales con DG, es necesario incluir otros factores como el sobrepeso (IMC), los AHF, la raza, la etnicidad y la localización geográfica, entre otros.
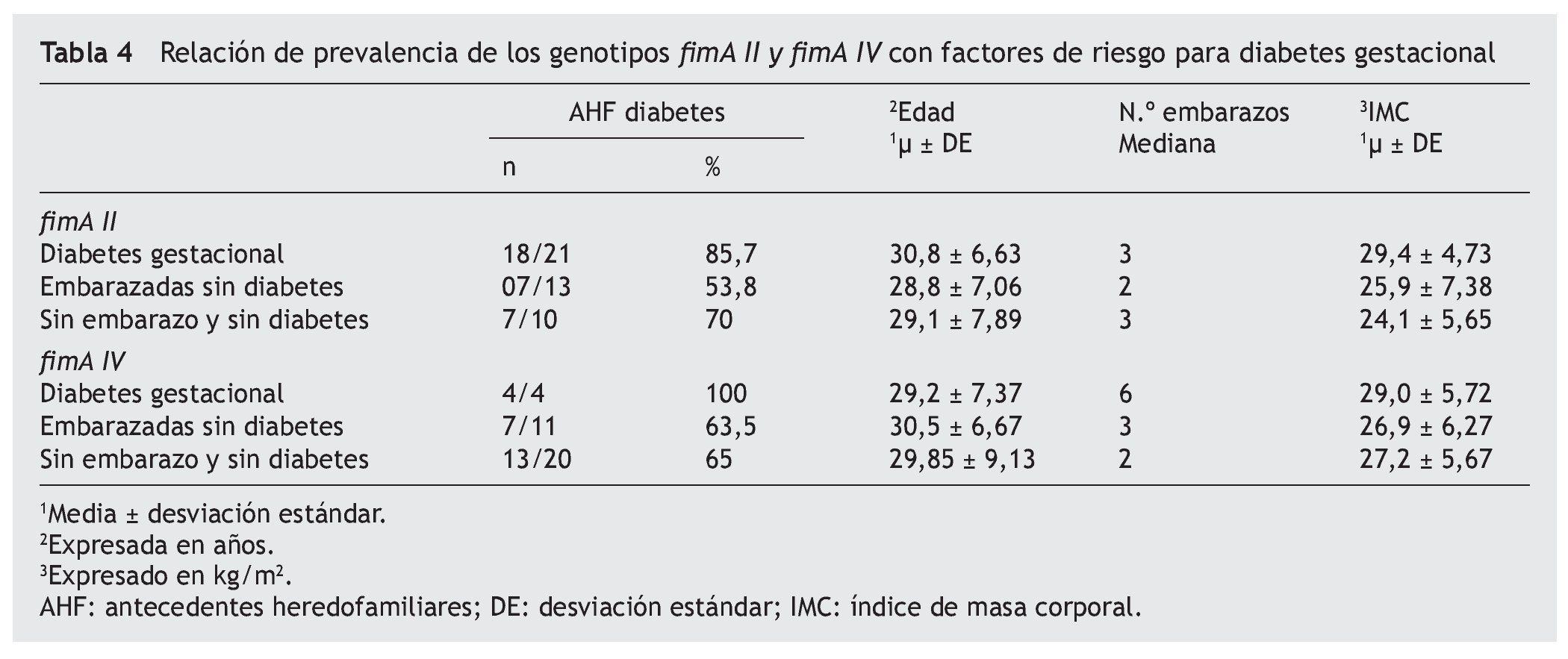
En este estudio se analizó la asociación de los AHF de DM tipo 2, el número de embarazos y el IMC con la prevalencia de los genotipos fimAII y IV de P. gingivalis. En las mujeres positivas para fimA II: la proporción de antecedentes familiares para diabetes del grupo DG fue mayor que el grupo ESD (p = 0,044), pero no se encontró diferencia con el grupo SESD (p = 0,169); ni tampoco entre el grupo ESD y el grupo SESD (p = 0,420). La media de edad del grupo DG fue mayor que la del grupo ESD (p = 0,048) y mayor que el grupo SESD (p = 0,011), pero no hubo diferencia entre el grupo ESD y el grupo SESD (p = 0,083). No se encontró diferencia significativa en la mediana del número de embarazos entre los grupos (p = 0,180). En el IMC, el grupo DG no fue diferente al grupo ESD (p = 0,158), pero fue mayor que el grupo SESD (p = 0,010); entre el grupo ESD y grupo SESD no presentó diferencia (p = 0,521). En las mujeres positivas para fimA IV: el grupo DG presentó una mayor proporción de AHF que el grupo ESD (p = 0,006), y que el grupo SESD (p = 0,001), pero no se encontró diferencia entre el grupo ESD y el grupo SESD (p = 0,940). La media del grupo de edad fue mayor en el grupo DG al compararla con el grupo ESD (p = 0,004) y con el grupo SESD (p = 0,007); el grupo ESD no fue diferente al grupo SESD (p = 0,116). No se encontró diferencia estadística entre la mediana de embarazos entre los grupos (p = 0,084). En el IMC no encontramos que entre el grupo DG y el grupo ESD existe diferencia (p = 0,569) y tampoco entre el grupo DG y el grupo SESD (p = 0,596); tampoco entre el grupo ESD y el grupo SESD (p = 0,900) (tabla 4).
Discusión
La asociación entre la periodontitis y la DG ha sido reportada por diversos autores. Es aceptado que la etiología de la periodontitis es debida a la presencia de múltiples microorganismos del biofilm subgingival18,19, pero la prevalencia y menos aún la importancia del proceso infectivo en relación con la DG no es bien conocida.
En este estudio determinamos la prevalencia de P. gingivalis, uno de los agentes causales más relacionado con el inicio y progresión de la periodontitis y su relación con DG, en específico con los genotipos fimA II y fimA IV, que han sido relacionados con el grado de severidad de esta, según lo reportado por diferentes autores20-23.
La capacidad patogénica de estos genotipos es debida a su mayor capacidad de transcripción del gen fimA, a su habilidad de adherencia a las estructuras del hospedador y, por lo tanto de su colonización, además de su mayor capacidad de promover mediadores inflamatorios en comparación con los demás genotipos. Se ha demostrado que el genotipo fimA II tiene 20 veces mayor expresión del gen fimA que el genotipo fimA IV24. El genotipo II se ha asociado a la presencia de mayor profundidad de la bolsa periodontal, a mayor severidad de la lesión, en agrandamiento gingival por medicamentos y a una mayor presencia en DM tipo 2. En tanto que el genotipo fimA IV ha sido mayormente asociado a casos de gingivitis24,25. La alta presencia observada de este último genotipo en nuestro grupo control refleja el pobre impacto de los programas de salud en México.
A diferencia de la mayoría de los estudios relacionados, decidimos utilizar el INTPC, dado que el objetivo fundamental fue determinar si se encontraba presente P. gingivalis en mujeres con DG, más que su relación con el diagnóstico de periodontitis y si la proporción encontrada era diferente en mujeres con ESD y mujeres SESD.
Aunque se han realizado numerosos estudios para establecer la relación entre periodontitis y DG, los criterios diagnósticos empleados difieren, de tal suerte que unos consideran periodontitis a una profundidad al sondeo ≥ 4 mm y sangrado al sondeo, mientras que otros consideran una profundidad al sondeo ≥ 4 mm más o al sondeo y una pérdida de inserción ≥ 2 mm más sangrado al sondeo26. Es importante señalar que el incremento en el volumen gingival durante el embarazo nos puede dar datos falsos para elaborar el diagnóstico. Por lo anterior, el empleo del INTPC nos permitió de una manera rápida conocer la condición de salud gingival de las pacientes. Estas aseveraciones toman mayor sentido cuando se toma en cuenta que el Hospital de la Mujer ISSEA de Aguascalientes atiende 13.500 embarazos al año (casi el 50% de los embarazos del estado), lo que genera un tiempo de consulta muy corto, y por otro lado, no se tiene contemplada la atención del estado de salud bucal, salvo casos de urgencia.
Una aportación del trabajo fue la de realizar la toma de la muestra utilizando tirillas de papel FTA, un sustrato ampliamente usado en la conservación de muestras forenses. El uso de papel FTA, por una parte, funciona de una manera muy similar a forma de sondaje, y por otra, permite conservar por mucho tiempo el ADN obtenido del biofilm subgingival; finalmente, permite, a través de PCR multiplex, la posibilidad de detectar simultáneamente múltiples patógenos del biofilm subgingival, entre ellos el complejo rojo; y en estudios longitudinales o de seguimiento, establecer la interrelación cronológica de los diferentes patógenos en la progresión de la enfermedad, tema ampliamente controversial en la literatura27. Asimismo, el uso de este substrato permitió establecer el grado de profundidad al que se encontraron los genotipos de P. gingivalis. Detectando a los patógenos a una profundidad de hasta 2 mm, lo que nos permite establecer si una paciente está en riesgo potencial de desarrollar enfermedad periodontal en cualquiera de sus formas, aun sin manifestaciones clínicas, y administrar un tratamiento temprano. Es importante señalar que aunque, tal como se ha mencionado, no hubo diferencias significativas entre la medición de la profundidad del surco gingival a través de sonda periodontal y tirillas de papel FTA, este método no se propone como una forma de sustituir al uso de la sonda.
En este estudio encontramos una proporción > 50% del genotipo fimA II en las mujeres con DG, lo que nos permite establecer una estrecha asociación de este genotipo con la patología mencionada28. En un estudio realizado en México para conocer la prevalencia de los genotipos de P. gingivalis en pacientes con DM tipo 2 y con diagnóstico de periodontitis, se reportó que los genotipos fimAIb, fimA II y fimA IV fueron los más prevalentes, lo que es congruente con los resultados de nuestro estudio. Asimismo, en dicha investigación se encontró que en pacientes sin diabetes ni periodontitis los genotipos encontrados fueron fimA I y fimA II29. Este hallazgo difiere de lo encontrado en nuestro estudio, ya que en nuestro grupo control, es decir, mujeres SESD, el 50% de ellas mostraron la presencia del genotipo fimA IV, y el 25%, de fimA II; sin embargo, son congruentes con lo reportado por Missailidis30, quien en un estudio realizado en una población brasileña con gingivitis, reportó una proporción de fimA IV del 65%.. Cabe hacer mención de que al categorizar a las pacientes del grupo SESD de acuerdo con el INTPC se encontraban en grado 2. Es también probable que la discrepancia con el estudio realizado en México se deba a que de una muestra de 25 pacientes solo 17 eran mujeres.
La relación del genotipo fimA II con la DG se ve reforzada cuando se compara la prevalencia encontrada con el grupo de ESD y en donde se presenta una prevalencia del genotipo fimA II 50% menor que en el grupo de DG. Diversos autores han mencionado que la condición hormonal durante el embarazo favorece la colonización en los tejidos de soporte dental por P. gingivalis31 ya que estas hormonas abastecen nutricionalmente a la bacteria. Queda de manifiesto al comparar estos 2 grupos que no solamente el estatus hormonal es suficiente para esta colonización32. Asimismo, se menciona que existen profundos cambios durante el embarazo que redundan en una inmunodepresión de la gestante lo que contribuiría a dicha colonización33. En la condición patológica de la DG, es evidente, en particular la endotelitis34 y otros eventos adversos que generan una sobremigración de elementos humorales y celulares de la respuesta inmune pudieran contribuir al daño celular y permitir que la bacteria colonice esos sitios dañados35. Son necesarios más estudios para establecer los eventos bioquímicos que favorecen esta colonización del tejido de soporte en el caso de las mujeres con DG.
Con anterioridad, se ha reportado que la población de P. gingivalis fimA II es susceptible a los incrementos de la HbA1c36. En nuestro estudio, a pesar de que prácticamente todas las pacientes analizadas presentaban un buen control glucémico, determinado este con la glucosa basal y la HbA1c; encontramos una elevada prevalencia del genotipo fimAII de P. gingivalis. Esto no indica necesariamente que esta se encuentre activa en cuanto a su infección, sin embargo, sugiere que este genotipo muestra una elevada persistencia, y que ante cambios fisiológicos específicos producto de la pérdida del control glucémico pueden generar una rápida producción de fimbrias y, por ende, una acelerada progresión de la enfermedad periodontal.
Los factores de riesgo para DG, de acuerdo con diversos estudios, como son: historia familiar de diabetes, obesidad (IMC) y multiparidad37,38, los consideramos en función de la presencia de los genotipos fimA II y fimA IV, encontrando que la edad y la proporción de familiares de primer grado con diabetes fue mayor en las mujeres fimA II positivas de las embarazadas con DG; pero no se encontró diferencia de IMC; esto sugiere que más que la obesidad y la edad, los antecedentes familiares para diabetes están asociados al genotipo fimA II.
En conclusión, en este estudio encontramos una estrecha asociación entre el genotipo fimA II de P. gingivalis y mujeres con DG con mínima necesidad de atención periodontal.
Conflicto de intereses
Todos los autores declaran no tener conflicto de intereses de ninguna índole.
Agradecimientos
Los autores agradecen a las mujeres participantes en el presente estudio. Asimismo, agradecen al Dr. José Armando Robles Ávila, director del Hospital de la Mujer del estado de Aguascalientes y a los Dres. Fernando Cahuantzi Jardón, Daniel Ely Bravo Aguirre y Leopoldo Serrano Díaz, subdirector, jefe de Enseñanza y jefe de la institución mencionada por permitirles recolectar las muestras para este estudio.
En particular, agradecen profundamente a la Universidad Autónoma de Aguascalientes por los recursos otorgados a través del proyecto PIBB-10N.
Recibido el 2 de octubre de 2013
y aceptado el 27 de marzo de 2014
* Autor para correspondencia.
Correo electrónico:gtzrafael@hotmail.com (R. Gutiérrez Campos).