Reportamos la asociación entre el polimorfismo de nucleótido simple de IL-10-592C/A (rs1800872) y la detección/abundancia relativa de los periodontopatógenos Porfiromonas gingivalis, Tenerella forsythia, Treponema denticola y Aggregatibacter actinomycetemcomitans. Además investigamos la influencia de los determinantes genéticos y microbiológicos en los niveles de expresión de IL-10 en lesiones periodontales.
MetodologíaFueron reclutados 117 pacientes con periodontitis crónica y 58 controles. Luego del examen clínico fueron obtenidas muestras microbiológicas y la presencia/carga bacteriana de especies de periodontopatógenos fue cuantificada por RT-PCR. El genotipo para IL-10-592C/A fue determinado mediante restriction fragment length polymorphism.
ResultadosLa distribución alélica del SNP rs1800872 en la población investigada cumplió con el equilibrio de Hardy-Weinberg (p=0,64). Como ya ha sido reportado, los sujetos polimórficos demostraron menor expresión de IL-10 y riesgo aumentado de sufrir periodontitis crónica. El polimorfismo IL-10-592C/A no demostró relación con la detección o carga bacteriana de ninguna de las bacterias investigadas, además los niveles de expresión de IL-10 no fueron influenciados por el perfil microbiológico, sino que se correlacionaron directamente con el genotipo para el polimorfismo IL-10-592C/A.
A study was conducted to investigate the possible influence of the single nucleotide polymorphism (SNP) IL-10-592C/A on the occurrence and load of the periodontal pathogens: P. gingivalis, T. forsythia, T. denticola and A. Actinomycetemcomitans; as well to investigate the influence of microbial and genetic factors on the modulation of local IL-10 mRNA levels.
MethodologyThe study included 117 cases and 58 controls. After clinical examination microbiological samples were obtained and the detection/quantification of the target bacterial species was performed by RT-PCR. SNP rs1800872 was assayed by restriction fragment length polymorphism (RFLP).
ResultsAllele distribution of rs1800872 was in Hardy-Weinberg equilibrium (P=64). As previously reported, polymorphic subjects demonstrated decreased IL-10 expression and increased risk of suffering chronic periodontitis. IL-10-592C/A rs1800872 SNP was not associated with the detection or the bacterial load of the investigated pathogens. Moreover, the presence/load of bacteria at periodontal sites did not influence IL-10 expression, which was determined by the genetic background of the study subjects. IL-10-592C/A SNP was not associated with detection/bacterial load of pathogenic bacteria. IL-10 expression levels were determined by the genetic background and were independent of the bacterial microenvironment.
La periodontitis es una enfermedad infecciosa en la que la respuesta inmunológica desregulada de un hospedero susceptible desencadena la destrucción progresiva e irreversible de los tejidos de soporte dentarios. Los eventos patológicos característicos de la periodontitis son el resultado de la compleja interacción entre las bacterias, la respuesta inmune del hospedero y los mecanismos de homeostasis de los tejidos de soporte. Además, la susceptibilidad a la periodontitis se encuentra influenciada por determinantes genéticos y ambientales que generan un fenotipo individual de riesgo1. Estudios en gemelos han determinado que hasta un 50% de la diferencia individual en susceptibilidad a la periodontitis podría encontrarse bajo influencia genética2. Los genes candidatos más estudiados son los relacionados con las diferentes etapas de la respuesta inmune a la infección, dado que los eventos destructivos del tejido de soporte periodontal ocurren principalmente por la exacerbación de los mecanismos inmunes de control de la infección1. La IL-10 es la citoquina característica del patrón de respuesta adaptativa de linfocitos T reguladores (Treg), caracterizada por poseer la capacidad de suprimir las respuestas adaptativas inflamatorias y la diferenciación de linfocitos T CD4+ hacia los linajes Th1, Th2 y Th17. Sin embargo, a pesar de su habilidad para suprimir las respuestas tipo Th2, la IL-10 fue considerada una citoquina característica de la respuesta Th2 antes del descubrimiento y caracterización del linaje de linfocitos Treg3. De forma interesante, actualmente se reconoce que puede existir una interrelación entre las respuestas Th2 y Treg (involucrando la secreción de IL-10), que resultaría en un estado de protección para la progresión de la destrucción tisular en modelos experimentales de periodontitis. En este sentido, es posible especular que la IL-10 podría ser un biomarcador de la respuesta efectora de ambos linajes de linfocitos CD4+ (Th2 y Treg)4.
La IL-10 es la principal citoquina supresora de las respuestas inmunes celulares y tiene el papel estratégico de determinar la finalización de las respuestas inmunológicas, devolviendo los tejidos a un estado de reposo3. Desde la perspectiva del metabolismo óseo, al analizar el papel de la IL-10 dentro del contexto del total de citoquinas expresadas durante la progresión de lesiones osteolíticas, es posible establecer que la expresión de IL-10 se correlaciona con la inactivación de los procesos destructivos y que sus niveles presentan una cercana asociación con los de osteoprotegerina y el marcador fenotípico de linfocitos Treg5. Por otro lado, aunque la IL-10 ha sido asociada con una disminución de la eficiencia de los mecanismos de control de la infección en algunas enfermedades6, la evidencia experimental en periodontitis crónica indica que el papel protector de IL-10 no interfiere con el control de la infección periodontal7. Por lo tanto, la abundancia relativa de IL-10 en los tejidos periodontales sería un factor protector para la pérdida ósea y la progresión de la enfermedad. En este contexto, la comprensión de los mecanismos que regulan los niveles de IL-10 en los tejidos periodontales se vuelve importante, ya que podría constituir un posible marcador de diagnóstico y progresión. En este mismo sentido, investigaciones previas de nuestro grupo indican que el polimorfismo IL-10-592C/A posee un efecto funcional asociándose a menor expresión de IL-10, que trae como consecuencia una modulación negativa de la expresión de osteoprotegerina y del inhibidor tisular de MMP TIMP-3 en sujetos portadores del alelo polimórfico (A). Estos niveles disminuidos de expresión de mediadores osteoprotectores predisponen a los sujetos polimórficos a un mayor riesgo de sufrir periodontitis crónica8.
A pesar de que el SNP IL-10-592C/A influencia los niveles de expresión de IL-10, estudios previos de nuestro grupo han demostrado que los periodontopatógenos (específicamente las bacterias pertenecientes al complejo rojo Pg, Tf y Td) poseen un efecto preponderante en la regulación de los niveles de citoquinas proinflamatorias9,10. De modo interesante, a pesar de la demostrada asociación entre las baterías periodontopatógenas putativas con la severidad, extensión y respuesta al tratamiento de la periodontitis crónica, también ha sido demostrado que la infección bacteriana por periodontopatógenos no solo estimula la expresión de citoquinas proinflamatorias, sino que ejerce un efecto estimulante en la expresión de mediadores antiinflamatorios (como IL-10)11,12. A pesar de lo anterior, hasta el momento ningún estudio ha investigado específicamente el rol de la infección por periodontopatógenos en la regulación de los niveles de expresión de IL-10 en la presencia o ausencia de variaciones genéticas polimórficas en IL-10-592C/A. Recientemente, estudios utilizando la estrategia de asociación de genoma completo (GWA) han establecido una relación entre determinantes genéticos y riesgo de infección específica por especies patógenas13. En este sentido, diversos estudios han establecido que las variaciones polimórficas del gen de IL-10 actúan como moduladores de la susceptibilidad del hospedero a la infección por diversas especies bacterianas14,15; sin embargo, hasta el momento ningún estudio ha asociado los patrones de infección por Pg, Tf, Td y Aa con las variaciones polimórficas en IL-10-592C/A.
Considerando toda la evidencia anteriormente citada, investigamos la influencia de la infección periodontal por bacterias del complejo rojo en asociación con las variaciones polimórficas de IL-10-592C/A (rs1800872) en la modulación de los niveles de expresión de IL-10 en lesiones periodontales. Adicionalmente, investigamos el efecto del polimorfismo IL-10-592C/A (rs1800872) en la frecuencia de detección y carga bacteriana de Pg, Tf, Td y Aa.
Materiales y métodoSelección de los participantesLos participantes fueron reclutados de la clínica de periodoncia de la Faculdade de Odontologia de Ribeirão Preto, Brasil. Todos los sujetos firmaron un consentimiento informado. El protocolo del estudio fue aprobado por el comité de ética local y cumplió estrictamente con las recomendaciones de la World Medical Association para la realización de investigación científica utilizando seres humanos. Una descripción detallada de los protocolos de reclutamiento, examinadores y criterios de inclusión ha sido publicada previamente16. Brevemente, todos los pacientes fueron examinados por un periodoncista experimentado, quien registró la posición de la encía, la profundidad al sondaje y el sangrado al sondaje en 6 sitios periodontales por diente, exceptuando los terceros molares. Los sujetos seleccionados para el grupo periodontitis crónica (n=117) debieron tener un mínimo de 14 dientes, por lo menos un diente por sextante, con profundidad al sondaje (PS)≥6mm, nivel de inserción clínica (NIC)≥4mm, sangrado al sondaje (SS)≥30% de los sitios examinados y requerir terapia periodontal quirúrgica en al menos un sextante. Los sujetos seleccionados para el grupo control (n=58) debieron tener un mínimo de 14 dientes, ningún sitio con PS≥3mm, NIC≤3mm, SS≤0% y requerir un procedimiento de alargamiento coronario por motivos restauradores en al menos un diente. Fueron excluidos de ambos grupos los sujetos diagnosticados de diabetes mellitus, fumadores, embarazadas o mujeres en periodo de lactancia, pacientes en tratamiento actual o en los últimos 6 meses con antibióticos o antiinflamatorios y aquellos que hubiesen recibido terapia periodontal en los últimos 2 años.
Cuantificación de interleucina 10 por real time PCR en biopsias gingivalesLas biopsias de tejido gingival fueron obtenidas durante la terapia periodontal quirúrgica en los pacientes del grupo periodontitis crónica (n=117) o procedimientos de alargamiento coronario en el grupo control (n=58). El ARN fue extraído del tejido utilizando TriZOL (Life Technologies, Grand Island NY, EE. UU.) siguiendo las instrucciones del fabricante. El ADNc fue sintetizado en una reacción de transcripción reversa utilizando 3μg de ARN mediante Superscript II (Gibco Life Technologies, Grand Island NY, EE. UU.). La detección cuantitativa del ARNm fue realizada en la plataforma RT-PCR MiniOpticon System (BioRad, Hercules CA, EE. UU.) sequence detection system utilizando el sistema SYBR-Green fluorescente de detección (Applied Biosystems, Warrington, Reino Unido).
Genotipificación para el polimorfismo IL-10-592C/A (rs1800872)El ADN fue extraído de frotis de células epiteliales obtenidos de la cara interna de la mejilla, con una secuencia de fenol/cloroformo y precipitación con sal/etanol8. Para realizar la identificación alélica del gen de IL-10 los fragmentos de ADN fueron amplificados utilizando un prímer en una reacción de PCR en volumen final de 25μl, incluyendo tampón PCR 10× (Promega Corporation, Madison WI, EE. UU.), MgCl2 (25mM), dNTPs (10mM), prímer (10pmol/ml), Taq polimerasa (2U) y 200ng de ADN. Las condiciones de amplificación fueron 95°C (5min), 40 ciclos 94°C (1min), 60°C (1min) y 72°C (1min); seguidos de un paso de extensión a 72°C (10min). Alícuotas del producto amplificado fueron sometidas a RFLP con Rsa I (Promega Corporation) y los productos fueron visualizados mediante electroforesis en gel de agarosa 2% teñido con 0,5μg/ml de bromuro de etidio.
Identificación y cuantificación de microorganismos mediante real time PCRAntes del procedimiento quirúrgico fue tomada una muestra del biofilm subgingival del sitio a ser intervenido y del sitio más profundo de cada sextante utilizando puntas de papel estéril ISO # 4017. El ADN bacteriano fue extraído de las muestras de biofilm utilizando el DNA Purification System (Promega Corporation). Las reacciones de RT-PCR fueron realizadas en la plataforma MiniOpticon System utilizando SybrGreen MasterMix, 5ng de DNA y prímers específicos descritos en detalle previamente17.
Análisis estadísticoLa normalidad de la distribución de las variables fue probada usando el ensayo de Shapiro-Wilk. Las características demográficas y parámetros clínicos fueron comparadas mediante el test exacto de Fisher y la prueba «t». El equilibrio de Hardy-Weinberg fue ensayado mediante la prueba Chi-cuadrado. La distribución genotípica y alélica fue comparada usando el test exacto de Fisher. La diferencia en la expresión de IL-10 fue comparada usando el ensayo ANOVA post hoc Bonferroni. Para la frecuencia de detección de Pg, Tf, Td y Aa en los diferentes genotipos fueron calculadas las OR y se estableció la significación de las diferencias con la prueba exacta de Fisher. Las diferencias en la carga bacteriana fueron probadas mediante el ensayo de Kruskal-Wallis. Las diferencias entre los niveles de expresión de IL-10 entre los diferentes genotipos en presencia o ausencia de infección específica fueron probadas mediante la prueba «t». Los análisis se realizaron en el programa Stata/SE v11.1 (College Station TX, EE. UU.) y para todos los ensayos se estableció un valor p<0,05 como estadísticamente significativo.
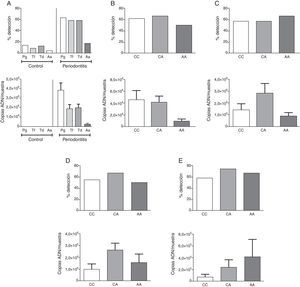
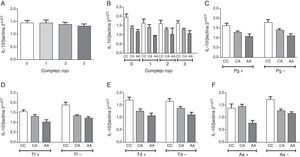
ResultadosLa descripción detallada de las características demográficas y clínicas de la población de estudio se encuentra en la tabla 1. Los individuos del grupo control fueron significativamente más jóvenes que los del grupo periodontitis crónica. De acuerdo a los criterios de inclusión la PS, NIC y SS fueron significativamente mayores en la población con periodontitis crónica respecto a los controles sanos. La muestra poblacional investigada, así como los subgrupos de los grupos control y periodontitis crónica cumplieron con la distribución alélica establecida por el principio de Hardy-Weinberg (p=0,64). La distribución genotípica en las poblaciones estudiadas demostró una proporción significativamente mayor de homocigotos ancestrales (CC) en el grupo control, así como también una proporción significativamente mayor de heterocigotos (CA) en el grupo de casos con periodontitis crónica. Respecto a la distribución alélica, los individuos del grupo control demostraron una mayor prevalencia del alelo ancestral (C) (tabla 1). Como previamente se ha reportado8, los individuos con periodontitis crónica presentando el alelo polimórfico (CA y AA) demostraron niveles disminuidos de expresión de IL-10 (tabla 2). Tanto la frecuencia de detección como el número de copias de ADN/muestra para cada una de las bacterias investigadas fue significativamente mayor en el grupo de pacientes con periodontitis crónica en relación con el control (fig. 1A). Las frecuencias de detección y cantidad relativa de Pg, Tf, Td y Aa en el grupo de sujetos con periodontitis crónica no demostró diferencias entre los diferentes genotipos del polimorfismo rs1800872 (fig. 1B-E). En la tabla 3 se presentan detalladamente las frecuencias de detección para cada uno de los microorganismos estudiados separadas por genotipo, tanto en el grupo control como en el grupo de pacientes con periodontitis crónica. No se observaron diferencias significativas para la frecuencia de detección al comparar homocigotos ancestrales (CC) con los individuos portadores del alelo polimórfico (CA+AA) en ninguno de los grupos. Por otro lado, los pacientes con periodontitis crónica demostraron un riesgo aumentado de infección por Pg, Tf, Td y Aa en relación con el grupo control (OR=10,36, p<0,001; OR=15,33, p<0,001; OR=11,33, p<0,001; OR=5,77, p<0,006, respectivamente). Los niveles de expresión de IL-10 no demostraron variaciones significativas al agrupar los pacientes según el número de microorganismos del complejo rojo (Pg, Tf y Td) detectados en la muestra (fig. 2A). Adicionalmente, al separar estos subgrupos según el genotipo para el polimorfismo rs1800872 no se observaron diferencias significativas en los niveles de expresión de IL-10 (fig. 2B). Finalmente, el nivel de expresión de IL-10 no demostró asociación con la detección de ninguno de los microorganismos estudiados de forma independiente (fig. 2C-F).
Características clínicas y demográficas de las poblaciones en estudio y distribución genotípica y alélica para el polimorfismo IL-10-592 C→A rs1800872 de las poblaciones en estudio
| Sano (n=58) | Periodontitis crónica (n=117) | Sano vs periodontitis crónica | |
|---|---|---|---|
| Distribución de género | 34m/24 f | 59m/58f | p=0,306 |
| Edad | 42,83±7,58 | 46,44±7,39 | p<0,05 |
| Profundidad de sondaje (PS) | 2,08±0,4 (mm) | 4,29±0,74 (mm) | p<0,001 |
| Nivel de inserción clínico (NIC) | 0,91±0,55 (mm) | 3,95±1,14 (mm) | p<0,001 |
| Sangrado al sondaje (SS) | 4,77±1,58 (%) | 62,68±11,76 (%) | p<0,001 |
| IL-10 -592 (C→A) rs1800872 | n (%) | n (%) | |
| CC | 27 (46,55) | 34 (29,06) | p<0,05 |
| CA | 23 (39,66) | 65 (55,56) | p<0,05 |
| AA | 8 (13,79) | 18 (15,38) | p=0,787 |
| Alelos | |||
| C | 77 (66,37) | 133 (56,83) | p<0,05 |
| A | 39 (33,62) | 101 (43,16) |
Expresión de IL-10 de acuerdo al genotipo para el polimorfismo IL-10-592 C→A rs1800872 en individuos con periodontitis crónica y controles sanos
| IL-10 -592 (C→A) rs1800872 | Sano (n=58) | Homocigoto ancestral vs polimorfos | Periodontitis crónica (n=117) | Homocigoto ancestral vs polimorfos |
|---|---|---|---|---|
| IL-10/βactina2ΔΔCT (media±DE) | IL-10/βactina2ΔΔCT (media±DE) | |||
| CC | 0,25±0,12 | 1,68±0,5 | ||
| CA | 0,26±0,18 | p>0,05 | 1,3±0,38 | p<0,001 |
| AA | 0,25±0,15 | p>0,05 | 1,08±0,31 | p<0,001 |
Frecuencia de detección y carga bacteriana de P. gingivalis, T. forsythia, T. denticola y A. actinomycetemcomitans en individuos del grupo control y los pacientes con periodontitis crónica (A). Frecuencia de detección y carga bacteriana en los diferentes genotipos del polimorfismo IL-10-592 C→A rs1800872 en pacientes con periodontitis crónica de P. gingivalis (B), T. forsythia (C), T. denticola (D) y A. actinomycetemcomitans (E).
Frecuencia de detección para los patógenos periodontales putativos Porfiromonas gingivalis, Tenerella forsythia, Treponema denticola y Aggregatibacter actinomycetemcomitans en los pacientes con periodontitis crónica y controles sanos de acuerdo al genotipo para el polimorfismo IL-10-592 C→A rs1800872
| Microorganismo | Control (n=58) | Periodontitis crónica (n=117) | Control vs periodontitis | |||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Negativo n, (%) | Positivo n, (%) | Valor de p* | OR* | Negativo n, (%) | Positivo n, (%) | Valor de p* | OR* | Valor de p** | OR* | |
| P. gingivalis | 50 (86,2) | 8 (13,8) | 0,06 | 0,37 | 44 (37,6) | 73 (62,4) | 0,55 | 1,03 | <0,001 | 10,36 |
| CC | 14 (51,8) | 13 (48,2) | 13 (38,2) | 21 (61,8) | ||||||
| CA | 15 (65,2) | 8 (34,8) | 22 (33,8) | 43 (66,2) | ||||||
| AA | 8 (100) | 0 (0) | 9 (50) | 9 (50) | ||||||
| CA+AA | 23 (74,2) | 8 (25,8) | 31 (37,3) | 52 (62,7) | ||||||
| T. forsythia | 53 (91,4) | 5 (8,6) | 0,22 | 3,85 | 47 (40,9) | 68 (59,1) | 0,49 | 1,09 | <0,001 | 15,33 |
| CC | 26 (96,3) | 1 (3,7) | 14 (42,4) | 19 (57,6) | ||||||
| CA | 21 (91,3) | 2 (8,7) | 27 (42,2) | 37 (57,8) | ||||||
| AA | 6 (75) | 2 (25) | 6 (33,3) | 12 (66,7) | ||||||
| CA+AA | 27 (87) | 4 (13) | 33 (40,2) | 49 (59,8) | ||||||
| T. denticola | 51 (87,9) | 7 (12,1) | 0,42 | 0,61 | 45 (39,1) | 70 (60,9) | 0,25 | 1,44 | <0,001 | 11,33 |
| CC | 23 (85,2) | 4 (14,8) | 15 (45,5) | 18 (54,5) | ||||||
| CA | 20 (86,9) | 3 (13,1) | 21 (32,8) | 43 (67,2) | ||||||
| AA | 8 (100) | 0 (0) | 9 (50) | 9 (50) | ||||||
| CA+AA | 28 (90,3) | 3 (9,7) | 30 (36,6) | 52 (63,4) | ||||||
| A. actinoactinomycetemcomitans | 56 (96,5) | 2 (3,5) | 0,71 | 0,87 | 97 (82,9) | 20 (17,1) | 0,44 | 1,27 | 0,006 | 5,77 |
| CC | 26 (96,3) | 1 (3,7) | 29 (85,3) | 5 (14,7) | ||||||
| CA | 22 (95,6) | 1 (4,4) | 53 (81,5) | 12 (18,5) | ||||||
| AA | 8 (100) | 0 (0) | 15 (83,3) | 3 (16,7) | ||||||
| CA+AA | 30 (96,8) | 1 (3,2) | 68 (81,9) | 15 (18,1) | ||||||
Nivel relativo de expresión de IL-10 en pacientes con periodontitis crónica. A. Estratificación según el número de especies del complejo rojo detectadas en la muestra. B. Subestratificación por genotipo para el polimorfismo IL-10-592 C→A rs1800872 en los grupos separados según el número de especies del complejo rojo detectadas en la muestra. C. Estratificación por genotipo y detección de P. gingivalis. D. Estratificación por genotipo y detección de T. forsythia. E. Estratificación por genotipo y detección de T. denticola. F. Estratificación por genotipo y detección de A. actinomycetemcomitans.
La IL-10 es la principal citoquina supresora de las respuestas inmunes, y en seres humanos ha sido demostrado que sus niveles se correlacionan inversamente a los parámetros clínicos de periodontitis18. Evidencia experimental apoya la evidencia obtenida en humanos y ha permitido establecer una relación causal en la que los niveles de IL-10 se asocian inversamente a la pérdida ósea en modelos animales de periodontitis5,7. Es en este contexto que se puede inferir que cualquier factor que ejerza una influencia en los niveles de IL-10 podría teóricamente afectar la presencia, severidad y/o extensión de la periodontitis. Previamente habíamos reportado que los individuos portadores de la forma variante del polimorfismo IL-10-592C/A presentaban niveles disminuidos de expresión de IL-10 y un riesgo aumentado de sufrir periodontitis crónica8. De forma interesante, la infección por bacterias del complejo rojo ha sido asociada con un aumento en la expresión de citoquinas proinflamatorias, pero también de IL-1011,12 y adicionalmente los polimorfismos del gen de IL-10 han sido asociados con la susceptibilidad a sufrir diversas infecciones14,15, estableciéndose una relación bidireccional entre ambas variables que hasta el momento no había sido investigada en pacientes con periodontitis crónica.
En primer lugar, los resultados del presente trabajo indican que los niveles de expresión tisular de IL-10 están determinados en mayor medida por el genotipo, y que la presencia/carga bacteriana de patógenos periodontales no ejerce un efecto significativo sobre la expresión de esta citoquina supresora. Desde la perspectiva de nuestro entendimiento actual de la patogénesis de la periodontitis parece razonable pensar que los periodontopatógenos del complejo rojo, clásicamente asociados a la ocurrencia, severidad y extensión de la periodontitis, estén directamente asociados con la producción de citoquinas proinflamatorias (consideradas clásicamente «destructivas»)9,10, y no se asocien fuertemente a la expresión de una citoquina con un papel eminentemente supresor y «protector», como la IL-10. Sin embargo, como ya fue mencionado anteriormente, estudios previos han demostrado que los periodontopatógenos pueden inducir la sobreexpresión de IL-10, tanto in vivo como in vitro11,12. En este contexto, nuestros resultados sugieren que la regulación de los niveles de expresión de la IL-10 se encuentra fuertemente influenciada por el perfil genético del hospedero, y que los estímulos microbiológicos, así como los mecanismos de regulación compensatorios del hospedero, solo desempeñarían un rol secundario19. Es así como en un artículo recientemente publicado se relevó la complejidad de los mecanismos regulatorios de IL-10, demostrando que varios tipos celulares pueden expresar IL-10 independientemente de los estímulos externos, mientras que en otras situaciones la intensidad o naturaleza de los estímulos tiene un efecto significativo en la expresión de IL-1019. Desde una perspectiva puramente teórica, la producción de IL-10 por parte del hospedero busca limitar el daño colateral producido por la respuesta inmune local para combatir la infección bacteriana19. De hecho, en muchas situaciones la expresión de citoquinas proinflamatorias e IL-10 ocurre simultáneamente, como un mecanismo de autorregulación inflamatoria19. Existe evidencia demostrando la asociación entre la expresión de citoquinas proinflamatorias (tales como IL-1β y TNF-α) con la expresión de las moléculas que directamente median la destrucción tisular en periodontitis (por ejemplo MMP y RANKL). Es en este sentido que la IL-10 puede ser considerada «protectora», limitando la destrucción tisular mediada por la respuesta inflamatoria a la infección, aunque por otro lado, sus efectos supresores generan una disminución en la capacidad de los mecanismos inmunes del hospedero, dificultando la eliminación de los microorganismos infectantes20. De modo interesante, algunos microorganismos poseen la capacidad de inducir selectivamente la secreción de IL-10 como parte de su batería de mecanismos de evasión de la respuesta inmune20,21. Aunque no existe evidencia específica en relación con mecanismos de evasión dependientes de IL-10 entre los patógenos del complejo rojo, un estudio reciente demostró que la respuesta inflamatoria a la infección simultánea por P. gingivalis y F. nucleatum se encuentra disminuida con relación a la inoculación de las bacterias en forma inviable, y que esta regulación negativa de la respuesta del hospedero se asocia a niveles aumentados de IL-10 e inhibición de la fagocitosis22. Estos hallazgos parecen mostrar que las variaciones en los niveles de IL-10, como los relacionados con el polimorfismo IL-10-592C/A SNP, podrían influir en el patrón de colonización microbiana subgingival. Sin embargo, nuestra evidencia apunta a que el genotipo para el polimorfismo IL-10-592C/A no ejerce ningún efecto en el perfil de infección subgingival. Es importante recordar que los efectos inmunosupresores de IL-10 han sido asociados a deficiencias en el control de infección en diversas enfermedades, sin embargo en todos los modelos experimentales anteriormente descritos la modulación de la expresión de IL-10 (vía inhibición o quimioatracción de Tregs) no ha demostrado asociación con la abundancia e infiltración tisular del patógeno Aa23 ni con aumento de los marcadores metabólicos de inflamación7. Esta evidencia experimental está de acuerdo con los resultados presentados, donde los portadores de los diferentes alelos para el SNP IL-10-592C/A no demostraron asociación con cambios en la frecuencia de detección o carga bacteriana de los periodontopatógenos investigados. Es en este contexto que presentamos la hipótesis de que las variaciones en los niveles de IL-10 no ejercen influencia en el patrón de infección subgingival por Pg, Tf, Td y Aa. En este sentido, ha sido previamente demostrado que genotipos/fenotipos hiperinflamatorios sufren una destrucción periodontal más severa, sin que ello se traduzca en una mayor eficiencia en el control de la infección periodontal24. Desde otra perspectiva esto significa que sujetos con un genotipo/fenotipo hipoinflamatorio sufren menor destrucción periodontal, sin ver afectada su capacidad de controlar la infección periodontal24. En este modelo podríamos evidenciar que los sujetos portadores del alelo ancestral para el polimorfismo IL-10-592C/A responderían a la definición de genotipo/fenotipo hipoinflamatorio. A pesar de lo anteriormente expuesto, es importante considerar que solo un número limitado de bacterias consideradas patógenos periodontales «clásicos» fue investigado y que la ecología subgingival es más compleja, incluyendo numerosas especies con posible efecto modulador de la respuesta del hospedero. De hecho, una emergente línea de evidencia sugiere que la presencia y abundancia relativa de bacterias benéficas podría constituir un factor protector para el desarrollo y progresión de la periodontitis. En esta perspectiva el estímulo inicial que desencadenaría la respuesta inmune sería el desbalance ecológico provocado por el aumento relativo de patógenos en detrimento de la flora comensal benéfica25. Dado el profundo efecto supresor de la IL-10 y su rol estratégico en el control de las respuestas inmunes, resulta posible pensar que sus niveles de expresión estén robustamente regulados y no se encuentren sometidos a la influencia de múltiples estímulos ambientales. La evidencia presentada soporta la idea de que los niveles de expresión de IL-10 en los tejidos periodontales responden principalmente a un programa genético y que variaciones polimórficas afectando la región promotora del gen de IL-10 podrían tener un importante efecto como determinantes de riesgo para la periodontitis crónica, siendo independientes de la presencia y carga bacteriana de periodontopatógenos. La principal debilidad del presente estudio es el limitado tamaño de la muestra, lo que dificulta la generalización de sus resultados a otras poblaciones. Estudios de replicación con poblaciones mayores son necesarios para comprobar los resultados aquí presentados. En este artículo reportamos que la expresión de IL-10 se encuentra significativamente influenciada por el polimorfismo IL-10-592C/A, donde los portadores del alelo A demuestran niveles disminuidos de la citoquina. La expresión de IL-10 no es afectada por la presencia ni carga bacteriana de Pg, Tf, Td y Aa, sugiriendo que su regulación es independiente de las alteraciones de la ecología subgingival.
FinanciaciónLa investigación fue financiada con fondos del Fundo de Amparo a Pesquisa do Estado de São Paulo y del Conselho Nacional de Desenvolvimento Cientifico e Tecnológico.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Agradecemos la financiación de la investigación al Fundo de Amparo a Pesquisa do Estado de São Paulo y al Conselho Nacional de Desenvolvimento Cientifico e Tecnológico.