El síndrome linfoproliferativo postrasplante es una complicación que se presenta con una baja incidencia en los pacientes que han sido trasplantados. Sin embargo, si el diagnóstico y manejo no son oportunos su mortalidad es alta. Por esta razón el radiólogo debe estar atento al diagnóstico al interpretar estudios de este tipo de pacientes, especialmente en el año siguiente al trasplante. Presentamos el caso de una paciente con antecedente de trasplante renal y síndrome linfoproliferativo postrasplante con afección del sistema nervioso central.
Post-transplantation lymphoproliferative disorder is a low incidence complication of transplant recipient patients. However, mortality is high if the diagnosis and management are not appropriate. For this reason the radiologist should be aware when dealing with images of these patients, particularly in the first year following the transplantation. In this article the case is presented of a woman who was recipient of a kidney, and developed post-transplantation lymphoproliferative disorder, affecting the central nervous system.
El síndrome linfoproliferativo postrasplante (SLPT) es una complicación rara pero potencialmente letal que pueden padecer los pacientes que han sido sometidos a trasplantes1. El radiólogo debe tener en cuenta esta afección a la hora de enfrentarse a un paciente con antecedente de trasplante, ya que ejerce un papel fundamental en el diagnóstico temprano de la entidad. Su rol se extiende también a la guía para la toma de la biopsia y así saber el subtipo histológico, lo cual va a llevar a un tratamiento adecuado, mejorando la sobrevida y la calidad de vida de estos pacientes. Por último, el radiólogo desempeña también una función importante en el seguimiento y evaluación de la respuesta a la terapia. Presentamos el caso de una mujer con SLPT renal con compromiso del sistema nervioso central.
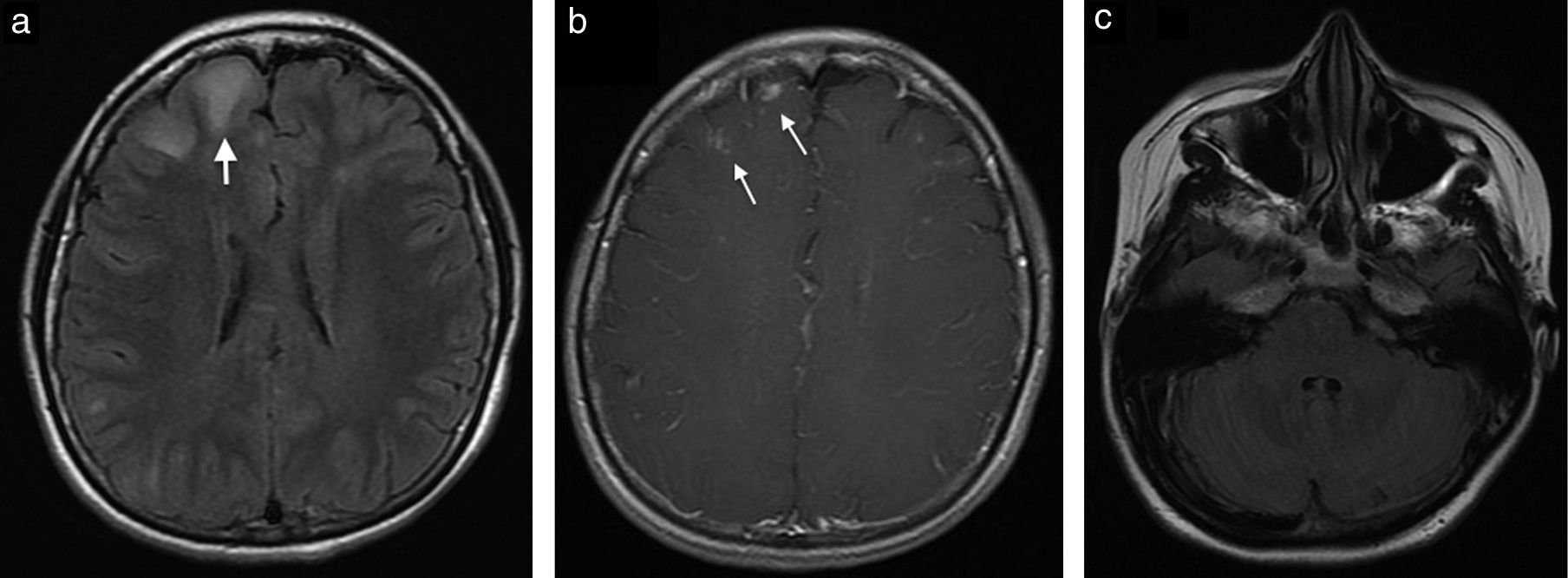
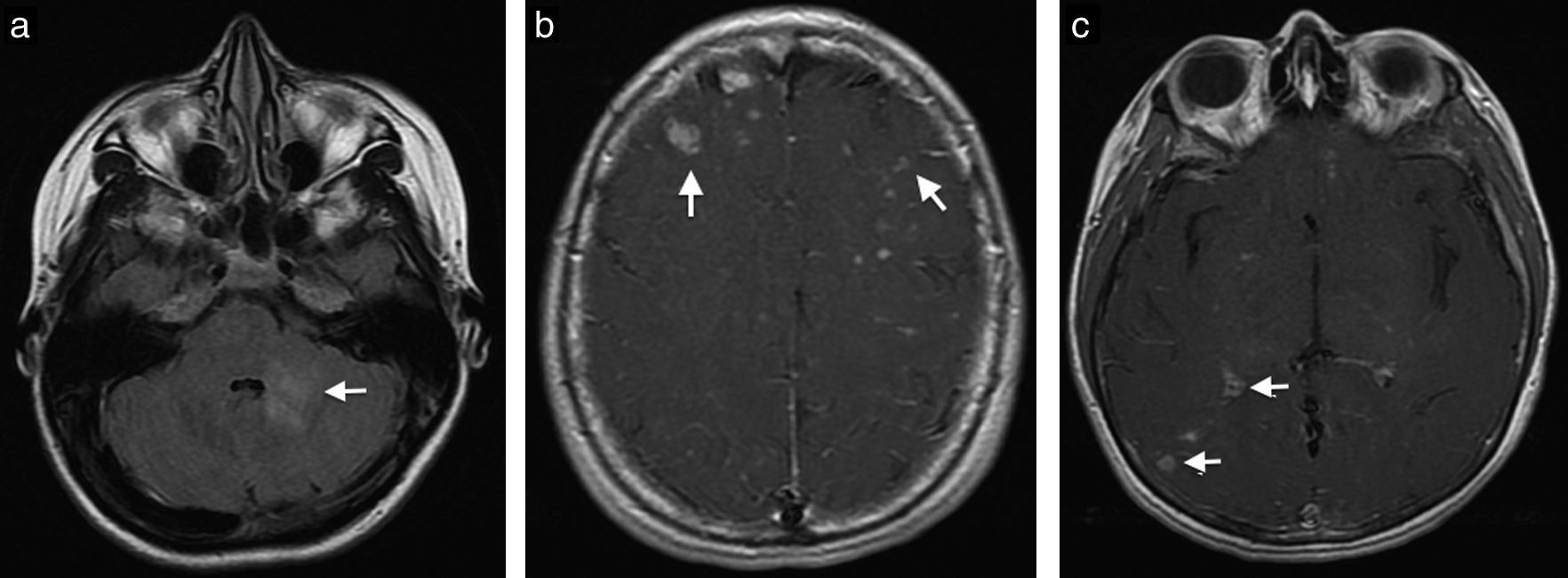
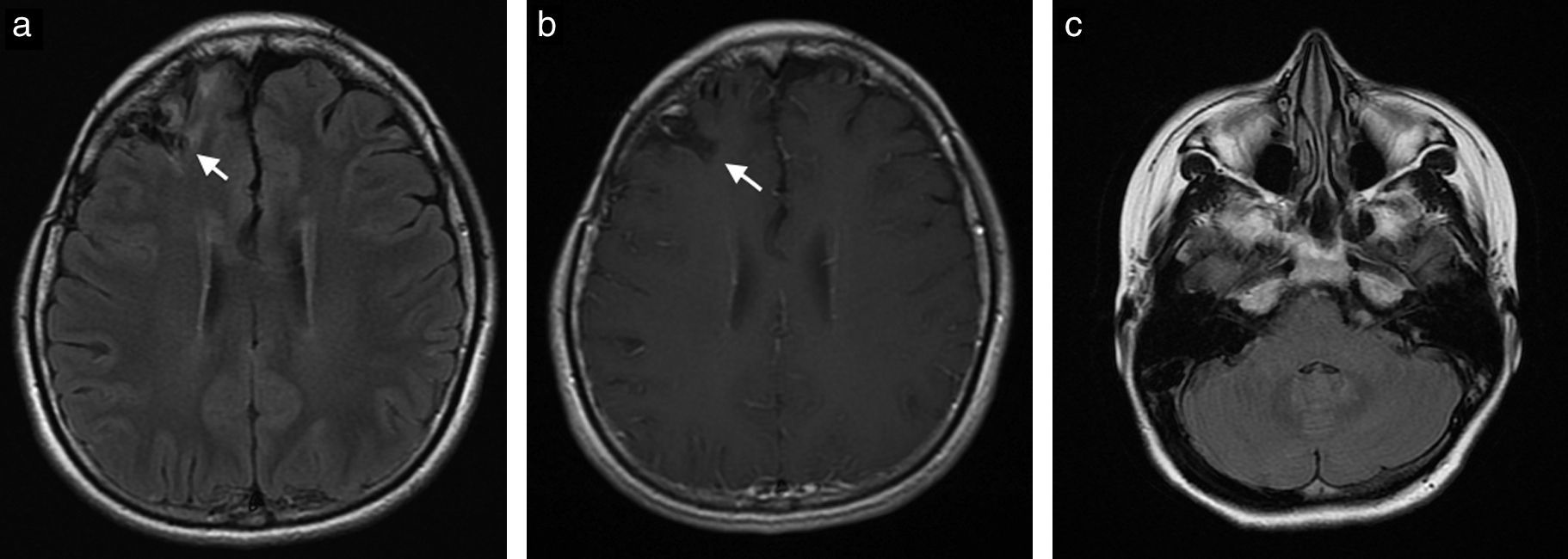
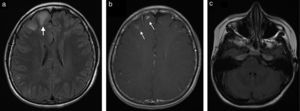
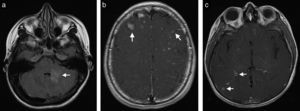
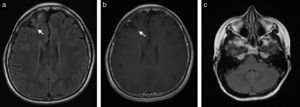
Caso clínicoPaciente de sexo femenino de 22 años de edad con diagnóstico desde los 15 años de lupus eritematoso sistémico, con nefropatía lúpica, quien requirió trasplante renal de donante cadavérico 10 meses antes de la consulta; desde entonces estaba con terapia inmunosupresora con tacrolimus 7mg al día, micofenolato 720mg 2 veces al día y prednisona 10mg interdiarios. Hasta el momento de la consulta no había presentado ninguna complicación postrasplante. Llega al Servicio de Urgencias por cuadro clínico de una semana de evolución de cefalea intensa, náuseas y visión borrosa. Se realiza una resonancia magnética (RM) cerebral, que muestra en secuencias potenciadas en T2 y FLAIR hiperintensidades en la unión corticosubcortical frontal bilateral (fig. 1a), y en las secuencias T1 con medio de contraste, un realce nodular, mal definido (fig. 1b). No hay compromiso de la fosa posterior (fig. 1c), tampoco restricción de la difusión ni residuo hemático. Dados los antecedentes de la paciente y las características de las lesiones se considera como primera posibilidad un proceso vasculítico, por lo que se realiza angiografía por sustracción digital, la cual es normal. También se considera como posibilidad diagnóstica una infección por germen oportunista, posiblemente toxoplasmosis, por lo que se inicia manejo antibiótico y antifúngico. La paciente presenta una evolución tórpida y el reporte del líquido cefalorraquídeo es negativo para proceso infeccioso. Se realizan otros exámenes, entre los que se encuentran anticuerpos antivirus de Epstein-Barr positivos. La RM de control a los 10 días demuestra un aumento en el número de lesiones en localización cortical, subcortical, ganglios basales, mesencéfalo y cerebelo, y numerosos focos de captación de contraste nodular, anular e irregular (fig. 2a, b y c). Considerando la posibilidad de infección por germen atípico o proceso linfoproliferativo se decide finalmente realizar a la paciente biopsia de las lesiones cerebrales. El reporte de anatomía patológica informa una infiltración por neoplasia de linfocitos B maduros compatibles con el diagnóstico de SLPT. Se decide suspender el tratamiento inmunosupresor e iniciar terapia biológica con timoglobulina. La paciente presenta una adecuada evolución clínica; se realiza una nueva RM cerebral al año de iniciado el cuadro, que muestra la resolución de la mayoría de las lesiones (fig. 3a, b y c).
a. Axial T2 FLAIR. Se identifican múltiples lesiones hiperintensas de localización subcortical y yuxtacortical de predominio en el hemisferio cerebral derecho, la mayor de estas lesiones de localización frontal con un diámetro de 22mm (flecha). b. Axial T1Gd. Se demuestran 2 lesiones con realce nodular, mal definido de localización subcortical en el lóbulo frontal derecho (flechas). c. Axial T2 FLAIR. Fosa posterior sin evidencia de lesiones en la RM inicial.
a. Axial T2 FLAIR. Se observan 2 lesiones hiperintensas que comprometen el hemisferio y el pedúnculo cerebeloso medio izquierdo (flechas). b. Axial T1Gd. Múltiples lesiones que realzan con el contraste en los lóbulos frontales de localización subcortical (flechas) principalmente. c. Axial T1Gd. Se observan múltiples lesiones que realzan con el contraste, redondeadas, algunas de ellas en diana y otras irregulares, de localización subcortical en el lóbulo temporal derecho (flechas).
a y b. Axial T2 FLAIR y axial T1Gd. RM de control un año después del tratamiento con quimioterapia. Área de gliosis frontal derecha secundaria a biopsia (flecha) sin que se identifiquen lesiones hiperintensas ni la captación anormal de contraste visualizadas previamente. c. Axial T2 FLAIR. Un año tras el tratamiento con quimioterapia. No se observan las lesiones hiperintensas visualizadas previamente en el hemisferio y pedúnculo cerebeloso medio izquierdo.
El SLPT es una complicación rara pero potencialmente letal que presentan los pacientes con trasplante de algún órgano. En la literatura están reportadas diferentes incidencias según el órgano trasplantado, siendo la más alta en los trasplantes multiviscerales (13-33%), seguida por un 7-11% para los trasplantes de intestino, un 9% en los de corazón y pulmón, un 3,4% en los de corazón. un 2,2% para los de hígado y un 1% en los de riñón en la población adulta2,3 y hasta del 4% en los niños4. La prevalencia es mayor en los 12 meses siguientes al trasplante5, especialmente en trasplantes de intestino, pulmón y pulmón-corazón, por recibir terapia de inducción inmunosupresora más intensiva3.
La mayoría de los SLPT se asocian a infección por el virus de Epstein-Barr, que ingresa en los linfocitos B induciendo en ellos proliferación policlonal difusa, al encontrarse el huésped inmunosuprimido. La respuesta es excesiva, resultando en un amplio espectro de desórdenes linfoproliferativos, desde hiperplasia linfoide benigna hasta linfoma monoclonal maligno. Otros factores de riesgo involucrados son: infección por citomegalovirus y la terapia inmunosupresora combinada, más que un medicamento en particular1,3,6.
La clasificación histopatológica del síndrome linfoproliferativo postrasplante más usada es la de la Organización Mundial de la Salud que lo divide en 4 categorías: lesiones tempranas, SLPT polimórfico, SLPT monomórfico y otros tipos7.
La primera se caracteriza por hiperplasia plasmocítica reactiva; la segunda, por destrucción de la arquitectura linfoide, necrosis y atipia nuclear. En el SLPT monomórfico más del 80% de los casos se origina de células B, presentándose con mayor frecuencia el linfoma difuso de células B. El último subtipo abarca en su mayoría lesiones similares a los linfomas de Hodgkin7.
El diagnóstico histopatológico requiere de biopsia de tejido para una evaluación completa, resaltando la importancia del diagnóstico imagenológico y la biopsia guiada por imágenes3,6.
La presentación clínica más frecuente es la aparición de fiebre, existiendo un compromiso extranodal en más de dos tercios de los casos, especialmente en los pacientes con trasplantes de intestino delgado y pulmón, pudiendo tener masas únicas o múltiples en cualquier órgano1. Los signos y síntomas varían dependiendo del sitio de la lesión; la cavidad abdominal se compromete en un 50 a un 75% de los casos de SLPT, afectando principalmente el tracto gastrointestinal y el hígado3. El sistema nervioso central se compromete entre el 20 y 30%8,9. En los pacientes con trasplante renal se ha reportado una incidencia de un 11,7% de afección del sistema nervioso central8, pudiendo ser el único sitio de manifestación de la enfermedad6.
En los pacientes que han sido trasplantados de órganos sólidos son frecuentes las complicaciones neurológicas por infecciones oportunistas, neurotoxicidad farmacológica y neoplasias secundarias. Los pacientes pueden comenzar con convulsiones, focalización neurológica o alteración del estado mental, por lo que la RM cerebral y de médula espinal junto con la punción lumbar son fundamentales para la aproximación diagnóstica. Las lesiones del sistema nervioso central se distribuyen, por orden de frecuencia, en los hemisferios cerebrales (81%), principalmente como masas solitarias periventriculares y de la sustancia blanca subcortical; en el bulbo raquídeo (15%), y en el cerebelo (4%)10.
Aunque estas características, ya sea en la tomografía computarizada o en la RM, no sean específicas y puedan, entre otras, simular linfomas cerebrales por síndrome de inmunodeficiencia adquirida, en el contexto de un paciente con antecedente de trasplante se debe considerar el SLPT dentro de los diagnósticos diferenciales5,6.
Los hallazgos en imágenes incluyen hemorragia, necrosis y realce en anillo5,10,11. En la tomografía computarizada sin contraste las lesiones son hiperdensas debido a la hipercelularidad o la hemorragia. La RM puede ser de baja intensidad o isointensa al parénquima en secuencias potenciadas en T1, o con alta intensidad de señal según el tiempo de evolución del sangrado. En las secuencias con potenciación T2 las lesiones presentan baja intensidad de señal debida a hipercelularidad, con áreas focales de alta intensidad de señal, que reflejan necrosis del tejido. Tras la administración del medio de contraste se observa realce en anillo. Usualmente están rodeadas de edema vasogénico5. Se observa restricción en la difusión y en la espectroscopia es común un pico elevado de colina y lactato y una reducción significativa de N-acetil aspartato12. Estas características no siempre facilitan la diferenciación con gliomas intraaxiales o neuroinfecciones como la toxoplasmosis, por lo que es necesaria la biopsia estereotáxica para la confirmación histopatológica13.
Recientemente, Camacho et al., en un trabajo conjunto entre la Universidad Emory de Atlanta y la Fundación Santa Fe de Bogotá, han propuesto una clasificación imagenológica de la enfermedad, dividiéndola en 2 grandes categorías: nodal y extranodal. El primer grupo hace referencia a linfadenopatías y se subdivide según la localización en mediastínica y retroperitoneal. El compromiso extranodal se clasifica, según los órganos afectados, en el tracto gastrointestinal, órganos sólidos y el sistema nervioso central. Con esta clasificación se pretende hacer una aproximación diagnóstica más acertada12.
No hay un consenso sobre el tratamiento; sin embargo, la primera línea consiste en disminuir la dosis de los inmunosupresores14. La respuesta ocurre en las siguientes 2 a 4 semanas, según el subtipo histológico3. La variante polimórfica usualmente responde adecuadamente, a diferencia de la monomórfica, cuya respuesta es escasa o nula, teniendo una alta tasa de mortalidad, por lo que está indicada la quimioterapia14. Cuando hay afección del sistema nervioso central hay una mayor resistencia a los agentes de quimioterapia por la baja permeabilidad de la barrera hematoencefálica al medicamento, por lo que se usan altas dosis de metotrexato9. Se ha reportado el uso de radioterapia localizada; sin embargo, la primera elección debe ser modular los agentes inmunosupresores3,9.
El pronóstico de la enfermedad varía según el subtipo histológico y el compromiso clínico del paciente, con tasas estimadas de sobrevida de entre el 25 y el 60%6.
ConclusionesEn los últimos años se ha presentado un aumento en la realización de trasplantes de órganos, y acompañando a esto, un mejoramiento de las terapias inmunosupresoras y la aparición de nuevas entidades patológicas antes desconocidas, como el SLPT. Un tratamiento tardío de estos pacientes conlleva un aumento en la morbimortalidad. Por esto es fundamental para el radiólogo y el clínico tener presente esta entidad, ya que sus manifestaciones clínicas e imagenológicas suelen ser atípicas y, por ende, pueden constituir un reto diagnóstico.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.