A pesar del avance en el tratamiento del cáncer en pediatría, en Chile el 15% de niños fallece por progresión de la enfermedad, siendo el dolor el síntoma más importante en esta etapa. Las pautas de la OMS demuestran que los opiáceos son fundamentales para controlar el dolor, sin embargo aún existe resistencia a su utilización.
ObjetivoDescribir la experiencia en el uso de opiáceos para el manejo del dolor en pacientes pediátricos con cáncer avanzado en cuidados paliativos (CP).
Pacientes y métodoEstudio retrospectivo de datos registrados en fichas clínicas de pacientes oncológicos ingresados en el Programa de CP, Hospital de Niños Dr. Roberto del Río entre los años 2002 y 2013. Se analizaron datos demográficos, diagnóstico oncológico, intensidad del dolor al ingreso y egreso según escalas validadas. Se registró el uso de antiinflamatorios no esteroideos, opiáceos débiles, opiáceos fuertes, fármacos coadyuvantes, efectos secundarios por uso de morfina y necesidad de sedación paliativa.
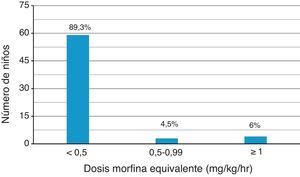
ResultadosSe analizaron 99 fichas médicas, 64,6% de hombres, mediana de 8 años, distribución similar en grupos de enfermedades oncológicas. Al ingreso un 43,4% manifestó de dolor intenso a severo y al egreso solo 4 pacientes, pero con EVA máxima de 7 solo en un caso. De 66 pacientes que utilizaron opiáceos fuertes el 89% requirió menos de 0,5mg/kg/h de morfina. El estreñimiento fue el efecto secundario más frecuente. Un 77% recibió algún fármaco coadyuvante para el manejo del dolor: 40 utilizaron corticoides, 11 benzodiacepinas y en 25 casos combinación de estos fármacos, incluyendo el uso de gabapentina en 7 casos.
ConclusionesDos tercios de los pacientes requirieron opiáceos fuertes, logrando un adecuado control del dolor, sin observar complicaciones severas. El uso de opiáceos en este grupo de pacientes, siguiendo un protocolo, es efectivo y seguro.
Despite advances in the treatment of cancer in paediatric patients, 15% of children die from the illness progression in Chile, and pain is the most significant symptom in advanced stages. Although the World Health Organization guidelines demonstrate that opioids are fundamental in pain management, there is still resistance to their use. The main objective of this article was to describe the experience in the use of opioids for pain management in paediatric patients with advanced cancer in palliative care (PC).
Patients and methodRetrospective study of patients admitted into the PC Program at the Hospital Roberto del Río between 2002 and 2013. Analysis was carried out on demographic data; oncological diagnosis; pain intensity on admission and discharge, according to validated scales; use of non-steroidal anti-inflammatory drugs; weak opioids; strong opioids; adjuvants drugs; the presence of secondary effects resulting from the use of morphine, and the need for palliative sedation.
ResultsOf the 99 medical records analysed, the median age was 8 years, 64.6% were male, and there was a similar distribution in three oncological diagnosis groups. Upon admission, 43.4% presented intense to severe pain, and upon discharge there were four patients, but with a maximum VAS score of 7 in only one case. Of the 66 patients taking strong opioids, 89% required less than 0.5mg/kg/hr. Constipation was the most frequently observed secondary effect.
ConclusionsTwo thirds of the patients studied required strong opioids, with which adequate pain management was achieved, with no serious complications observed. The use of opioids in this group of patients, following a protocol, is considered effective and safe.
Actualmente en Chile los niños con cáncer presentan una sobrevida a 5 años del 75%, similar a lo que se observa en países desarrollados. En nuestro país la incidencia anual de cáncer infantil es de 480 a 520 casos, falleciendo 80 a 85 niños por progresión de su enfermedad oncológica. El 2003 se organizó el programa de alivio del dolor (AD) y cuidados paliativos (CP) para niños con cáncer avanzado, dependiente del Ministerio de Salud de Chile. Este programa consiste en una red de atención a lo largo del país, con equipos capacitados en CP que trabajan incluidos en las unidades de oncología pediátricas de los hospitales públicos de Chile, utilizando protocolos de manejo del dolor, consensuados y basados en evidencia nacional e internacional1.
El dolor es el síntoma más importante y frecuente en el paciente pediátrico oncológico, produciendo mucho temor en el niño, la familia y el equipo de salud. En las etapas avanzadas de la enfermedad la incidencia del dolor es mucho más alta, requiriendo manejo farmacológico en el 90% de los casos2–5.
El tratamiento farmacológico constituye un pilar fundamental para el manejo del dolor por cáncer. Según las recomendaciones de la Organización Mundial de la Salud (OMS) del año 2012, los opiáceos fuertes, como la morfina, deben ser utilizados en los niños que presenten dolor moderado a severo, ya que el uso de opiáceos débiles, como la codeína, no asegura un control adecuado del dolor moderado, debido a la importante variabilidad genética en su biotransformación2,6,7.
La prescripción de la morfina requiere una valoración individual de la dosis, utilizando escalas de evaluación del dolor validadas para niños, debido a que no existe una dosis máxima límite para cada paciente. El principio fundamental consiste en aumentar la dosis hasta obtener la máxima analgesia con los mínimos efectos adversos. La morfina sigue siendo el opiáceo fuerte más utilizado para el manejo de dolor moderado a severo en CP por cáncer, además es el fármaco que posee más evidencia científica que respalda su uso3–5,7–11.
En nuestro medio no existen publicaciones en relación con el uso de opiáceos en pacientes pediátricos con cáncer avanzado sin posibilidad de curación, y persiste todavía en la práctica clínica cierta resistencia a su indicación y uso entre los familiares y los equipos de salud que atienden niños5. El objetivo de este estudio es describir la experiencia en la utilización de opiáceos para el manejo del dolor en pacientes con cáncer avanzado en CP.
Pacientes y métodoEstudio retrospectivo, de serie de casos, a partir de la recolección de los datos registrados en las fichas clínicas de pacientes con cáncer en etapa avanzada que ingresaron en el Programa de AD y CP del Hospital de Niños Dr. Roberto del Río entre enero de 2002 y diciembre de 2013, y que fueron atendidos por el equipo de CP de este centro hasta su fallecimiento.
Se incluyeron todos los niños que se encontraban en tratamiento activo en algún protocolo oncológico o posterior a trasplante de progenitores hematopoyéticos y que requirieron CP10,11. Todos los pacientes que recibieron protocolos de tratamiento oncológico tenían consentimiento informado firmado por sus padres o tutores, y en estos consentimientos se incluyó la posibilidad de ingreso en el programa de AD y CP, si la evolución de la enfermedad lo requiriera. Los consentimientos informados fueron aprobados por el Comité de Ética de Investigación del Hospital y del Servicio de Salud Metropolitano Norte.
Se registraron las siguientes variables: edad, sexo, diagnóstico oncológico de base categorizado en 3 grupos (leucemia aguda, tumores de sistema nervioso central y tumores sólidos); los días de permanencia en CP y el lugar de fallecimiento.
La intensidad del dolor al ingreso en CP y al egreso o fallecimiento fue evaluada por medio de escalas, según la edad del paciente: escala de Face, Legs, Activity, Cry, Consolability (FLACC), Escala de caras o Escala visual análoga (EVA), incluidas en el protocolo nacional, y fue el paciente o su cuidador principal, educado por el equipo, quien otorgó puntuación de 0 a 10 (0: sin dolor, 1-2: dolor leve, 3-4: dolor moderado, 5-6: dolor intenso y 7-10: dolor severo)10.
En relación con el tratamiento farmacológico se registró el uso de antiinflamatorios no esteroideos (paracetamol, ibuprofeno, ketoprofeno), uso de opiáceos débiles (codeína, tramadol) y en los casos en que se utilizaron opiáceos fuertes se registró el tipo, la vía de administración (morfina intravenosa, subcutánea u oral, fentanilo intravenoso y metadona oral), la dosis inicial y final requerida. La dosis de morfina total utilizada en 24h se registró como mg/kg/hora. Como las dosis son individuales y no existe dosis máxima preestablecida, se categorizaron las dosis máximas utilizadas en 3 grupos: menor a 0,5; entre 0,5 a 0,99 y mayor o igual a 1mg/kg/h. Estos grupos se definieron operacionalmente, considerando lo descrito en la literatura, donde se establece como dosis masiva de opiáceos aquella mayor a 3mg/kg/h, lo que corresponde aproximadamente a 100 veces la dosis estándar de inicio de infusión continua10–13.
El aumento de las dosis de morfina se realizó utilizando las directrices que aparecen en la pauta de la OMS y en el protocolo nacional. La modalidad de administración consiste en que, a partir de una dosis inicial calculada según la edad y el peso del niño, se evalúa periódicamente la necesidad de dosis de rescate requeridas en 24h para modificar la dosis horaria o la dosis diaria en caso de infusión continua endovenosa o subcutánea5,9,10.
En cada caso se consignaron los efectos secundarios observados o descritos por el paciente o los cuidadores principales, el uso de fármacos coadyuvantes (benzodiacepinas y/o corticoides) y la necesidad de sedación paliativa, que se define como la administración de la asociación de morfina y midazolam, en infusión continua endovenosa o subcutánea, con el fin de disminuir el estado de conciencia del paciente para el manejo del dolor u otro síntoma que no logra ser controlado con tratamientos habituales14–16.
Para la descripción de las variables cuantitativas se consideró su distribución normal, para lo cual se aplicó la prueba de Shapiro-Wilk. Al no presentar esta distribución fueron descritas con mediana y rango intercuartílico. Las variables cualitativas fueron descritas con frecuencias absolutas y relativas. Por tratarse de un estudio descriptivo no se exploró asociaciones de variables. El análisis estadístico fue realizado con el programa Stata 12 y las tablas fueron confeccionadas en Microsoft Word.
ResultadosLa muestra obtenida fue de 114 pacientes incluidos en el Programa de AD y CP, de los que se excluyeron 15 casos por registro incompleto de datos, obteniéndose un total de 99 casos para el análisis. De las 99 fichas médicas analizadas el 64,6% de los pacientes eran de sexo masculino, mediana de edad 8 años y mediana de permanencia en CP de 38 días. Los diagnósticos oncológicos de base fueron: 39 pacientes con tumores del sistema nervioso central, 34 con leucemia aguda y 26 con tumores sólidos. En relación con el lugar de fallecimiento en el 50,5% de los casos este sucedió en el domicilio del niño (tabla 1).
Características clínicas y demográficas pacientes pediátricos oncológicos en CP (n=99)
| Variable | |
|---|---|
| Edad (años) | |
| Mediana | 8 |
| Rango intercuartílico | 4,08-11,91 |
| N (%) | |
|---|---|
| Sexo | |
| Masculino | 64 (64,6) |
| Femenino | 35 (35,4) |
| Diagnóstico oncológico | |
| Tumor SNC | 39 (39,4) |
| Leucemia aguda | 34 (34,3) |
| Tumores sólidos (no tumores del SNC) | 26 (26,3) |
| Permanencia en CP (días) | |
| Mediana | 38 |
| Rango intercuartílico | 14-88 |
| Lugar de fallecimiento | |
| Domicilio | 50 (50,5) |
| Hospital | 48 (48,5) |
| Otro | 1 (1) |
CP: cuidados paliativos; SNC: sistema nervioso central.
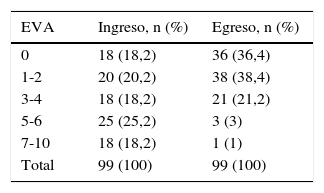
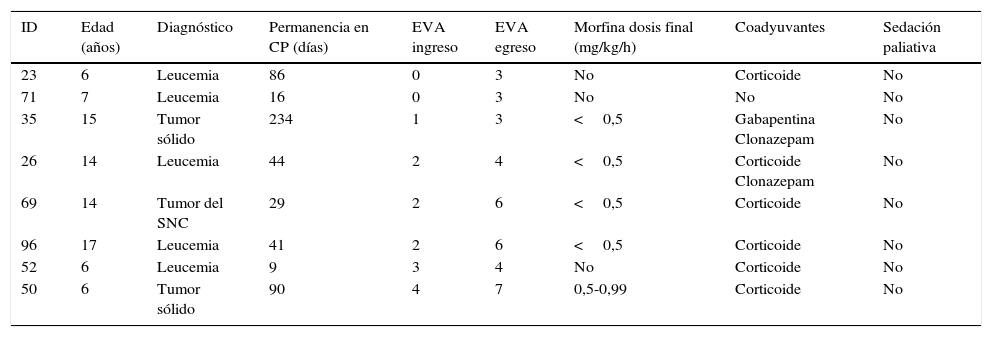
Al analizar en el grupo total la variable intensidad de dolor se observó que el 18,2% de los pacientes ingresaron en CP sin dolor, mientras que el 43,4% manifestó dolor intenso a severo (EVA 5 a 10) al ingresar en el programa (tabla 2). En 14 casos no se observó disminución de la intensidad del dolor durante su permanencia en CP. En 6 de ellos se mantuvo la intensidad en rango leve (EVA 1-2), sin embargo, en 5 la intensidad del dolor aumentó hasta EVA 3-4 y en 3 casos se observó aumento de la intensidad del dolor falleciendo con EVA en rango de dolor intenso a severo, pero solo uno de estos pacientes con EVA máxima de 7, como se detalla en la tabla 3.
Intensidad del dolor al ingreso y egreso del programa de CP
| EVA | Ingreso, n (%) | Egreso, n (%) |
|---|---|---|
| 0 | 18 (18,2) | 36 (36,4) |
| 1-2 | 20 (20,2) | 38 (38,4) |
| 3-4 | 18 (18,2) | 21 (21,2) |
| 5-6 | 25 (25,2) | 3 (3) |
| 7-10 | 18 (18,2) | 1 (1) |
| Total | 99 (100) | 99 (100) |
EVA: escala visual analógica o su equivalente según la edad11.
CP: Cuidados Paliativos
Características de pacientes con aumento en la EVA durante permanencia en CP
| ID | Edad (años) | Diagnóstico | Permanencia en CP (días) | EVA ingreso | EVA egreso | Morfina dosis final (mg/kg/h) | Coadyuvantes | Sedación paliativa |
|---|---|---|---|---|---|---|---|---|
| 23 | 6 | Leucemia | 86 | 0 | 3 | No | Corticoide | No |
| 71 | 7 | Leucemia | 16 | 0 | 3 | No | No | No |
| 35 | 15 | Tumor sólido | 234 | 1 | 3 | <0,5 | Gabapentina Clonazepam | No |
| 26 | 14 | Leucemia | 44 | 2 | 4 | <0,5 | Corticoide Clonazepam | No |
| 69 | 14 | Tumor del SNC | 29 | 2 | 6 | <0,5 | Corticoide | No |
| 96 | 17 | Leucemia | 41 | 2 | 6 | <0,5 | Corticoide | No |
| 52 | 6 | Leucemia | 9 | 3 | 4 | No | Corticoide | No |
| 50 | 6 | Tumor sólido | 90 | 4 | 7 | 0,5-0,99 | Corticoide | No |
CP: cuidados paliativos; EVA: escala visual analógica o su equivalente según la edad; SNC: sistema nervioso central.
En relación con el manejo farmacológico del dolor, se observó que un 11,1% de los niños no requirió opiáceos y recibió solo antiinflamatorios no esteroideos. De aquellos que utilizaron opiáceos 22 pacientes solo utilizaron opiáceos débiles hasta su fallecimiento, en 22 casos se inició el tratamiento con un opiáceo débil, progresando luego al uso de opiáceo fuerte, mientras que 44 pacientes requirieron el uso de opiáceo fuerte desde el ingreso al programa, por lo tanto el 66,7% de los casos atendidos en este período recibieron en algún momento de su evolución un opiáceo fuerte, y de este grupo, un 57,5% falleció hospitalizado (tabla 4).
Para el análisis de la dosis final de opiáceo fuerte empleada, no fue necesario convertir a dosis de morfina equivalente, debido a que la totalidad de los pacientes del estudio utilizó morfina y no otro tipo de opiáceo fuerte en el momento del fallecimiento. En relación con la vía de administración de la morfina se observó que en el 83,3% de los casos se utilizó la vía intravenosa, en el 13,6% la vía oral y en el 3,1% la vía subcutánea.
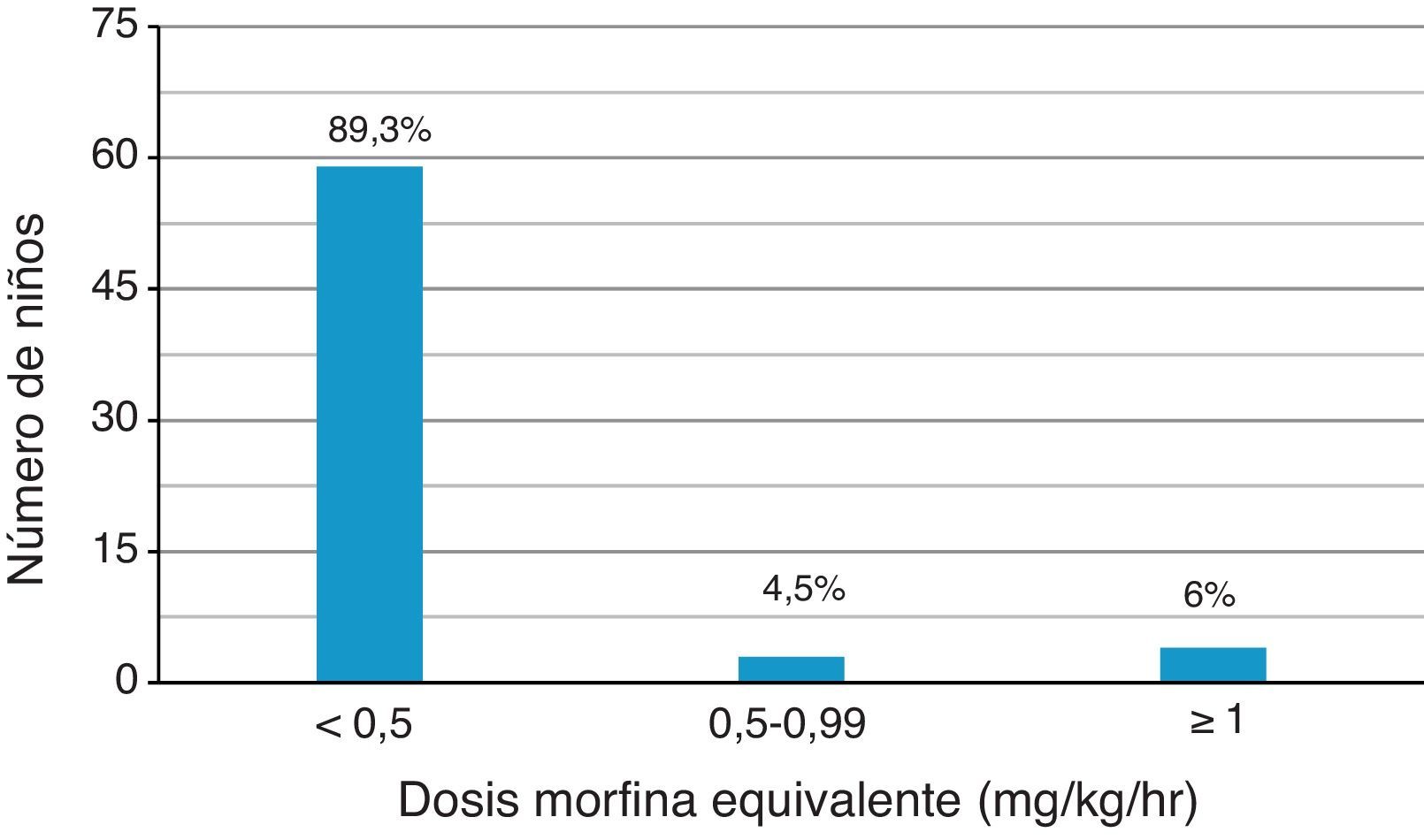
Como se observa en la figura 1, de los 66 pacientes que utilizaron opiáceo fuerte un 89,5% requirió dosis menores a 0,5mg/kg/h de morfina, logrando un control adecuado del dolor en la mayoría de los casos.
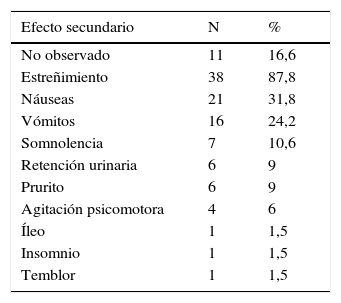
No se registró la presencia de efectos secundarios asociados al uso de opiáceos fuertes en el 16,6%. En aquellos que sí presentaron, la mayoría manifestó más de 2 síntomas asociados, y de ellos el 92,7% presentó algún síntoma gastrointestinal, siendo el más frecuente el estreñimiento (tabla 5). En este grupo no se observaron efectos secundarios severos, como depresión respiratoria, y no fue necesario realizar rotación o suspensión de opiáceos en ninguno de los pacientes.
Un 77% de los pacientes recibió algún fármaco coadyuvante para el manejo del dolor: 40 utilizaron corticoides, 11 benzodiacepinas y en 25 casos combinación de estos fármacos, incluyendo el uso de gabapentina en 7 casos.
La sedación paliativa fue utilizada en 15,6% de los casos, y esta fue indicada exclusivamente por disnea severa asociada a la presencia de metástasis pulmonares.
DiscusiónEl manejo oportuno y adecuado del dolor es considerado un derecho humano, y debe ser un imperativo en la atención de los equipos de salud. En los niños con cáncer en CP este síntoma puede ser muy frecuente e intenso. Como se observa en el grupo estudiado, un 43,4% de los pacientes con cáncer avanzado presentaba dolor intenso a severo (EVA 5-10) al ingreso en CP, lo que se relaciona con lo descrito en la literatura. Debido a que este estudio fue retrospectivo y descriptivo, no se puede plantear que el dolor haya sido más intenso en los niños con tumores sólidos, como describen algunos artículos. Cabe destacar que un porcentaje no menor (18,2%) de los pacientes ingresan en el programa sin dolor, a diferencia de lo que se observa en los pacientes adultos con cáncer avanzado, en los que el 90% ingresa con dolor de intensidad variable5,7,9,11–13.
Es importante señalar que el manejo del dolor en este grupo de pacientes se inició de forma precoz, ya que este modelo de atención cuenta con un equipo de CP integrado en el equipo oncológico. Esto representa una ventaja en el control del dolor porque no hay demora en la derivación al equipo especializado, y los cuidadores son educados en la evaluación del dolor desde el ingreso del niño en CP1,10,11.
La última guía de la OMS entrega recomendaciones basadas en la evidencia científica para el manejo del dolor persistente en niños, incluyendo el uso de analgésicos no opiáceos, opiáceos y coadyuvantes. En esta guía se insiste en la administración de morfina como la principal alternativa para el control del dolor moderado a severo5. En el grupo analizado, 2/3 de los pacientes requirieron morfina hasta su fallecimiento, logrando un control adecuado del dolor, esto es, obteniendo una disminución en la EVA hasta dolor leve o sin dolor en la casi totalidad de los casos. En los 3 casos en que se observó aumento de la intensidad del dolor hasta EVA 6-7, a pesar del uso de morfina, esto podría estar relacionado con factores como poca adherencia o resistencia de los cuidadores a la administración de este fármaco, pese a las indicaciones del equipo tratante, ya que las dosis utilizadas en ellos eran bajas y podrían haberse aumentado hasta lograr control del dolor, sin riesgo para los pacientes5,9,16.
La resistencia al uso de opiáceos fuertes por parte de los cuidadores y los equipos de salud ha disminuido en la medida que los equipos dedicados a CP han ido educando para derribar los «mitos» sobre el uso de la morfina y han demostrado que su administración, siguiendo protocolos establecidos, es segura y efectiva. Sin embargo, como se observa en este grupo, aún existe temor por parte de los encargados de administrar a los niños estos fármacos, por lo que resulta fundamental seguir insistiendo en las ventajas que tiene el uso de dosis crecientes de opiáceos para lograr un adecuado control del dolor en los casos que sea pertinente5,10,16–18.
Según las recomendaciones de la OMS la mejor vía para el manejo del dolor es la vía oral, sin embargo, como se observó, el 83,3% de los pacientes que recibieron morfina lo hicieron por vía intravenosa. Lo anterior se debe a que este grupo de pacientes dispone de catéter venoso central permanente, que permite la administración de medicamentos sin tener que puncionar de forma repetida al niño, y los cuidadores son educados en su manejo. Además, la formulación de morfina para uso oral está disponible en nuestro hospital desde hace 3 años, y su presentación en solución de 20mg/ml (16 gotas) no resulta práctica en recién nacidos y lactantes menores.
De acuerdo a lo observado, la gran mayoría no requirió dosis altas de morfina, y no hubo necesidad del uso de sedación para el manejo de dolor intratable, ya que fueron efectivas las medidas habituales que se detallan en los protocolos en uso12–16.
Respecto a los efectos secundarios registrados en relación con el uso de opiáceos fuertes, un 83,4% de los pacientes presentó algún tipo de efecto secundario, siendo el más frecuente el estreñimiento, destacando la ausencia de efectos graves como depresión respiratoria y anafilaxia. De este modo, siendo los síntomas gastrointestinales los que con mayor frecuencia se relacionan con el uso de opiáceos, resulta indispensable la indicación profiláctica de laxantes, estimulantes de la motilidad intestinal y antieméticos2,4,5,17,18.
Esta experiencia, basada en el uso de un protocolo, demuestra que la evaluación del dolor (de forma periódica, por medio de escalas validadas y adecuadas a la edad de cada paciente) permite la administración de opiáceos fuertes como la morfina en dosis crecientes, sin riesgos para los pacientes, logrando un buen control de este síntoma y con efectos secundarios predecibles, que deben ser evaluados continuamente de forma dirigida y que requieren un manejo preventivo.
En relación con las limitaciones del estudio, por ser de tipo retrospectivo, la recolección de datos estuvo restringida a la información registrada en las fichas clínicas, lo que conllevó una valoración insuficiente de algunas variables, como tipo y localización del dolor. Además de los sesgos en relación con la recolección de datos, hubo restricciones debido a fichas clínicas incompletas y no estandarizadas. Esto plantea el desafío de desarrollar una ficha digital, en red, disponible en todos los centros pediátricos de CP del país, con el fin de obtener una base de datos significativa y fiable, que permita realizar un estudio prospectivo y multicéntrico, contribuyendo a generar mayor evidencia científica en el manejo de estos pacientes.
ConclusionesEsta es la primera publicación de ámbito nacional que muestra la experiencia con el uso de morfina para el manejo del dolor en pacientes pediátricos oncológicos en etapa avanzada, siguiendo un protocolo basado en las recomendaciones de la OMS. En este sentido, creemos que es un aporte para que este fármaco sea considerado como una alternativa segura frente a dolor moderado o severo en los niños.
El uso de opiáceos forma parte indiscutible de la práctica clínica en el área del cuidado paliativo de pacientes pediátricos con cáncer. Sin embargo, es importante destacar que en países como Estados Unidos y Canadá la enfermedad oncológica es la tercera causa de ingreso en unidades de CP pediátrico, después de las enfermedades neurológicas y congénitas. Por esto el manejo adecuado del dolor también debe ser incorporado por todos los equipos de salud que atienden a niños y adolescentes con necesidades especiales en salud (NANEAS) con enfermedades limitantes de la vida, que pueden requerir el uso de analgésicos potentes debido a la progresión de su enfermedad de base19.
Conflicto de interesesEste trabajo cumple con los requisitos sobre consentimiento/asentimiento informado, comité de ética, financiación, estudios animales y sobre la ausencia de conflicto de intereses según corresponda.