La sepsis es causa importante de morbimortalidad neonatal.
ObjetivosDetectar el tiempo en que la curva de crecimiento bacteriano es evidenciada en la muestra de sangre inoculada en los hemocultivos y comparar estos tiempos de crecimiento bacteriano entre bacterias gramnegativas y grampositivas, entre los tipos de sepsis neonatal y determinar las bacterias más frecuentemente aisladas entre neonatos prematuros y de término.
Pacientes y métodoEstudio descriptivo de recién nacidos en riesgo de sepsis o con sospecha de sepsis por manifestaciones clínicas o de laboratorio, en que se evaluaron 114 hemocultivos positivos entre 1.932 hemocultivos tomados entre mayo de 2010 y mayo de 2014. Los datos se analizaron con Stata® 11.0.
ResultadosEl 5,9% de los hemocultivos tuvieron crecimiento bacteriano. La mediana y rango intercuartílico de tiempos de crecimiento bacteriano para gramnegativos fue 11h (10-13h), para grampositivos diferentes a Staphylococcus coagulasa negativo (SCoN) 12h (12-18h) y para SCoN 42h (36-44h). El 95,8% de las bacterias grampositivas y el 96% de las gramnegativas tuvieron tiempos de crecimiento bacteriano≤24h de incubación, mientras que en los SCoN el 100% de los hemocultivos fue positivo en≤62h de incubación.
ConclusiónEl 100% de sepsis por bacterias gramnegativas, grampositivas no SCoN y 90% de las ocasionadas por SCoN, son identificadas en los hemocultivos en las primeras 48h, por lo cual podemos concluir que para descartar una sepsis, un período de incubación en hemocultivos de 48h es suficiente.
Sepsis is a major cause of neonatal morbidity and mortality.
ObjectivesTo detect the time when the bacterial growth curve is evidenced in the blood sample inoculated blood cultures and comparing the times of bacterial growth between Gram negative and Gram positive bacteria, among the types of neonatal sepsis and identifying microorganisms more often isolated from preterm and term.
Patients and methodA descriptive study. 114 positive blood cultures from 1,932 blood cultures taken from 01-May-2010 and 31-May-2014 were evaluated. Data were analyzed with Stata® 11.0.
Results5.9% of blood cultures had bacterial growth. The median and interquartile range of Gram negative times of bacterial growth was 11h (10-13h), for Gram positive coagulase-negative Staphylococcus different (CoNS) 12h (12-18h) and CoNS 42h (36-44h). 95.8% of Gram positive and 96% of Gram negative, were the times of bacterial growth≤24h incubation, whereas the 100% CoNS was positive≤62h of incubation.
Conclusion100% of sepsis by Gram negative and Gram positive no CoNS and 90% of those caused by CoNS are identified in blood cultures in 48h, so we can conclude that to rule out sepsis, an incubation period of 48h in blood cultures is sufficient.
La incidencia de sepsis severa en recién nacidos aumentó entre 1995 y 2005, desde 4,5 a 9,7 por cada 1.000 nacidos vivos1. El período perinatal es un período de mucho riesgo para desarrollar sepsis dadas las múltiples exposiciones a microorganismos virulentos en sitios potenciales como útero, canal del parto, la unidad de cuidados intensivos neonatales, los procedimientos invasivos, los dispositivos, los cuidadores de la salud y la misma comunidad. Pero los neonatos de mayor riesgo son los prematuros por la inmadurez de su sistema inmune, hospitalización prolongada, mayor exposición a procedimientos y dispositivos invasivos, empleo de antibióticos de amplio espectro, lo que los hace más susceptibles a infecciones bacterianas, con el creciente aumento de los microorganismos multirresistentes2.
Siendo el aislamiento del microorganismo en sangre el método estándar utilizado3, el diagnóstico de la sepsis neonatal no es fácil, dada la poca especificidad de los signos clínicos y la baja sensibilidad del laboratorio. La identificación en el laboratorio del microorganismo causal de un sitio estéril, que es lo óptimo para el diagnóstico definitivo, no siempre es posible4.
En el pasado, la identificación bacteriana a través de hemocultivos se realizaba por técnicas manuales y de observación, con tiempos de crecimiento bacteriano (TCB) más tempranos de 36-72h. Desde los años 90 se han desarrollado varios sistemas de cultivos de sangre que pueden ser continuamente monitorizados5. Estos sistemas permiten monitorizar electrónicamente las botellas de hemocultivos las 24h del día; por lo general la revisión de cada botella se hace cada 8-10min. Recientes estudios indican que las bacterias causantes de la sepsis neonatal pueden ser rápidamente identificadas mediante estas técnicas de laboratorio6. El objetivo principal del estudio fue detectar el tiempo en que se descubre crecimiento bacteriano en los hemocultivos y comparar estos TCB entre bacterias gramnegativas y grampositivas. Los objetivos secundarios incluyeron determinar los microorganismos más frecuentemente aislados según tipo de sepsis en neonato prematuros y a término, así como cuantificar los TCB según tipo de sepsis.
Pacientes y métodoDiseño del estudioSe realizó un estudio descriptivo con los hemocultivos tomados de recién nacidos en riesgo de sepsis o con sospecha de sepsis por manifestaciones clínicas o de laboratorio, en la Unidad de Cuidados Intensivos Neonatales de la Fundación Hospital San José de Buga, Colombia.
En el estudio se incluyeron todos los neonatos de 500g o más de peso al nacer, de 24 o más semanas de edad gestacional al nacer, de ambos sexos, a quienes se les haya tomado uno o más hemocultivos por riesgo o sospecha de sepsis no asociada o asociada a la atención en salud, que hayan ingresado a la Unidad de Cuidados Intensivos Neonatales entre el 1 de mayo de 2010 y el 31 mayo de 2014.
Variables analizadasLas variables analizadas incluyeron la positividad del hemocultivo, TCB y tipo de bacteria aislada. El tiempo de incubación del hemocultivo en el que este fue informado positivo por el equipo BacT/Alert, fue el tiempo que duró la incubación de cada hemocultivo hasta que el equipo BacT/Alert identificó crecimiento bacteriano. El estado del hemocultivo definido como positivo o negativo en el día 5 de incubación fue considerado como el resultado final. Igualmente se identificaron los aislamientos bacterianos.
En los neonatos se tomaron los hemocultivos según la indicación clínica. En casos de riesgo o sospecha de sepsis temprana al menos un hemocultivo periférico, en casos de sospecha de sepsis tardía 2 periféricos y en casos de sospecha de infección asociada a la atención en salud, 2 periféricos y uno de cada de catéter central cuando estuviera indicado, con un volumen de sangre de 1mL bajo condiciones asépticas como recomiendan Sarkar et al.7 y Polin y el Committee On Fetus And Newborn8, la cual fue inoculada al medio de cultivo aeróbico para sangre BacT/Alert (BioMérieux, Inc., Durham, Carolina del Norte, EE. UU.). La botella se incubó a 37°C. Este sistema detecta la producción de dióxido de carbono producido por las bacterias, indicando al ordenador que el hemocultivo es positivo mediante la activación de una alarma. Se definió sepsis a cada caso ocurrido en un neonato con factores de riesgo o sospecha de sepsis, quien tuviera clínica, con o sin laboratorio (hemograma alterado o proteína C reactiva elevada) y crecimiento de una bacteria habitual productora de sepsis neonatal en al menos un cultivo sanguíneo, y se consideró crecimiento por una bacteria contaminante cuando este ocurriera para gérmenes no habituales productores de sepsis temprana o tardía no asociadas a la atención en salud en un solo hemocultivo, como es el caso de los Staphylococcus coagulasa negativos (SCoN). Para determinar que una sepsis por SCoN fuera real se requirió del crecimiento de esta bacteria en al menos 2 hemocultivos periféricos o uno periférico y uno por barrido de catéter central, asociado a manifestaciones clínicas acompañado o no de alteraciones en hemograma o elevación de la proteína C reactiva. Se definió sepsis neonatal temprana a la ocurrida en las primeras 72h de vida, sepsis tardía a la ocurrida después de 72h de vida, y sepsis asociada a la atención en salud a la sepsis asociada a dispositivos como catéteres centrales (subclavio, yugular, epicutáneo y umbilicales), tubos orotraqueales (asociados a neumonías relacionadas con ventilador), catéteres urinarios (asociados a infecciones urinarias relacionadas con sondaje vesical) y sepsis nosocomiales no asociadas a dispositivos.
Las muestras para hemocultivo se incubaron en el sistema automatizado BACTEC 9050 (Becton Dickison). Los gérmenes grampositivos y gramnegativos se identificaron a través del analizador MicroScan WalkAway 98 PlusMicro así como la determinación de la sensibilidad bacteriana, la cual fue confirmada con sensidiscos estándares.
Los tiempos de las señales de positividad y los detalles de los microorganismos aislados se obtuvieron del Laboratorio Ángel, que presta los servicios al hospital. En el trabajo se incluyeron todos los hemocultivos tomados y analizados en el período descrito.
Análisis estadísticoLos datos fueron trasladados a Stata® versión 11.0 para su análisis. Las variables continuas se expresaron como promedios y su desviación estándar o medianas con su rango intercuartílico (RI), empleándose pruebas t no pareada y Ranksum para compararlas según su distribución. Las variables categóricas se expresaron en frecuencias y proporciones. Los tiempos de positividad de los hemocultivos se agruparon en rangos: 0-12h, 13-24h, 25-36h, 37-48h y 49-72h. Para hacer el análisis de los tiempos de positividad de hemocultivos para microorganismos gramnegativos, grampositivos no SCoN y para SCoN, se empleó la gráfica de Kaplan Meier, comparándose con la prueba Log-rank. Toda p<0,05 se consideró significativa.
La investigación fue aprobada por el Comité de Ética institucional y careció de conflicto de intereses.
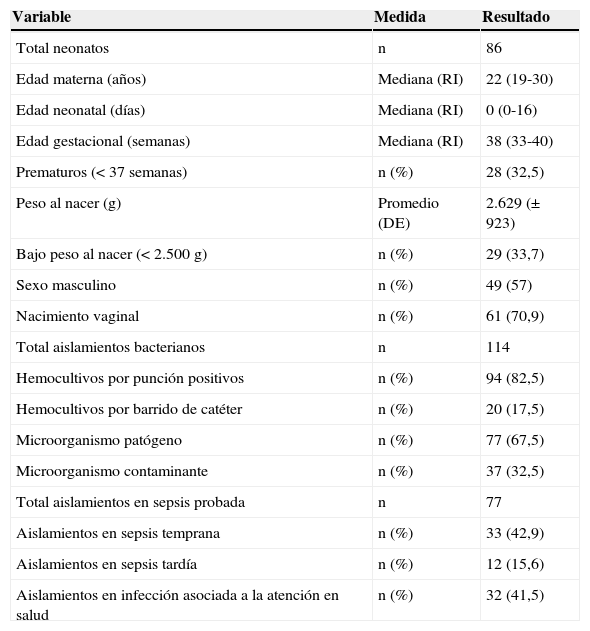
ResultadosLa tabla 1 muestra las características demográficas maternas y neonatales, resaltando que los prematuros representaron el 32,5%, los neonatos con bajo peso al nacer el 33,7% y el 57% fueron varones. Hubo crecimiento bacteriano en 94 hemocultivos obtenidos de sangre periférica y 20 crecimientos bacterianos en hemocultivos de sangre por barrido de catéter.
Características maternas, neonatales y tipos de sepsis
| Variable | Medida | Resultado |
|---|---|---|
| Total neonatos | n | 86 |
| Edad materna (años) | Mediana (RI) | 22 (19-30) |
| Edad neonatal (días) | Mediana (RI) | 0 (0-16) |
| Edad gestacional (semanas) | Mediana (RI) | 38 (33-40) |
| Prematuros (<37 semanas) | n (%) | 28 (32,5) |
| Peso al nacer (g) | Promedio (DE) | 2.629 (±923) |
| Bajo peso al nacer (<2.500g) | n (%) | 29 (33,7) |
| Sexo masculino | n (%) | 49 (57) |
| Nacimiento vaginal | n (%) | 61 (70,9) |
| Total aislamientos bacterianos | n | 114 |
| Hemocultivos por punción positivos | n (%) | 94 (82,5) |
| Hemocultivos por barrido de catéter | n (%) | 20 (17,5) |
| Microorganismo patógeno | n (%) | 77 (67,5) |
| Microorganismo contaminante | n (%) | 37 (32,5) |
| Total aislamientos en sepsis probada | n | 77 |
| Aislamientos en sepsis temprana | n (%) | 33 (42,9) |
| Aislamientos en sepsis tardía | n (%) | 12 (15,6) |
| Aislamientos en infección asociada a la atención en salud | n (%) | 32 (41,5) |
DE: Desviación estándar; RI: rango intercuartílico.
Total neonatos con aislamiento bacteriano: 86; total aislamientos bacterianos: 114.
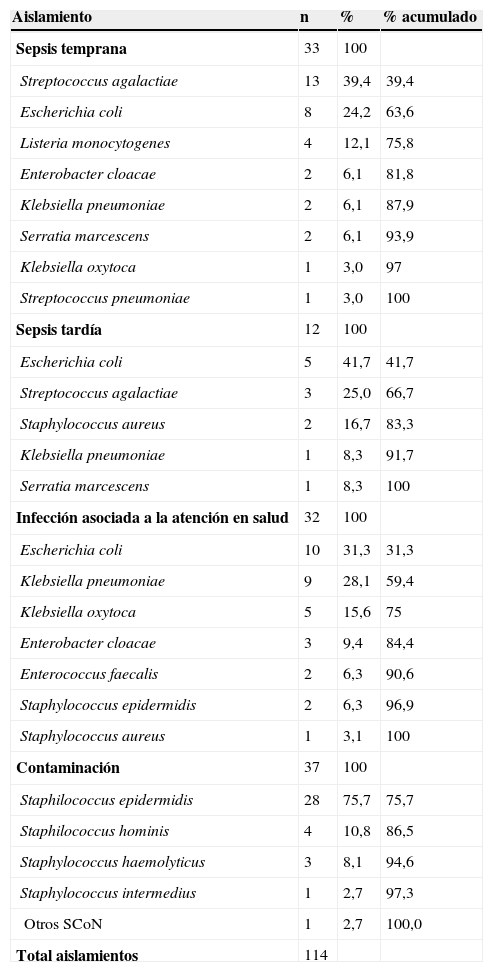
De un total de 1.932 hemocultivos tomados a 1.838 neonatos durante el período del estudio, hubo crecimiento bacteriano en 114 (5,9%). Entre los aislamientos bacterianos patógenos hubo 51 (44,7%) gramnegativos, 24 (21,1%) grampositivos patógenas y 39 (34,2%) considerados contaminantes, todos SCoN. Los microorganismos principalmente aislados según el tipo de infección fueron para la sepsis temprana (n=33), Streptococcus agalactiae (S. agalactiae) (39,4%) y Escherichia coli (E. coli) (24,2%); para sepsis tardía (n=12) E. coli (41,7%) y S. agalactiae (25%); para sepsis asociada a la atención en salud (n=32) E. coli (31,3%) y Klebsiella pneumoniae (K. pneumoniae) (28,1%) (tabla 2).
Aislamiento bacteriano en hemocultivos según tipo de sepsis
| Aislamiento | n | % | % acumulado |
|---|---|---|---|
| Sepsis temprana | 33 | 100 | |
| Streptococcus agalactiae | 13 | 39,4 | 39,4 |
| Escherichia coli | 8 | 24,2 | 63,6 |
| Listeria monocytogenes | 4 | 12,1 | 75,8 |
| Enterobacter cloacae | 2 | 6,1 | 81,8 |
| Klebsiella pneumoniae | 2 | 6,1 | 87,9 |
| Serratia marcescens | 2 | 6,1 | 93,9 |
| Klebsiella oxytoca | 1 | 3,0 | 97 |
| Streptococcus pneumoniae | 1 | 3,0 | 100 |
| Sepsis tardía | 12 | 100 | |
| Escherichia coli | 5 | 41,7 | 41,7 |
| Streptococcus agalactiae | 3 | 25,0 | 66,7 |
| Staphylococcus aureus | 2 | 16,7 | 83,3 |
| Klebsiella pneumoniae | 1 | 8,3 | 91,7 |
| Serratia marcescens | 1 | 8,3 | 100 |
| Infección asociada a la atención en salud | 32 | 100 | |
| Escherichia coli | 10 | 31,3 | 31,3 |
| Klebsiella pneumoniae | 9 | 28,1 | 59,4 |
| Klebsiella oxytoca | 5 | 15,6 | 75 |
| Enterobacter cloacae | 3 | 9,4 | 84,4 |
| Enterococcus faecalis | 2 | 6,3 | 90,6 |
| Staphylococcus epidermidis | 2 | 6,3 | 96,9 |
| Staphylococcus aureus | 1 | 3,1 | 100 |
| Contaminación | 37 | 100 | |
| Staphilococcus epidermidis | 28 | 75,7 | 75,7 |
| Staphilococcus hominis | 4 | 10,8 | 86,5 |
| Staphylococcus haemolyticus | 3 | 8,1 | 94,6 |
| Staphylococcus intermedius | 1 | 2,7 | 97,3 |
| Otros SCoN | 1 | 2,7 | 100,0 |
| Total aislamientos | 114 |
SCoN: Staphylococcus coagulasa negativo.
En la sepsis temprana entre los neonatos prematuros (n=17) el aislamiento más frecuente fue E. coli (35,3%), seguido por S. agalactiae (29,4%) y Listeria monocytogenes (L. monocytogenes) (11,8%) mientras que en sepsis temprana en neonatos de término (n=16), el microorganismo más frecuente fue S. agalactiae (50%), seguido por E. coli, L. monocytogenes y Serratia marcescens (12,5% cada una).
El tiempo más corto de identificación de positividad en hemocultivo se presentó para una E. coli (5h) y los más prolongado para una E. coli (48h) y 2 SCoN (62h).
Las medianas y RI de los TCB de los hemocultivos para bacterias gramnegativas fue 11h (RI: 10-12h), para grampositivas 12h (RI: 12-18h) y para SCoN 42h (RI: 36-44h), con una diferencia estadísticamente significativa para los TCB entre gramnegativos y grampositivos (p=0,0050) y entre SCoN y las otras bacterias grampositivas y negativas (p<0,001).
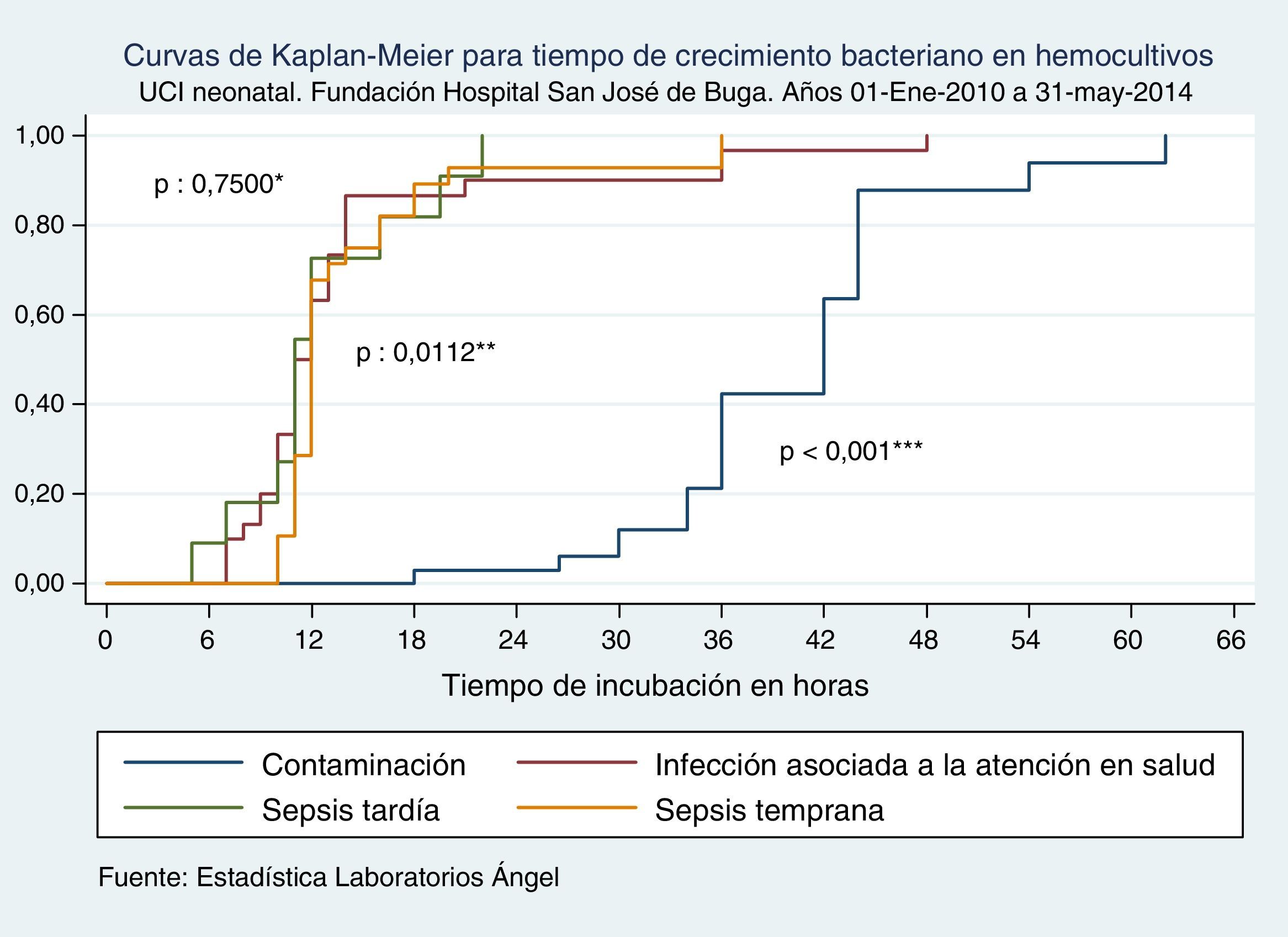
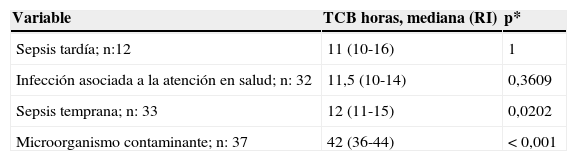
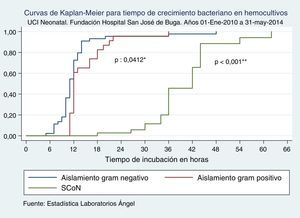
Cuando comparamos los TCB según los tipos de sepsis neonatal, no se halló diferencia estadísticamente significativa de TCB entre sepsis tardía y sepsis asociada a la atención en salud, mientras encontramos que en sepsis temprana estos TCB fueron significativamente más prolongados que en sepsis tardía, al igual que cuando se trató de un microorganismo contaminante (tabla 3 y fig. 1).
Tiempo de crecimiento bacteriano en hemocultivos según tipo de sepsis
| Variable | TCB horas, mediana (RI) | p* |
|---|---|---|
| Sepsis tardía; n:12 | 11 (10-16) | 1 |
| Infección asociada a la atención en salud; n: 32 | 11,5 (10-14) | 0,3609 |
| Sepsis temprana; n: 33 | 12 (11-15) | 0,0202 |
| Microorganismo contaminante; n: 37 | 42 (36-44) | <0,001 |
p *: prueba de Ranksum; TCB: tiempo de crecimiento bacteriano.
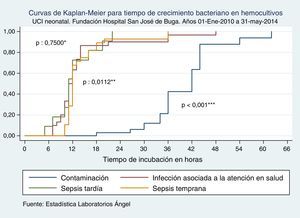
Curvas de Kaplan-Meier para tiempo de crecimiento bacteriano en hemocultivos según tipo de sepsis. UCI Neonatal. Fundación Hospital San José de Buga. Del 1 de mayo de 2010 al 31 de mayo del 2014.
Fuente: Estadística Laboratorios Ángel.
*Diferencia entre sepsis tardía e infección asociada a la atención en salud.
**Diferencia entre sepsis tardía y sepsis temprana.
***Diferencia entre sepsis tardía y crecimiento bacteriano por contaminación.
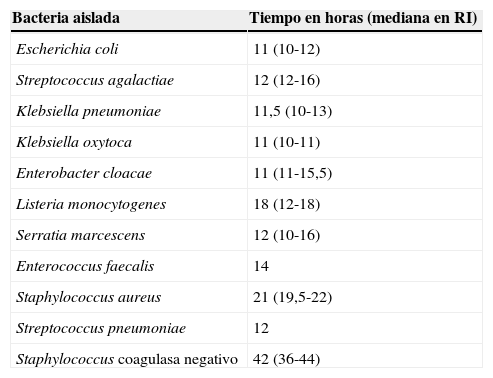
La tabla 4 muestra los TCB en hemocultivos por tipo de aislamiento bacteriano. Para los 2 principales microorganismos causantes de las sepsis neonatal la mediana de las horas de positividad de los hemocultivos fue para E. coli 11h (RI: 10-12h) y para S. agalactiae 12h (RI: 12-16h).
Tiempos de crecimiento bacteriano en hemocultivos por tipo de bacteria
| Bacteria aislada | Tiempo en horas (mediana en RI) |
|---|---|
| Escherichia coli | 11 (10-12) |
| Streptococcus agalactiae | 12 (12-16) |
| Klebsiella pneumoniae | 11,5 (10-13) |
| Klebsiella oxytoca | 11 (10-11) |
| Enterobacter cloacae | 11 (11-15,5) |
| Listeria monocytogenes | 18 (12-18) |
| Serratia marcescens | 12 (10-16) |
| Enterococcus faecalis | 14 |
| Staphylococcus aureus | 21 (19,5-22) |
| Streptococcus pneumoniae | 12 |
| Staphylococcus coagulasa negativo | 42 (36-44) |
RI: rango intercuartílico.
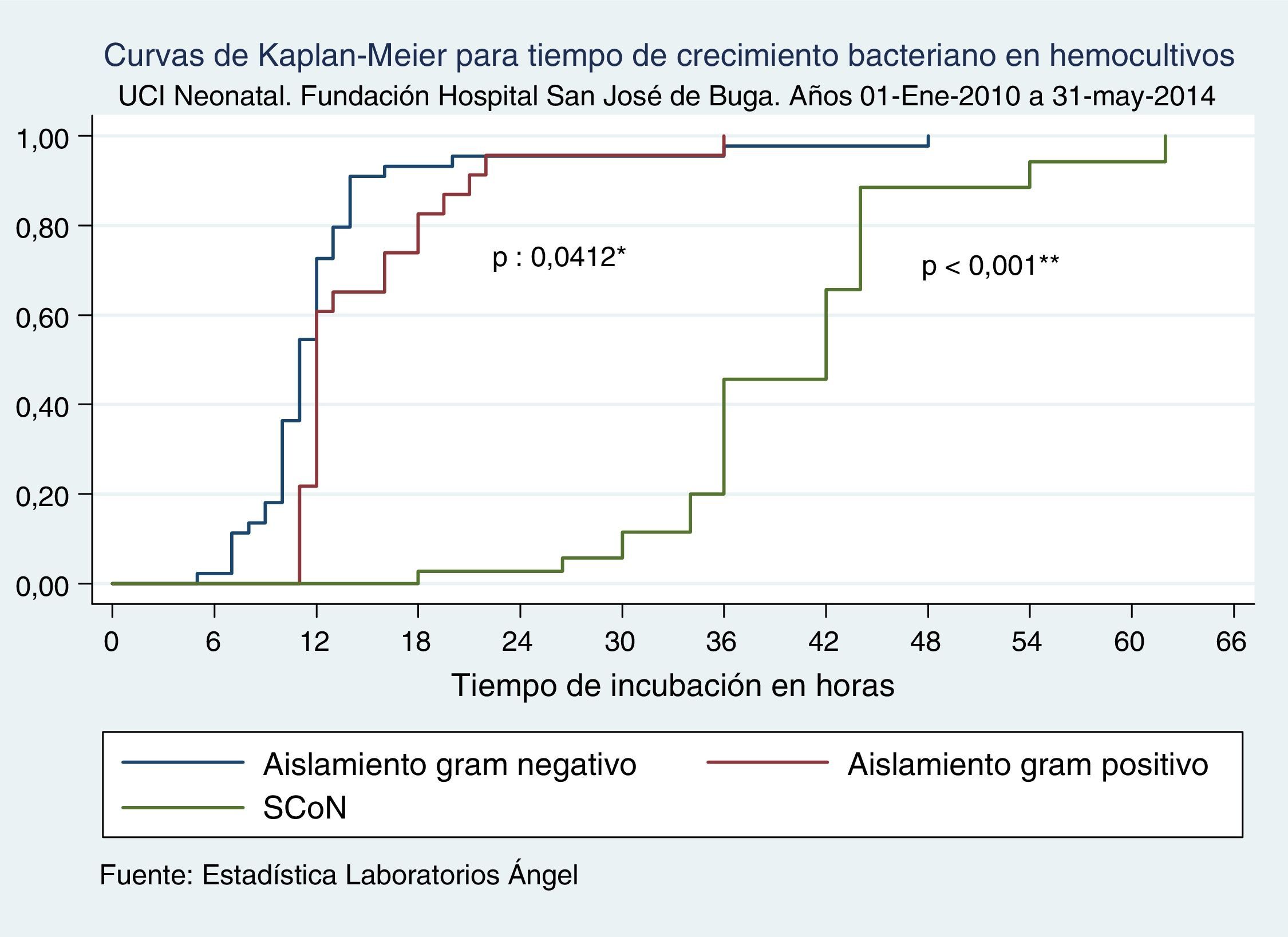
En las primeras 24h de vida encontramos crecimiento bacteriano en un 95,8% de hemocultivos para bacterias grampositivas y un 96% de bacterias gramnegativas, diferencia que fue significativa (p=0,0412) (fig. 2). El TCB más tardío ocurrió con una K. pneumoniae y una E. coli, las cuales resultaron positivas a las 36 y 48h respectivamente. Por otro lado, para el 2,6% de SCoN el TCB en hemocultivos ocurrió en las primeras 24h, el 43,6% entre 25-36h y el 10,3% entre 49-62h, diferencia que fue estadísticamente significativa cuando se comparó con los demás TCB de los otros aislamientos bacterianos (p<0,001) (fig. 2).
Curvas de Kaplan-Meier para tiempo de crecimiento de microorganismos en hemocultivos según tipo de microorganismo. UCI Neonatal. Fundación Hospital San José de Buga. Del 1 de mayo de 2010 al 31 de mayo del 2014. SCoN: Staphylococcus coagulasa negativo o Staphylococcus no aureus.
Fuente: Estadística Laboratorios Ángel.
*Diferencia entre bacterias gramnegativas y grampositivas.
**Diferencia entre SCoN y otras bacterias (gramnegativas y grampositivas).
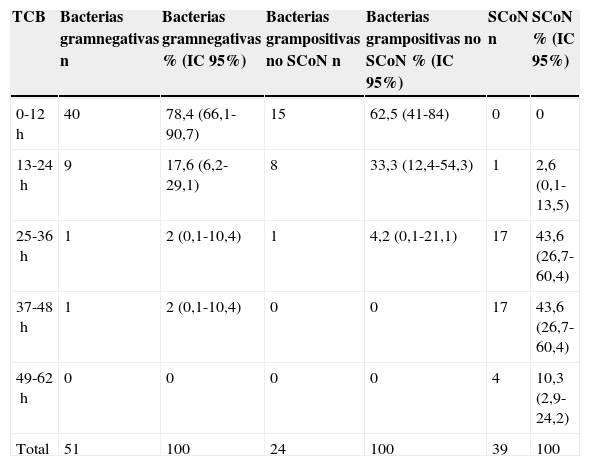
En las primeras 12h de incubación de los hemocultivos, se identificó crecimiento bacteriano en el 78,4% (IC 95%: 66,1-90,7%) de bacterias gramnegativas, en el 62,5% (IC 95%: 41-84%) de grampositivas y ninguno de SCoN. En las primeras 24h de incubación más del 95% de bacterias gramnegativas y grampositivas habían mostrado crecimiento en los hemocultivos, mientras la totalidad de estas bacterias fue identificada en las primeras 48h de incubación. Para el caso de los SCoN este crecimiento fue más lento, sin embargo su identificación se hizo en la totalidad en las primeras 72h de incubación (tabla 5).
Tiempo de crecimiento bacteriano en hemocultivos según tipo de aislamiento
| TCB | Bacterias gramnegativas n | Bacterias gramnegativas % (IC 95%) | Bacterias grampositivas no SCoN n | Bacterias grampositivas no SCoN % (IC 95%) | SCoN n | SCoN % (IC 95%) |
|---|---|---|---|---|---|---|
| 0-12h | 40 | 78,4 (66,1-90,7) | 15 | 62,5 (41-84) | 0 | 0 |
| 13-24h | 9 | 17,6 (6,2-29,1) | 8 | 33,3 (12,4-54,3) | 1 | 2,6 (0,1-13,5) |
| 25-36h | 1 | 2 (0,1-10,4) | 1 | 4,2 (0,1-21,1) | 17 | 43,6 (26,7-60,4) |
| 37-48h | 1 | 2 (0,1-10,4) | 0 | 0 | 17 | 43,6 (26,7-60,4) |
| 49-62h | 0 | 0 | 0 | 0 | 4 | 10,3 (2,9-24,2) |
| Total | 51 | 100 | 24 | 100 | 39 | 100 |
h: horas; IC: intervalo de confianza; SCoN: Staphylococcus coagulasa negativo o Staphylococcus no aureus; TCB: tiempo de crecimiento bacteriano.
La sepsis neonatal es causa importante de morbimortalidad en el primer mes de vida9. Hasta un 62% de los prematuros de extremado bajo peso al nacer que sobreviven más de 12h después del nacimiento tienen al menos un hemocultivo positivo durante su hospitalización1. Entre todos los hemocultivos tomados durante el tiempo del estudio, el 5,9% resultaron positivos para aislamiento bacteriano, cifra superior a la mencionada por Brown et al.6, similar a la de Evans y Fine10, e inferior a la informada por otros autores11–14. Estos bajos porcentajes de aislamiento bacteriano se han relacionado con conteos de colonias bacterianas≤4UFC/mL en una cuarta parte y<10UFC/mL en 2 terceras partes de los casos<2meses de edad15,16. Una parte importante de los neonatos a los cuales se les toma hemocultivos son pacientes con riesgo de sepsis por diferentes causas, cuyas incidencias de sepsis temprana son bajas15.
El 43% de nuestros aislamientos fueron bacilos gramnegativos, el 57% bacterias grampositivas, entre las cuales el 60% correspondió a SCoN, cifra similar a la informada por otros autores11,13,17. Encontramos que el 67,5% de los aislamientos ocurrieron en neonatos con sepsis probada, mientras que el 32,5% fueron bacterias consideradas contaminantes de hemocultivos, todos pertenecientes a SCoN. Hay informes que indican que las tasas de contaminación de los cultivos están entre el 0,6% y más del 6% en las diferentes instituciones. Los SCoN representan más del 50% de las bacterias aisladas en hemocultivos en prematuros en los EE. UU. y muchos centros de todo el mundo. La proporción de falsos positivos (de los cuales más del 67% son SCoN) es directamente proporcional a la edad del niño y es tan alta como del 17% en neonatos<12 semanas de vida1. Cuando un patógeno potencial crece a partir de un hemocultivo, es importante distinguir entre sepsis verdadera y crecimiento de una bacteria potencialmente contaminante. La sepsis verdadera ocurrida en nuestros neonatos estuvo asociada a clínica, generalmente con alteraciones en el laboratorio (hemograma y proteína C reactiva) y aislamiento de una bacteria patógena habitual como E. coli o S. agalactiae entre otras. Algunos casos de sepsis por SCoN, en especial Staphylococcus epidermidis (S. epidermidis) ocurrieron en neonatos prematuros, con compromiso sistémico y con catéteres centrales, acompañados de signos clínicos y en general con cambios de laboratorio. Para ello se requirió el aislamiento de SCoN en al menos un hemocultivo en sangre periférica y otro en sangre obtenida por barrido de catéter central. Para diferenciar si una recuperación bacteriana en sangre obedece a una infección verdadera o representa una contaminación, se emplean técnicas de cultivo cuantitativo. En SAC generalmente las densidades bacterianas en los cultivos obtenidos por catéter central son mayores (entre 4 y 10 veces) a las obtenidas por sangre periférica18,19. Sin embargo, nuestro centro no contó con este tipo de cultivos, por lo cual la definición de cultivo contaminado, no tuvo en cuenta un conteo de UFC. Para nosotros el crecimiento bacteriano en hemocultivos para SCoN fue del 2,6% en las primeras 24h y del 89,8% a las 48h, similar a lo descrito por Evans y Fine10. Estos autores informan que TCB≥36h están muy relacionados con contaminación de los hemocultivos (p=0,028). Haimi-Cohen et al.19 informan que cuando las densidades de SCoN son<10UFC/mL, los TCB en hemocultivos fueron siempre>16,5h, mientras que cuando las densidades de SCoN fueron≥100UFC/mL el TCB en hemocultivos fue<15,5h.
Los microorganismos bacterianos patógenos más frecuentemente aislados son la E. coli y S. agalactiae, reconocidos colonizadores del tracto genitourinario gastrointestinal materno20. En nuestro trabajo, estas 2 bacterias representaron el 29,9 y 20,8% respectivamente de todos los casos de sepsis. Para los prematuros la E. coli fue el predominante, tal como es referenciado en la literatura20,21, mientras el S. agalactiae es el principal microorganismo causante de la sepsis en neonatos de término20. De otro lado, tanto los Staphylococcus aureus como los SCoN o Staphylococcus no aureus están asociados más frecuentemente a sepsis tardía, sepsis asociada a la atención en salud, especialmente en neonatos prematuros, siendo los S. epidermidis los causantes del 60-93% de las sepsis por SCoN22,23.
El TCB en hemocultivos para la mayoría de los microorganismos patógenos en niños es<24h17,24–26 y<36h de incubación27. En este informe encontramos que para bacilos gramnegativos el TCB fue significativamente más corto que para bacterias grampositivas (p=0,0050), mientras que para SCoN fue significativamente más prolongado (p<0,001). Nuestros datos informan que todos los grampositivos mostraron TCB a las 36h y todos los gramnegativos a las 48h de incubación. Mientras tanto, para el caso de los SCoN, el 46,2, 89,8 y 100% tuvieron TCB a las 36h, 48h y 62h, respectivamente. Nuestros TCB son similares a los informados por otros autores6,11–13,25,28. Guerti et al.14 informan TCB significativamente más cortos para bacilos gramnegativos que para bacterias grampositivas (p=0,001), mientras bacterias grampositivas no SCoN tienen TCB significativamente más cortos que SCoN (p=0,001).
Los TCB de E. coli, K. pneumoniae y S. agalactiae estuvieron entre 11-12h de incubación de los hemocultivos, siendo estos datos similares a los mostrados por otros autores10,14,17,28. Cuando comparamos los TCB para sepsis neonatal temprana y tardía no asociada a la atención en salud, encontramos TCB muy similares, aunque significativamente más prolongados para las sepsis temprana. Estos datos son contrarios a los informados por Jardine et al.28, para quienes en sepsis temprana el TCB fue menor (mediana 13,7h; RI: 11-16,7h) que en los casos de sepsis tardía (mediana 17,2h; RI: 12,2-23,4h).
A pesar de sus limitaciones, el hemocultivo sigue siendo el estándar de oro para la detección de bacteriemia. Una correcta interpretación de resultados de los cultivos es fundamental desde el punto de vista del cuidado del paciente individual, de epidemiología hospitalaria y de salud pública. Las pistas que pueden ayudar a diferenciar la contaminación de una bacteriemia real incluyen la identidad del organismo, número de conjuntos de cultivo positivos, número de botellas positivas dentro de un conjunto, TCB, cantidad de crecimiento, clínica y datos de laboratorio, fuente de cultivo y la clasificación de la tecnología automatizada utilizada. Hall y Lyman informan que los SCoN representaron el 44,3% de los aislamientos, entre los cuales el 82% fueron contaminaciones29. Ahora bien, algunos TCB en hemocultivos han sido considerados como determinantes de contaminación. Varios estudios han encontrado que cultivos que se hacen positivos a los 3-5 días después de la incubación han sido ocasionados por bacterias contaminantes30–33. En nuestro informe, el 100% de los hemocultivos fue positivo≤62h, incluyendo los microorganismos contaminantes.
En conclusión, en este trabajo, en sepsis temprana y en sepsis en neonatos a término, el microorganismo más frecuentemente aislado fue S. agalactiae, en sepsis tardía y en sepsis en neonatos prematuros el más importante fue E. coli. El TCB en sepsis tardía es significativamente más corto que en sepsis temprana. Un período de incubación de 48h es suficiente para descartar la sepsis en el neonato asintomático con sepsis temprana y tardía asociada o no a la atención en salud, utilizando el sistema BacT/Alert de detección microbiana. De acuerdo con nuestros resultados, ante la sospecha de sepsis asociada o no a la atención en salud, puede ser seguro el retiro de antibióticos si la clínica y el laboratorio no sugieren una sepsis y los hemocultivos son negativos a las 48h. Esta información es sumamente importante, ya que acorta el tiempo de uso de los antibióticos empíricos, con lo cual se reduce la resistencia antimicrobiana, se acortan las estancias hospitalarias, se disminuye la carga de trabajo y se rebajan los costos para el sistema de salud.
Conflicto de interesesEste trabajo cumple con los requisitos sobre consentimiento/asentimiento informado, comité de ética, financiación, estudios animales y sobre la ausencia de conflicto de intereses según corresponda.