El síndrome de hipoplasia de corazón izquierdo (SHCI) es una cardiopatía congénita con letalidad superior al 95%. La etapificación quirúrgica es la principal vía de tratamiento, y se inicia con la operación de Norwood; la sobrevida a largo plazo de los pacientes tratados es desconocida en nuestro medio.
Objetivos1) Revisar nuestra experiencia en el manejo de todos los pacientes con SHCI evaluados entre enero 2000 y junio 2010. 2) Identificar factores de riesgo de mortalidad quirúrgica.
Pacientes y métodoEstudio retrospectivo de una única institución con una cohorte de pacientes con SHCI. Se revisan antecedentes clínicos, quirúrgicos, y registros de seguimiento.
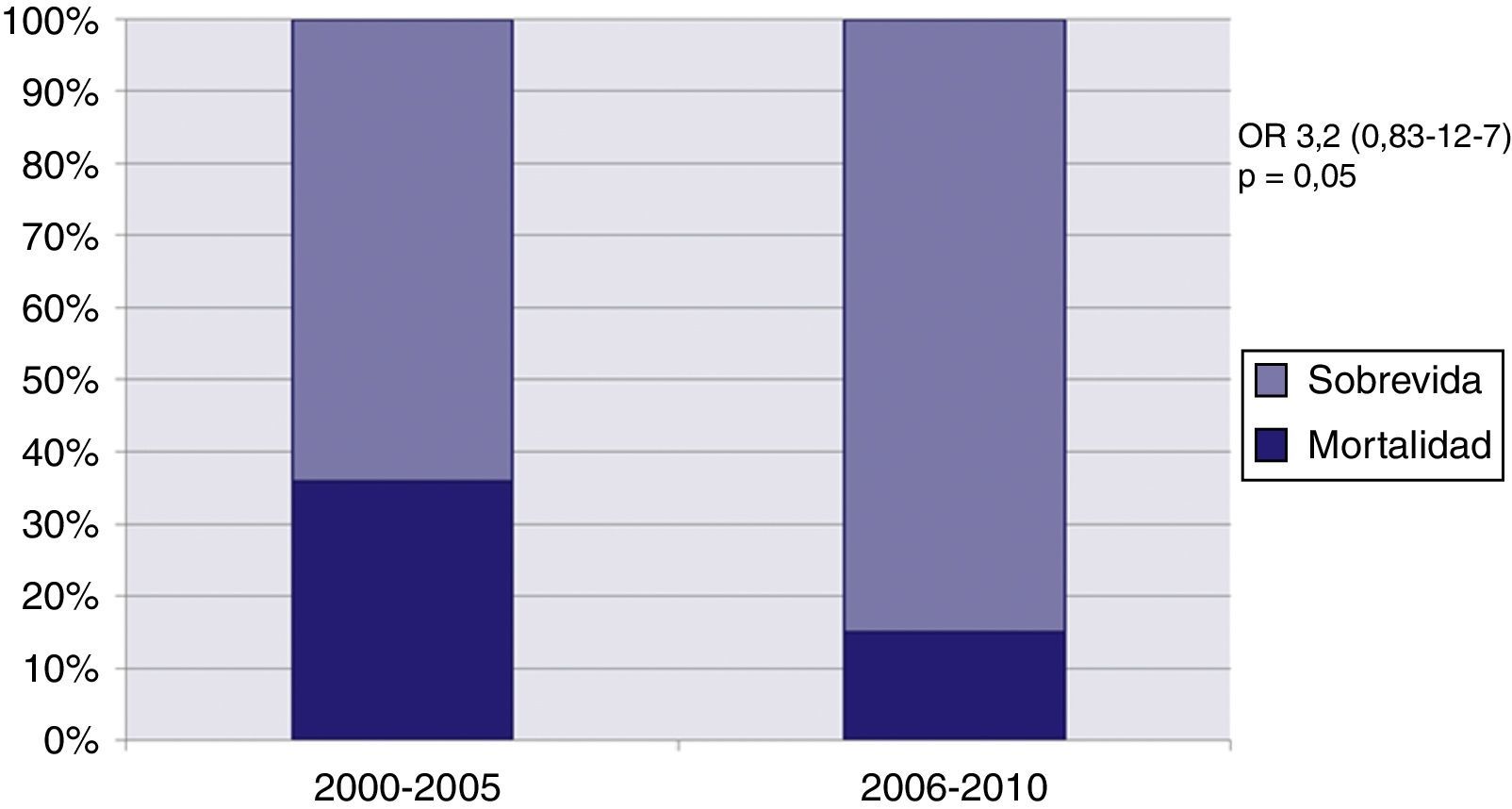
ResultadosSe evaluaron 76 pacientes con SHCI; 9/76 tenían comunicación interauricular (CIA) restrictiva, y 8/76, aorta ascendente de <2mm; 65/76 fueron tratados: 77% tuvieron operación de Norwood con conducto entre ventrículo derecho y ramas pulmonares como fuente de flujo pulmonar, 17% Norwood con shunt de Blalock-Taussig, y 6% otra cirugía. La mortalidad en la primera etapa quirúrgica fue del 23%, y en operación de Norwood, del 21,3%. En el período 2000-2005 la mortalidad en la primera etapa quirúrgica fue del 36%, y entre 2005-2010, del 15% (p=0,05). La sobrevida global fue del 64% a un año y del 57% a 5años. Por análisis multivariado fueron factores de riesgo para mortalidad la presencia de aorta ascendente diminuta y CIA restrictiva.
ConclusionesNuestros resultados inmediatos y a largo plazo en la etapificación quirúrgica de SHCI son similares a la experiencia de grandes centros. Hay una mejoría en mortalidad operatoria en la segunda mitad de la serie. Se identifican factores de riesgo de mortalidad.
Hypoplastic left heart syndrome (HLHS) is a lethal congenital heart disease in 95% of non-treated patients. Surgical staging is the main form of treatment, consisting of a 3-stage approach, beginning with the Norwood operation. Long term survival of treated patients is unknown in our country.
Objectives1) To review our experience in the management of all patients seen with HLHS between January 2000 and June 2012. 2) Identify risk factors for mortality.
Patients and methodRetrospective analysis of a single institution experience with a cohort of patients with HLHS. Clinical, surgical, and follow-up records were reviewed.
ResultsOf the 76 patients with HLHS, 9 had a restrictive atrial septal defect (ASD), and 8 had an ascending aorta ≤2mm. Of the 65 out of 76 patients that were treated, 77% had a Norwood operation with pulmonary blood flow supplied by a right ventricle to pulmonary artery conduit, 17% had a Norwood with a Blalock-Taussig shunt, and 6% other surgical procedure. Surgical mortality at the first stage was 23%, and for Norwood operation 21.3%. For the period between 2000-2005, surgical mortality at the first stage was 36%, and between 2005-2010, 15% (P=.05). Actuarial survival was 64% at one year, and 57% at 5years. Using a multivariate analysis, a restrictive ASD and a diminutive aorta were high risk factors for mortality.
ConclusionsOur immediate and long term outcome for staged surgical management of HLHS is similar to that reported by large centres. There is an improvement in surgical mortality in the second half of our experience. Risk factors for mortality are also identified.
El síndrome de hipoplasia de corazón izquierdo (SHCI) es un espectro de malformaciones congénitas del corazón caracterizadas por diversos grados de subdesarrollo del ventrículo izquierdo y la aorta ascendente. Desde un punto de vista fisiológico, tiene como denominador común un ventrículo izquierdo incapaz de mantener la circulación sistémica; la sobrevida depende de la eyección del ventrículo derecho y la persistencia del ductus arterioso. Se trata de una cardiopatía relativamente infrecuente, correspondiendo al 7,5% del total de cardiopatías congénitas, pero con una historia natural severa: sin tratamiento quirúrgico el 95% de los niños afectados fallece dentro del primer mes de vida, siendo la principal causa de mortalidad neonatal por cardiopatías congénitas1,2. El manejo del SHCI ha significado un desafío mayor en la historia de la cirugía de las cardiopatías congénitas. El año 1981 el Dr. William Norwood reportó la primera paliación quirúrgica satisfactoria en SHCI, y posteriormente en 1983 describió la etapificación quirúrgica, con la operación de Fontan como etapa definitiva, en la cual el ventrículo derecho (VD) funciona como ventrículo sistémico3,4. En 1990 Bridges describe la incorporación de la anastomosis cavopulmonar bidireccional5, u operación de Glenn bidireccional (GBD), como una etapa intermedia en pacientes de alto riesgo para la operación de Fontan. Hoy en día esta paliación quirúrgica en 3 etapas (operación de Norwood en período neonatal, operación de GBD a los 4-6meses de edad, operación de Fontan a los 2-4años de edad) constituye la principal vía de tratamiento en niños con SHCI, en la mayoría de los grandes centros cardioquirúrgicos pediátricos6.
Los resultados quirúrgicos de esta cardiopatía han mejorado en forma importante en los últimos años, lo cual puede atribuirse tanto a modificaciones en la técnica quirúrgica, como a una mejor comprensión de los desafíos en el cuidado postoperatorio de estos pacientes. Uno de los más importantes avances quirúrgicos ha sido la incorporación en la operación de Norwood de un conducto entre el VD y la arteria pulmonar (AP), o shunt de Sano7; esta modificación en la fuente de flujo pulmonar se introdujo como una alternativa al shunt de Blalock-Taussig (SBT) modificado derecho clásico. La operación de Norwood-Sano se asocia a mayor estabilidad hemodinámica postoperatoria inmediata, mejor función ventricular y mayor sobrevida inmediata8,9. En la actualidad la mortalidad quirúrgica de las diversas etapas, según lo reportado por diversas series internacionales, varía entre el 10 y el 30% en la operación de Norwood10,11, del 2 al 5% en la operación de GBD9, y del 3 al 5% en la operación de Fontan9, con una sobrevida actuarial a 5años del 50 al 54%, y a 10años del 38 al 50%12-14. A nivel nacional, nuestro grupo reportó una mortalidad quirúrgica del 24% en la operación de Norwood en pacientes con distintas formas de corazón univentricular, incluyendo aquellos con forma clásica de SHCI15. El Hospital Clínico de la Pontificia Universidad Católica de Chile inició el año 2000 un programa cardioquirúrgico en etapas para SHCI; en 2003 incorporamos la modificación de Sano a la operación de Norwood.
Los objetivos de este trabajo fueron analizar los resultados inmediatos y alejados de todos los pacientes con diagnóstico de SHCI evaluados en nuestro centro en el período 2000-2010, analizando su morbilidad, la mortalidad quirúrgica y la mortalidad global; se analizan además factores de riesgo de mal pronóstico quirúrgico y global para esta patología.
Pacientes y métodoPacientesSe revisó el registro de pacientes ingresados al Hospital Clínico de la Pontificia Universidad Católica de Chile con diagnóstico de cardiopatía congénita entre enero de 2000 y junio de 2010, identificándose los portadores de SHCI según definición propuesta por la International Society for Nomenclature of Paediatric and Congenital Heart Disease16. De manera retrospectiva se obtuvieron los antecedentes clínicos y quirúrgicos de cada paciente desde las fichas clínicas, protocolos operatorios e informes de ecocardiografías realizadas en nuestra institución. Se registraron datos demográficos, anatómicos, clínicos, quirúrgicos, complicaciones perioperatorias y mortalidad. La actualización de la información se obtuvo a través de los controles de seguimiento clínico, contacto con médicos tratantes y/o registro de mortalidad de pacientes portadores de cardiopatías congénitas; la información de mortalidad fue corroborada mediante la obtención del certificado de defunción correspondiente en la oficina virtual del Registro Civil e Identificación17.
Características generalesPara cada paciente se registró información demográfica y perinatal (edad gestacional y peso de nacimiento), así como la forma de presentación al diagnóstico, diagnóstico antenatal de cardiopatía, y la presencia de malformaciones extracardíacas y síndromes genéticos asociados.
Datos anatómicosLa información anatómica se obtuvo de manera retrospectiva mediante la revisión de los informes ecocardiográficos y los hallazgos quirúrgicos correspondientes descritos en los protocolos operatorios. A cada paciente se le asignó una de 4 posibles categorías anatómicas de acuerdo al International Paediatric and Congenital Cardiac Code (IPCCC)16: atresia mitral y atresia aórtica (AM/AA), estenosis mitral y estenosis aórtica (EM/EA), atresia mitral y estenosis aórtica (AM/EA), y estenosis mitral y atresia aórtica (EM/AA). Se registró para cada paciente el tamaño de la aorta ascendente, la presencia o ausencia de coartación aórtica, las características del septum interauricular (en especial, existencia de septum interauricular restrictivo, definido por ecocardiografía y comportamiento clínico), la presencia o ausencia de insuficiencia tricuspídea, la presencia de disfunción sistólica ventricular derecha, y eventuales anomalías del retorno venoso pulmonar.
Datos quirúrgicos y postoperatorioLos detalles de la técnica quirúrgica han sido descritos previamente15. Se registró el tipo de cirugía realizada, la edad a la cirugía, el tiempo de circulación extracorpórea, el pinzamiento aórtico y el paro circulatorio con hipotermia profunda, así como el momento del cierre esternal (primario o diferido). Se analizó la frecuencia de complicaciones durante el postoperatorio. Se definió como síndrome de hipodébito (SH) al cuadro clínico caracterizado por acidosis metabólica, oligoanuria, mala perfusión distal y/o hipotensión, que haya requerido de manejo específico. Se registró la presencia de otras complicaciones (arritmias, fracaso de extubación, infecciones, falla renal y parálisis de cuerdas vocales).
Definición de mortalidadSe definió como mortalidad operatoria la muerte ocurrida dentro de los 30días posteriores a la intervención quirúrgica, ya sea que el fallecimiento se presentara dentro o fuera del hospital. La muerte ocurrida posterior a los 30días postoperatorios se consideró mortalidad interetapas, ya sea que el fallecimiento se presentara dentro o fuera del hospital.
Análisis estadísticoSe realizó análisis estadístico descriptivo de variables continuas presentadas como mediana y rango. Algunas variables continuas fueron dicotomizadas para crear variables categóricas, para su posterior análisis. Las variables categóricas son presentadas como número y frecuencias. Se realizó análisis estadístico con software SPSS (IBM) versión 19. Se realizó análisis con test de Mann-Whitney de comparación de medianas en variables continuas y test de Chi cuadrado o test exacto de Fischer en variables categóricas. Se realizó análisis univariado de factores de riesgo para mortalidad operatoria y global. Los factores de riesgo significativos en el modelo univariado fueron incluidos en el análisis multivariado, con modelo de regresión lineal múltiple. Los factores de riesgo se muestran como odds ratio (OR) y su respectivo intervalo de confianza (IC) del 95%. Se calculó sobrevida actuarial con método de Kaplan-Meier al grupo total y por subgrupos, y se realizó comparación de curvas con test de Log-Rank. Se consideró como estadísticamente significativo un valor de p<0,05.
El estudio fue aprobado por el Comité de Ética de la Facultad de Medicina, Pontificia Universidad Católica de Chile.
ResultadosSe identificó un total de 76 pacientes con diagnóstico de SHCI ingresados en nuestra Institución en el período estudiado. Se observó un aumento progresivo del número de ingresos por año, con un promedio de 5 ingresos por año en el período 2000-2005 y 10,2 ingresos por año en el período 2006 a junio de 2010. Las características generales de los pacientes, incluyendo características demográficas, antropométricas y perinatales, se describen en la tabla 1. La forma de presentación más frecuente al diagnóstico fue diagnóstico antenatal (55,3%), seguido de shock cardiogénico (10,5%), soplo cardíaco (9,2%) y cianosis (9,2%).
Características de los pacientes con diagnóstico de SHCI (n=76)
| Características generales | |
| Mujeresa | 32 (42,1%) |
| Prematureza | 8 (10,5%) |
| Síndrome genéticoa | 7 (9,2%) |
| Malformaciones extracardíacasa | 8 (10,5%) |
| Peso de nacimiento (g)b | 3.260 (1.760-4.310) |
| Edad gestacional (semanas)b | 38,5 (34-40) |
| Edad al diagnóstico (días)b | 0 (0-9) |
| Características anatómicas | |
| Subgrupo anatómicoa | |
| AM/AA | 39 (51,3%) |
| EM/EA | 19 (25%) |
| EM/AA | 14 (18,4%) |
| AM/EA | 2 (2,6%) |
| Septum interauricular restrictivoa | 9 (11,8%) |
| Anomalías del drenaje venoso pulmonara | 4 (5,2%) |
| Insuficiencia tricuspídea más que levea | 8 (10,5%) |
| Disfunción sistólica de VDa | 8 (10,5%) |
| Coartación aórticaa | 59 (77%) |
| Aorta ascendente (mm)b | 2,55 (1,7-7) |
| Aorta ascendente menor de 2 mma | 8 (10,5%) |
De los 76 pacientes identificados, 65 fueron intervenidos quirúrgicamente; los motivos por los cuales 11/76 pacientes (14,5%) no fueron operados fueron: presencia de síndrome malformativo o genopatía (4/11), patología grave del sistema nervioso central (3/11), falla orgánica múltiple (3/11) y prematurez (1/11). Todos estos pacientes fallecieron en una mediana de 13,5días (rango 7-172días).
En los 65 pacientes sometidos a cirugía, el procedimiento realizado fue operación de Norwood con modificación de Sano en 50 casos (77%), Norwood con SBT en 11 casos (17%), procedimiento híbrido en 2 casos (3%), y otra cirugía en 2 casos (3%) (reparación de coartación aórtica en un caso y anastomosis de Damus-Kaye-Stansel en otro). La mortalidad operatoria en la primera etapa quirúrgica fue de 15/65 (23%): 13 pacientes sometidos a cirugía de Norwood y 2 pacientes sometidos a procedimiento híbrido. La mortalidad en la operación de Norwood fue de 13/61 (21,3%). Las características clínicas de la primera cirugía se describen en la tabla 2. Dentro de las complicaciones postoperatorias de la primera etapa destacan el SH y la falla renal como las más frecuentes. La mediana de estadía en unidad de cuidados intensivos fue de 13,5 (2-86) días, y la de hospitalización total, de 20 (4-86) días.
Caracterización de cirugía primera etapa. Incluye pacientes con operación de Norwood y pacientes con procedimientos híbridos (sin CEC) (n=65)
| Características generales | |
| Edad (días)b | 8 (0-18) |
| Tiempo de CEC (min)b | 199 (0-294) |
| Tiempo de pinzamiento aórtico (min)b | 75 (0-159) |
| Tiempo de PCHP (min)b | 15 (0-102) |
| Características del período postoperatorio | |
| Cierre esternal diferidoa | 56 (86%) |
| Tiempo de esternón abierto (días)b | 4 (0-11) |
| Tiempo de ventilación mecánica (días)b | 7 (2-86) |
| Tiempo de estadía en UCI (días)b | 13,5 (2-86) |
| Tiempo de estadía hospitalaria (días)b | 20 (4-86) |
| Complicaciones del período postoperatorio | |
| Síndrome de hipodébitoa | 20 (31%) |
| Arritmiaa | 9 (13,8%) |
| Falla de extubación | 12 (18,4%) |
| Infeccióna | 13 (20%) |
| Falla renala | 17 (26,2%) |
| Parálisis de cuerda vocala | 16 (24,6%) |
CEC: circulación extracorpórea; PCHP: paro circulatorio con hipotermia profunda.
En los 50 pacientes que sobrevivieron al período postoperatorio de la primera etapa quirúrgica se registró una mortalidad interetapas de 5 pacientes (7,7%). De los 45 pacientes sobrevivientes, 3 de ellos cambiaron de centro de referencia, trasladándose a continuar su etapificación en otro centro asistencial, y un paciente fue sometido a reparación biventricular.
Fueron sometidos a operación de GBD 41 pacientes. La mortalidad operatoria en esta cirugía fue de 2/41 (4,8%). La mortalidad interetapa en este momento de la evolución fue de un caso (2,4%). Al momento del análisis de la casuística, 18 pacientes se encontraban en etapa de GBD.
Completaron la anastomosis cavopulmonar total con operación de Fontan 20 pacientes. La mortalidad operatoria en esta etapa fue de 2/20 (10%). La mortalidad posterior a la cirugía de Fontan es de un caso (5%).
En los pacientes operados, la sobrevida actuarial fue del 64% a un año y del 57% a 5años, la que se grafica en la figura 1. En el análisis por subgrupo anatómico de los pacientes operados no hay diferencias estadísticamente significativas en sobrevida actuarial.
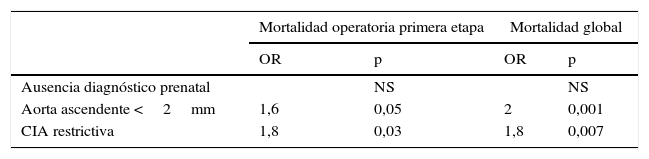
El análisis univariado de factores de riesgo de mortalidad operatoria y global mostró que la presencia de aorta ascendente diminuta (<2mm) y la obstrucción al retorno venoso pulmonar, ya sea por comunicación interauricular restrictiva, como por anomalías del drenaje venoso pulmonar obstructivas, resultaron factores de riesgo significativos para mortalidad operatoria y global. La ausencia de diagnóstico antenatal resultó ser un factor de riesgo significativo de mortalidad operatoria para la primera etapa en el análisis univariado (tabla 3a). Al realizar análisis multivariado se obtiene como factores de riesgo significativo de mortalidad operatoria y global solamente la presencia de aorta ascendente diminuta, y la restricción al retorno venoso pulmonar (tabla 3b).
Análisis univariado de factores de riesgo de mortalidad operatoria en primera etapa y global
| Mortalidad operatoria primera etapa | Mortalidad global | |||
|---|---|---|---|---|
| OR | p | OR | p | |
| Peso <2.500g | 2,2 (0,4-10,3) | NS | 4 (0,89-17) | NS |
| Ausencia diagnóstico prenatal | 7,9 (1,2-185) | 0,02 | 1,97 (0,7-5,4) | NS |
| Forma anatómica | 0,8 (0,2-2,6) | NS | 1,1 (0,4-2,7) | NS |
| Aorta ascendente <2mm | 5,6 (1,1-28) | 0,02 | 15,1 (1,8-127) | 0,002 |
| CIA restrictiva | 5,7 (1,1-29) | 0,02 | 13 (1,6-110) | 0,01 |
| Insuficiencia tricuspídea | 0,37 (0,1-1,4) | NS | 1,04 (0,4-2,9) | NS |
| Disfunción de VD | 0,73 (0,02-5) | NS | 2,2 (0,47-12) | NS |
| SBT vs Sano | 1,1 (0,1-6) | NS | 3,1 (0,7-14) | NS |
CIA: comunicacion interauricular; SBT: shunt de Blalock-Taussig; VD: ventrículo derecho.
Análisis multivariado de factores de riesgo de mortalidad operatoria en primera etapa y global
| Mortalidad operatoria primera etapa | Mortalidad global | |||
|---|---|---|---|---|
| OR | p | OR | p | |
| Ausencia diagnóstico prenatal | NS | NS | ||
| Aorta ascendente <2mm | 1,6 | 0,05 | 2 | 0,001 |
| CIA restrictiva | 1,8 | 0,03 | 1,8 | 0,007 |
CIA: comunicacion interauricular.
Finalmente, se analizó la mortalidad operatoria de la cirugía para la primera etapa por períodos, dividiendo los procedimientos realizados entre la primera parte del programa (2000-2005) y la segunda parte (2005-2010). La mortalidad operatoria en la primera etapa fue del 36%, con una tendencia a la disminución en el segundo período al 15% (p=0,05). Esta relación se grafica en la figura 2.
DiscusiónEl manejo del SHCI continúa hoy en día siendo uno de los principales desafíos en cardiocirugía pediátrica. La experiencia lograda en los últimos 20años, incluyendo una mejoría en el manejo médico y quirúrgico de esta patología, ha significado una preferencia en la mayoría de los centros a nivel mundial por la etapificación quirúrgica10,18. Sin embargo, la operación de Norwood para SHCI tiene una mortalidad significativamente mayor que la de otras cirugías realizadas en el período neonatal19. Un elemento importante en dicha operación, que ha recibido especial atención y que en parte podría explicar una mejoría en los resultados quirúrgicos, es la elección del tipo de fuente de flujo pulmonar (SBT modificado versus conducto de Sano). La Pediatric Heart Network condujo un estudio comparativo llamado «Single Ventricle Reconstruction» en 15 centros norteamericanos, cuyos resultados fueron publicados recientemente20. En este estudio, 555 pacientes en quienes se realizó la operación de Norwood para SHCI o patologías asociadas a VD fueron aleatoriamente designados para recibir el conducto entre VD-AP (Sano) o SBT como fuente de flujo pulmonar. El logro primario, sobrevida libre de trasplante a 12meses postaleatorización, fue significativamente mayor en el grupo Sano que en el grupo SBT (74% vs 64%; p=0,01). A mayor período de seguimiento, sin embargo, la sobrevida entre ambos grupos no demostró diferencias significativas, existiendo solo una tendencia a mejores resultados en el grupo Sano. Es muy probable que el flujo continuo hacia el pulmón generado por el SBT determine menor presión diastólica aórtica, menor perfusión coronaria, y aumento en la relación entre flujo pulmonar y flujo sistémico. Sin embargo, es necesario contar con estudios con mayor tiempo de seguimiento para poder evaluar los factores potencialmente deletéreos del conducto de Sano, como podrían ser el daño al VD generado por una ventriculotomía, y AP potencialmente más pequeñas y distorsionadas, elementos importantes a considerar en pacientes con etapificación univentricular hacia la vía de Fontan. Estudios recientes (Pediatric Heart Network SVR Extension Study) sugieren que en pacientes con SHCI el tipo de shunt escogido en la operación de Norwood impacta la función del VD previo a la etapa de Fontan, y en aquellos en que se elige el conducto de Sano existiría un deterioro en la función del VD, al parecer como reflejo de remodelamiento del VD21. En el seguimiento a largo plazo de nuestros pacientes es importante considerar este factor, lo cual deberá ser motivo de futuros estudios.
Dada la alta mortalidad inicial en la operación de Norwood, algunos centros en la década de los noventa desarrollaron una opción alternativa, conocida como «procedimiento híbrido» (por la combinación de un procedimiento quirúrgico y uno por cateterismo intervencional), que consiste en implante de un stent en el ductus arterioso para mantenerlo abierto, asociado a regulación del flujo pulmonar mediante cerclajes en las ramas pulmonares, y septostomía del septum interauricular22. La vía «híbrida» para SHCI ha sido desarrollada en centros con alta mortalidad en la operación de Norwood, por su eventual menor mortalidad en la etapa inicial y su potencial ventaja en cuanto a evitar el paro circulatorio y la hipotermia profunda inherentes a la operación de Norwood23-25. Sin embargo, dado que los elementos anatómicos fundamentales del SHCI permanecen sin haber cambiado luego de la primera etapa de la vía hibrida, la operación que necesariamente se debe realizar en la etapa ii de esta vía es técnicamente más compleja comparada con el GBD habitual de la vía Norwood, que tiene una baja incidencia de morbimortalidad. La etapa ii de la vía hibrida se transforma en una gran operación que incluye reconstrucción del arco aórtico, retiro de cerclajes y plastia de las AP, y creación del shunt cavopulmonar bidireccional. Posterior a la etapa ii, ambas estrategias convergen en una operación de Fontan común. Los resultados reportados demuestran una sobrevida similar postetapa ii en ambas vías, cercana al 80%, aunque con mayor incidencia de reintervención y menor calibre de las ramas pulmonares, en pacientes que siguieron la vía híbrida25. En nuestra serie solo 2 pacientes siguieron esta vía, dado que se ha optado como vía preferencial de paliación quirúrgica la operación de Norwood, habiéndose reservado la vía híbrida solo para los peores casos anatómicos y/o fisiológicos.
Los resultados expuestos por nuestro grupo reflejan la experiencia de 10años de un programa cardioquirúrgico para el tratamiento del SHCI en un único centro. La mortalidad operatoria y global observada en la serie es similar a la reportada en la literatura10-14, y comparable a los resultados reportados por Ohye et al.20. Se observa también una tendencia a una disminución en mortalidad operatoria en la operación de Norwood, que es la que concentra la mayor mortalidad en la etapificación quirúrgica, en la segunda mitad del período estudiado. Esto probablemente es atribuible a muchos factores, entre ellos la mejoría en la estabilización preoperatoria, y mayor experiencia en el manejo postoperatorio inmediato. El cambio de técnica entre SBT y conducto de Sano no resultó ser un factor significativo en esta disminución, probablemente dado el bajo número de pacientes sometidos a cirugía con SBT en los comienzos de nuestro programa.
En el análisis de la sobrevida actuarial en los pacientes que recibieron tratamiento quirúrgico es necesario incluir la mortalidad operatoria de la operación de Norwood, mortalidad inter etapas y muertes tardías post-Fontan. En nuestra serie, la sobrevida a 5años es del 57%, cifra comparable a lo reportado en la literatura para esta patología, aunque se requiere un mayor seguimiento para confirmar estos resultados11.
En la búsqueda de factores de riesgo de mortalidad operatoria y global se identificó la presencia de una aorta ascendente diminuta como factor de riesgo significativo. Esto puede explicarse por la dificultad en la manipulación quirúrgica de la aorta en la cirugía de primera etapa, con el consiguiente riesgo de alteraciones de la geometría que pudieran determinar alteraciones de la perfusión coronaria en este grupo, así como mayor riesgo de isquemia miocárdica ya superada la etapa de Norwood que pudiera llevar a muerte súbita o disfunción ventricular a largo plazo. Se identificó también la restricción al retorno venoso pulmonar como un factor de riesgo de mortalidad operatoria y global, lo que es concordante con lo reportado en la literatura26,27. Se cree que esto está relacionado con la presencia de hipertensión venosa pulmonar que produce alteraciones de grado variable en la vasculatura pulmonar, en algunos casos desde la etapa prenatal, lo que es especialmente deletéreo en la fisiología de Fontan.
Es destacable que un 55% de nuestros pacientes tuvieron diagnóstico prenatal de su patología; en teoría, el diagnóstico antenatal ofrecería varias ventajas, especialmente el evitar la presentación clásica de cardiopatías obstructivas izquierdas relacionada con el cierre del ductus arterioso, cuya consecuencia es un SH agudo, con acidosis metabólica y falla multiorgánica secundaria. Sin embargo, de manera similar a lo reportado en series internacionales28, la presencia de diagnóstico antenatal no mostró impacto en la mortalidad operatoria ni global.
Estos resultados demuestran la evolución que ha presentado la paliación univentricular en SHCI en nuestro grupo, como consecuencia de las modificaciones introducidas en la técnica quirúrgica, cuidados pre y postoperatorio, y seguimiento a mediano plazo, todo lo cual da cuenta de una mayor experiencia del equipo a cargo del programa. A medida que mejora la mortalidad quirúrgica inicial en la operación de Norwood, se hace necesario concentrar esfuerzos en mejorar la mortalidad interetapas, que en esta serie fue del 7,7% entre las etapas i y ii, y del 2,4% entre las etapas ii y iii. Como ha sido demostrado por otros grupos, esto es lograble con la introducción de programas de seguimiento adecuados y medidas de vigilancia estricta de estos pacientes posterior al alta, incluyendo programas de monitorización domiciliaria29,30.
ConclusiónHace 3 décadas el SHCI era considerado una cardiopatía congénita letal, y en nuestro país no existía experiencia en el manejo quirúrgico de esta enfermedad. Los resultados presentados demuestran el progreso logrado en nuestro centro cardioquirúrgico en los últimos años en el manejo de esta patología, destacando una mortalidad operatoria en la operación de Norwood del 21,3%, con una mortalidad en la primera etapa quirúrgica del 23%. Destaca además una mejoría en mortalidad en la primera etapa quirúrgica, desde un 36% en la primera mitad de la serie al 15% en la segunda mitad, y una sobrevida a 5 años de los niños tratados cercana al 60%. Esto se compara favorablemente con resultados obtenidos en grandes centros pediátricos en EE.UU. y Europa. Importantes desafíos se presentan, especialmente en cuanto a mejorar la mortalidad operatoria, la mortalidad interetapas, y la morbimortalidad a largo plazo en estos pacientes.
Conflicto de interesesEste trabajo cumple con los requisitos sobre consentimiento/asentimiento informado, comité de ética, financiación, estudios animales y sobre la ausencia de conflicto de intereses según corresponda.