El empleo de sulfato de magnesio para neuroprotección fetal es un tratamiento cada vez más frecuente.
ObjetivoEstudiar la asociación entre sulfato de magnesio administrado a la gestante y la necesidad de reanimación neonatal.
Pacientes y métodoEstudio prospectivo de un grupo de prematuros menores de 32 semanas expuestos al sulfato de magnesio como neuroprotector y otro grupo retrospectivo inmediatamente anterior al inicio de este tratamiento. En ambos grupos se descartaron los casos que no habían recibido maduración pulmonar con corticoides. Se analizaron y compararon el porcentaje de reanimación y diferentes comorbilidades.
ResultadosSe incluyó a 107 prematuros, 56 expuestos al sulfato de magnesio. El porcentaje de reanimación avanzada fue similar en ambos grupos. No se encontraron diferencias en mortalidad, ventilación mecánica invasiva, tiempo de la primera deposición y otras comorbilidades.
ConclusionesEl sulfato de magnesio para neuroprotección no aumenta de forma significativa la necesidad de reanimación de los prematuros menores de 32 semanas.
Magnesium sulphate administration is recommended for foetal neuroprotection in pregnant women at imminent risk of early preterm birth.
ObjectiveTo evaluate the relationship between intrapartum magnesium sulphate for foetal neuroprotection and delivery room resuscitation of preterm infants less 32 weeks.
Patients and methodA prospective observational study was conducted on preterm infants less 32 weeks exposed to magnesium sulphate for neuroprotection, and a comparison made with another historic group immediately before starting this treatment. Cases in both groups that had not reached lung maturity with corticosteroids were rejected. The rates of resuscitation, morbidity and mortality for each of the groups were analysed and compared.
ResultsThere was a total of 107 preterm, with 56 exposed to magnesium sulphate. Rate of advanced resuscitation were similar between the two groups. There were no other differences in mortality, invasive mechanical ventilation, time to first stool, and other comorbidities.
ConclusionsIntrapartum magnesium sulphate for foetal neuroprotection was not associated with an increased need for intensive delivery room resuscitation and other morbidities in these cohorts of less than 32 weeks preterm infants.
La neuroprotección con sulfato de magnesio administrada a la madre ha demostrado su utilidad para reducir los casos de parálisis cerebral en menores de 32 semanas1. El magnesio desempeña un importante papel en el tono vascular, bloqueando el canal de calcio de las células del músculo liso y produciendo vasodilatación. A nivel cerebral, no se conoce con exactitud su mecanismo de acción, pero contribuye a la estabilidad hemodinámica, evita los daños neuronales por hiperexcitabilidad, evitando la apoptosis en situaciones de hipoxia cerebral, y tienes propiedades antioxidantes y antinflamatorias2.
Los posibles efectos adversos del uso de sulfato de magnesio en perinatología han sido la depresión respiratoria, la hipotonía y las alteraciones del patrón de deposiciones. Existen pocos estudios sobre el efecto del sulfato de magnesio prenatal en el recién nacido prematuro para neuroprotección fetal. Nuestro objetivo primario es determinar si la exposición a sulfato de magnesio aumenta la necesidad de reanimación avanzada en prematuros menores de 32 semanas.
Pacientes y métodoSe incluyó a pacientes prematuros menores de 32 semanas admitidos en la Unidad de Neonatología del Hospital Universitario Santa Lucía de Cartagena, España, entre octubre del 2012 y marzo del 2015. Ellos fueron comparados con controles históricos, sin exposición a magnesio, 2,5 años inmediatamente anteriores al inicio del protocolo. No existieron cambios importantes en el manejo de los recién nacidos en este periodo, salvo la administración no invasiva de surfactante. Criterios de inclusión: cumplir criterios para neuroprotección (vide infra) y haber recibido al menos una dosis de corticoides para maduración pulmonar (entendida como al menos una dosis de corticoides 12 h antes del parto). Los criterios para neuroprotección fetal fueron: edad gestacional entre 24+0 y 31+6 semanas; parto pretérmino en curso en gestación única o múltiple; riesgo de parto prematuro e indicación o posibilidad de finalización electiva por causa materna o fetal en menos de las próximas 24h. Las contraindicaciones maternas fueron: cardiopatías, bloqueos cardiacos, insuficiencia renal, miastenia gravis, insuficiencia respiratoria, hipocalcemia e hipopotasemia, y las contraindicaciones fetales fueron tener grandes malformaciones o previsión del parto en menos de 2h. Criterios de exclusión: traslado posnatal a nuestro hospital, malformaciones digestivas diagnosticadas prenatalmente o haber recibido sulfato de magnesio por otras causas.
La administración materna de sulfato de magnesio consistió en una carga de 4g seguido de una perfusión de 1g/h, al menos durante 4h, con un máximo de 12h. La decisión sobre la necesidad de ventilación mecánica (VM) y otros aspectos era valorada por el médico responsable en cada momento. En general, colocamos CPAP nasal de forma rutinaria en menores de 29 semanas si existe adecuado esfuerzo respiratorio. Si esas medidas no son efectivas, se aplica VM. Se analizaron la edad materna, el tipo de parto, la sospecha de corioamnionitis, la diabetes materna, el peso, la edad gestacional, los corticoides maternos, el Apgar al minuto y 5 min, la necesidad de reanimación (definiendo como reanimación la ventilación con presión positiva intermitente, la intubación, el masaje cardiaco o el uso de fármacos), el apoyo respiratorio máximo (ventilación no invasiva, VM convencional, ventilación de alta frecuencia oscilatoria), la necesidad de surfactante, la necesidad de hemoderivados, sepsis confirmada, ductus que precisó tratamiento médico o quirúrgico, ecografías cerebrales patológicas (excluida la hemorragia intraventricular grados i y ii), índice de Clinical Risk Index for Babies, la ausencia de deposiciones a las 48 y 72h de vida y la necesidad de nutrición parenteral. La enterocolitis necrosante se definió a partir de grado iiA de Bell. El retraso de la evacuación de meconio se basó en ese diagnóstico al alta, la necesidad de enemas de gastrografín y la consulta a Cirugía Pediátrica por este motivo. Posteriormente, se hizo un análisis por subgrupos de edad gestacional. Este estudio fue aprobado por el Comité de Ética de nuestro hospital.
Se creó una tabla de recogida de datos y estos fueron analizados con el paquete estadístico SPSS® versión 20. Para el estudio descriptivo se usaron las medias ± desviación estándar, y la mediana y rango, según distribución, usando el test de Kolmogorov-Smirnov. Las variables cualitativas se estudiaron mediante los test de la chi al cuadrado y el test exacto de Fisher, según procediera. Las variables cuantitativas se estudiaron mediante la t de Student o la prueba de Mann-Whitney. Se realizó estudio de regresión logística para ajustar los resultados por otros factores distintos de la exposición al magnesio, como el peso, la edad gestacional, la edad la madre, el tipo de parto, la diabetes materna y la presencia de corioamnionitis Se consideran valores estadísticamente significativos aquellos con p<0,05. Para el cálculo del tamaño muestral se emplearon los datos de necesidad de presión positiva intermitente en la reanimación del estudio SEN1500 de 20113 (56%), calculándose al menos unos 48 pacientes en cada rama para demostrar una diferencia clínicamente relevante en el efecto (estimado como un aumento del 56 al 82%) con un poder del 80% (error beta=0,2) y un error alfa de 0,05 a 2 colas. Otros estudios europeos, como el Euroneonet, dan cifras del 67,7% de reanimación en este grupo de pacientes, pero consideran reanimación la CPAP en la sala de partos4.
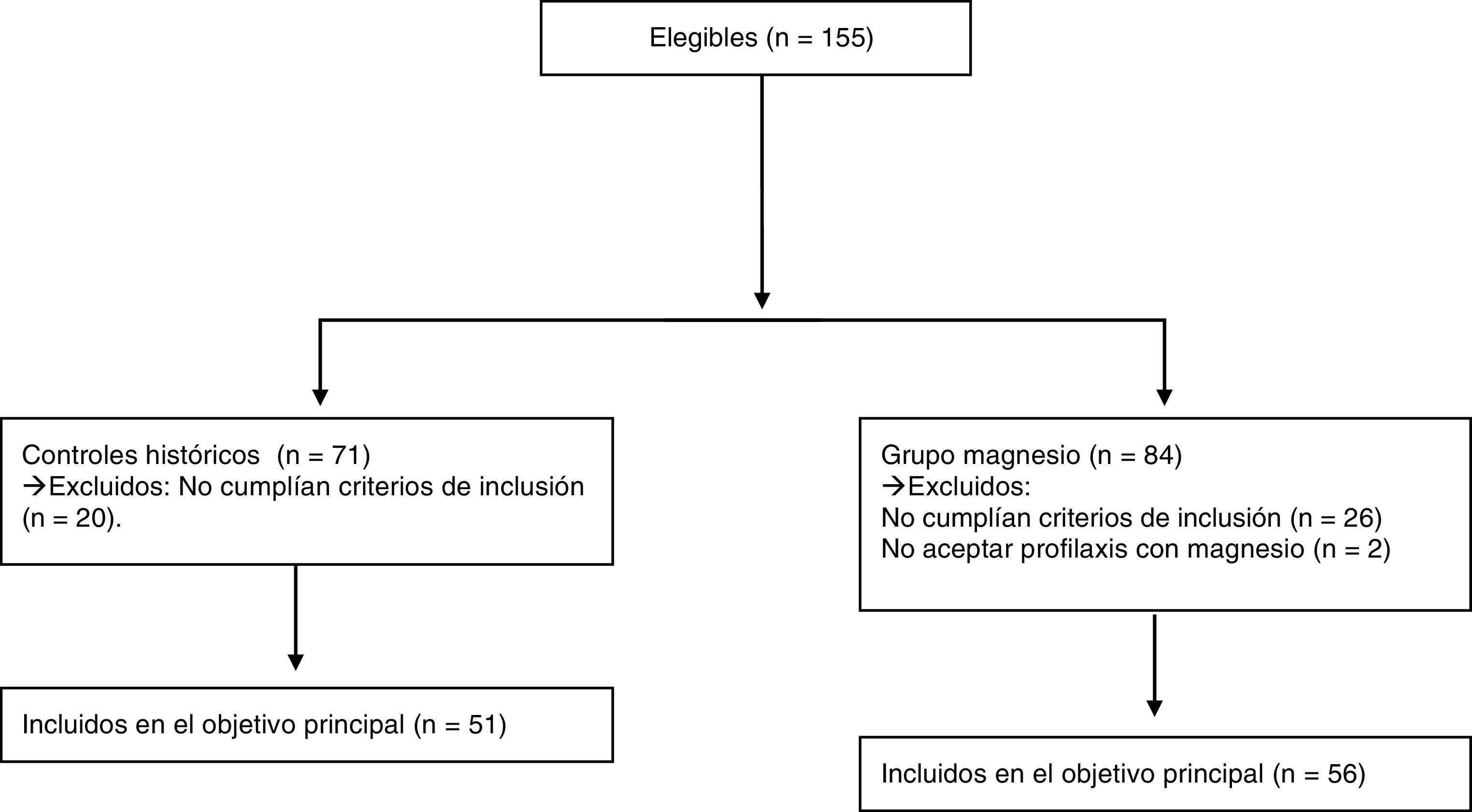
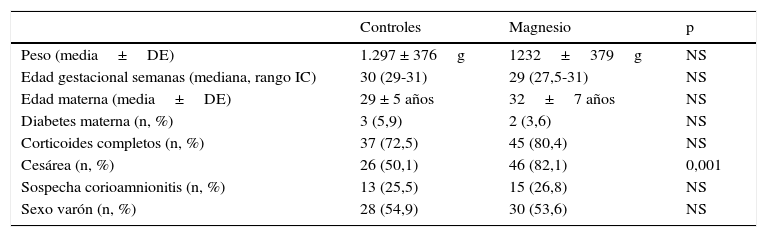
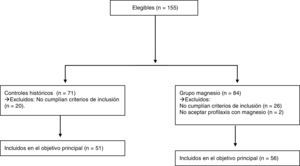
ResultadosDel total de 155 niños menores de 32 semanas ingresados durante ese periodo, fueron elegibles 107 (fig. 1). Los excluidos lo fueron principalmente por no haber recibido corticoterapia materna para maduración pulmonar (porcentaje similar en ambos grupos). De ellos, 56 madres recibieron sulfato de magnesio. En los controles se recogieron 51 neonatos. Todos los recién nacidos fueron atendidos por al menos un neonatólogo en el paritorio. Las características de los grupos se exponen en la tabla 1. Los grupos de estudio no diferían, salvo un mayor porcentaje de cesáreas en el grupo del magnesio (p=0,001).
Características de los grupos en estudio
| Controles | Magnesio | p | |
|---|---|---|---|
| Peso (media±DE) | 1.297 ± 376g | 1232±379g | NS |
| Edad gestacional semanas (mediana, rango IC) | 30 (29-31) | 29 (27,5-31) | NS |
| Edad materna (media±DE) | 29 ± 5 años | 32±7 años | NS |
| Diabetes materna (n, %) | 3 (5,9) | 2 (3,6) | NS |
| Corticoides completos (n, %) | 37 (72,5) | 45 (80,4) | NS |
| Cesárea (n, %) | 26 (50,1) | 46 (82,1) | 0,001 |
| Sospecha corioamnionitis (n, %) | 13 (25,5) | 15 (26,8) | NS |
| Sexo varón (n, %) | 28 (54,9) | 30 (53,6) | NS |
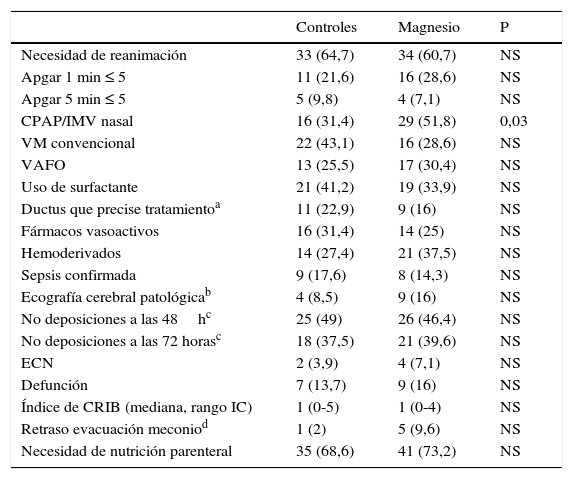
No existieron diferencias significativas en cuanto a la necesidad de recibir presión positiva intermitente, intubación o masaje cardiaco entre los grupos (tabla 2). De forma secundaria, no se encontraron diferencias entre la necesidad de uso de surfactante, ductus que precisara tratamiento, fármacos vasoactivas, hemoderivados, tener una ecografía cerebral patológica o defunción. El grupo expuesto al magnesio tuvo más porcentaje de uso de CPAP nasal, aunque no hubo diferencias en el uso de cualquier tipo de soporte ventilatorio. En cuanto al inicio de las deposiciones espontáneas, no existieron diferencias entre ambos grupos ni en cuanto al diagnóstico de enterocolitis necrosante o perforación intestinal espontánea. En el análisis de regresión logística, usando como variable dependiente la necesidad de reanimación, no se encontraron factores asociados independientes (peso, edad gestacional, edad materna, cesárea, sospecha corioamnionitis, diabetes, magnesio, maduración completa).
Resultados neonatales en los grupos de estudio (n, %)
| Controles | Magnesio | P | |
|---|---|---|---|
| Necesidad de reanimación | 33 (64,7) | 34 (60,7) | NS |
| Apgar 1 min ≤ 5 | 11 (21,6) | 16 (28,6) | NS |
| Apgar 5 min ≤ 5 | 5 (9,8) | 4 (7,1) | NS |
| CPAP/IMV nasal | 16 (31,4) | 29 (51,8) | 0,03 |
| VM convencional | 22 (43,1) | 16 (28,6) | NS |
| VAFO | 13 (25,5) | 17 (30,4) | NS |
| Uso de surfactante | 21 (41,2) | 19 (33,9) | NS |
| Ductus que precise tratamientoa | 11 (22,9) | 9 (16) | NS |
| Fármacos vasoactivos | 16 (31,4) | 14 (25) | NS |
| Hemoderivados | 14 (27,4) | 21 (37,5) | NS |
| Sepsis confirmada | 9 (17,6) | 8 (14,3) | NS |
| Ecografía cerebral patológicab | 4 (8,5) | 9 (16) | NS |
| No deposiciones a las 48hc | 25 (49) | 26 (46,4) | NS |
| No deposiciones a las 72 horasc | 18 (37,5) | 21 (39,6) | NS |
| ECN | 2 (3,9) | 4 (7,1) | NS |
| Defunción | 7 (13,7) | 9 (16) | NS |
| Índice de CRIB (mediana, rango IC) | 1 (0-5) | 1 (0-4) | NS |
| Retraso evacuación meconiod | 1 (2) | 5 (9,6) | NS |
| Necesidad de nutrición parenteral | 35 (68,6) | 41 (73,2) | NS |
CPAP: presión positiva continua en la vía aérea; CRIB: Clinical Risk Index for Babies; ECN: enterocolitis necrosante; IMV: ventilación mandatoria intermitente; VAFO: ventilación de alta frecuencia oscilatoria; VM: ventilación mecánica.
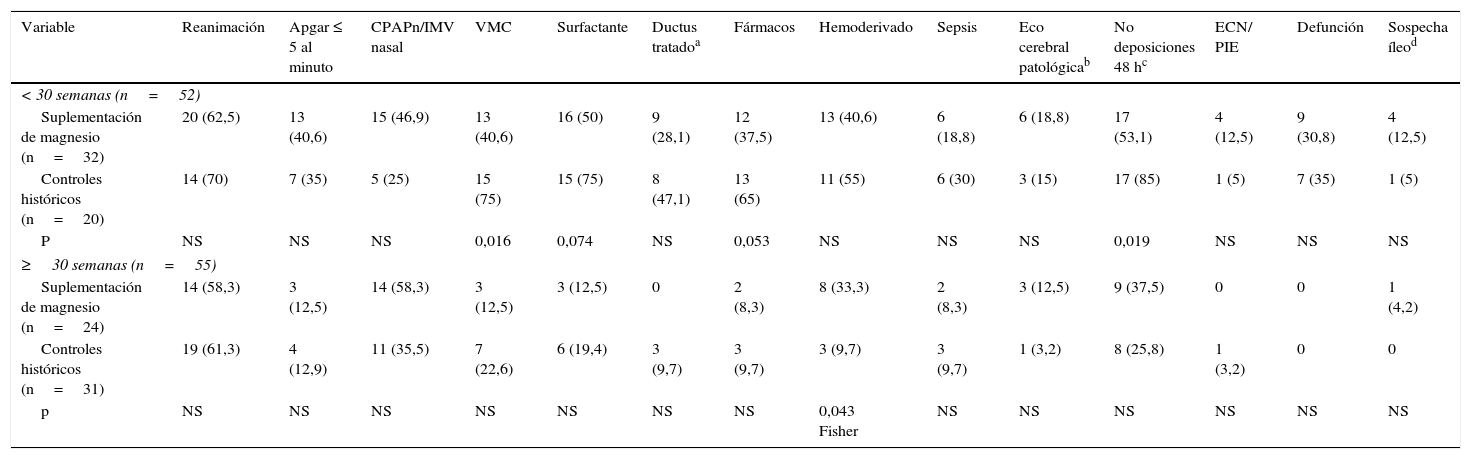
Analizando según subgrupos por edad gestacional, en menores de 30 semanas hubo mayor uso de VM en el grupo que no recibió magnesio y el número de niños que no tuvieron deposiciones a las 48h era significativamente mayor. En ambos grupos, la necesidad de reanimación fue similar (tabla 3).
Análisis según subgrupos por edad gestacional (n, %)
| Variable | Reanimación | Apgar ≤ 5 al minuto | CPAPn/IMV nasal | VMC | Surfactante | Ductus tratadoa | Fármacos | Hemoderivado | Sepsis | Eco cerebral patológicab | No deposiciones 48 hc | ECN/ PIE | Defunción | Sospecha íleod |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| < 30 semanas (n=52) | ||||||||||||||
| Suplementación de magnesio (n=32) | 20 (62,5) | 13 (40,6) | 15 (46,9) | 13 (40,6) | 16 (50) | 9 (28,1) | 12 (37,5) | 13 (40,6) | 6 (18,8) | 6 (18,8) | 17 (53,1) | 4 (12,5) | 9 (30,8) | 4 (12,5) |
| Controles históricos (n=20) | 14 (70) | 7 (35) | 5 (25) | 15 (75) | 15 (75) | 8 (47,1) | 13 (65) | 11 (55) | 6 (30) | 3 (15) | 17 (85) | 1 (5) | 7 (35) | 1 (5) |
| P | NS | NS | NS | 0,016 | 0,074 | NS | 0,053 | NS | NS | NS | 0,019 | NS | NS | NS |
| ≥30 semanas (n=55) | ||||||||||||||
| Suplementación de magnesio (n=24) | 14 (58,3) | 3 (12,5) | 14 (58,3) | 3 (12,5) | 3 (12,5) | 0 | 2 (8,3) | 8 (33,3) | 2 (8,3) | 3 (12,5) | 9 (37,5) | 0 | 0 | 1 (4,2) |
| Controles históricos (n=31) | 19 (61,3) | 4 (12,9) | 11 (35,5) | 7 (22,6) | 6 (19,4) | 3 (9,7) | 3 (9,7) | 3 (9,7) | 3 (9,7) | 1 (3,2) | 8 (25,8) | 1 (3,2) | 0 | 0 |
| p | NS | NS | NS | NS | NS | NS | NS | 0,043 Fisher | NS | NS | NS | NS | NS | NS |
ECN: enterocolitis necrotizante; VMC: ventilación mecánica.
El uso de sulfato de magnesio en la madre ha sido frecuente en el tratamiento de la eclampsia, preeclampsia y como tocolítico5. El magnesio atraviesa la placenta de forma pasiva o facilitada y llega al feto en concentraciones mayores que en la madre ante exposiciones prolongadas. Desde la revisión Cochrane de 20091, se recomienda con el objetivo de neuroprotección fetal en menores de 32 semanas, siendo necesarias tratar 63 madres para prevenir un caso de parálisis cerebral, con escasos efectos adversos en el recién nacido a las dosis recomendadas (riesgo de hipermagnesemia con hiporreflexia y depresión respiratoria), por lo que el uso de sulfato de magnesio se está volviendo una práctica cada vez más común en embarazadas. Dicha revisión no encuentra diferencias en mortalidad neonatal, hemorragia intraventricular, leucomalacia, Apgar menor de 7 a los 5 min, convulsiones, hipotonía, etc., solamente una discreta reducción en la necesidad de VM en quienes recibieron magnesio. Recientemente se ha sugerido que la neuroprotección puede deberse a un aumento del flujo sanguíneo cerebral6.
Existen algunas dudas sobre otros posibles efectos adversos que este tratamiento puede crear en el recién nacido, dado que otros estudios sí encuentran menores valoraciones del Apgar al minuto y 5 min, hipotonía, necesidad de intubación, en relación significativa con el nivel de magnesio en la madre, aunque la mayoría son en neonatos a término y a dosis para el tratamiento de la preeclampsia y eclampsia7. En otros trabajos, el uso de sulfato de magnesio se asoció a mayores tasas de ductus que precisaban tratamiento8, debido al papel que sobre el tono vascular tiene el magnesio y a menor respuesta a la indometacina9; alteraciones óseas neonatales con el uso prolongado10, supresión paratiroidea11, alteraciones neutrofílicas12, mayor riesgo de hemorragia intraventricular13, corioamnionitis14 o mayor tasa de ingreso en cuidados intensivos en neonatos a término15. Dos trabajos multicéntricos recientes, uno en menores de 29 semanas, no encontraron diferencias en la necesidad de intubación o asistencia respiratoria en las primeras 24h en los niños expuestos; incluso el riesgo de necesitar esa asistencia respiratoria era menor al tercer día16. El otro trabajo no encontró diferencias en la necesidad de intubación o masaje cardiaco en menores de 32 semanas17. Nosotros no encontramos diferencias en la necesidad de VM convencional, y sí un mayor porcentaje de ventilación no invasiva en quienes recibieron magnesio. Es posible que estos cambios se deban a la cada vez menor tendencia hacia la intubación. Concordantemente, en el subgrupo menor de 30 semanas de controles históricos, el empleo de VM fue significativamente mayor.
El tratamiento con sulfato de magnesio en la madre se ha relacionado con el retraso de la evacuación de meconio, síndrome del tapón meconial18-20 y perforación intestinal espontánea21 en prematuros. Este último puede deberse además a otras patologías, como la propia prematuridad, ser hijo de madre diabética o alteraciones en las células de Cajal22. La relación con la administración de sulfato de magnesio no está dilucidada, existiendo comunicaciones de casos aislados. En un estudio reciente en prematuros el flujo mesentérico fue similar, pero no aumentó en los primeros 5 días de vida en aquellos expuestos a magnesio, aunque no hubo diferencias en la primera deposición, tiempo en alcanzar la alimentación completa o tolerancia alimentaria23. Sorprendentemente, pues el uso de sulfato de magnesio se ha asociado con el retraso en la evacuación de meconio, el subgrupo de menores de 30 semanas expuestos a magnesio tuvieron, con mayor frecuencia, su primera deposición en las primeras 48 h, frente a los no expuestos, de forma estadísticamente significativa.
Parece evidente que los escasos efectos adversos de la perfusión de magnesio dependen de la dosis total administrada a la madre. Algunos autores propugnan que el magnesio debería ser monitorizado para mantener los niveles neonatales en límites seguros, no debiendo repetirse ciclos de tratamiento sin valorar el posible riesgo neonatal24-26.
En nuestro estudio no hubo un aumento significativo de la necesidad de reanimación en menores de 32 semanas expuestos a magnesio para neuroprotección, con alguna dosis de maduración pulmonar, pero tiene varias limitaciones, principalmente las derivadas de usar una cohorte histórica y no haberse monitorizado niveles maternos ni fetales de magnesio. Además, la estimación del tamaño muestral se realizó estimando una diferencia importante en la tasa de reanimación, donde un aumento más discreto precisaría de estudios de mayor tamaño. Finalmente, desconocemos si el aumento en el número de cesáreas en el grupo del magnesio influyó en los resultados. Esto pudo deberse a que se frenen los partos para dar tiempo a la administración del sulfato y que esto se asocie a mayor número de cesáreas, aunque por el diseño del estudio no podemos afirmarlo de modo fehaciente. Futuros estudios prospectivos aleatorizados permitirían discriminar con precisión los efectos de la exposición a magnesio prenatal.
ConclusionesEl sulfato de magnesio para neuroprotección fetal administrado a la madre no aumenta la necesidad de reanimación de prematuros de menos de 32 semanas. Tampoco se ha apreciado un aumento de forma significativa de otras morbilidades neonatales.
Conflicto de interesesEste trabajo cumple con los requisitos sobre consentimiento/asentimiento informado, comité de ética, financiación, estudios animales y sobre la ausencia de conflicto de intereses según corresponda.