La participación de mecanismos epigenéticos, junto con infecciones en etapas tempranas de la vida, moldean lesiones premalignas del cáncer, en particular el cáncer gástrico, uno de los tumores más frecuentes en Chile, Latinoamérica y el mundo. El principal objetivo de este artículo, como parte de la serie de revisiones en torno a mecanismos epigenéticos en el desarrollo de enfermedades crónicas, es actualizar el rol de alteraciones epigenéticas (i.e. metilación del ADN) en el contexto de la infección crónica por H. pylori en las etapas precursoras del cáncer gástrico. Las investigaciones desarrolladas en esta área permiten delinear desafíos e interrogantes, en los cuales la pediatría tiene un papel preponderante en el desarrollo de estrategias de prevención y detección temprana de esta enfermedad.
The role of epigenetics and infectious diseases at early stages of life influence pre-malignant lesions of cancer, in particular, gastric cancer, one of the most frequent tumours in Chile, Latin America, and worldwide. This article examines the role of H.pylori and epigenetic alterations (i.e. DNA methylation) at early stages of gastric cancer and proposes, from the paediatric point of view, strategies for prevention and early detection.
El cáncer, como otras enfermedades crónicas, es el resultado de interacciones complejas entre genoma y ambiente. Es así como exposiciones prolongadas a agentes infecciosos contribuyen al desarrollo del cáncer en sujetos con determinanda programación epigenética. Este artículo es la continuación de la serie de revisiones en torno a la participación de los mecanismos epigenéticos en el desarrollo de enfermedades crónicas, y los capítulos anteriores ya han presentado los conceptos de modificaciones epigenéticas y su rol en la accesibilidad y modulación de la transcripción génica1,2. También ya han señalado cómo algunas de estas modificaciones epigenéticas son permanentes y potencialmente reversibles1,2. Esta revisión se enfoca en cáncer, como otro ejemplo de enfermedades crónicas, y en concreto en un tipo de cáncer particularmente relevante en la población adulta, el cáncer gástrico, y el rol de las alteraciones epigenéticas en el desarrollo de esta enfermedad a consecuencia de infecciones crónicas adquiridas durante la infancia.
El cáncer representa el 13% y el 24,6% de la mortalidad en el mundo y en Chile, respectivamente. Por otra parte, los agentes infecciosos representan la tercera causa de mortalidad asociada a cáncer3. En particular el cáncer gástrico, con 951.000 casos nuevos y 723.000 muertes anuales, ocupa el quinto lugar en incidencia y el tercero en mortalidad en el mundo, respectivamente. En países en vías de desarrollo el cáncer gástrico es un tumor particularmente prevalente, donde concentra 2/3 de su mortalidad4, y Latinoamérica tiene una de las mayores tasas de incidencia y mortalidad en el mundo5. En esta región los países con mayor mortalidad (por ejemplo >20 casos por 100.000) están en las costas del pacífico (Chile, Costa Rica, Colombia y Ecuador) y los de menor mortalidad (<4/100.000) en América del Norte (EE. UU. y Canadá) o Centroamérica (por ejemplo Cuba y Puerto Rico)5. A diferencia de otras zonas del mundo, en Latinoamérica el cáncer gástrico no está en disminución6,7, sino que al contrario, debido al envejecimiento de la población, esta neoplasia ascenderá al décimo lugar como causa global de muerte en los próximos años8.
El cáncer gástrico tiene un origen multifactorial, asociado a infecciones crónicas y a una variedad de condiciones ambientales que pueden interactuar en su desarrollo. En relación con las infecciones crónicas esta neoplasia ha sido asociada a Helicobacter pylori (H. pylori) y virus de Epstein-Barr (EBV)9,10. La infección por H. pylori ha sido encontrada hasta en el 87,4% de los casos11, y en similar frecuencia a nivel poblacional12. Por otro lado, la infección por EBV se ha descrito entre un 5% a 17% de casos13. Al igual que otros tumores asociados a agentes infecciosos, el cáncer gástrico se inicia con infecciones adquiridas en etapas tempranas de la vida14, y de ahí el rol de la pediatría en la prevención y detección temprana de esta enfermedad.
Las clasificaciones histológicas del cáncer gástrico incluyen las variantes papilar, tubular, mucinoso (coloidal) y carcinomas pobremente cohesivos, según la OMS14, como también los subtipos intestinal y difuso, según Lauren15. En esta segunda clasificación el subtipo intestinal se caracteriza por la formación de estructuras glandulares que asemejan mucosa colónica y que está precedida por una secuencia de lesiones premalignas16. Por otra parte, el subtipo difuso no forma estructuras glandulares, y en consecuencia no tiene lesiones precursoras16. Esta última forma de cáncer gástrico está fuertemente asociada a herencia familiar17,18. La vigencia de la clasificación histológica de Lauren, en el contexto de la urgencia de nuevas clasificaciones moleculares19, se basa en que esta permite su asociación con lesiones premalignas del cáncer gástrico. En este sentido, y a consecuencia de infección persistente por H. pylori, las lesiones premalignas siguen una secuencia específica16, iniciándose con inflamación crónica en la mucosa del estómago en etapas tempranas de la vida20, denominada gastritis crónica no atrófica (GCNA). A consecuencia de la infección persistente por H. pylori, la GCNA puede evolucionar hacia lesiones específicamente premalignas que incluyen gastritis atrófica, metaplasia intestinal, displasia y finalmente carcinoma gástrico16. Estudios epidemiológicos han identificado el riesgo de desarrollar cáncer gástrico para cada una de estas lesiones, que van desde 0,1% para MAG, 0,25% para metaplasia intestinal y 0,6% a 6% para displasia21.
El rol de Helicobacter pylori en la progresión de lesiones premalignas del cáncer gástricoLa cascada premaligna del cáncer gástrico postula que se inicia con la infección de H. pylori16. Modelos experimentales en primates han descrito 2 patrones de infección de H. pylori: transitoria o persistente22,23. Ambos modelos han sido confirmados en humanos y en particular en población pediátrica24,25. En Latinoamérica los 2 tipos de infección por H. pylori han sido caracterizados en asintomáticos menores de 5 años26,27 y en niños sintomáticos mayores de 3 años28. En menores de 5 años los estudios indican de 18% a 41% y de 11% a 49% (n=95) de infección persistente y transitoria, respectivamente26,27. Las infecciones persistentes fueron adquiridas durante los 24 primeros meses de vida y estuvieron asociadas al fenotipo no-secretor, definido por la incapacidad de secretar en saliva antígenos sanguíneos (p=0,02), una condición relevante a la patogenicidad de H. pylori29 y a la asistencia a salas cuna (p=0,019)27. Estos resultados indicaron además una mayor frecuencia de infección persistente en población pediátrica de Latinoamérica en comparación con otras regiones del mundo24,25,30. Un estudio subsecuente identificó que niños con infección persistente de H. pylori tenían una mayor frecuencia de cepas cagA (p=0,002) y tendencia a cepas vacA s1 (p=0,067)31.
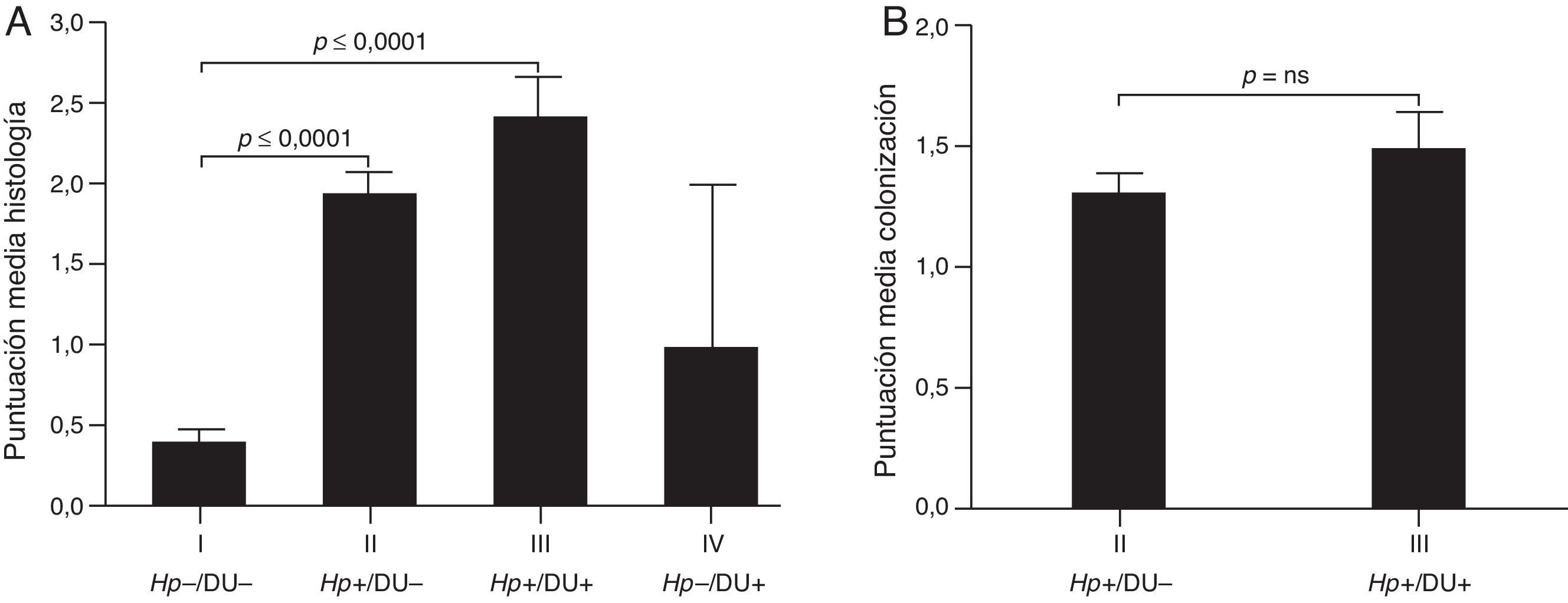
En niños asintomáticos Ganga-Zandzou et al.32 evaluaron 18 casos con infección por la misma cepa de H. pylori durante 2 años de seguimiento. El análisis histológico durante este periodo de observación longitudinal demostró una inflamación progresiva con extensión desde el antro hacia el cuerpo, y un aumento de la variante nodular de GCNA, en particular en niños infectados por cepas cagA-positivo32. En niños sintomáticos mayores a 3 años Hernandez et al.33 identificaron infección por H. pylori en el 56,1% (n=237). El análisis histológico de la mucosa gástrica en un subgrupo de casos (n=130) demostró hallazgos similares a los observados por Ganga-Zandzou et al.32. Por otra parte, la densidad bacteriana fue similar con o sin úlcera duodenal (fig. 1)33. Este estudio observó que el aumento de neutrófilos y de IFN-gamma ocurría de manera significativa en los casos con úlcera duodenal. En este sentido es relevante mencionar que la metilación del ADN es el principal mecanismo epigenético que controla la expresión de genes asociados a respuesta TH11, en particular asociado a la metilación del promotor de IFN-gamma34. Tomados en conjunto, la información presentada sugeriría que la infección persistente de H. pylori, y en particular de cepas cagA, está fuertemente asociada a respuesta inmune e inflamación de la mucosa gástrica, y en consecuencia puede evolucionar hacia lesiones premalignas más avanzadas. La decisión de esta progresión dependerá en parte del tipo de cepa infectante, cag-positiva y posiblemente vacA s1m1, que favorecerá la progresión a lesiones premalignas (por ejemplo MAG) o cag-negativa y vacA s2m2 que favorecerá la permanencia en GCNA.
Niveles de inflamación y colonización de H. pylori en 130 niños referidos a endoscopia digestiva alta por sintomatología clínica. A. La presencia de H. pylori induce de manera significativa la inflamación en la mucosa gástrica, de manera independiente a la presencia de úlcera duodenal. B. Los niveles de colonización de H. pylori en la mucosa gástrica fueron similares en niños infectados con o sin úlcera duodenal.
Tomada con autorización de Hernandez et al.33.
Las enfermedades crónicas, incluidas las neoplásicas, son el resultado de interacciones complejas entre agentes infecciosos (por ejemplo H. pylori), alteraciones del genoma/epigenoma del huésped y una variedad de condiciones ambientales que pueden interactuar en su desarrollo1. De este modo, no solo la infección persistente por H. pylori-cag-positiva y vacA s1m1 contribuiría a la progresión de la cascada de lesiones premalignas del cáncer gástrico, sino que también alteraciones en regiones codificantes y no codificantes del genoma influirían en su desarrollo. En este sentido, polimorfismos de nucleótido simple (single nucleotide polymorphisms) en regiones no-codificantes de genes asociados a respuesta inmune (IL-1beta, IL-8, IL-10, TLR-2) tienen una importante influencia en la progresión de la cascada premaligna y subtipos de cáncer gástrico35.
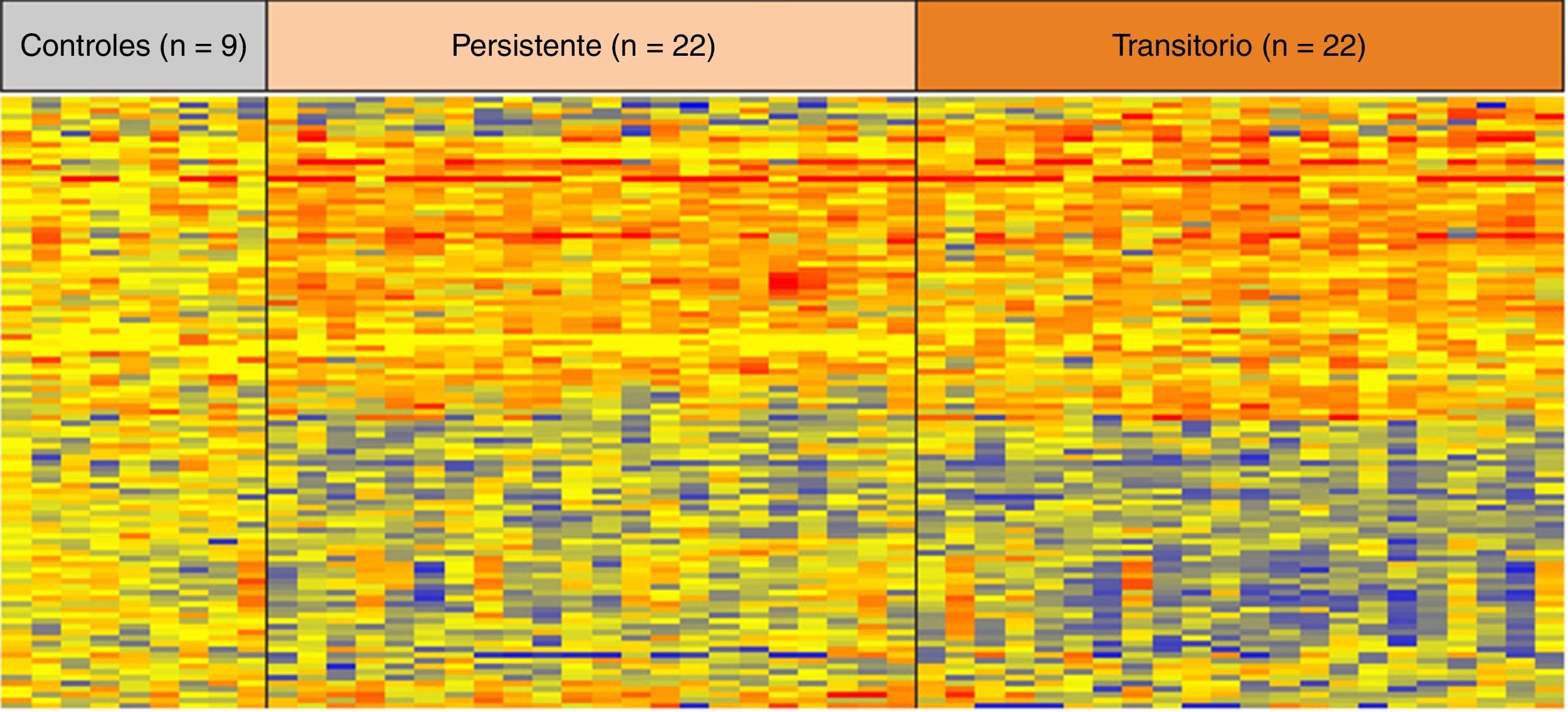
En relación con las alteraciones epigenéticas, y en el contexto de infección persistente por H. pylori, Alvarez et al. analizaron el estado de metilación de los genes Thrombospondin-1, Hypermethylated in cancer 1 y Gata binding protein-4, previamente asociados a cáncer gástrico19. Entre ellos, Thrombospondin-1 y Gata binding protein-4 estuvieron asociados a la infección por H. pylori en población pediátrica (p<0,01)36. Hallazgos similares fueron reportados por Shin et al.37 en 7 regiones promotoras de 12 genes evaluados. En este mismo escenario O’Ryan et al.31 realizaron un estudio de perfiles de expresión génica en sangre periférica en niños menores de 3 años con infecciones persistentes y transitorias de H. pylori. Entre los 810 genes diferencialmente expresados (fig. 2) se incluían algunos asociados a procesos biológicos asociados a cáncer, tales como ciclo celular (TGFA, CDT1, NUSAP1, BTG3) y apoptosis o muerte celular programada (C3ORF38, GZMH, TIAM 1, IFNG, HIPK2, SLC5A8)31. Tomados en conjunto, estas publicaciones indican que alteraciones en perfiles de expresión y metilación de múltiples genes ocurriría en etapas muy tempranas de la vida, en el contexto de infección por H. pylori, incluso previo a la aparición de lesiones histológicas asociadas a la cascada premaligna del cáncer gástrico. Estudios longitudinales deberían indicar si la metilación de estos genes favorecería la progresión hacia lesiones premalignas de cáncer gástrico.
Perfiles de expresión génica en sangre total en niños infectados por H. pylori de forma permanente y transitoria y controles sanos. La expresión de cada gen fue normalizada según la media de expresión. Cada columna representa a un individuo participante en el estudio y cada fila representa la expresión de un gen. El color rojo indica genes sobreexpresados y el color azul genes con pérdida de expresión. Tomado con autorización de O’Ryan et al.31.
La reversibilidad de la metilación y la consecuente regulación de la expresión génica38 ha abierto proyecciones terapéuticas en este campo. En este sentido, y en paralelo, Chan et al.39 y Leung et al.40 no solo demostraron una frecuente hipermetilación de E-cadherina en relación con la infección por H. pylori (p=0,002), sino también una reversión de esta metilación después de la erradicación de H. pylori. En esta línea, Maekita et al.41 han expandido este hallazgo a otros genes en población asintomática con y sin infección por H. pylori (p<0,0001). Una asociación particularmente interesante es la reportada por Schneider et al.42, al identificar que la metilación específica del gen Reprimo, un potencial gen supresor de cáncer en el cáncer gástrico38, estaría asociado a la presencia de cepas cagA positivo.
Una aproximación «omica» también ha sido desarrollada por Zhang et al.43, quienes han identificado 3.000 y 386 regiones diferencialmente metiladas después de erradicar H. pylori en mucosa gástrica y sangre periférica, respectivamente. Las regiones diferencialmente metiladas después de la erradicación correspondieron a regiones promotoras de genes, en mucosa gástrica y regiones no asociadas a genes en linfocitos de sangre periférica43. Los genes identificados en mucosa gástrica estaban principalmente asociados a vías inflamatorias, y su evaluación en el The Cancer Genome Atlas sugería una asociación a cáncer gástrico43. Tomados en conjunto, estos estudios sugieren que la infección por H. pylori está fuertemente asociada a metilación del ADN. La infección por H. pylori provocaría una masiva desregulación de genes asociados a procesos inflamatorios y cáncer. Por último, la erradicación de H. pylori lograría regresar la metilación del ADN, al menos en etapas de gastritis atrófica. Estudios experimentales que exploren estas observaciones clínicas serán necesarios para comprender en profundidad los mecanismos biológicos asociados a H. pylori y metilación del ADN.
Conclusiones finalesEl cáncer gástrico es un problema de salud pública en Chile, Latinoamérica y el mundo. A diferencia de otras regiones, en Latinoamérica el cáncer gástrico no está en disminución6,7. A consecuencia de la infección persistente por H. pylori, las lesiones premalignas siguen una secuencia específica16, iniciándose con inflamación crónica en la mucosa del estómago en etapas tempranas de la vida20. La infección por H. pylori ha sido caracterizado en asintomáticos menores de 5 años26,27 y en niños sintomáticos mayores de 3 años28. La información recogida sugeriría que la infección persistente de H. pylori y en particular de cepas cagA está fuertemente asociada a respuesta inmune e inflamación. La progresión de lesiones premalignas del cáncer gástrico son el resultado de interacciones complejas entre agentes infecciosos (por ejemplo H. pylori) y alteraciones del genoma/epigenoma del huésped las que resultan en alteraciones en perfiles de expresión y metilación de múltiples genes en etapas muy tempranas de la vida. Las alteraciones epigenéticas y la reversibilidad de la metilación han abierto nuevas proyecciones en este campo. No solo hay una frecuente hipermetilación de E-cadherina y otros genes, sino también reversión de la metilación después de erradicación de H. pylori. Tomados en conjunto, la infección por H. pylori está fuertemente asociada a metilación del ADN, provocando masiva desregulación de genes asociados a procesos inflamatorios y cáncer. La erradicación de H. pylori lograría regresión de la metilación del ADN abriendo nuevas oportunidades de prevención a temprana edad de una de las enfermedades de mayor mortalidad a nivel mundial.
FinanciamientoEste trabajo ha sido financiado por CONICYT-FONDAP #15130011 y Fondecyt Regular #1151411 del Gobierno de Chile.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Esta actualidad forma parte de un ciclo de 5 actualidades consecutivas sobre el tema de Epigenética, a ser publicadas en los números de 1 a 5 Vol. 87 de la Revista Chilena de Pediatría 2016.