La hiperuricemia se ha observado como una alteración metabólica adicional en pacientes adultos obesos, pero es poco conocida su magnitud en pacientes pediátricos.
ObjetivosAnalizar la asociación entre ácido úrico sérico (AUS) con magnitud de la obesidad general y visceral y con otras mediciones bioquímicas en niños y adolescentes obesos de Santiago, Chile.
Sujetos y métodoEn un estudio transversal se evaluaron 770 niños (edades: 6-15 años) de un colegio público de Santiago, Chile, encontrando 227 obesos (29%) (IMC>2 DE, estándares OMS). Se seleccionaron aleatoriamente 90 niños y aceptaron participar 77, sin otras enfermedades crónicas. Se evaluó: peso, talla, perímetro abdominal, adiposidad visceral con ultrasonografía abdominal y mediciones metabólicas: insulinemia, glucemia (HOMA), lípidos séricos, aspartato aminotransferasa, alanina aminotransferasa (ALT) y AUS.
ResultadosLas concentraciones de AUS fueron 0,200±0,065mmol/l. El AUS fue mayor en niños con valores de hiperinsulinismo (ajustado según edad): 0,221±0,075 vs 0,183±0,054mmol/l (p<0,01), sin diferencias según HOMA; las diferencias también se observaron según ALT (>vs<26 U/ml): 0,238±0,070 vs 0,178±0,054mmol/l, p<0,001; la regresión logística controlando por sexo, edad e intensidad de la obesidad mostró solo las ALT asociadas a aumento de AUS. No hubo asociación de mayor AUS con magnitud de IMC, adiposidad visceral o hígado graso.
ConclusionesLos niños y adolescentes obesos de Santiago, Chile, tienen una uricemia mayor en asociación a un aumento de la actividad de la enzima ALT e hiperinsulinismo. Se justifica analizar uricemia en el estudio de niños obesos y en su seguimiento.
Hyperuricaemia has been suggested as an additional metabolic factor in adult obese patients, but it has not been sufficiently studied in paediatric.
ObjectivesTo assess the relationship between serum uric acid levels (SUAL) with the level of general and visceral obesity, and other biochemical parameters in children and adolescents of Santiago, Chile.
Subjects and methodA cross sectional study was conducted on 770 children and adolescents (ages: 6-15 y.) from a public school in Santiago, Chile, of whom 227 (29%) were obese (BMI>2 SD, WHO growth standards). Ninety subjects were randomly selected and 77 with no other chronic disease (41 males) accepted to participate. Data was collected on weight, stature, abdominal circumference (AC), visceral adiposity using ultrasound, and other biochemical measurements including fasting glucose, insulin, serum lipids, aspartate aminotransferase (AST), alanine aminotransferase (ALT), and SUAL.
ResultsThe mean SUAL was 0.200±0.065mmol/L, and was increased in children with hyperinsulinism (adjusted by age: 0.221±0.075 vs 0.183±0.054mmol/L; P<.01), with no significant differences according to HOMA. Differences were also found between children with ALT>or<26 U/mL: 0.238±0.070 vs 0.178±0.054mmol/L, P<.001. The logistic regression showed the increased SUAL was only associated with increased ALT. No significant differences were found in general or visceral adiposity measurements or fatty liver.
ConclusionsChildren and adolescents from Santiago, Chile have higher uric acid serum uric acid levels as well as an association with increased ALT and insulin. It is demonstrated in this study that uric acid should be measured in obese children and adolescents, and in their follow up.
Los niños y adolescentes obesos presentan frecuentes alteraciones metabólicas asociadas a sus signos clínicos. El denominado síndrome metabólico fue descrito inicialmente para adultos jóvenes como un conjunto de alteraciones clínicas y metabólicas, con un valor predictivo para el riesgo de diabetes tipo ii y enfermedad cardiovascular en edades más avanzadas: perímetro abdominal aumentado, aumento de presión arterial sistólica y diastólica, hipertrigliceridemia, disminución de colesterol HDL e hiperglucemia. Este conjunto de alteraciones propuestas ha sido también estudiado en poblaciones pediátricas y parece tener también un buen valor predictivo para esas condiciones de la vida adulta en escolares y adolescentes1–3.
Diversos estudios han mostrado que las mediciones de obesidad general (IMC) tienen una menor asociación con riesgo de alteraciones metabólicas propias del síndrome metabólico; el perímetro abdominal, y mejor aún las mediciones ultrasonográficas de adiposidad intraabdominal, son mejores indicadores de esas alteraciones que el IMC3–6.
Se han propuesto otras alteraciones metabólicas también asociadas al síndrome metabólico en la adultez, entre ellas la hiperuricemia7–13, pero estas han sido poco estudiadas en las edades pediátricas y no disponemos información en el ámbito nacional.
El objetivo de este estudio fue analizar la asociación entre concentraciones séricas de ácido úrico con indicadores de obesidad general, de adiposidad visceral, y con otras mediciones bioquímicas relacionadas con el síndrome metabólico en escolares y adolescentes obesos.
Sujetos y métodoEstudio transversal, prospectivo. Se evaluaron 770 escolares y adolescentes, con edades de 6-15 años (rango en el cual se ha estudiado el valor pronóstico de los componentes del síndrome metabólico), asistentes a un colegio que atiende a niños de estratos socioeconómicos bajos (seleccionado por cercanía geográfica al hospital base) de Santiago, Chile. Se excluyeron aquellos que presentaran: diabetes mellitus i o ii, enfermedades neurológicas en tratamiento con anticonvulsivantes, depresión, que recibieran medicamentos hipolipidemiantes o antiinflamatorios u hormona del crecimiento o análogos de LH-RH, o corticoides de uso crónico. Se encontraron 227 niños (29%) con un IMC>2z de los estándares OMS. De estos niños se seleccionaron de forma aleatoria 90 niños a cuyos padres se les solicitó un consentimiento escrito e informado (más asentimiento a aquellos niños>8 años); finalmente 77 niños y adolescentes fueron incorporados al estudio.
El tamaño muestral fue calculado según el coeficiente de correlación entre adiposidad visceral e insulinemia basal observado por Goran et al.14; se utilizó un error alfa de 5% y un poder de 80%. La muestra requerida para el estudio fue de 75 individuos y se consideró un 15% de posibles pérdidas.
Se les midió en condiciones estandarizadas: peso, estatura, perímetro abdominal (1cm por encima de las crestas ilíacas), presión arterial; desarrollo puberal acorde a los criterios de Tanner.
La adiposidad visceral se evaluó por ultrasonografía abdominal, midiendo el segmento columna vertebral-borde interno del músculo recto anterior y la presencia de hígado graso. Fue realizada por un mismo médico radiólogo infantil entrenado en un mismo equipo ultrasonográfico ATLHDI 3000, con un transductor sectorial electrónico 3,5MHz, Phillips®, las medidas se repitieron 3 veces, consignándose el promedio. La técnica consideró a: transductor a 1cm cefálico del ombligo en la línea xifo-umbilical ejerciendo la mínima presión para visualizar la vértebra, congelamiento de la imagen en expiración y medición del segmento con los calibradores electrónicos; el segmento fue medido entre la cara ventral de la 4.ª-5.ª vértebra lumbar y la interfase de la grasa-músculo recto anterior6,12. La presencia de hígado graso se evaluó comparando la ecogenicidad hepática con la del riñón ipsilateral y se categorizó como normal o sospecha de hígado graso (hiperecogenicidad evidente).
Las mediciones metabólicas en ayunas fueron: insulinemia basal, glucemia (HOMA), lípidos séricos, enzimas aspartato aminotransferasa (AST) y alanino aminotransferasa (ALT) y uricemia. La estimación de insulina se hizo mediante radioinmunoanálisis (kit RIA DCP, LA, USA), clasificándose como hiperinsulinismo en los sujetos prepúberes con insulina basal ≥10uUI/ml y en los púberes ≥15uUI/ml15.
Los triglicéridos fueron medidos con la técnica de ATP peroxidasa (kit de reactivos 7D74). Se consideró hipertrigliceridemia a triglicéridos plasmáticos ≥100mg/dl. El colesterol HDL fue medido directamente (kit 3K 33HDL/1E68 calibrador HDL). De acuerdo a los criterios de Cook et al.1 consideramos riesgo cardiovascular el colesterol HDL≤40mg/dl.
La uricemia se midió de acuerdo al método de la uricasa descrito por Trivedi y Kabasakalian16,17.
El estudio fue previamente aprobado por el Comité de Ética en investigación del Instituto de Nutrición y Tecnología de los Alimentos de la Universidad de Chile. Se les solicitó firmar a los padres y niños (>8 años) un consentimiento-asentimiento escrito e informado.
El análisis estadístico incluyó estadística descriptiva, correlación lineal de Pearson, «t» de Student para evaluar diferencias entre variables continuas paramétricas; se efectuaron diversos modelos de regresión múltiple logística para estudiar asociaciones entre variables clínicas y uricemia categorizadas. Además se llevaron a cabo curvas ROC de sensibilidad-especificidad para analizar los puntos de corte más adecuados para asociaciones entre transferasas con hígado graso ecográfico, distancia ecográfica columna-músculo recto anterior o insulinemia, o entre uricemia y las otras variables metabólicas.
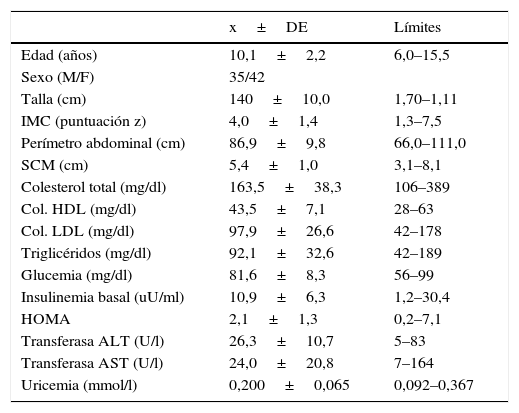
ResultadosLas características de los niños y adolescentes estudiados se muestran en la tabla 1.
Características de los niños y adolescentes obesos chilenos estudiados (n=77)
| x±DE | Límites | |
|---|---|---|
| Edad (años) | 10,1±2,2 | 6,0–15,5 |
| Sexo (M/F) | 35/42 | |
| Talla (cm) | 140±10,0 | 1,70–1,11 |
| IMC (puntuación z) | 4,0±1,4 | 1,3–7,5 |
| Perímetro abdominal (cm) | 86,9±9,8 | 66,0–111,0 |
| SCM (cm) | 5,4±1,0 | 3,1–8,1 |
| Colesterol total (mg/dl) | 163,5±38,3 | 106–389 |
| Col. HDL (mg/dl) | 43,5±7,1 | 28–63 |
| Col. LDL (mg/dl) | 97,9±26,6 | 42–178 |
| Triglicéridos (mg/dl) | 92,1±32,6 | 42–189 |
| Glucemia (mg/dl) | 81,6±8,3 | 56–99 |
| Insulinemia basal (uU/ml) | 10,9±6,3 | 1,2–30,4 |
| HOMA | 2,1±1,3 | 0,2–7,1 |
| Transferasa ALT (U/l) | 26,3±10,7 | 5–83 |
| Transferasa AST (U/l) | 24,0±20,8 | 7–164 |
| Uricemia (mmol/l) | 0,200±0,065 | 0,092–0,367 |
Col.: colesterol; IMC: índice de masa corporal; SCM: segmento ultrasonográfico columna-músculo recto anterior.
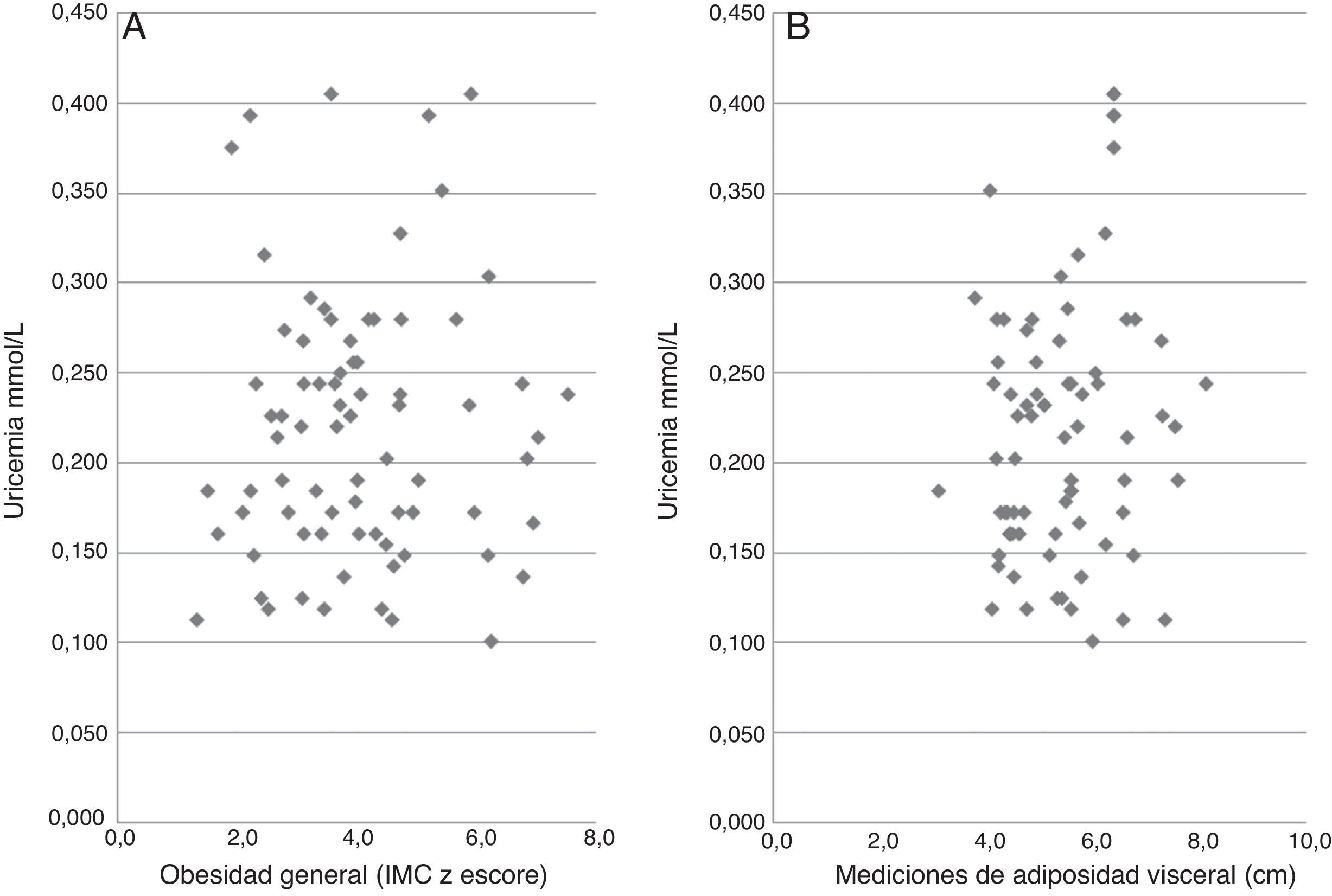
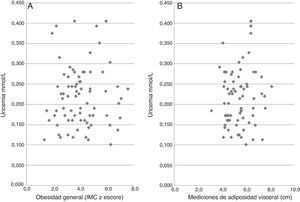
Las concentraciones de AUS fueron 0,200±0,065mmol/l (3,36±1,10mg/dl), sin diferencias estadísticamente significativas entre varones y mujeres (0,205±0,065 vs 0,194±0,065mmol/L, NS). El límite superior de normalidad de nuestra muestra (x+2SD) fue similar al descrito para adultos (0,319mmol/l=4,92mg/dl); un 7% de los niños presentaron concentraciones sobre ese límite y otro 18% las tenían entre +1 y+2z (fig. 1).
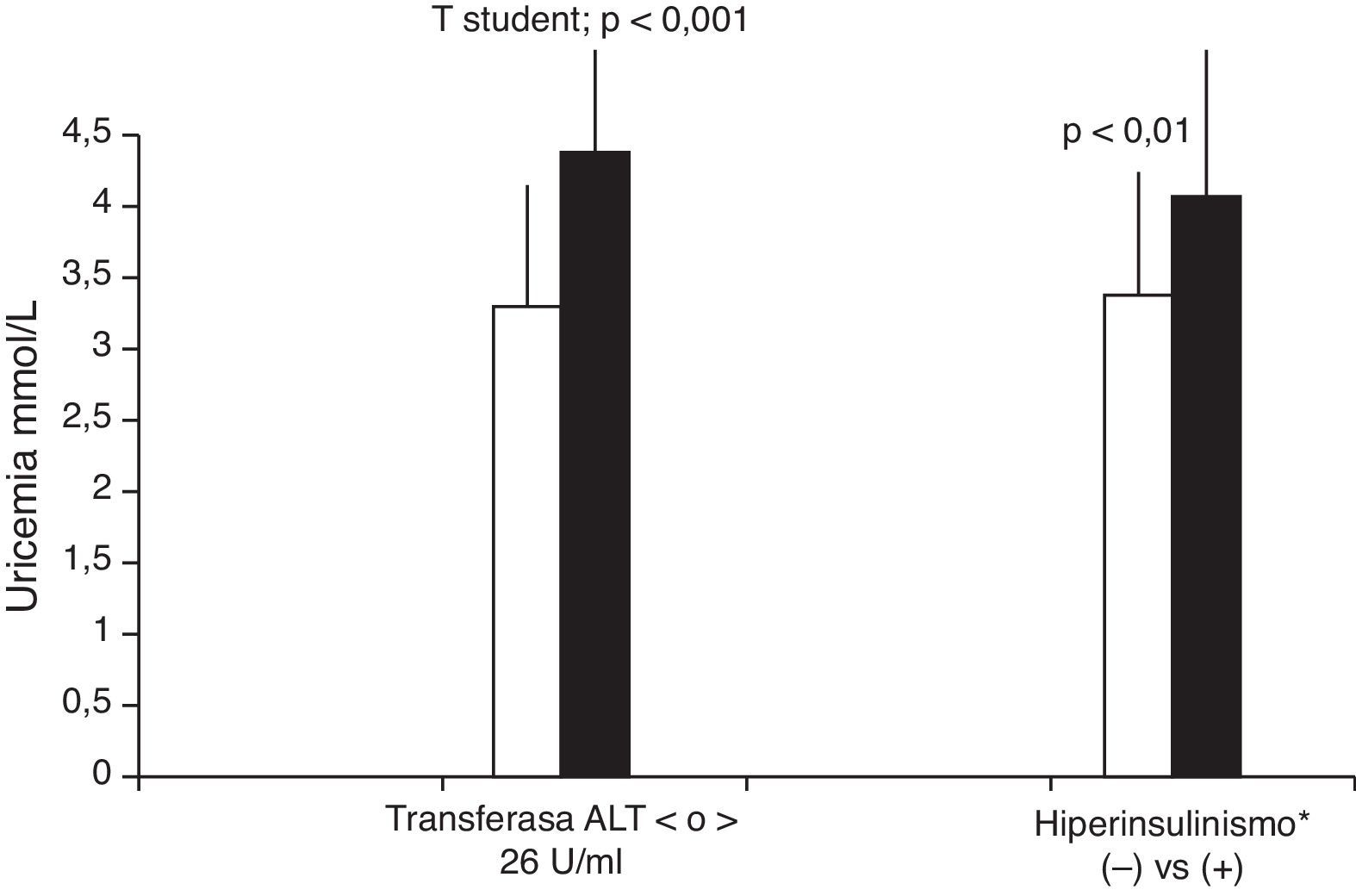
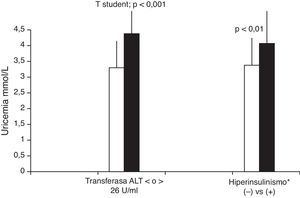
Se encontró concentraciones significativamente mayores de uricemia en niños con hiperinsulinismo, acorde con los puntos de corte sugeridos para escolares o adolescentes (normoinsulinémicos: 0,184±0,054 vs hiperinsulinémicos: 0,221±0,076mmol/l; p<0,01), sin diferencias significativas acorde a los diversos puntos de corte de HOMA.
Mediante análisis ROC se buscó el mejor punto de corte de sensibilidad-especificidad de transferasas AST y ALT asociadas a alteraciones de insulinemia, o a presencia de hígado graso, o de distancia ecográfica de columna-músculo recto anterior. Se encontró que>26U/l de ALT se asociaba mejor a presencia de hígado graso (sensibilidad de 56,8%, especificidad de 74,4%, área bajo la curva de 63%). Se observó una diferencia estadísticamente significativa en la uricemia entre niños con ALT>o<26 U/l: 0,238±0,070 vs 0,178±0,054mmol/l; p<0,001 (fig. 2). No se encontraron diferencias estadísticamente significativas de uricemia acorde a categorías de AST, o de magnitud de IMC, perímetro abdominal, perímetro abdominal/talla, mediciones ecográficas de adiposidad intraabdominal o sospecha ecográfica de hígado graso. No hubo asociación entre uricemia y valores de presión arterial sistólica (NS), o diastólica (hiperuricémicos: mayor de x+1z: 67,3±13,9 vs normouricémicos: 63,0±10,2mmHg, NS).
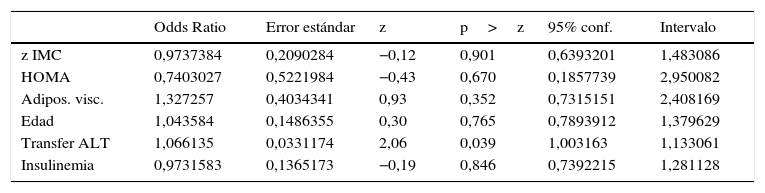
Se probaron diversos modelos de regresión múltiple logística con uricemia normal vs alterada (>+1z) como variable dependiente, quedando las transferasas ALT como las única asociadas estadísticamente significativas (p<0,033) (tabla 2).
Modelo de regresión logística evaluando factores de riesgo asociados a hiperuricemia (x+1SD>0,243mmol/l) en niños y adolescentes chilenos
| Odds Ratio | Error estándar | z | p>z | 95% conf. | Intervalo | |
|---|---|---|---|---|---|---|
| z IMC | 0,9737384 | 0,2090284 | −0,12 | 0,901 | 0,6393201 | 1,483086 |
| HOMA | 0,7403027 | 0,5221984 | −0,43 | 0,670 | 0,1857739 | 2,950082 |
| Adipos. visc. | 1,327257 | 0,4034341 | 0,93 | 0,352 | 0,7315151 | 2,408169 |
| Edad | 1,043584 | 0,1486355 | 0,30 | 0,765 | 0,7893912 | 1,379629 |
| Transfer ALT | 1,066135 | 0,0331174 | 2,06 | 0,039 | 1,003163 | 1,133061 |
| Insulinemia | 0,9731583 | 0,1365173 | −0,19 | 0,846 | 0,7392215 | 1,281128 |
IMC: índice de masa corporal.
Nuestros resultados muestran que el aumento de la uricemia está asociado a otros parámetros metabólicos propios del síndrome metabólico, en escolares y adolescentes obesos chilenos. Si el componente metabólico mayoritariamente asociado al conjunto de alteraciones clínicas y metabólicas del síndrome metabólico son las alteraciones de insulinemia, la asociación observada entre aumento de la uricemia e hiperinsulinismo va acorde con esta fisiopatología7,8,18–21. El no haber encontrado asociación entre aumento del HOMA y aumento de la uricemia puede estar asociado al hecho de que no se ha logrado demostrar en escolares, y especialmente en adolescentes, puntos de corte de HOMA concordantes con resistencia insulínica22.
En la actualidad no hay consenso para establecer puntos de corte que definan hiperuricemia en niños. Tang et al.13 han propuesto definir hiperuricemia como el promedio+1DE de las concentraciones de uricemia de una población normal, acorde a la edad.
La sospecha ultrasonográfica de hígado graso y el aumento de transferasas está también asociada a alteraciones de la insulinemia22,23, lo mismo que el aumento de indicadores ecográficos de adiposidad intraabdominal24. Sin embargo, no observamos una asociación entre AUS con severidad de la obesidad general (IMC) o con perímetro abdominal, ni con sospecha ultrasonográfica de hígado graso.
Algunos estudios previos han observado una asociación entre aumento del AUS e incremento de la presión arterial, como parte del síndrome metabólico25–27. No observamos esta asociación en nuestros datos.
Ante el riesgo de que un aumento prolongado de la uricemia en niños obesos lleve a un riesgo de daño renal y también del endotelio vascular28–30, diversos estudios sugieren una terapia hipouricemiante con alopurinol ante concentraciones por encima de los 6,5 a 7mg/dl30.
Nuevos estudios muestran una aparente asociación de uricemia con un polimorfismo del gen de la enzima metilenetetrahidrofolato reductasa que regula las concentraciones de homocisteína plasmática, metabolito asociado al daño endotelial31. Esta asociación aporta más aún a intentar explicar la fisiopatología del daño vascular propia del síndrome metabólico. En el grupo estudiado por nosotros, con obesidad de intensidad moderada o severa, una fracción ya presentaba concentraciones de ácido úrico sérico anormales (>2z) y otra en un rango de posible riesgo entre+1 y+2z. Sin embargo, no se encontró asociación entre valores de uricemia con los de presión arterial sistólica o diastólica, aunque un aumento del tamaño muestral pudiera llegar a dar como significativa la mayor presión arterial diastólica promedio de 4mmHg observada en aquellos niños con uricemia>x+1 z, en comparación con aquellos con concentraciones inferiores a ese punto de corte.
La alta frecuencia de síndrome metabólico descrita en niños y adolescentes obesos chilenos, de hasta un 30%4, orienta a un proceso que se va estableciendo progresivamente en estas edades. Las alteraciones de uricemia también es probable que estén en progresión, por lo que al final de las edades pediátricas la frecuencia tanto de síndrome metabólico como de hiperuricemia podría ser más elevada aún.
El presente estudio pudiera tener limitaciones relacionadas con la representatividad del grupo de escolares seleccionados de Santiago para otros estratos socioeconómicos u otras ciudades de Chile, con diferentes bases genéticas poblacionales y diferentes patrones alimentarios. Por otra parte creemos que abre interesantes perspectivas de estudio en el futuro, principalmente relacionadas con el impacto clínico de estas alteraciones durante las edades pediátricas y sus proyecciones hacia décadas posteriores.
En resumen, nuestros datos comprueban que los escolares y adolescentes obesos de Santiago, Chile, presentan una frecuente elevación del ácido úrico sérico, en asociación con el aumento de la enzima ALT y de la insulinemia basal. Se justifica su estudio rutinario al inicio de un programa de control de la obesidad en niños y adolescentes y en su seguimiento.
Conflicto de interesesEste trabajo cumple con los requisitos sobre consentimiento/asentimiento informado, comité de ética, financiación, estudios animales y sobre la ausencia de conflicto de intereses según corresponda.
Agradecemos sinceramente a Alejandra Ávila (enfermera universitaria) por su aporte en la obtención, el procesamiento y el almacenamiento de las muestras biológicas.