La evidencia indica que la exposición a diversas condiciones ambientales en etapas tempranas de la vida puede inducir alteraciones persistentes en el epigenoma. Los estudios epigenómicos en sujetos obesos han permitido evaluar el papel de los mecanismos epigenéticos en el origen y desarrollo de la obesidad. La presente revisión aborda estudios que dan cuenta de la asociación entre la obesidad y metilación global del genoma (ADN), analizando el potencial impacto de intervenciones previas y posteriores al nacimiento que afectan la metilación del ADN y la obesidad en etapas más avanzadas de la vida. Estudios realizados principalmente en leucocitos, han logrado identificar sitios del ADN diferencialmente metilados asociados con obesidad. Estudios hasta la fecha no han demostrado que dichos cambios en metilación sean revertidos luego de bajar de peso. Esto contrasta con resultados iniciales en este campo, que sugieren que existirían marcadores epigenéticos presentes desde el nacimiento que permitirían definir el riesgo de obesidad durante el curso de la vida. La evidencia actual sugiere que algunas marcas epigenéticas son modificables, basándonos en la exposición en la vida intrauterina y también por los hábitos dietarios y de actividad fisica durante las etapas del crecimiento y en la adultez. Esto sugiere que existe la oportunidad de intervenir durante la gestación o en la vida posnatal temprana, que modificaría los perfiles epigenéticos desfavorables e idealmente contribuiría a prevenir la obesidad en los sujetos o poblaciones susceptibles.
Current evidence supports the notion that exposure to various environmental conditions in early life may induce permanent changes in the epigenome that persist throughout the life-course. This article focuses on early changes associated with obesity in adult life. A review is presented on the factors that induce changes in whole genome (DNA) methylation in early life that are associated with adult onset obesity and related disorders. In contrast, reversal of epigenetic changes associated with weight loss in obese subjects has not been demonstrated. This contrasts with well-established associations found between obesity related DNA methylation patterns at birth and adult onset obesity and diabetes. Epigenetic markers may serve to screen indivuals at risk for obesity and assess the effects of interventions in early life that may delay or prevent obesity in early life. This might contribute to lower the obesity-related burden of death and disability at the population level. The available evidence indicates that epigenetic marks are in fact modifiable, based on modifications in the intrauterine environment and changes in food intake, physical activity and dietary patterns patterns during pregnancy and early years of adult life. This offers the opportunity to intervene before conception, during pregnancy, infancy, childhood, and also in later life. There must be documentation on the best preventive actions in terms of diet and physical activity that will modify or revert the adverse epigenetic markers, thus preventing obesity and diabetes in suceptible individuals and populations.
La epidemia de obesidad presenta una creciente prevalencia en países pobres y ricos, definiéndose en la actualidad como un problema de salud pública de ámbito global1. En la actualidad la obesidad es el factor de riesgo y la causa más importante de la diabetes tipo 2, la hipertensión, la enfermedad coronaria y otras enfermedades cardiovasculares2. Los datos también indican que la obesidad es, después del tabaco, la principal causa de cáncer de ámbito global. Por lo tanto, la epidemia de obesidad amenaza no solo con reducir la duración y la calidad de vida de las generaciones actuales y futuras, sino que también representa un reto importante para las economías de los países que emergen del subdesarrollo y deben asumir un creciente gasto en salud para hacer frente a los gastos de atencion médica y la menor productividad laboral de la población afectada por la obesidad y las enfermedades asociadas (diabetes, hipertensión, enfermedad coronaria y otras vasculares, esteatohepatitis y cirrosis y diversos tipos de cáncer [colon, mama, vesícula, páncreas, hígado y riñón]) que afectan la salud de la población en el presente y en el futuro. La evidencia a la fecha apoya la necesidad de implementar estrategias de prevención eficaz para la obesidad, con el fin de frenar la tendencia ascendente y las formas más onerosas de tratamiento médico y quirúrgico. Los gobiernos y las organizaciones sociales relacionadas con la salud en el ámbito nacional e internacional han destacado el limitado éxito en la reducción de las tasas de obesidad en el medio y largo plazo. Este fracaso, en parte, se relaciona con el hecho de que las estrategias se implementan después de que la obesidad está ya firmemente establecida3,4. Los datos hasta la fecha indican que la obesidad es difícil de revertir, por lo tanto, las estrategias preventivas deben iniciarse con la identificación temprana de los sujetos de mayor riesgo, ojalá que con un enfoque del ciclo vital, es decir, preparar a las mujeres para optimizar las condiciones de salud antes de la concepción. Este debe ser el foco de los esfuerzos de prevención de la obesidad, de manera tal que se eviten las consecuencias para la población y el país. La prevención temprana tiene como fin evitar la obesidad y sus consecuencias sobre la salud a lo largo del ciclo de la vida, aumentar los años de vida saludable y evitar el gasto económico impuesto por el tratamiento y el sufrimiento asociado con el sobrepeso y la obesidad1.
Es necesario actuar temprano y de forma efectiva; para esto debemos mejorar las estrategias de prevención y tratamiento. En este contexto es esencial que entendamos mejor los factores que contribuyen al desarrollo de la obesidad en los primeros años de vida y cuál es el momento de hacer algo al respecto. Existe un creciente interés por la epigenética y su papel en el desarrollo de enfermedades crónicas como la obesidad. Las enfermedades genéticas tradicionales ligadas a mutaciones en el ADN modifican la secuencia de las bases de manera permanente. Los cambios epigenéticos, por el contrario, son potencialmente reversibles y se refieren a modificaciones de las histonas (proteínas del nucleosoma asociadas al ADN) y en el ADN mismo, sin cambiar la secuencia de este5. Las marcas epigenéticas son potencialmente hereditarias mediante la división celular mitótica. Sin embargo, se discute si estas pueden traspasarse de una generación a otra. Las formas más representativas de marcas epigenéticas son: a) la metilación del ADN que se produce en las citosinas adyacentes las guaninas (sitios «CpG»); b) la acetilación y/o metilación postraduccional (adición de grupos metilo o acetilos al ADN) de las histonas; y c) microARN o mARN, que son secuencias cortas de ARN que interfieren con la traducción de un gen a una proteína. De esta manera los procesos epigenéticos definen el acceso de la maquinaria transcripcional, determinando si el gen está «activo o no» en un momento dado5. La secuencia de ADN de los genes en un individuo (genoma) es en general estable; en contraste, el epigenoma tiene el potencial de ser modificado por la exposición a una serie de factores nutricionales y/o ambientales permitiendo la adaptación en un menor tiempo y responder a cambios ambientales de forma más dinámica. La importancia de los procesos epigenéticos en la salud y enfermedad humana se identificó por primera vez en el campo del cáncer en la decada de los 80. Desde entonces ha habido un gran número de estudios que han descrito los cambios epigenéticos en los tejidos cancerosos y en las células sanguíneas de pacientes con cáncer, y alteraciones en el nivel de metilación de genes específicos han sido propuestos como nuevos biomarcadores en la detección del cáncer.
La atención reciente de la comunidad científica se ha centrado en el potencial rol de las modificaciones epigenéticas en la patogenia de condiciones del desarrollo asociado con la obesidad; el rebote adiposo y la maduración puberal que influyen en el riesgo de obesidad y enfermedades asociadas, que afectan la salud en etapas pospuberales6. Los estudios iniciales estaban limitados por el tamaño de la muestra y el número de sitios CpG estudiados. Sin embargo, con los avances tecnológicos y el uso de métodos más asequibles y de alto rendimiento para detectar la metilación, se ha producido un aumento en estudios a gran escala que han avanzado en decifrar el gran-epigenoma7. Los estudios de asociación que exploran la relación entre el medio ambiente, el epigenoma y los estados patológicos son complejos, de hecho, la metilación del ADN, ya sea sitio-específica, o genómica a nivel global con niveles de resolución de un solo nucleótido constituyen las marcas epigenéticas más estudiadas. Por otra parte, las investigaciones de modificaciones de las histonas en relación con la obesidad en los seres humanos son limitadas; resultados a la fecha sugieren que existe una asociación entre las modificaciones de histonas y el desarrollo de obesidad, o una mayor susceptibilidad a desarrollarla.
La evidencia actual apoya la hipótesis de que la propensión a la obesidad en adultos se origina en etapas tempranas del desarrollo y tiene efectos inter y transgeneracionales8. Los estudios epidemiológicos más recientes han demostrado que la exposición a un ambiente nutricional subóptimo durante el desarrollo, como resultado de una ingesta de energía (calorías) materna excesiva o una ingesta deficiente de micronutrientes esenciales como el Zn y el Fe, se asocia con un mayor riesgo de obesidad y otras enfermedades crónicas relacionadas con ella; estas incluyen la diabetes tipo 2, la resistencia a la insulina y las enfermedades cardiovasculares9–12. Los hallazgos de efectos a largo largo plazo han contribuido a reforzar la hipótesis de los orígenes tempranos de la salud y la enfermedad (DOHaD), sugiriendo que el riesgo de estas enfermedades es en parte programado por el ambiente perinatal que afecta no tan solo al feto, sino que en el caso de un feto se sexo femenino puede tener efectos transgeneracionales al marcar los oocitos del ovario de la futura progenie en la segunda generación6,8. Esta hipótesis sugiere que las exposiciones ambientales transitorias experimentadas temprano en la vida pueden tener efectos permanentes, que se manifiestan en etapas posteriores de la vida que lleva al aumento en el riesgo de padecer enfermedad crónica. Los mecanismos precisos que establecen esta «memoria» en la respuesta metabólica no están absolutamente claros, pero es probable que incluyan cambios en las trayectorias de maduracioó y desarrollo de los tejidos, la reprogramación de células madre, los cambios en la estructura de los tejidos, las modificaciones del sistema endocrino y de regulación metabólica relacionado con el crecimiento y la maduración sexual. La programación epigenética puede ser el mecamismo íntimo o «causa» final de estos procesos, o alternativamente solo proporciona una lectura que coincide en el tiempo con su ocurrencia. Por otra parte, una vez establecidos los cambios epigenéticos en la vida temprana por causa nutricional, estos pueden permanecer en estado latente hasta que su influencia biológica se active más adelante en el curso de la vida6.
La evidencia que apoya el rol de la epigenética en la programación del desarrollo de enfermedades del adulto se origina principalmente en estudios en animales que han demostrado el impacto del entorno nutricional intrauterino subóptimo en el epigenoma y el fenotipo de la descendencia13,14. Hay pocos estudios en humanos en esta área, pero uno de los estudios más significativos se llevó a cabo en niños que nacieron de mujeres expuestas a la desnutrición severa durante el embarazo, como resultado del invierno del hambre (hambruna holandesa) impuesta por los invasores alemanes hacia fines de la Segunda Guerra Mundial. Medio siglo después se reportó evidencia de una reducción de metilación del gen IGF2 impresa en estos individuos en la adultez15–17. Esto tiene especial relevancia, dado que estos individuos también demostraron tener un mayor riesgo de obesidad o intolerancia a la glucosa, dependiendo del momento de la exposición al hambre y la desnutrición18–20. Esta revisión proporciona una visión general de los hallazgos más recientes en el área de investigación de la epigenética y la obesidad, centrado específicamente en los estudios en humanos. Los estudios que investigan la asociación entre la metilación global, la metilación sitio específica o metilación de todo el genoma de ADN y la obesidad se resumen y comentan en la próxima sección que incluye el impacto de las intervenciones en los perfiles de metilación del ADN y la obesidad.
Descripción general de los estudios incluidos en este análisisComo descripción general, un tercio de los estudios incluidos en esta revisión evaluaron la relación entre las medidas de obesidad y la metilación del ADN global, así como relaciones entre la obesidad con la metilación del ADN en genes candidatos específicos y/o la metilación del genoma, comparando individuos obesos/magros, o documentaron una asociación con las medidas de la obesidad. Un quinto de estos estudios evaluó los perfiles de metilación del ADN en relación con pérdida de peso no voluntaria, la metilación del ADN en la vida temprana y con medidas de salud de los padres o con estados de salud en etapas posteriores de la vida. Así mismo, un nivel de metilación global bajo se vinculó con inestabilidad cromosómica y un aumento de eventos de mutación que se considera característico de algunos cánceres; sabemos menos sobre el significado de la metilación global en otros estados de enfermedad. Elementos repetitivos, tipo Alu y LINE1, comprenden ∼50% del genoma, y el grado de metilación en estos elementos a menudo se utiliza como un sustituto para representar la metilación global nivel del genoma. Los niveles de metilación globales son relativamente fáciles de determinar en un gran número de muestras, y relativamente de bajo costo y alto rendimiento, lo que los hace ideales para fines de selección.
En su mayoría estos estudios utilizaron muestras de sangre, y en menor número muestras de músculo, placenta y colon. Todos los estudios utilizaron el índice de masa corporal (IMC) o cambios en el IMC para clasificar la obesidad; 2 estudios utilizaron además el porcentaje de grasa corporal21,22. La mayoría de estas investigaciones, incluyendo un gran estudio que combinó 4 poblaciones de estudio, representó el máximo de 1.254 personas, en todos salvo en 34 se encontró una asociación entre la obesidad y la metilación global22–28.
Dos estudios que incluyeron solo mujeres21,29 encontraron una reducción en la metilación global con el aumento del IMC, sin embargo, en uno de estos estudios esto solo se produjo en presencia de bajas concentraciones de la donante de metilo folato21. Por el contrario, otros 2 estudios que incluyeron tanto a hombres como a mujeres, a partir de 2 poblaciones diferentes (Samoa y China), informó de una relación positiva entre la metilación global en leucocitos de sangre periférica (PBMC) y el IMC30,31, así como en un estudio de metilación global de más tejidos de la placenta fue mayor en los obesos en comparación con las mujeres magras28. Solo un estudio examinó la metilación de histonas mundial de la obesidad, que muestra sustancialmente disminuidos los niveles de dimetilación de la lisina 4 en la histone 3 en los adipocitos de los individuos con sobrepeso en comparación con sujetos delgados, con aumento de los niveles de trimetilación de lisina 4 observados en individuos obesos/diabéticos32. Por tanto, aunque algunos estudios reportan asociaciones significativas entre la metilación global y medidas relacionadas con la obesidad, la dirección del cambio no es consistente, y ambas, tanto la hipometilación como la hipermetilación se han relacionado con medidas21,22,29 relacionadas con la obesidad33. Existe multiples factores tales como el género, el origen étnico, la edad, la exposición a productos químicos, el humo de tabaco, el alcohol y la dieta que afectan los niveles de metilación global, lo que podría explicar las asociaciones observadas entre la metilación global y la obesidad22,34–38.
Varios estudios han examinado posibles factores confundentes, aplicando correcciones de algunos de estos; lamentablemente a menudo no se conocen todos los factores que deben considerarse. En general, los estudios disponibles de metilación global en la obesidad no proporcionan evidencia consistente de una relación entre la metilación global y la obesidad. En comparación con el cáncer, los cambios de metilación global en la obesidad (si está afectada) es probable que sean menos marcados y por lo tanto más difíciles de detectar, teniendo en cuenta la influencia de múltiples factores no del todo conocidos. En consecuencia, por ahora debemos privilegiar los análisis de metilación en sitios específicos, ya sea en loci relacionados con la obesidad o con un enfoque sitio-específico en todo el genoma (genome wide). Pensamos que este enfoque es posible que ilustre una mejor representación de la asociación entre la obesidad y la metilación del ADN. Muestras de mayor tamaño (n≥1.000) también pueden facilitar la obtención de resultados más específicos con más poder predictivo. Los estudios realizados hasta la fecha sobre la posibilidad de que el sexo afecte en la relación entre el IMC y la metilación global son sugerentes de un dimorfismo sexual en los efectos. Esto también requiere una investigación más detallada y sugiere la necesidad de examinar las posibles asociaciones separando por sexos.
Metilación del ADN en genes específicos y la obesidadEl entorno epigenético de genes individuales proporciona un componente crítico que contribuye a su regulación y nivel de expresión. Producto de la relativa facilidad de análisis de genes específicos, la metilación del ADN es la marca epigenética más ampliamente estudiada en estudios que relacionan los efectos sobre la salud de los cambios epigenéticos, incluyendo la obesidad. Históricamente la metilación del ADN elevada ha sido asociada con la represión de la expresión génica. Sin embargo, con el uso diseminado de los métodos que procesan todo el genoma, incluyendo el análisis de metilación del ADN, se reconoce ahora que la asociación de la metilación del ADN con la expresión génica no es tan simple como se pensaba, y parece depender del locus dentro de la secuencia del gen en que se produce la metilación. En general, en el ADN la metilación en las regiones promotoras/potenciadoras de genes se asocia con el silenciamiento de estos, mientras que una mayor metilación en la región codificante de los genes estaría asociada con la expresión activa de ellos, pero incluso esto es una sobresimplificación. Por otra parte, la mayoría de los estudios que examinan la relación sitio-específica de metilación del ADN y la obesidad son transversales; es decir, tanto la metilación como el fenotipo se miden en el mismo punto de tiempo. Por lo tanto, no se puede establecer si la asociación entre una marca de metilación de ADN específica y la obesidad es una causa o una consecuencia del fenotipo obeso.
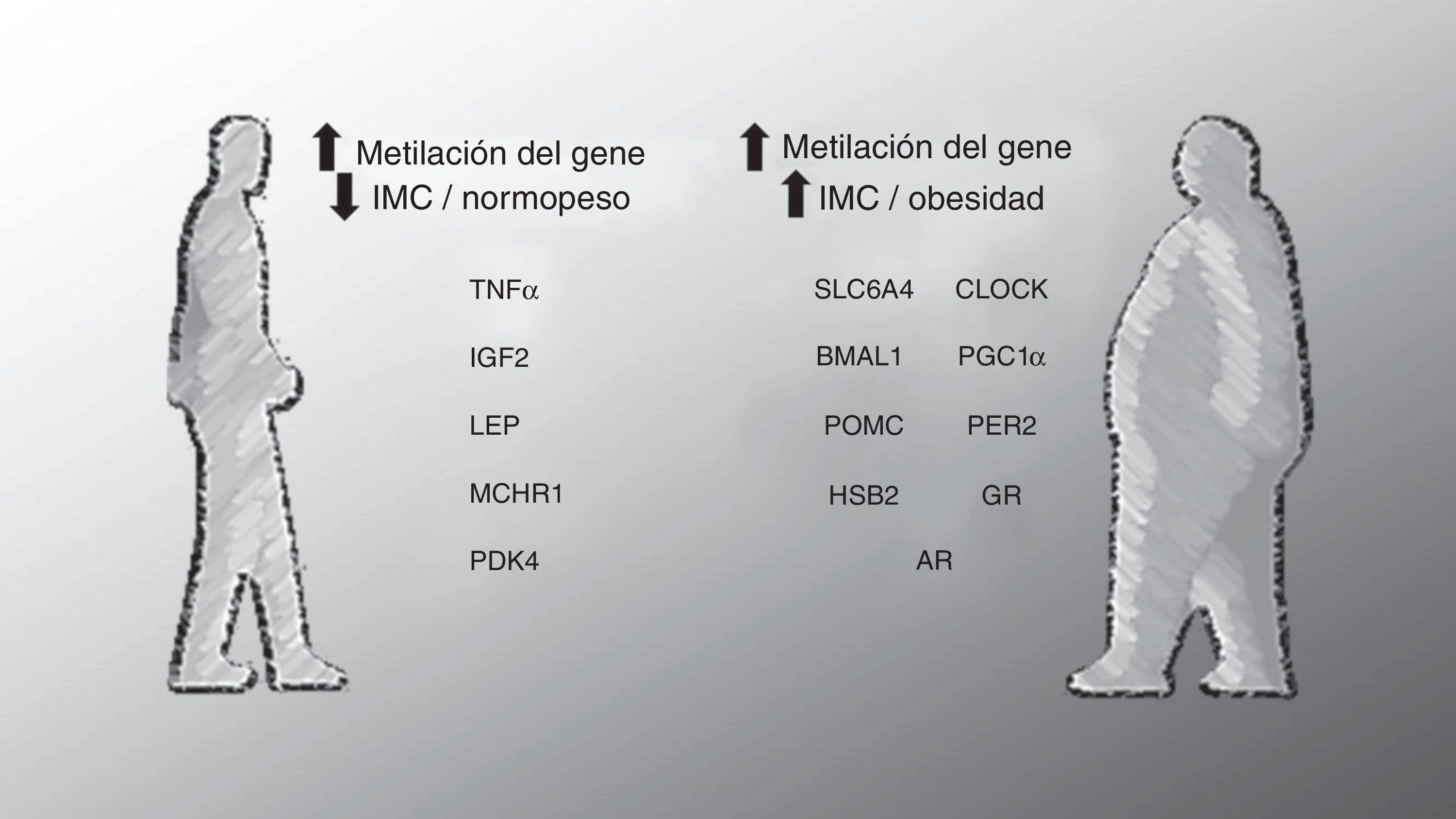
Múltiples estudios han utilizado un enfoque de «genes candidatos» basado en algunas hipótesis. En alguno de estos casos la elección de genes se ha basado en el análisis previo de las diferencias de expresión génica. Los estudios de metilación de genes candidatos se han centrado en una serie de genes implicados en la obesidad, el control del apetito y/o el metabolismo, la señalización de insulina, la inmunidad, el crecimiento, la regulación del ciclo circadiano y genes impresos, evaluándose su relación con una variedad de marcadores de obesidad (fig. 1). En conjunto, estos estudios han identificado una baja metilación del factor de necrosis tumoral alfa (TNFa) en PBMC39, la piruvato deshidrogenasa quinasa 4 en músculo40 y de la leptina en sangre completa41. A su vez se ha encontrado un aumento de metilación de proopiomelanocortina en leucocitos42, el gen del receptor de aril hidrocarburos nucleares translocadoras similar en PBMC43 y el coactivador de PPAR alfa tipo 140 en el músculo en obesos en comparación con las personas delgadas. Cabe destacar que en una subpoblación de la cohorte Early Bird Diabetes Study, el grado de metilación del promotor para el coactivador de PPAR alfa tipo 1 durante la infancia (5 a 7 años) ha demostrado ser un predictor del nivel de adiposidad durante la pubertad (∼13 años)44. Por otra parte, asociaciones entre el IMC, la adiposidad y la circunferencia de la cintura, con metilación en piruvato deshidrogenasa quinasa 4 (músculo esquelético)40, receptor de la hormona melanocortina 1 (leucocitos)45, así como el gen del transportador de serotonina46, el receptor de andrógenos47, 11 b-hidroxiesteroide deshidrogenasa de tipo 248, la proteína del período del reloj circadiano 243 y del receptor de glucocorticoides48 en PBMC también han sido reportados. Las asociaciones epigenéticas observadas más consistentemente han sido las de metilación en la región H19 del IGF2 en células de la sangre con medidas de adiposidad48,49. En conjunto, estos estudios proporcionan evidencia de que la obesidad está asociada con alteraciones de la regulación epigenética de un número importante de genes para el metabolismo.
Análisis de metilación de genoma completo y carga de obesidadEl reciente desarrollo de métodos epigenómicos para la cuantificación específica de sitios de metilación del ADN a lo largo de todo el genoma ha dado lugar al inicio de estudios que no están dirigidos a genes específicos, sino más bien a la búsqueda de asociaciones a través de un gran número de genes y sus CpGs con la obesidad. La obesidad asociada a niveles de metilación diferencial (MD) en genes ha permitido detectar sitios de MD en células de sangre periférica en 4 estudios del genoma total ya publicados in extenso50–53, exsistiendo en ellos pequeñas alteraciones en la metilación. En un caso se ha revelado una «marca» en los sitios de MD para predecir la obesidad en un grupo de validación51, mientras que en otros estudios CpG con MD específicos fueron validados en una segunda cohorte52, o en un segundo momento del estudio53. Sitios asociados con una MD y obesidad general se encuentran enriquecidos tanto en genes candidatos para obesidad51 como genes con una amplia diversidad de otras funciones, tales como la respuesta inmune, la diferenciación celular51,52 y la regulación de transcription50. Otros sitios relacionados con MD también han sido identificados en genes sin una relación/función conocida con la obesidad o el tejido adiposo.
Estudios de intervención en adultosDurante mucho tiempo se ha asumido que los perfiles de metilación del ADN permanecen estables durante toda la vida adulta; sin embargo, este punto de vista está cambiando. Intervenciones como el ejercicio, la dieta y la cirugía de pérdida de peso han demostrado que modulan activamente los perfiles de metilación en diferentes tipos de tejido40,54,55. Curiosamente, luego de determinadas intevenciones los perfiles de metilación de los individuos obesos se asemejan más a los de individuos delgados. Se ha propuesto que los perfiles de metilación pueden ser modificados por las reducciones en el peso corporal o una reducción en la masa grasa. Un estudio pequeño en individuos obesos luego de cirugía para reducir de peso40 demostró cambios en los perfiles de metilación. Esta conclusión puede implicar que algunas marcas de metilación son una consecuencia del fenotipo obeso, en lugar de una marca programada que predispone a las personas a convertirse en obesos; el dilema de definir si estos fenómenos son causa o consecuencia de la obesidad requiere estudios adicionales. Estos hallazgos aumentan la importancia de estudiar las marcas de metilación temprano en la vida, antes de que la enfermedad se manifieste, para definir cuáles marcas se convierten en permanentes, y por lo tanto servirían como marcadores tempranos del riesgo de enfermar, y cuáles son semipermanentes y/o modificables en la vida posterior.
En otro grupo de estudios se compararon los perfiles de metilación de personas que perdieron peso con éxito durante las intervenciones y los que no lo hacían; esto se ha utilizado con el fin de determinar si puede haber biomarcadores que predicen la respuesta individual a las intervenciones de pérdida de peso. Los resutados de estos estudios identificaron43,55–58 diferencias en el perfil de metilación de ADN entre estos individuos, en las regiones de genes implicados con el control del peso, la secreción de insulina, la inflamación y el ritmo circadiano. Tales diferencias de metilación podrían deberse a que la propensión para bajar de peso en distintos individuos puede depender de mecanismos epigenéticos que ocurren de manera gen-específica, incluso en situaciones en que la ingesta de alimentos es limitada. Cabe destacar que la adherencia a las intervenciones se controló en la mayoría de los estudios a través de reuniones periódicas con las dietistas del estudio, o la asistencia a ejercicios en grupo o sesiones de terapia. Sin embargo, es muy difícil supervisar cumplimiento de estas rutinas en los estudios de intervención nutricional en humanos, por lo que es posible que el hecho de bajar de peso también pueda ser un reflejo de la baja adherencia de los participantes a la intervención.
Prevención temprana (prenatal y postnatal)El período de desarrollo embrionario ha sido reconocido como una ventana crítica en el establecimiento del epigenoma, con una fuerte influencia en la estructura de este a largo plazo. Hay pruebas convincentes de que un entorno posnatal y prenatal adverso puede aumentar el riesgo de obesidad en la vida de adulto6,8. Esto ha llevado a la búsqueda de intervenciones nutricionales que tegan el potencial para mitigar o superar este programming durante el embarazo y la lactancia59. Las intervenciones de dieta y pérdida de peso en madres obesas pueden conducir a una disminución en el riesgo de obesidad en la descendencia, posiblemente mediado a través de cambios en la señalización de la insulina, el almacenamiento de grasa, el gasto de energía o vías de control del apetito. Se ha propuesto que, en estas condiciones, los mecanismos epigenéticos tendrían un papel en modificar el perfil de riesgo alterado, hipótesis que estaría en parte basada en la presencia de marcas epigenéticas asociadas a la obesidad que se han podido indentificar en genes implicados en estos procesos. Los estudios en humanos que muestran una relación directa entre la exposición prenatal específica (nutricionales) en los perfiles de metilación de la descendencia y el riesgo subsiguiente de la obesidad en la edad adulta son escasos. Sin embargo, hay una serie de estudios que han evaluado diferencias en la metilación de genes candidatos en los niños en relación con características60–63 maternas/paternas y que han explorado los marcadores epigenéticos en la sangre del cordón umbilical en el parto y la obesidad/resultados metabólicos en la infancia. Cabe destacar, sin embargo, que todos estos estudios reflejan principalmente asociaciones sin aclarar; la participación de mecanismos epigenéticos en las causas o efectos del riesgo de obesidad.
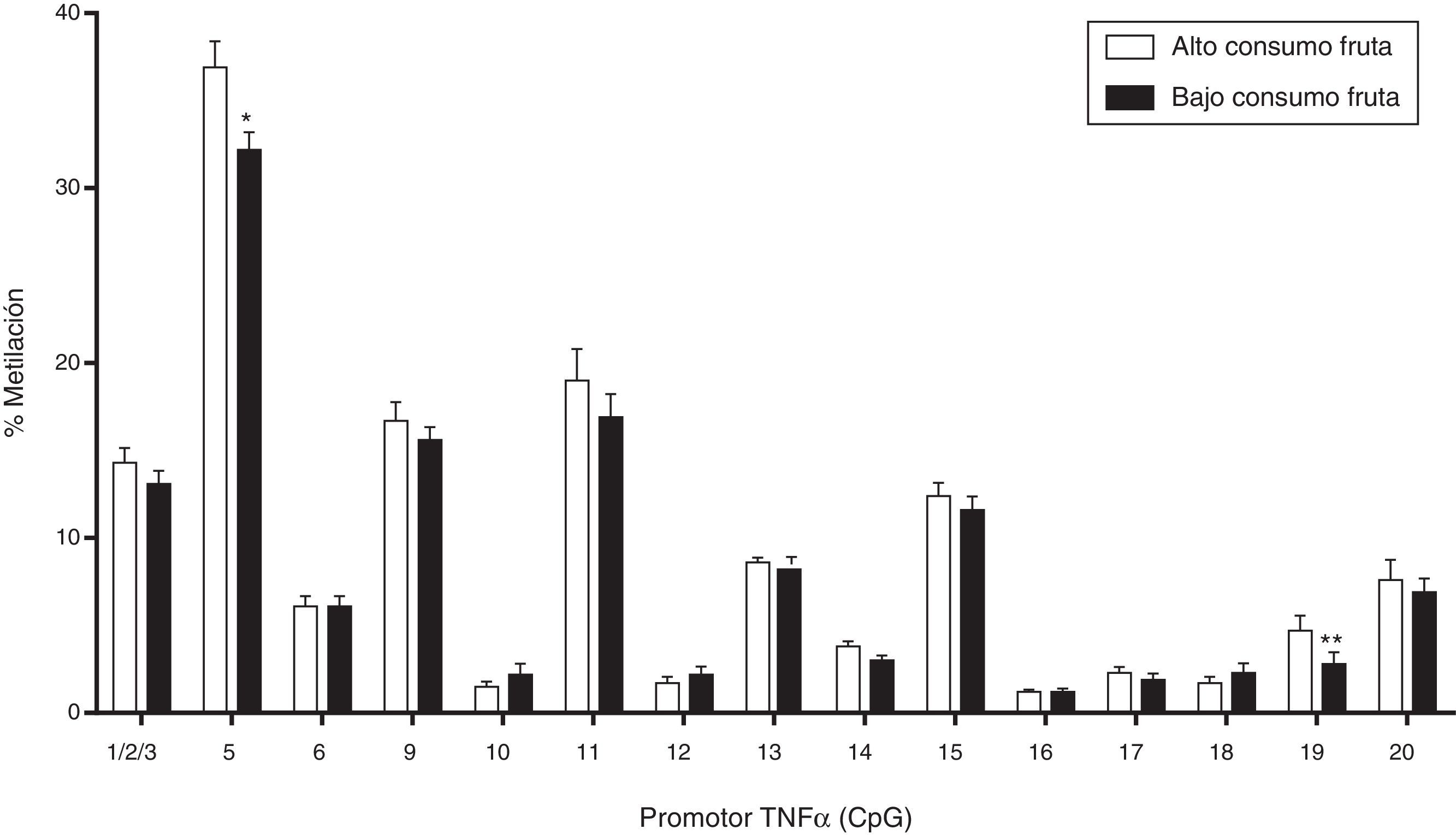
Uno de estos estudios comparó los perfiles de metilación de los hermanos nacidos antes y después de la cirugía de pérdida de peso materno, e informó de diferencias entre los hermanos en las características de la obesidad y en la metilación de perfiles de genes implicados en la regulación de la homeostasis de la glucosa y la función inmune64,65, algunas de las cuales se traducen en alteraciones en la expresión de genes y la sensibilidad a la insulina. Aunque el estudio tuvo un tamaño muestral limitado, sus resultados sugieren que la pérdida de peso significativa en la madre es de importancia para el futuro de la salud cardiovascular y metabólica de la descendencia. Por otra parte, al comparar el nivel de metilación del promotor del gen para TNF¿ en adultos metabólicamente sanos, cuya única diferencia era el consumo de frutas por encima (alto consumo) y por debajo de la media (bajo consumo) se encontró una relación inversa entre el nivel global de metilación del promotor, así como en 2 sitios específicos de la región del gen de interés (fig. 2)66.
Niveles de metilación en promotor de TNF¿ e ingesta de fruta. Se ha reportado una asociación positiva entre el alto consumo de fruta y el grado de metilación global y específico (CpGs 5 y 19) del promotor del factor pro-inflamatorio TNF¿. El potencial efecto antiinflamatorio de esta mayor metilación sugiere un efecto protector de la dieta por la vía de mecanismos epignéticos. Valores expresados como media±EEM.
*p<0,05.
**p<0,01.
Adaptado de Carraro et al., 2012.
Financiado por Fondecyt Regular 1120928 (PC), 1141195 (JAC), 1130277 (RU) y 1130801 (BJK).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Esta actualidad forma parte de un ciclo de 5 actualidades consecutivas sobre el tema de Epigenética, a ser publicados en los números del 1 al 5, Vol. 87 de la Revista Chilena de Pediatría 2016.