El cáncer papilar de tiroides (CPT) es una enfermedad infrecuente en pediatría. La presentación de CPT asociado a hipotiroidismo congénito (HC) dishormonogénico es excepcional, y hay pocos casos reportados en la literatura.
ObjetivoPresentar un caso de CPT en un paciente con HC dishormonogénico sin bocio, expuesto a radiación ionizante. Evaluar asociaciones entre estos factores y el desarrollo de CPT.
Caso clínicoPaciente varón con antecedentes de HC dishormonogénico, por lo que recibió suplementación precoz con levotiroxina, logrando niveles normales de tirotropinas y hormonas tiroideas. Con antecedentes de cardiopatía congénita, fue sometido tratamiento intervencional con 10 cateterismos cardíacos y aproximadamente 26 radiografías de tórax con dosis pediátrica. A la edad de 6 años se encontró un nódulo tiroideo mediante ecografía. La citología por punción aspirativa con aguja fina confirmó alta sospecha de carcinoma tiroideo (Bethesda 5). El estudio de etapificación no mostró metástasis en el tórax ni en el cerebro. Fue sometido a tiroidectomía total y el análisis histopatológico reveló un microcarcinoma papilar de 0,5cm intratiroideo, sin evidencia de diseminación.
ConclusiónLas mutaciones genéticas propias de esta enfermedad y la exposición a radiación ionizante pudieran estar implicadas en el desarrollo de CPT. Es probable que haya vías fisiopatológicas comunes que requieren mayor investigación.
Papillary thyroid carcinoma (PTC) is a rare childhood disease. The development of PTC in dyshormonogenetic congenital hypothyroidism (CH) is infrequent, with very few case reports in literature.
ObjectiveTo report a case of PTC in a boy with dyshormonogenetic CH without goitre and exposed to ionising radiation. To evaluate relationships between these factors and development of PTC.
Case reportWe present a boy with dyshormonogenetic CH since birth. Early hormonal substitution was initiated, with subsequent normal levels of thyrotropin and thyroid hormones. He has also congenital cardiomyopathy, exposed to interventional treatment with 10 heart catheterisations, and approximately 26 chest X-rays at paediatric doses. A thyroid nodule was found in thyroid echography at the age of 6 years old. Fine needle aspiration biopsy confirmed high probability of thyroid carcinoma (Bethesda 5). The pre-surgical thorax and cerebral scan showed no evidence of metastasis. The patient underwent total thyroidectomy. Pathological examination revealed a 0.5cm papillary thyroid micro-carcinoma in the right lobe, with no evidence of dissemination.
ConclusionGenetic mutations and radiation exposure may play an important role in the development of PTC. There may be common pathways between dyshormonogenetic CH and thyroid carcinoma that need further investigation.
El cáncer papilar de tiroides es un diagnóstico infrecuente en pediatría, correspondiendo a 0,4% a 3% de las neoplasias en este grupo1–4. Sin embargo, es el tumor endocrino de cabeza y cuello más frecuente. La incidencia anual global en población pediátrica se ha estimado en 5,4 por 1.000.000, y en las últimas décadas ha aumentado sostenidamente en 3-4% anual5–11. El 70% de los casos se presenta en niños entre 11 y 17 años.
La presentación clínica más común es la presencia asintomática de un nódulo tiroideo o una masa cervical. Su comportamiento es más agresivo que en adultos, con alta frecuencia de invasión extratiroidea, presentación multifocal o bilateral, metástasis linfática y a distancia, principalmente de pulmón y huesos. La tasa de recurrencia varía entre 10% a 30% a 5 años. A pesar de esto, el pronóstico es bueno con una sobrevida global a 20 años del 90-95%1,2,4,9.
Para realizar el diagnóstico se recomienda evaluar los nódulos con ecografía, y según su resultado, realizar una punción aspirativa con aguja fina, procedimiento con valor predictivo positivo de 67% y valor predictivo negativo de 100%. La confirmación diagnóstica se realiza con la histología de la pieza quirúrgica1,5.
En relación con el tratamiento The National Institute of Child Health and Human Development recomienda realizar una tiroidectomía total, seguido por terapia ablativa con 131I, y continuar con terapia hormonal supresiva de hormona estimuladora del tiroides (TSH) a largo plazo. El manejo debe ser agresivo debido a la presencia en ambos lóbulos tiroideos de tumores multicéntricos en el 50-80% de los casos, recurrencia del 25% en el lóbulo remanente e incidencia del 66% de cáncer oculto en el lóbulo contralateral1. Así mismo, este manejo permite un seguimiento seguro y detección temprana de recurrencia, guiado por los niveles de tiroglobulina sérica. Sin embargo, la dualidad entre comportamiento agresivo y buen pronóstico global abre la controversia a más de una opción de tratamiento2. Hay remisión total de la enfermedad cuando la cintigrafía de exploración sistémica es negativa y los niveles de tiroglobulina indetectables, con anticuerpos antitiroglobulina negativos. Los niveles elevados de tiroglobulina sérica requieren seguimiento con estudios complementarios (ecografía cervical y cintigrafía de exploración sistémica con 131I) y observación de acuerdo a las recomendaciones de la guía clínica de la Asociación Americana del Tiroides 201510.
Las causas que explican el aumento de la incidencia son desconocidas y se han postulado factores genéticos, mayor exposición a radiación y una mayor tasa de diagnóstico, siendo el principal la radiación, especialmente antes de los 5 años y en altas dosis10. Se ha establecido clara asociación entre radiación en altas dosis con el desarrollo de CPT en niños y adolescentes, sin embargo, la radiación para estudios y procedimientos médicos no se sabe cuánto podría contribuir al desarrollo de cáncer12,13.
Por otro lado, el hipotiroidismo congénito (HC) es una enfermedad benigna, cuya principal etiología son alteraciones genéticas que afectan la diferenciación, migración y función de la glándula en el período embrionario. No se ha establecido asociación entre estas alteraciones y el desarrollo de cáncer de tiroides9. En Chile la incidencia del HC es 1:3.163 recién nacidos vivos14. Dentro de sus causas la principal es la alteración de genes que regulan el desarrollo del tiroides, produciendo HC primario. Se puede manifestar como ausencia o alteración anatómica del tiroides (disembriogénesis) o alteración funcional de la producción de hormonas con tiroides in situ (dishormonogénesis), dependiendo del momento en el que se produzca la alteración. El desarrollo de la glándula comienza a partir de la cuarta semana de período embrionario, y un error en este primer momento produce aplasia, hipoplasia o ectopia tiroidea (disembriogénesis) presente en el 85% de los casos. Si la alteración se produce durante el período de diferenciación funcional, a partir de la semana décima o decimosegunda, se obtendrá una alteración de la producción de hormonas con tiroides anatómicamente normal (dishormonogénesis) presente en el 15% de los casos con HC primario3,14,15. El desarrollo de CPT en pacientes pediátricos con HC dishormonogénico es impredecible, muy poco frecuente y hasta ahora ha sido muy poco estudiado.
ObjetivoPresentar un caso clínico de CPT en un paciente de 7 años con HC dishormonogénico sin bocio, expuesto a radiación ionizante. Evaluar asociaciones entre estos factores y el desarrollo de CPT.
Caso clínicoPaciente varón de 7 años, hijo de padres sanos, no consanguíneos, sin antecedentes familiares de cáncer ni enfermedad tiroidea. Fue recién nacido de término de 38 semanas, de un embarazo controlado, con peso de nacimiento de 2.700g y longitud de 48cm. Tuvo diagnóstico prenatal de hipoplasia de ventrículo izquierdo por atresia valvular mitral y aórtica y coartación aórtica.
A los 11 días de vida se diagnosticó HC en el tamizaje neonatal, iniciando inmediatamente aporte de levotiroxina, con buenos controles posteriores y niveles de tirotropinas en rango normal.
El mismo día se realizó la primera cirugía cardíaca, Norwood Sano, en la cual se resecó el septum primum, obteniendo una amplia comunicación interauricular, se reconstruyó la aorta, se creó una anastomosis entre la neoaorta y el tronco pulmonar y se construyó un shunt entre las arterias pulmonares y el ventrículo derecho. A los 7 meses se realizó la segunda cirugía, Glenn bidireccional, en la que se construyó una anastomosis entre la vena cava superior y la arteria pulmonar, y se seccionó el shunt entre las arterias pulmonares y el ventrículo derecho. Finalmente, a los 2 años 9 meses se llevó a cabo la tercera cirugía cardíaca, llamada Fontan extracardíaco fenestrado, que consistió en la construcción de una anastomosis entre la arteria pulmonar y la vena cava inferior usando un tubo fenestrado mediante el cual se creó una anastomosis entre el tubo y la aurícula derecha.
Evolucionó favorablemente, en tratamiento con ácido acetilsalicílico, captopril y digoxina. Durante su tratamiento fue sometido a 10 cateterismos cardíacos y aproximadamente a 26 radiografías de tórax con dosis pediátrica antes de los 6 años.
A la edad de 6 años 8 meses, mediante ecografía tiroidea, se pesquisó un nódulo tiroideo derecho, de 7×4mm, hipoecogénico, asociado a finas calcificaciones en su interior, sin otras alteraciones. Después de 5 meses se realizó nueva ecografía que describió el nódulo de 10×5mm, hipoecogénico con imágenes sugerentes de microcalcificaciones en su interior. Después de 3 meses, la tercera ecografía mostró un nódulo hipoecogénico, de 6,4mm, con calcificaciones irregulares en su borde externo, contornos mal definidos y vascularización central, categoría TIRADS 4b, sin adenopatías.
Fue derivado a un centro de derivación de enfermedad oncológica infantil, donde se realizó citología por punción espirativa con aguja fina que informó de lesión sugerente de carcinoma de tiroides (Bethesda 5) y ecografía cervical compartimentalizada, que mostró 2 adenopatías sospechosas en la región submentoniana y submandibular derecha, sin otras alteraciones. El estudio de etapificación con tomografía computarizada cerebral, de tórax sin contraste y cintigrafía ósea resultó dentro de los límites normales. Las pruebas tiroideas prequirúrgicas fueron TSH 5,29uUI/ml (0,66-4,14) y tiroxina libre (T4L): 1,50ng/dl (0,90-1,67), en tratamiento con 50mcg de levotiroxina de lunes a viernes y 37,5mcg el sábado y el domingo.
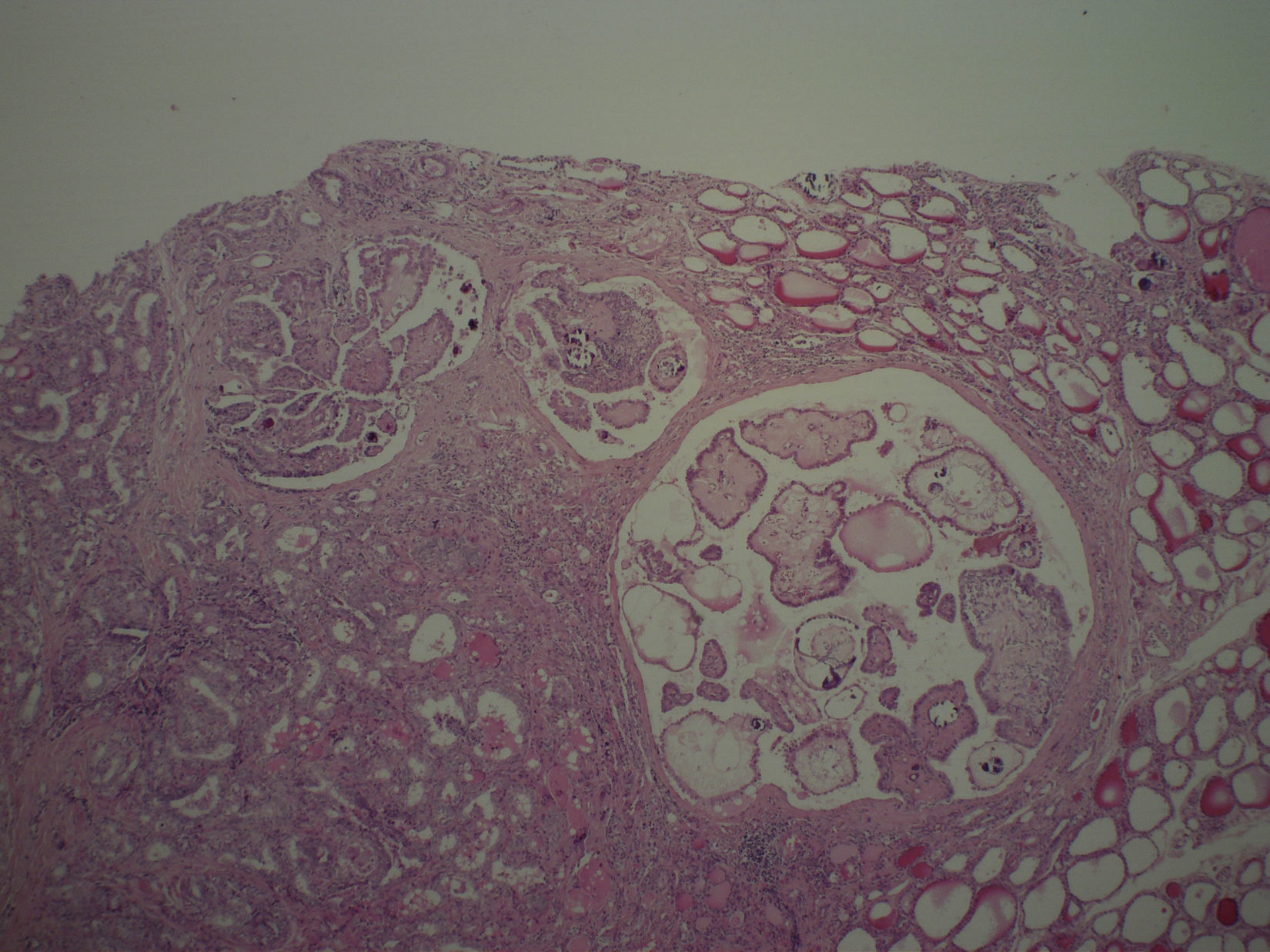
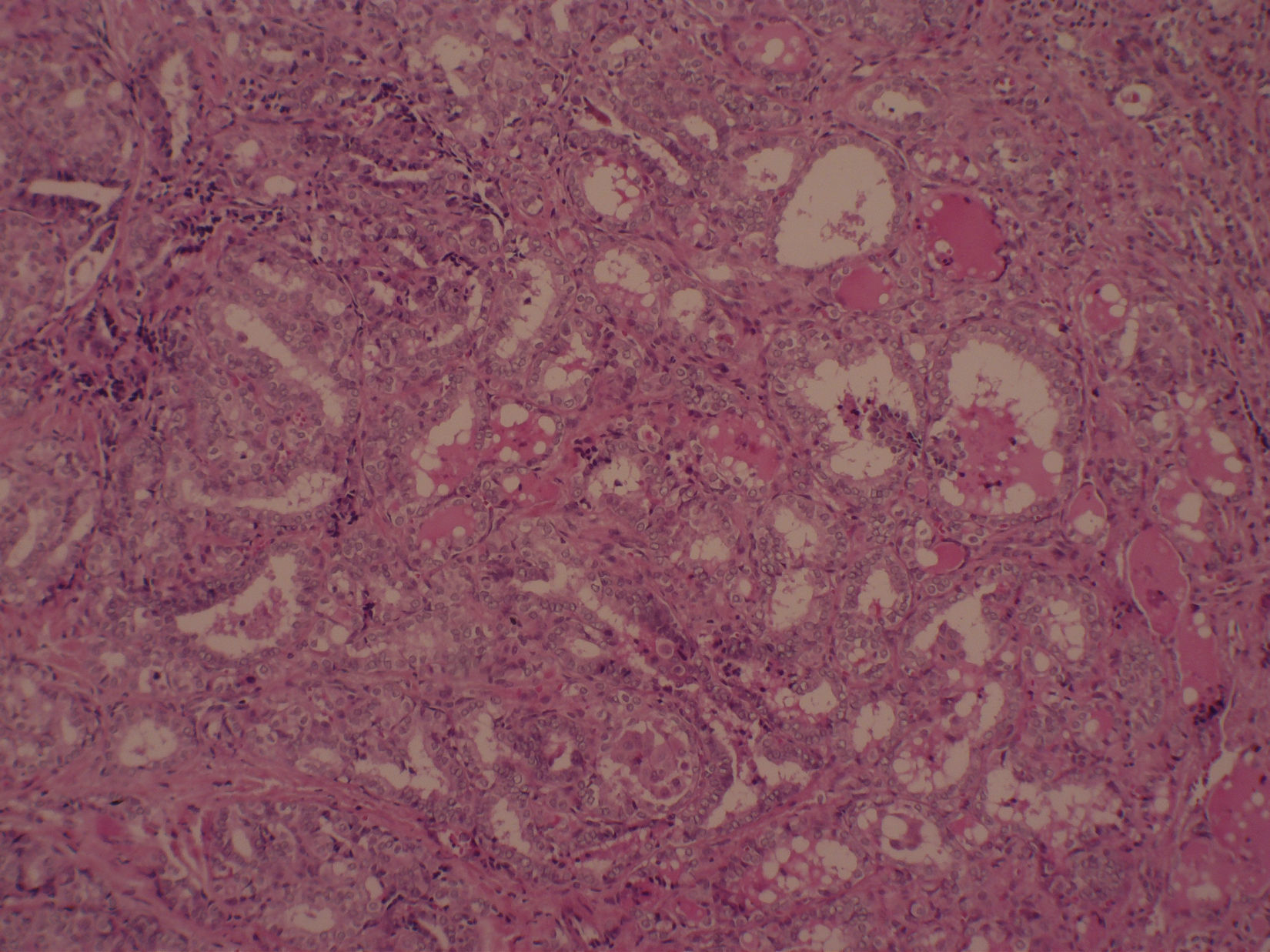
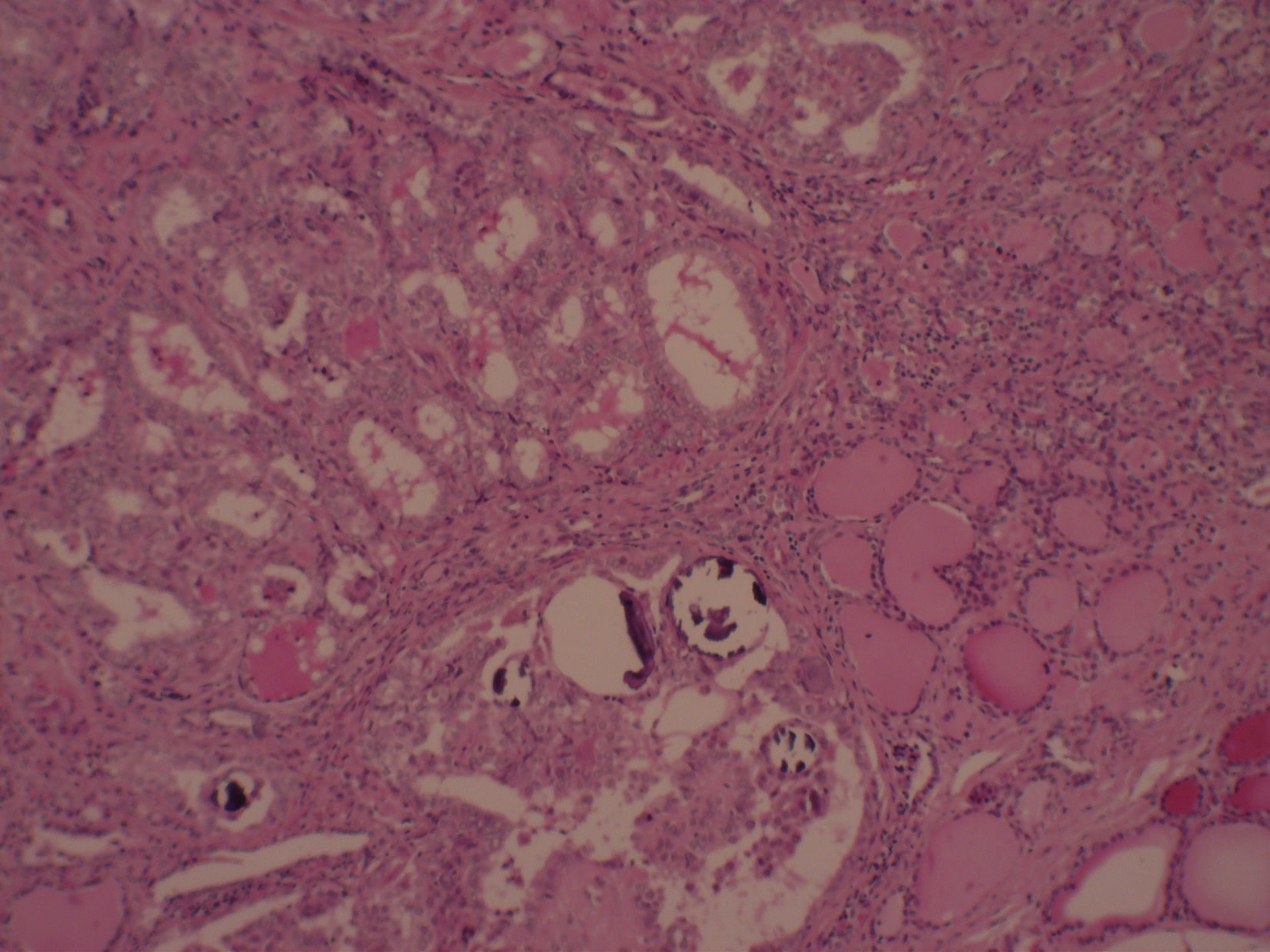
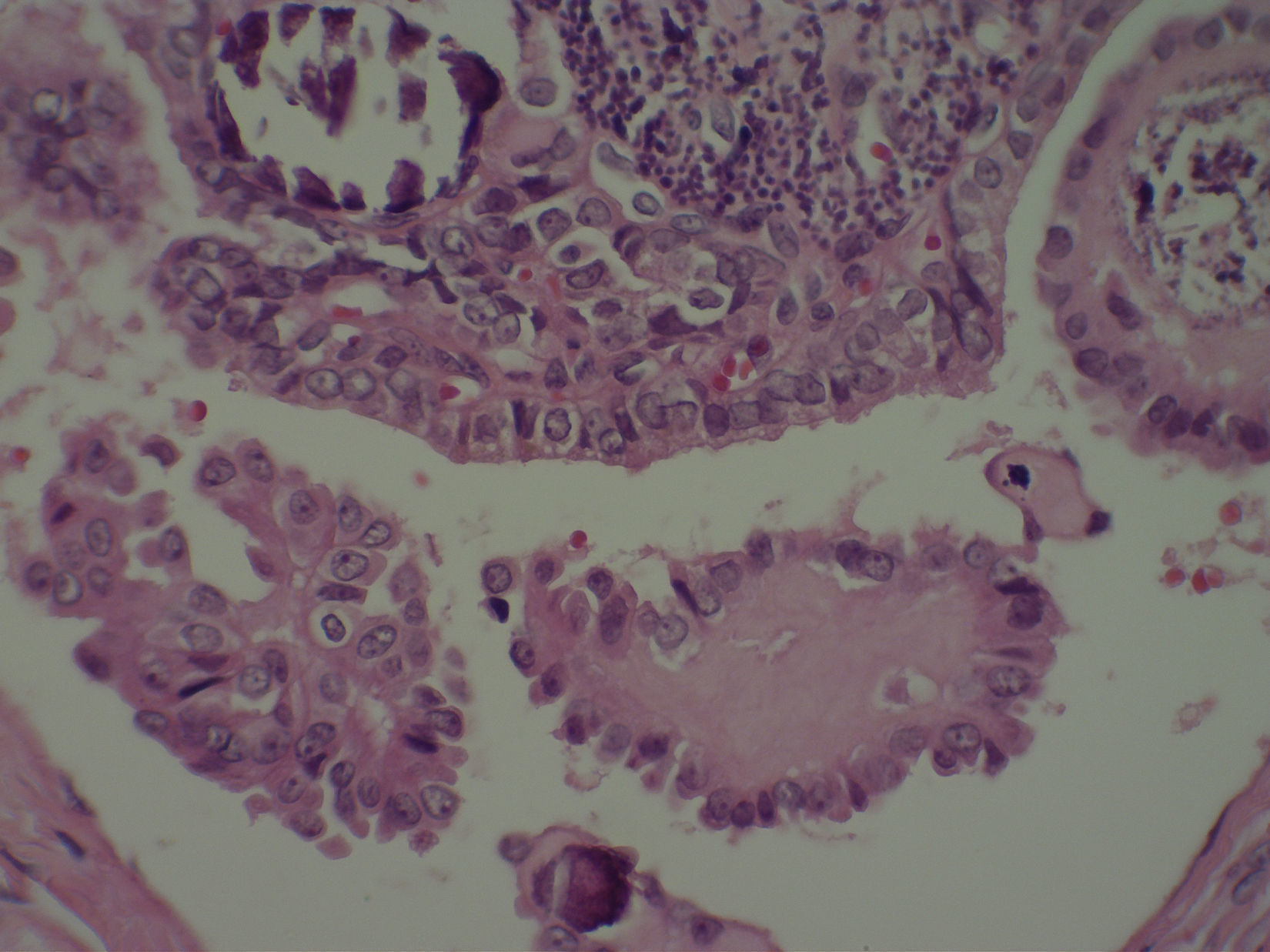
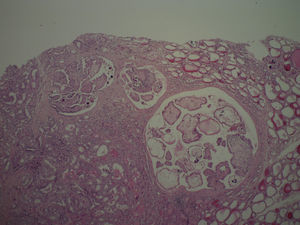
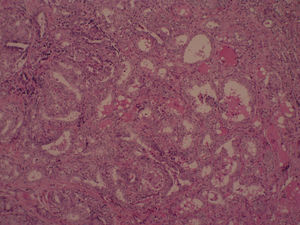
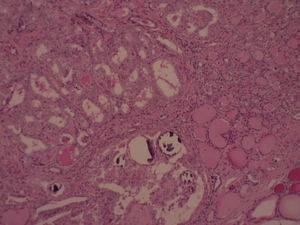
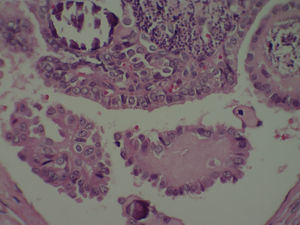
A los 7 años y 10 meses ingresó en el pabellón para la resolución quirúrgica. Se realizó lobectomía derecha, que fue enviada a biopsia intraoperatoria, informando de carcinoma papilar de tiroides, variedad clásica. Se completó la tiroidectomía total y la biopsia de la pieza quirúrgica mostró un nódulo intratiroideo en el lóbulo derecho (fig. 1), bien definido, correspondiente a un carcinoma papilar del tiroides, variedad clásica (fig. 2), de 0,5cm, con microcalcificaciones (fig. 3) y núcleos atípicos (fig. 4), sin invasión linfovascular ni perineural, ambos lóbulos con hiperplasia multinodular macro y microfolicular, con áreas de atrofia. Tamaño del tiroides normal.
A los 3 meses de la cirugía se realizó terapia ablativa con 50mCi de 131I. La exploración sistémica con cintigrafía evidenció una leve captación en el lecho operatorio correspondiente a remanente tiroideo, sin otros focos de captación. En el seguimiento a 3 meses la tiroglobulina sérica resultó en 3,1ng/ml (valor esperado <0,1), anticuerpos anti-tiroglobulina 8,84 UI/ml (valor esperado <4,11) y las pruebas tiroideas fueron normales: TSH 3,3uUI/ml y T4L: 1,61ng/dl. Luego de los siguientes 3 meses los marcadores se encontraban a la baja, con valores de tiroglobulina de 0,9ng/ml y anticuerpos antitiroglobulina de 6,29UI/ml. La ecografía de control a los 6 meses mostró un linfonodo levemente más prominente en la región submandibular izquierda, de 5,3mm de diámetro, ovoide, hipoecogénico con centro ecogénico y señal vascular ligeramente excéntrica, sin otros hallazgos. Se sugirió mantener controles con imágenes.
DiscusiónEl rol del HC en el desarrollo del CPT es un tema controvertido. El efecto de una sobreestimulación de TSH se ha visto involucrado en el desarrollo de nódulos microfoliculares, sólidos, con presencia de hiperplasia folicular o atipias, incluso calcificaciones o cuerpos de Pasammomma han sido descritos como hallazgos de HC dishormonogénico sometido a altos niveles de TSH4,15,16. En nuestro paciente la ausencia de bocio y el buen control tiroideo disminuyen la probabilidad de un cáncer inducido por exceso de TSH.
Los mecanismos implicados en el desarrollo de CPT en HC dishormonogénico no están claros. Hay 2 casos pediátricos publicados en la literatura de pacientes con HC dishormonogénico con buen control tiroideo. Ambos pacientes de sexo femenino, edades de 5 y 15 años, con presentación clínica habitual de CPT, sin factores de riesgo identificados4,15. Medeiros-Neto et al. reportaron un caso de cáncer folicular de tiroides congénito en una paciente recién nacida, también de sexo femenino, con HC y bocio. El estudio genético descubrió una mutación ubicada en el exón 14 del gen de la peroxidasa tiroidea, que encontraron también en su padre y abuela paterna, la última operada por un cáncer de tiroides a la edad de 26 años. La mutación provocó una detención en la señal del exón 16 del gen, produciendo una transcripción alterada de la peroxidasa tiroidea17. Recientemente se reportó el primer caso de una mujer con HC dishormonogénico, portadora de un defecto del transportador de yodo, suplementada con T4 desde el año de vida, que a los 40 años fue diagnosticada de una forma agresiva de CPT18. La coexistencia de mutaciones genéticas propias del HC y el desarrollo de CPT en estos casos clínicos abre la discusión sobre la existencia de vías comunes o asociaciones entre el HC dishormonogénico y el desarrollo de cáncer tiroideo.
Uno de los factores que probablemente más influya en el aumento de la incidencia de CPT es la mayor exposición a radiación ionizante. Se desconoce si en casos de HC dishormonogénico hay una mayor probabilidad de transformación maligna por exposición a radiación. Wagner describe asociación entre leucemia, cáncer de mama, de tiroides, de pulmón y de cerebro en niños que recibieron radiación médica19, y Preston reportó un riesgo relativo de incidencia de cáncer sólido de 2,0 (IC 95%=1,4 a 2,8) por cada 1 Sievert (Sv) de exposición en aquellos pacientes expuestos antes de los 6 años20. En este paciente la dosis de radiación total recibida se estima en, al menos 40,12 milliSievert (mSv), equivalente a 2.006 radiografías de tórax (principalmente atribuible a los cateterismos cardiacos realizados bajo fluoroscopia)21. Esta dosis de radiación aumenta la posibilidad de afectar órganos vecinos radiosensibles como los ojos, la tiroides y las gónadas, más aún a edad temprana.
La cantidad de dosis de radiación segura en edades tempranas de la vida continúa siendo un tema controvertido. Existen limitaciones estadísticas para evaluar el riesgo de cáncer en humanos expuestos a dosis menores a 100mSv (dosis equivalente a 40 veces la exposición a radiación acumulada anual). Una revisión de datos obtenidos en estudios biológicos concluyó que el riesgo podría aumentar de forma continua siguiendo un «modelo lineal sin umbral»22. Es por esto que la Food and Drug Administration realiza una serie de recomendaciones para reducir el riesgo de daño inducido por radiación, introduciendo el concepto As Low As Reasonably Achievable —ALARA— (tan bajo como sea razonablemente posible) que promueve el menor uso de radiación posible sin perjudicar el resultado clínico19,23,24. En la guía clínica de nódulo tiroideo y cáncer diferenciado de tiroides del Ministerio de Salud de Chile 2013 se indica que «no es recomendable tamizar cáncer de tiroides en pacientes expuestos a estudios radiológicos de segmentos próximos a la tiroides. Solo individuos menores de 15 años sometidos a estudios radiológicos repetidos podrían ser evaluados» (nivel de evidencia 2. Recomendación tipo B)25.
ConclusiónEl desarrollo de cáncer en pediatría sigue siendo un desafío para el clínico. Su presencia asociada a HC es un tema controvertido que requiere futuros estudios. La falta de análisis genéticos genera incertidumbre respecto a la existencia de vías comunes en el desarrollo de ambas enfermedades. Es posible que, en este caso, una glándula tiroidea con un defecto intrínseco en la síntesis de hormonas, y la exposición a radiación ionizante de forma repetida, pudiesen haber estado implicados en el desarrollo de CPT en forma conjunta. Los estudios diagnósticos y terapéuticos basados en bajas dosis de radiación ionizante han aumentado espectacularmente en las últimas décadas, y conocer e informar de sus riesgos, especialmente en pediatría, cobra cada vez mayor relevancia. Finalmente, el diagnóstico y tratamiento del cáncer de tiroides en pediatría deben ser precoces y agresivos para asegurar mayor tiempo de sobrevida libre de enfermedad, guardando un balance con los efectos adversos asociados al tratamiento.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A Macarena Pérez Acevedo, Secretaria de División de Investigación del Complejo Asistencial Dr. Sótero del Río.