Desnutrición, retardo en el crecimiento e infecciones oportunistas sobrevienen a alteraciones metabólicas, inmunológicas y gastrointestinales que produce el virus de la inmunodeficiencia humana (VIH). La deficiencia de zinc se ha asociado con deterioro nutricional, falla en el crecimiento y riesgo de infecciones. El objetivo de este estudio fue asociar los niveles de zinc en células mononucleares de sangre periférica (PBMC) con el estado nutricional en niños infectados por el VIH y en niños no infectados expuestos al virus.
Pacientes y MétodoEstudio analítico observacional, transversal, en 17 niños infectados y 17 expuestos, entre 2 y 10 años de edad. Se realizó valoración antropométrica, historia clínica-nutricional, recordatorio de 24 horas, medición de actividad física y determinación de zinc en PBMC por citometría de flujo.
ResultadosLa talla para la edad, el consumo de energía, y la adecuación de energía, proteínas y zinc alimentario fueron significativamente mayores en los niños expuestos comparados con los niños infectados (p < 0,05). No se hallaron diferencias significativas en el índice de masa corporal, los niveles de zinc en monocitos, linfocitos CD4+ y CD4− entre los dos grupos de estudio (p > 0,05); sin embargo, la mediana de los niveles de zinc en monocitos de pacientes infectados fue mayor (218,6) comparado con el grupo control (217,0). No se encontró asociación entre consumo de zinc y niveles de zinc intracelular.
ConclusionesEl deterioro del estado nutricional y el retardo en el crecimiento en niños estuvo asociado al VIH, pero no a los niveles de zinc intracelular. El consumo alimentario de este nutriente no se asoció a niveles de zinc en monocitos y linfocitos CD4+ y CD4—.
Malnutrition, growth retardation and opportunistic infections outlast the metabolic, immune and gastrointestinal disorders produced by HIV. Zinc deficiency has been associated with deteriorating nutritional status, growth failure, and risk of infection. The aim of this study is to determine the association between zinc levels in peripheral blood mononuclear cells (PBMC) and the nutritional status of HIV-infected and uninfected children exposed to the virus.
Patients and MethodsAn analytical, observational, cross-sectional study was conducted on 17 infected and 17 exposed children, aged 2-10 years. Anthropometric measurements, clinical and nutritional history, 24h recall, measurement of physical activity, and zinc in PBMC by flow cytometry analysis were recorded.
ResultsHeight according to age, energy consumption and adequacy of energy, protein and dietary zinc were significantly higher in children exposed to the virus compared to those infected with HIV (P <.05). No significant differences were found in BMI, levels of zinc in monocytes, CD4 + and CD4− lymphocytes between the two study groups (P >.05). However, the median levels of zinc in monocytes of infected patients was higher (218.6) compared to the control group (217.0). No association was found between zinc intake and levels of intracellular zinc.
ConclusionsThe deterioration of nutritional status and growth retardation in children were associated with HIV, but not with the levels of intracellular zinc. The dietary intake of this nutrient was not associated with levels of zinc in monocytes or CD4 + and CD4− lymphocytes.
El virus de la inmunodeficiencia humana (VIH) continúa siendo un problema de salud pública mundial debido a su gran incidencia y al alto índice de morbimortalidad en las poblaciones vulnerables1. De acuerdo a ONUSIDA 2013, en el mundo, 35 millones de personas vivían con la infección, de los cuales, 3,2 millones eran niños. Para América Latina, 1,6 millones tenían la infección, de los cuales 35000 eran niños2. La causa más frecuente de contagio en niños sigue siendo la transmisión madre-hijo1, aunque ha disminuido de un 35% en 2001 a un 26% en 20103.
El VIH está asociado a factores biológicos y sociales que afectan a la capacidad del individuo para consumir, utilizar y obtener alimentos. Así, en los niños, la infección repercute en su crecimiento y composición corporal, aumentando la progresión hacia el sida y disminuyendo el tiempo de supervivencia4,5.
Algunas investigaciones han mostrado cómo la deficiencia de micronutrientes es común en niños infectados, y el zinc es uno de los nutrientes involucrados; su deficiencia afecta adversamente al desarrollo y la función celular produciendo disminución de la velocidad de crecimiento lineal, pérdida de peso y alteraciones inmunológicas, gastrointestinales y nutricionales6–9.
Estudios en modelos experimentales en humanos y animales han elucidado parcialmente el papel del zinc intracelular en monocitos y macrófagos, entre otras células, el cual, unido a proteínas como la metalotionina, actúa como segundo mensajero en procesos de señalización y como agente antioxidante y antiinflamatorio, funciones que también pueden afectarse con su deficiencia8.
Existen marcadores que reflejan el estado corporal de los micronutrientes, pero la escasez de biomarcadores sensibles para medir el estado de zinc ha sido bien documentado; el uso del zinc sérico o plasmático continúa siendo ampliamente usado pero con grandes limitaciones biológicas, como su baja sensibilidad para indicar estado marginal de deficiencia, y poca especificidad debido a que en procesos agudos de infección e inflamación crónica pueden también disminuir sus niveles plasmáticos, según el tipo de alimentos consumidos, la hora del día y el uso de ciertos medicamentos10.
El objetivo de esta investigación fue asociar los niveles de zinc en células mononucleares de sangre periférica (PMBC) con el estado nutricional de los niños infectados por el VIH y de los niños no infectados que fueron expuestos al virus.
Pacientes y MétodoDiseñoEstudio analítico observacional, tipo transversal, realizado en un grupo de niños infectados por el VIH o expuestos al virus pero no infectados, entre los 2 y 10 años de edad, atendidos en instituciones que trabajan con este tipo de población en la ciudad de Medellín, Colombia.
SujetosSe conformó una muestra de 34 niños infectados por el VIH vía perinatal (grupo caso) o expuestos a la infección durante la gestación y/o el parto, no infectados (grupo control). Los casos salieron de tres fundaciones de Medellín que trabajan con niños con VIH y sus familias, y de un hospital de alta complejidad de la ciudad; los controles se obtuvieron de las mismas fundaciones. Los niños expuestos fueron equiparados por sexo y ± 2 años de edad frente a los infectados. Una vez aplicados los criterios de inclusión de los casos y controles, y debido al apareamiento por sexo y edad del grupo control frente al grupo caso, se reclutaron 17 niños caso, y su respectivo par, niños expuestos no infectados. La muestra fue recolectada en el período comprendido entre septiembre de 2011 y agosto de 2012.
Criterios de inclusiónNiños con el VIH o expuestos a la infección durante la gestación y/o el parto y que no se hubieran contagiado; los infectados debían estar recibiendo terapia antirretroviral; y todos los participantes tener consentimiento informado.
Criterios de exclusiónDiagnóstico de sida en niños infectados; estar recibiendo suplementos de zinc en forma continua por más de 3 meses y/o en tratamiento con inmunomoduladores en un período de 60 días antes de la participación en el estudio; niños que hubieran presentado fiebre, diarrea o deshidratación en el momento de la evaluación y/o con infecciones crónicas.
Características evaluadasSe aplicó una historia clínica-nutricional, donde se indagó por datos generales, síntomas en el último mes, consumo de medicamentos y suplementos dietéticos, y cambios en el patrón alimentario. También se registró la información de valoración antropométrica, ingesta dietética y actividad física.
Valoración antropométricaEl estado nutricional fue evaluado mediante la toma de peso, la estatura, el perímetro del brazo y el pliegue de grasa tricipital. Se calcularon peso/edad (P/E), talla/edad (T/E) e índice de masa corporal (IMC)/edad (IMC/E) expresados en puntaje Z, y área magra y grasa del brazo (antropometría braquial) en percentiles. Para la valoración se emplearon: balanza digital tanita HD313 (Arlington Heights, Illnois), capacidad 150kg, sensibilidad 100g; tallímetro portátil seca 208 (Alemania), capacidad 2 m, sensibilidad 1 mm; cinta métrica metálica Lufkin W606PM (México), capacidad 200cm, sensibilidad de 1mm; calibrador Harpenden (British Indicators, Reino Unido) capacidad 57mm, sensibilidad 0,2mm.
La toma de medidas antropométricas y la ubicación de los equipos se realizó cumpliendo con las exigencias y normas internacionales11; además, se solicitó que los niños estuvieran en ayunas. Todas las medidas antropométricas fueron tomadas por una persona estandarizada, para evitar sesgos y variabilidad en la toma de datos. Los indicadores P/E, T/E e IMC/E fueron analizados con los software anthro y anthroplus, y comparados con los patrones de crecimiento publicados por la Organización Mundial de la Salud (OMS) 2006-2007 para los niños y adolescentes de 0-18 años, y adaptados para Colombia de acuerdo a la Resolución 2121 de 2010, considerando normalidad el puntaje Z entre −1 y +112. El análisis de antropometría braquial se realizó con los valores de referencia de Frisancho, 198113.
Para nuestra investigación se tuvieron en cuenta las siguientes consideraciones: los estándares de la OMS solo analizan el indicador P/E para los niños menores de 9 años-11 meses; en este estudio, tres de los participantes eran mayores; por lo tanto, su estado nutricional se evaluó por los indicadores T/E e IMC/E12. El indicador peso/estatura (P/T) no se tuvo en cuenta para la interpretación del estado nutricional de los niños, debido a que su resultado solo se analiza en los niños menores de 5 años. Los resultados de la clasificación de P/T en estos niños fueron comparados con los de IMC/E, mostrando la misma clasificación e interpretación.
Muestras biológicasSe tomó una muestra de sangre venosa periférica en ayunas para el análisis de zinc intracelular por citometría de flujo, y en los niños expuestos, además, la prueba presuntiva tipo ELISA para confirmar su seronegatividad. En los niños infectados se recolectaron 4ml con heparina, y en expuestos 4ml de sangre con el mismo anticoagulante y 1ml sin anticoagulante. En los días previos al examen, los niños no debían presentar fiebre, diarrea, deshidratación, infecciones oportunistas, ni otro síntoma que pudiera afectar a los niveles de zinc.
Análisis por citometría de flujo del zinc intracelularEl zinc se analizó en células mononucleares de sangre periférica (PBMC), método de Malavolta et al., 200614, con las siguientes modificaciones: las células fueron separadas por gradiente de densidad convencional con Ficoll-Hypaque (Sigma-Aldrich, UK), colectadas por buffy-coat, lavadas con medio RPMI 1X Glutamax libre de zinc suplementado con 1 mM EDTA y 100 UI/ml de estreptomicina/penicilina; e inmediatamente usadas para detectar zinc intracelular. Las células se dividieron en dos alícuotas de 2 x 105 células. Una alícuota control se incubó por 30 minutos a 37°C y 5% CO2, en medio RPMI libre de zinc amortiguado con HEPES, conteniendo 1mM EDTA. La segunda alícuota se incubó en las mismas condiciones con 15μM zinpyr-1 (ZP1) (Sigma-Aldrich, USA), para detectar el zinc intracelular total. Posteriormente, de la segunda alícuota se transfirieron 250 μl de la suspensión celular a otro tubo con 5μl de CD4-Percp-Cy5.5 (BecktonDickinson, USA) para detectar zinc intracelular en linfocitos CD4+. Finalizado este proceso, las células fueron transportadas protegidas de la luz hacia el sitio de lectura. La intensidad media de fluorescencia (IMF) de zinc y de ZP1 (excitación, longitud de onda 488nm; detección a 525nm) se obtuvo en un citómetro de flujo FACSCanto II (Beckton Dickinson, California). Los resultados de 10 000 eventos se analizaron con el programa Kaluza versión 1,1 (Beckman Coulter, Inc, California, USA, 2009).
Evaluación consumo alimentarioSe aplicaron dos recordatorios de 24 horas en días no consecutivos, con un lapso de tiempo mínimo de 3 días y máximo de 15, entre el primer y segundo recordatorio, incluyendo los 7 días de la semana. El segundo recordatorio se aplicó en forma aleatoria y en días no consecutivos, con el objetivo de garantizar independencia entre las observaciones, permitiendo estimar y ajustar la variabilidad intraindividual. Con el fin de precisar las cantidades de alimentos consumidas se empleó un álbum de fotografías con utensilios de medidas caseras en la porción real, modelos de alimentos y figuras geométricas que representaban los alimentos en diferentes tamaños.
Los datos sobre consumo alimentario fueron ingresados y analizados en el programa de evaluación de ingesta dietética de la Escuela de Nutrición y Dietética, de la Universidad de Antioquia (EVINDI, versión 4,0)15. Finalmente, los datos obtenidos se normalizaron mediante el programa PC-SIDE (Personal Computer Version of Software for Intake Distribution Estimation), versión 1,0, de junio de 2004, disponible en el departamento de estadística en Iowa State University Statistical Laboratory, Ames IA, Estados Unidos.
La metodología de recolección de información y análisis de datos fue la misma que se empleó en la Encuesta Nacional de Situación Nutricional en Colombia (ENSIN) 200516.
Determinación del nivel de actividad físicaLos datos se obtuvieron por medio de la aplicación del cuestionario “Recordatorio de actividad física de 3 días (3DPAR)”17,18. Se aplicó con el objetivo de establecer el nivel de actividad física de cada niño (leve, moderada o intensa), y determinar el requerimiento calórico, y compararlo con el consumo calórico actual. Los cuestionarios fueron diligenciados por la persona responsable del niño.
Análisis estadísticoLa descripción de los datos cuantitativos se realizó mediante medias, desviación estándar (DE), medianas, rangos intercuartílicos (RQ) y valores de intervalos de confianza. Los datos cualitativos se mostraron como frecuencias y porcentajes. Para el análisis estadístico se comprobaron los supuestos de normalidad y varianzas iguales con la prueba de Shapiro Wilk y la prueba de Levene, respectivamente; con el objetivo de buscar diferencias entre los grupos de estudio, en aquellas variables que distribuyeron normal se utilizó la prueba t de Student, y en las que no distribuyeron normal, la prueba U de Mann-Whitney. Además, se aplicó la prueba chi al cuadrado de tendencia para determinar si existía diferencia en el número de niños ubicados en las clasificaciones del área magra y grasa en los dos grupos de estudio. Se realizaron correlaciones con la prueba Rho de Spearman para identificar posibles asociaciones entre las variables estudiadas. Finalmente, se realizó un análisis multivariado de la varianza manova, donde las variables dependientes establecidas fueron los tres indicadores antropométricos y la variable independiente la presencia o no de VIH; además, se controlaron en la manova las variables IMF de monocitos, linfocitos CD4+ y CD4−, y R de calorías, proteína y zinc alimentario. Los datos estadísticos fueron procesados en el programa estadístico SPSS versión 19,0 (Illnois, Chicago, 2010).
Aspectos éticosSe tuvieron en cuenta todas las consideraciones y principios establecidos en la declaración de Helsinki y en la Resolución N° 008430 de 1993, del Ministerio de Salud, de la República de Colombia19,20. El trabajo fue avalado por el comité de bioética del Instituto de Investigaciones Médicas de la Facultad de Medicina de la Universidad de Antioquia, y de la E.S.E. Hospital La María, Medellín-Colombia. Se obtuvo consentimiento informado del padre o la persona adulta a cargo del menor, y el asentimiento informado de los niños con edad mayor o igual a 7 años.
ResultadosUn total de 34 niños entre los 2 y 10 años de edad participaron en la investigación, de los cuales el 97,1% contaba con seguridad social y el 100% de los niños infectados recibían terapia antirretroviral. La media de edad del total de la muestra fue de 7,0 ± 2,1 años (IC95%: 6,3-7,8 años); al comparar los grupos no se presentaron diferencias significativas por edad (p = 0,599) y por sexo (p = 1,00).
Con relación a la presencia de síntomas en el mes previo a la investigación, el 47,1% de los niños infectados reportaron principalmente gripe, fiebre y/o diarrea, y el 64,7% de los expuestos, gripe, dolor de cabeza y/o dolor de estómago, sin diferencia estadística entre los grupos (p = 0,3001).
Valoración antropométricaEn los niños infectados, la media de peso y estatura fue de 22,0 ± 7,0kg y 114,0 ± 15,3cm, respectivamente; y en los expuestos, la media de peso y estatura fue de 22,7 ± 6,4kg y 118,0 ± 9,0cm. Aunque no se presentaron diferencias significativas entre los grupos (p > 0,05), se observó en los niños expuestos una variabilidad menor, con una estatura más alta con respecto a los infectados.
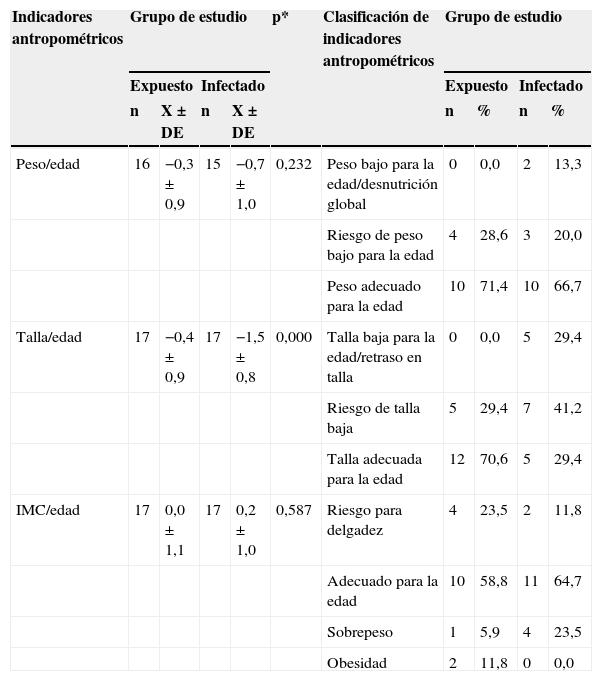
La tabla 1 muestra las medidas descriptivas de los indicadores antropométricos P/E, T/E e IMC/E y las clasificaciones de los mismos. Al comparar los dos grupos, solo se encontró diferencia significativa en la T/E (p = 0,000), donde los niños infectados fueron de menor estatura. Respecto a la antropometría braquial, medida por el área magra y grasa del brazo, no se encontraron diferencias en el número de niños infectados y expuestos ubicados en las diferentes clasificaciones de estas medidas (p > 0,05).
Valoración antropométrica por indicadores de peso/edad, talla/edad e IMC/edad en los niños infectados y expuestos no infectados
| Indicadores antropométricos | Grupo de estudio | p* | Clasificación de indicadores antropométricos | Grupo de estudio | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Expuesto | Infectado | Expuesto | Infectado | |||||||
| n | X ± DE | n | X ± DE | n | % | n | % | |||
| Peso/edad | 16 | −0,3 ± 0,9 | 15 | −0,7 ± 1,0 | 0,232 | Peso bajo para la edad/desnutrición global | 0 | 0,0 | 2 | 13,3 |
| Riesgo de peso bajo para la edad | 4 | 28,6 | 3 | 20,0 | ||||||
| Peso adecuado para la edad | 10 | 71,4 | 10 | 66,7 | ||||||
| Talla/edad | 17 | −0,4 ± 0,9 | 17 | −1,5 ± 0,8 | 0,000 | Talla baja para la edad/retraso en talla | 0 | 0,0 | 5 | 29,4 |
| Riesgo de talla baja | 5 | 29,4 | 7 | 41,2 | ||||||
| Talla adecuada para la edad | 12 | 70,6 | 5 | 29,4 | ||||||
| IMC/edad | 17 | 0,0 ± 1,1 | 17 | 0,2 ± 1,0 | 0,587 | Riesgo para delgadez | 4 | 23,5 | 2 | 11,8 |
| Adecuado para la edad | 10 | 58,8 | 11 | 64,7 | ||||||
| Sobrepeso | 1 | 5,9 | 4 | 23,5 | ||||||
| Obesidad | 2 | 11,8 | 0 | 0,0 | ||||||
X ± DE: promedio ± desviación estándar. IMC: Indice de Masa Corporal.
*Prueba t de Student para grupos independientes.
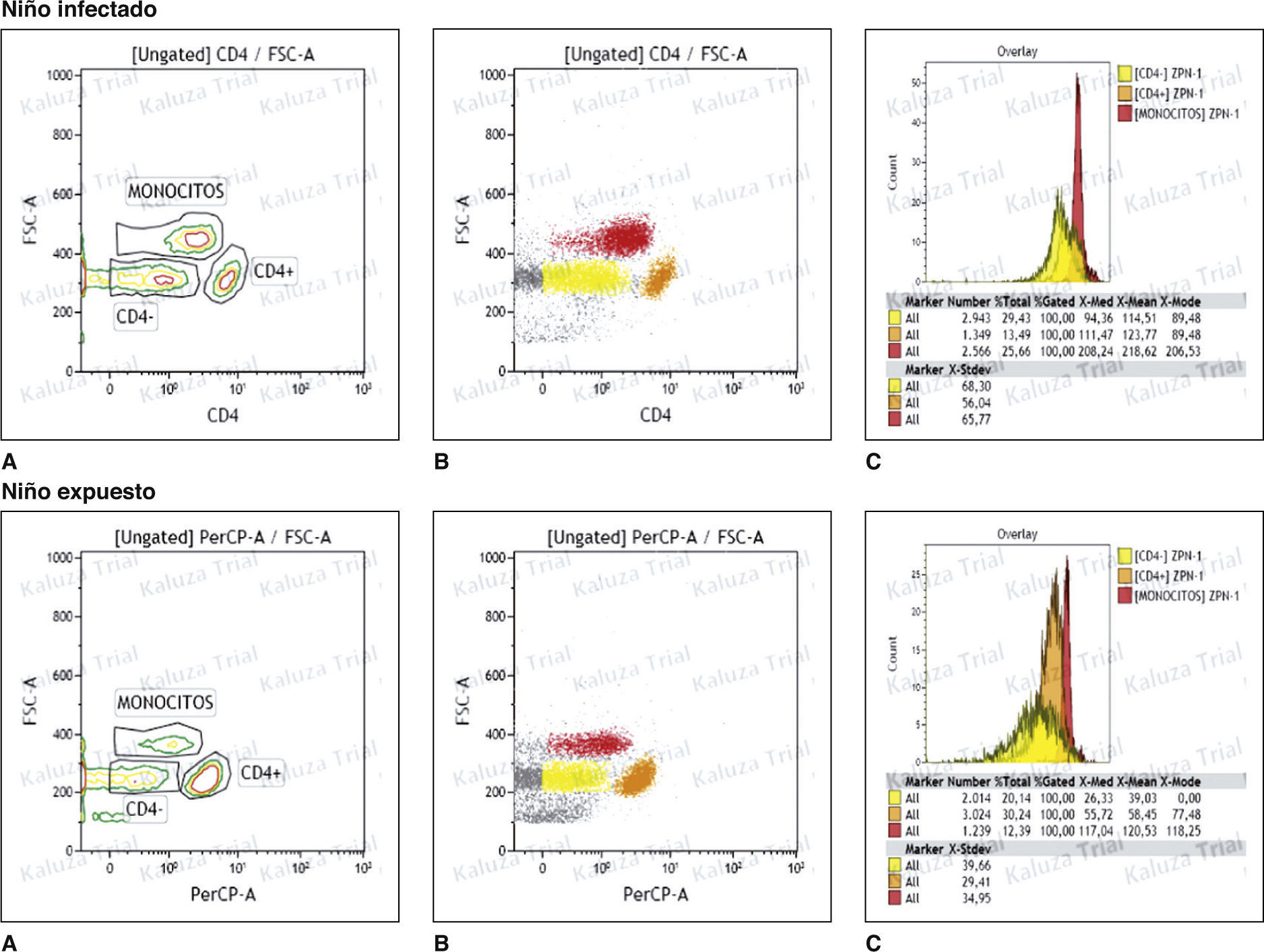
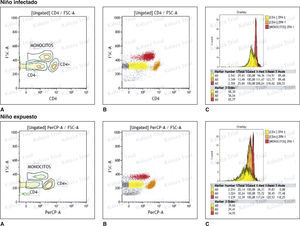
Se encontró que en los niños expuestos, la mediana de la IMF de zinc de monocitos fue 217,0 (RQ 105,4), linfocitos CD4+ 111,4 (RQ 57,5) y CD4− 85,2 (RQ 65,2), y en los infectados de 218,6 (RQ 238,4), 131,4 (RQ 121,3) y 117,1 (RQ 122,7), respectivamente. Comparando los resultados entre los dos grupos, no se encontró diferencia significativa entre los valores de la IMF en los monocitos (U = 134; p = 0,718), en los linfocitos CD4+ (U = 132; p = 0,667) y CD4− (U = 124; p = 0,480) (fig. 1); sin embargo, la mediana de los niveles de zinc en monocitos de pacientes infectados fue mayor comparado con el grupo control.
Análisis de zinc intracelular en monocitos, linfocitos CD4+ y CD4− en niños infectados por el VIH y en niños expuestos no infectados. A. Gráfica de contorno de la distribución de zinc intracelular en células mononucleares de sangre periférica, monocitos, linfocitos CD4+ y CD4−, en un niño infectado y uno expuesto. B. Gráfica de nube de puntos de la distribución de zinc intracelular en células mononucleares de sangre periférica, monocitos, linfocitos CD4+ y CD4−, en un niño infectado y uno expuesto. C. Histograma del resultado de la intensidad media de fluorescencia (IMF) de los niveles de zinc en células mononucleares de sangre periférica, monocitos, linfocitos CD4+ y CD4−, en un niño infectado y uno expuesto.
En los niños expuestos, el 11,8% tenía un consumo adecuado de calorías y el 88,2% exceso; el total de los niños presentó una adecuación (R) de proteína por encima de 1,0 y el 100% cubrió con la alimentación la EAR de zinc. Mientras que en los infectados, el 23,5% presentó déficit en el consumo de calorías, el 17,6% una ingesta adecuada y el 58,9% exceso; el 5,9% deficiencia en el consumo de proteína y el 94,1% consumo por encima de la recomendación; finalmente, el 100% un R de zinc >1,0, ingesta que se encontraba entre el rango de EAR y UL.
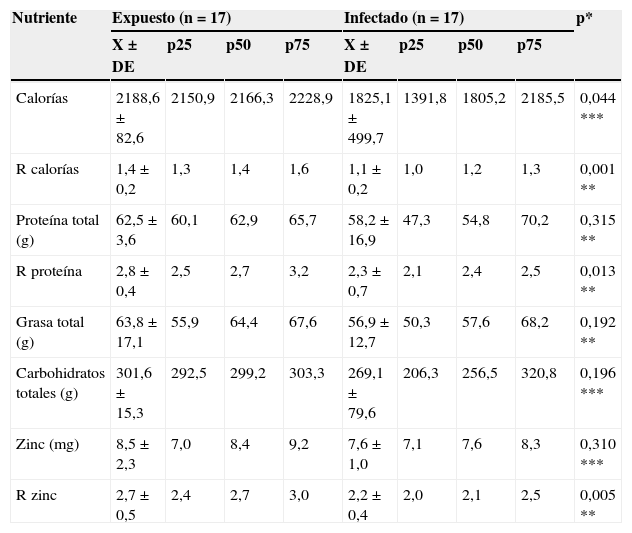
La tabla 2 muestra la variación en la ingesta de calorías, macronutrientes y zinc entre los dos grupos, con diferencia significativa en el consumo de calorías y en R de calorías, proteína y zinc (p < 0,05), evidenciando en los expuestos una mayor ingesta de energía y adecuación de los nutrientes.
Ingesta de calorías, macronutrientes y zinc, y R (adecuación) de calorías, proteína y zinc en los niños infectados y expuestos no infectados
| Nutriente | Expuesto (n = 17) | Infectado (n = 17) | p* | ||||||
|---|---|---|---|---|---|---|---|---|---|
| X ± DE | p25 | p50 | p75 | X ± DE | p25 | p50 | p75 | ||
| Calorías | 2188,6 ± 82,6 | 2150,9 | 2166,3 | 2228,9 | 1825,1 ± 499,7 | 1391,8 | 1805,2 | 2185,5 | 0,044 *** |
| R calorías | 1,4 ± 0,2 | 1,3 | 1,4 | 1,6 | 1,1 ± 0,2 | 1,0 | 1,2 | 1,3 | 0,001 ** |
| Proteína total (g) | 62,5 ± 3,6 | 60,1 | 62,9 | 65,7 | 58,2 ± 16,9 | 47,3 | 54,8 | 70,2 | 0,315 ** |
| R proteína | 2,8 ± 0,4 | 2,5 | 2,7 | 3,2 | 2,3 ± 0,7 | 2,1 | 2,4 | 2,5 | 0,013 ** |
| Grasa total (g) | 63,8 ± 17,1 | 55,9 | 64,4 | 67,6 | 56,9 ± 12,7 | 50,3 | 57,6 | 68,2 | 0,192 ** |
| Carbohidratos totales (g) | 301,6 ± 15,3 | 292,5 | 299,2 | 303,3 | 269,1 ± 79,6 | 206,3 | 256,5 | 320,8 | 0,196 *** |
| Zinc (mg) | 8,5 ± 2,3 | 7,0 | 8,4 | 9,2 | 7,6 ± 1,0 | 7,1 | 7,6 | 8,3 | 0,310 *** |
| R zinc | 2,7 ± 0,5 | 2,4 | 2,7 | 3,0 | 2,2 ± 0,4 | 2,0 | 2,1 | 2,5 | 0,005 ** |
*Se comparan los valores de consumo de calorías, proteína, grasa, carbohidratos totales y zinc, y la adecuación (R) de calorías, proteína y zinc entre los dos grupos de estudio (niños expuestos e infectados).
**Prueba t de Student para grupos independientes.
***Prueba U de Mann Whitney.
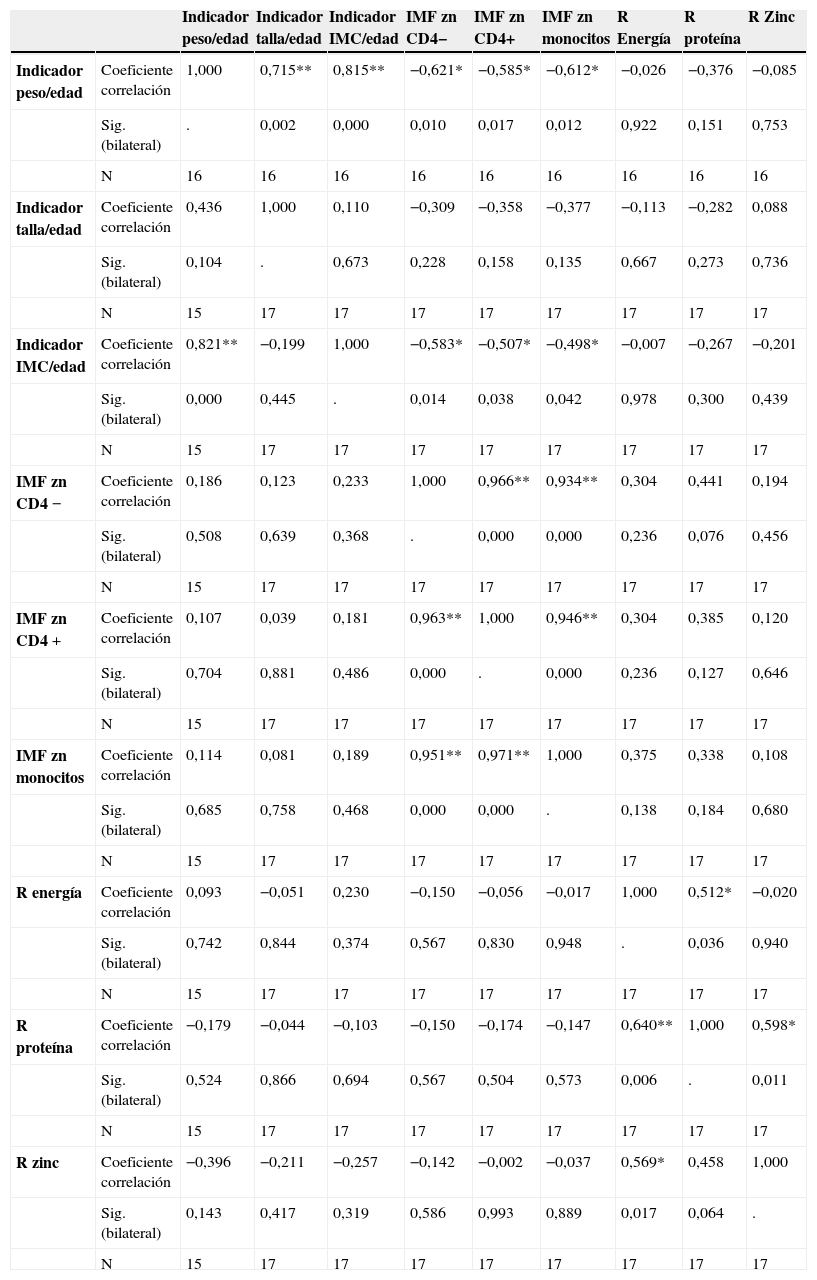
Solo se encontró asociación entre las variables de la misma área, es decir, entre indicadores antropométricos; el nivel de zinc en los monocitos, linfocitos CD4+ y CD4−, y entre las R de calorías, proteína y zinc. No se halló asociación entre el consumo alimentario de zinc y los niveles de zinc en células mononucleares (tabla 3).
Correlaciones entre variables en los niños infectados y expuestos no infectados
| Indicador peso/edad | Indicador talla/edad | Indicador IMC/edad | IMF zn CD4− | IMF zn CD4+ | IMF zn monocitos | R Energía | R proteína | R Zinc | ||
|---|---|---|---|---|---|---|---|---|---|---|
| Indicador peso/edad | Coeficiente correlación | 1,000 | 0,715** | 0,815** | −0,621* | −0,585* | −0,612* | −0,026 | −0,376 | −0,085 |
| Sig. (bilateral) | . | 0,002 | 0,000 | 0,010 | 0,017 | 0,012 | 0,922 | 0,151 | 0,753 | |
| N | 16 | 16 | 16 | 16 | 16 | 16 | 16 | 16 | 16 | |
| Indicador talla/edad | Coeficiente correlación | 0,436 | 1,000 | 0,110 | −0,309 | −0,358 | −0,377 | −0,113 | −0,282 | 0,088 |
| Sig. (bilateral) | 0,104 | . | 0,673 | 0,228 | 0,158 | 0,135 | 0,667 | 0,273 | 0,736 | |
| N | 15 | 17 | 17 | 17 | 17 | 17 | 17 | 17 | 17 | |
| Indicador IMC/edad | Coeficiente correlación | 0,821** | −0,199 | 1,000 | −0,583* | −0,507* | −0,498* | −0,007 | −0,267 | −0,201 |
| Sig. (bilateral) | 0,000 | 0,445 | . | 0,014 | 0,038 | 0,042 | 0,978 | 0,300 | 0,439 | |
| N | 15 | 17 | 17 | 17 | 17 | 17 | 17 | 17 | 17 | |
| IMF zn CD4 − | Coeficiente correlación | 0,186 | 0,123 | 0,233 | 1,000 | 0,966** | 0,934** | 0,304 | 0,441 | 0,194 |
| Sig. (bilateral) | 0,508 | 0,639 | 0,368 | . | 0,000 | 0,000 | 0,236 | 0,076 | 0,456 | |
| N | 15 | 17 | 17 | 17 | 17 | 17 | 17 | 17 | 17 | |
| IMF zn CD4 + | Coeficiente correlación | 0,107 | 0,039 | 0,181 | 0,963** | 1,000 | 0,946** | 0,304 | 0,385 | 0,120 |
| Sig. (bilateral) | 0,704 | 0,881 | 0,486 | 0,000 | . | 0,000 | 0,236 | 0,127 | 0,646 | |
| N | 15 | 17 | 17 | 17 | 17 | 17 | 17 | 17 | 17 | |
| IMF zn monocitos | Coeficiente correlación | 0,114 | 0,081 | 0,189 | 0,951** | 0,971** | 1,000 | 0,375 | 0,338 | 0,108 |
| Sig. (bilateral) | 0,685 | 0,758 | 0,468 | 0,000 | 0,000 | . | 0,138 | 0,184 | 0,680 | |
| N | 15 | 17 | 17 | 17 | 17 | 17 | 17 | 17 | 17 | |
| R energía | Coeficiente correlación | 0,093 | −0,051 | 0,230 | −0,150 | −0,056 | −0,017 | 1,000 | 0,512* | −0,020 |
| Sig. (bilateral) | 0,742 | 0,844 | 0,374 | 0,567 | 0,830 | 0,948 | . | 0,036 | 0,940 | |
| N | 15 | 17 | 17 | 17 | 17 | 17 | 17 | 17 | 17 | |
| R proteína | Coeficiente correlación | −0,179 | −0,044 | −0,103 | −0,150 | −0,174 | −0,147 | 0,640** | 1,000 | 0,598* |
| Sig. (bilateral) | 0,524 | 0,866 | 0,694 | 0,567 | 0,504 | 0,573 | 0,006 | . | 0,011 | |
| N | 15 | 17 | 17 | 17 | 17 | 17 | 17 | 17 | 17 | |
| R zinc | Coeficiente correlación | −0,396 | −0,211 | −0,257 | −0,142 | −0,002 | −0,037 | 0,569* | 0,458 | 1,000 |
| Sig. (bilateral) | 0,143 | 0,417 | 0,319 | 0,586 | 0,993 | 0,889 | 0,017 | 0,064 | . | |
| N | 15 | 17 | 17 | 17 | 17 | 17 | 17 | 17 | 17 |
IMC: indice de Masa Corporal. IMF: Intensidad Media de Fluorescencia.
Los datos que se encuentran por encima de la diagonal corresponden a los niños expuestos, y los otros valores a los niños infectados.
*La correlación es significativa al nivel 0,05 (bilateral).
**La correlación es significativa al nivel 0,01 (bilateral).
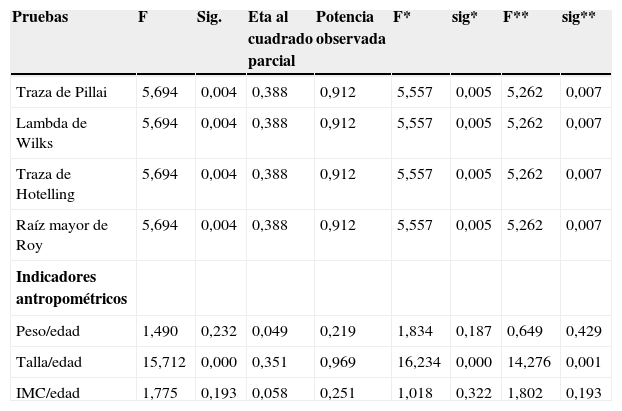
La tabla 4 muestra que el estado nutricional de los niños tuvo asociación con el diagnóstico de VIH (prueba de Pillai), resultado que no varió después de que la relación entre el estado nutricional y la presencia o no del virus fuera ajustada por las otras variables (IMF de zinc en monocitos, linfocitos CD4+ y CD4−, R de calorías, proteína y zinc); solo se encontró diferencia significativa en la T/E (p = 0,000); los niños infectados tuvieron más afectado este indicador.
Análisis multivariado del estado nutricional frente al diagnóstico de VIH y la intensidad media de fluorescencia (IMF) de monocitos, linfocitos CD4+, CD4−, R calorías, proteína y zinc
| Pruebas | F | Sig. | Eta al cuadrado parcial | Potencia observada | F* | sig* | F** | sig** |
|---|---|---|---|---|---|---|---|---|
| Traza de Pillai | 5,694 | 0,004 | 0,388 | 0,912 | 5,557 | 0,005 | 5,262 | 0,007 |
| Lambda de Wilks | 5,694 | 0,004 | 0,388 | 0,912 | 5,557 | 0,005 | 5,262 | 0,007 |
| Traza de Hotelling | 5,694 | 0,004 | 0,388 | 0,912 | 5,557 | 0,005 | 5,262 | 0,007 |
| Raíz mayor de Roy | 5,694 | 0,004 | 0,388 | 0,912 | 5,557 | 0,005 | 5,262 | 0,007 |
| Indicadores antropométricos | ||||||||
| Peso/edad | 1,490 | 0,232 | 0,049 | 0,219 | 1,834 | 0,187 | 0,649 | 0,429 |
| Talla/edad | 15,712 | 0,000 | 0,351 | 0,969 | 16,234 | 0,000 | 14,276 | 0,001 |
| IMC/edad | 1,775 | 0,193 | 0,058 | 0,251 | 1,018 | 0,322 | 1,802 | 0,193 |
*Ajustado por: IMF de zinc en monocitos, linfocitos CD4+ y CD4−.
**Ajustado por: IMF de zinc en monocitos, linfocitos CD4+ y CD4− y los R de calorías, proteína y zinc.
Las deficiencias nutricionales, el retardo en el crecimiento lineal y la pérdida de peso en los niños con VIH han sido bien documentados en diferentes poblaciones. Los hallazgos de esta investigación mostraron que el estado nutricional de los niños tuvo asociación con el diagnóstico de VIH, encontrándose diferencia significativa solo para T/E, en donde los niños infectados presentaron una talla más baja que los expuestos.
Datos comparables se han encontrado en estudios realizados en Estados Unidos, donde muestran que niños con VIH presentan detención temprana del crecimiento con disminución de T/E en ausencia de desgaste o bajo P/E21. Al igual que un estudio publicado por ONUSIDA-Colombia, mostró entre los parámetros evaluados, que el 67% de los niños infectados presentaron alteración en la T/E22. En un estudio realizado en Uganda, en 247 niños entre 1 y 5 años de edad, donde evaluaron el estado del zinc sérico y el estado nutricional, se encontró que al inicio del estudio un 53% de los niños presentaron retraso del crecimiento23. El estudio realizado por Fontana et al., en 86 niños infectados y 113 no infectados, evaluando la composición corporal y su relación con la progresión de la enfermedad, mostró que los niños infectados independientemente del estadio de la infección, presentaron significativamente menor peso y talla que el grupo control no infectado24.
Aunque algunos de estos estudios han mostrado que la principal condición que contribuye al deterioro del estado nutricional, al retraso en el crecimiento y al bajo peso en los niños infectados, es la presencia de la malnutrición proteico-energética asociada a una baja disponibilidad de fuentes de proteínas, ya sea por inadecuada ingesta de alimentos, alteraciones en el metabolismo y malabsorción de nutrientes, o por el aumento del requerimiento energético y de macro y micronutrientes25–28; en nuestra investigación se halló que la deficiencia en T/E en los niños infectados por el VIH no puede ser explicada por un bajo consumo de zinc, calorías y/o proteínas, puesto que no se encontró asociación entre estas variables y la T/E.
De acuerdo a la evidencia, una posible explicación de los hallazgos en el deterioro de la T/E en los niños infectados, residiría en la relativa resistencia a la hormona del crecimiento en estos niños, puesto que investigaciones en niños VIH+ con alteraciones en el crecimiento y retraso en el desarrollo, han mostrado bajos niveles del factor de crecimiento-1 (IGF-1) y de la proteína 3 de unión al factor de crecimiento parecido a la insulina (IGFBP)29; además, otras investigaciones han reportado que en los niños infectados se observa un grado moderado de hipotiroidismo bioquímico, caracterizado por concentraciones disminuidas de hormona del crecimiento y del factor de crecimiento-1 semejante a la insulina, cuyas funciones son estimular el crecimiento óseo longitudinal, la proliferación de linfocitos y la regeneración muscular y nerviosa, la cual se encuentra alterada en los pacientes con VIH.
A diferencia de los estudios realizados en niños y adultos para identificar el estado de zinc sérico asociado con el estado nutricional, y a los resultados obtenidos, en esta investigación donde se evaluó el zinc en PBMC, no se halló diferencia significativa en los niveles de este nutriente, entre los grupos, y tampoco asociación entre los niveles de zinc intracelular, zinc alimentario y estado nutricional.
Este hallazgo puede deberse al tamaño de la muestra, y a que los niños evaluados no presentaron trastornos gastrointestinales como enteropatías, diarrea crónica o enterocolitis, causantes de la malabsorción del zinc, siendo el sistema digestivo fundamental en el control homeostático del metabolismo de este oligoelemento30–32.
Finalmente, al buscar posibles asociaciones entre las variables que fueron estudiadas, en los niños expuestos se encontró una asociación inversa entre los niveles de zinc en PMBC y el P/E e IMC/E. Este hallazgo podría indicar que existen mecanismos intracelulares y moleculares que se desconocen, que contribuyen a la regulación y el mantenimiento de las funciones bioquímicas relacionadas con la homeostasis de zinc; por lo tanto, es necesario plantear nuevas investigaciones que analicen el estado nutricional frente a las concentraciones intracelulares de zinc, explorando los mecanismos moleculares que tienen las células inmunes para hacer una homeostasis de este oligoelemento, en caso de deficiencias, situaciones de estrés o infecciones, como en el caso del VIH33.
Aunque en nuestro estudio no se evalúo la expresión génica de zinc en monocitos y mecanismos de apoptosis en pacientes con VIH, un hallazgo interesante fue encontrar en este estudio niveles de zinc en monocitos mayores en niños infectados comparados con los expuestos; resultado importante de continuar explorando como mecanismos de protección de apoptosis en monocitos de individuos con VIH, lo cual fue mostrado en un estudio realizado por Raymond et al.33. Se deben plantear más investigaciones de ensayos clínicos controlados para buscar relación entre niveles de zinc intracelular, estado nutricional y respuesta inmune en individuos sanos, debido al fenómeno que existe en la interacción entre nutrición e inmunidad; los nutrientes, específicamente los micronutrientes, ejercen un papel importante en el desarrollo, la preservación, la integridad y la función del sistema inmunitario. Los primeros trabajos realizados en niños con malnutrición proteico-calórica revelaron que la infección y la malnutrición se encontraban estrechamente relacionadas, demostrando que la disminución en la funcionalidad del sistema inmunitario en niños con malnutrición aumentaba el riesgo y la severidad de las infecciones6.
De esta investigación se puede concluir que el deterioro del estado nutricional y el retardo en el crecimiento en niños estuvo asociado al VIH, pero no a los niveles de zinc intracelular.
NotaEsta investigación fue presentada en las “II jornadas de actualización en pediatría – 53 congreso Chileno de pediatría”, realizado desde el 7 hasta el 9 de noviembre de 2013, en la ciudad de Santiago de Chile, donde obtuvo el segundo lugar en categoría general del premio “Dr. Alfredo Commentz L. 2013”.
FinanciamientoEscuela de Nutrición y Dietética de la Universidad de Antioquia, y por las investigadoras principales.
Conflicto de interésEste trabajo cumple con los requisitos sobre consentimiento/asentimiento informado, comité de ética, financiamiento, estudios animales y sobre la ausencia de conflictos de intereses según corresponda.
A los directivos, padres de familia y niños de las fundaciones que trabajan por el VIH/sida en la ciudad de Medellín-Colombia; a los laboratorios de la Sede de Investigación Universitaria (SIU) de la Universidad de Antioquia; al laboratorio Clínico Congregación Mariana. A la E.S.E. Hospital La María; y al profesor Alejandro Estrada, estadístico de la escuela de Nutrición y Dietética de la Universidad de Antioquia.