La cirugía artroscópica de hombro en posición de silla de playa es una cirugía frecuente y se asocia a buenos resultados. Causa preocupación el reporte de casos de isquemia cerebral asociados a morbimortalidad. Este artículo hace una revisión de la literatura referente a estos casos, realizando un análisis de los factores involucrados y de los cambios que ocurren al sentar a un paciente bajo el efecto de la anestesia general y/o regional. Es muy importante que el equipo quirúrgico comprenda las limitaciones de la técnica y concilie una buena exposición quirúrgica junto con el menor impacto hemodinámico. Actualmente se sugiere sentar a los pacientes con ángulos no mayores a 45°, evitar errores en la lectura de la presión arterial, que traduzcan un adecuado flujo sanguíneo cerebral. Cuando se mide oxigenación cerebral mediante NIRS (ScO2) las mayores caídas de los valores se asocian a anestesia general en ventilación mecánica con hiperventilación y en ángulos de posición de 80-90°. La anestesia regional se asocia a menores caídas de ScO2, pero requiere de un equipo con experiencia.
Shoulder arthroscopic surgery performed in the beach chair position is common and is associated with good results. The report of cases of cerebral ischaemia associated with morbidity and mortality is a cause for concern. This article presents a review of the literature concerning these cases, as well as an analysis of the factors involved and the changes that occur in patients when the beach chair position is used under general or regional anaesthesia. It is very important that the surgical team understands the limitations of the technique, and combines a good surgical exposure along with the least haemodynamic impact. Beach chair positions with angles not greater than 45°, are now suggested in order avoid errors in the blood pressure reading, which may lead to an adequate cerebral blood flow. When measuring cerebral oxygenation using NIRS (ScO2), the biggest drops in the values are associated with general anaesthesia and mechanical ventilation with hyperventilation and position angles of 80-90 degrees. Regional anaesthesia is associated with lower falls of ScO2, but requires an experienced team.
En la actualidad la cirugía artroscópica de hombro (CAH) es un procedimiento quirúrgico frecuente, que permite resolver en forma mínimamente invasiva la mayoría de las lesiones del hombro. Se asocia a bajo riesgo de complicaciones, y por lo mismo, muchas veces se realiza en el ámbito de la cirugía ambulatoria. Dependiendo de la dolencia, las preferencias y formación del cirujano, se realiza con los pacientes en decúbito lateral o en posición en «silla de playa» (PSP), siendo esta última la posición más frecuentemente utilizada por los cirujanos. La PSP varía de 30 a 90° entre el respaldo de la mesa quirúrgica y el plano horizontal, lo que depende del requerimiento de cada cirujano para facilitar el acto quirúrgico.
Durante la última década se reportaron 6 pacientes operados de hombro, que evolucionaron con resultados catastróficos secundarios a isquemia neurológica, todos en PSP y bajo anestesia general (AG)1–3. Actualmente suman 23 los casos conocidos, entre reportes de casos provenientes de la literatura médica e información de compañías de seguro4,5.
Es probable que la aparición de complicaciones neurológicas isquémicas en esta población quirúrgica sea multifactorial, no obstante, tenemos que saber que sentar a un paciente anestesiado no es del todo inocuo. El impacto de la PSP sobre la presión arterial (PA) y la presión de perfusión cerebral (PPC) no está del todo definida, pero la literatura de la cual disponemos reporta significativas caídas de la saturación regional cerebral de oxígeno (ScO2) al adoptar esta posición bajo AG6.
La CAH recluta un grupo bastante heterogéneo de pacientes, que comprende desde pacientes jóvenes deportistas a pacientes mayores portadores de diversos grados de limitación de sus reservas fisiológicas. Con este último grupo debemos tener especial consideración, posicionando a nuestros pacientes con un menor ángulo al sentarlos, siendo rigurosos en la monitorización hemodinámica y menos tolerantes frente a la hipotensión (a veces solicitada por el cirujano para obtener una mejor visión). Lo anterior también es válido en pacientes sanos, ya que entre los casos reportados existen pacientes sin factores de riesgo.
Hemos querido revisar este tema ya que, aunque sea una complicación poco frecuente, no solo se traduce en un resultado devastador para pacientes y familiares, sino que posee un alto costo para los médicos involucrados por sus implicancias médico-legales, sociales y profesionales.
Isquemia cerebral perioperatoria, generalidades y factores de riesgoLa isquemia cerebral perioperatoria o «stroke»’ se define como un déficit neurológico global o focal de origen cerebrovascular, que persiste más de 24h (o que se interrumpe por muerte del paciente dentro de las 24h), en el contexto de un paciente quirúrgico. El stroke es una complicación grave que se asocia a morbimortalidad y que se ve más frecuentemente asociado a cirugía cardíaca, vascular y neuroquirúrgica, con una incidencia del 2,2-5,2%. En el resto de la población quirúrgica la incidencia fluctúa entre un 0,05-2,5%2,7. La mayoría de los strokes perioperatorios son de origen isquémico, exceptuando la cirugía cardíaca en que son principalmente de origen embólico. En el ámbito de la cirugía ortopédica, la artroplastia de cadera se asociaba a un mayor riesgo, sobre todo en pacientes con enfermedades predisponentes, pero actualmente también figura la cirugía de hombro en PSP7.
La mortalidad asociada al stroke perioperatorio (26-60%), es más del doble que la de los strokes ocurridos en un contexto no quirúrgico (13-46%). Lo anterior estaría dado por el estado de inflamación que desencadena el estímulo quirúrgico, lo que empeora los fenómenos isquémicos. Pacientes con antecedente de stroke previo poseen una mortalidad más elevada aun, estimándose en un 87%7. Probablemente los pacientes que poseen daño endotelial previo (aunque sea una condición subclínica) poseen mayor riesgo de isquemia ya que el endotelio posee un rol fundamental en el control del tono vascular cerebral y fenómenos inflamatorios al liberar óxido nítrico, prostaciclinas y otras sustancias mediadoras. Dado lo anterior, el endotelio «disfuncionante» será más proclive a la rotura de placa, al vasoespasmo y a la trombosis, lo que se suma a toda la respuesta neuroendocrina e inflamatoria del contexto quirúrgico2,7.
Dentro de los factores de riesgo identificados están: pacientes añosos, stroke previo, fibrilación auricular, enfermedad cardiovascular y/o metabólica. La hipotensión intraoperatoria no se ha identificado como factor de riesgo o factor etiológico frecuente, responsable de isquemia cerebral. Lo anterior se entiende porque en el período intraoperatorio los pacientes son continuamente monitorizados y los períodos de hipotensión son fenómenos aislados que rápidamente se pesquisan y se revierten. La hipotensión mantenida probablemente sí posee otro impacto7. La hipotensión intraoperatoria sí es un factor de riesgo para pacientes que cursan con «zonas de penumbra» en casos de enfermedad cerebrovascular en período agudo, estenosis carotídea crítica y teóricamente en pacientes que presentan anomalías anatómicas como incompetencia del polígono de Willis o ausencia de una carótida. Existe evidencia que demuestra que hasta un 45% de la población presenta anomalías del polígono de Willis o un polígono incompleto, como también un 8% puede presentar ausencia de una carótida3.
Isquemia cerebral asociada a posición en «silla de playa»La PSP para CAH se practica desde la década de los ochenta8 y en EE. UU. 2 tercios de los cirujanos prefieren esta posición5. En el año 2003 se reportan 2 casos de daño neurológico asociado a esta posición, un caso de pérdida de visión y oftalmoplejía y otro caso que evolucionó con afasia y hemiparesia1. Dos años después Pohl y Cullen2 reportaron una serie de 4 casos con resultado neurológicos graves, 3 con isquemia cerebral y uno con isquemia medular. Todos eran pacientes en edad media de la vida (47-53 años), 2 sin antecedentes mórbidos y 2 con antecedentes de cardiopatía, pero totalmente asintomáticos al momento de la cirugía, todos bajo AG y ventilación mecánica, y con un período intraoperatorio sin incidentes. El año 2012 se publica otro caso de isquemia cerebral focal en que se demostró la presencia de una anormalidad anatómica que pudo favorecer el stroke3.
Friedman et al.5 publicaron el resultado de una encuesta que realizaron a 267 cirujanos pertenecientes a la Sociedad Americana de Cirujanos de Hombro y Codo. Se reportaron 8 casos de daño neurológico, todos en PSP, estimándose una incidencia del 0.00461%. Durante el año 2011 la Sociedad Americana de Anestesiología, en el análisis que realiza periódicamente de casos médico-legales cerrados, publica que el 24% de las lesiones neurológicas cervicales ocurren en cirugías con pacientes sentados9.
Actualmente se conocen 23 casos de stroke asociado a PSP en CAH. Los datos han sido obtenidos de publicaciones médicas o aportados por compañías de seguro, pero desconocemos la verdadera incidencia por el subreporte existente4. Por otro lado, puede existir déficit neurológico sin llegar al stroke; existe evidencia que demuestra la asociación entre transtornos neurocognitivos y períodos de desaturación cerebral (DcO2) intraoperatoria en PSP10.
Cambios hemodinámicos en posición en «silla de playa» bajo anestesia generalEn individuos sin anestesia, los cambios hemodinámicos que ocurren frente a cambios de posición son discretos, ya que existe compensación mediada por el sistema nervioso simpático. Si bien se produce una reducción del gasto cardíaco y de la PA de un 20% y una caída de la PPC de un 15%, estas variaciones se compensan rápidamente con el aumento de la resistencia vascular sistémica y el incremento de la frecuencia cardíaca2,11.
En pacientes bajo AG no ocurre lo mismo; por un lado las respuestas reflejas del sistema nervioso simpático que regulan la PA están inhibidas, y por otro, existe una disminución del retorno venoso secundario a la vasodilatación que generan los fármacos anestésicos. Lo anterior genera redistribución de flujo venoso principalmente en las extremidades inferiores, caída de la precarga, del gasto cardíaco, de la PA media (PAM) y de la PPC2,11,12. A lo anterior hay que sumar otro factor que acentúa la disminución del retorno venoso y está dado por el aumento de la presión intratorácica que genera la ventilación mecánica. Otro factor que también han sido involucrado y puede contribuir a la disminución del retorno venoso proveniente del cerebro es la obstrucción mecánica de la venas yugulares secundario a flexión lateral de la cabeza o compresión externa por collar de fijación. Lo anterior teóricamente también puede generar aumento de la presión intracraneal y vasoconstricción arterial secundaria. La hiperflexión anteroposterior también se ha asociado a cuadriplejía en otro tipo de cirugías y en trabajos en animales de experimentación2.
Es difícil establecer un límite inferior de PAM para mantener asegurada la autorregulación cerebral, ya que existe mucha variabilidad interindividual, pero se sugiere no tolerar caídas de presiones sistólicas más allá de los 90mmHg o mayores a un 20% de la PA basal. Clásicamente se ha planteado que la autorregulación de flujo cerebral (mecanismo que mantiene el flujo cerebral estable) se mantiene con PAM de 50-150mmHg en pacientes sanos. Actualmente se plantea que la PAM mínima necesaria para mantener la autorregulación cerebral es de 70mmHg en sujetos normotensos, PAM menores se relacionan con una caída lineal de la PPC13,14. Existen condiciones desconocidas que pueden generar mayor riesgo de isquemia, como puede ocurrir en pacientes con cuadros subclínicos de estenosis arterial o población con malformaciones vasculares. Existe evidencia de que hasta un 45% de la población puede presentar estas variaciones anatómicas3,15.
Por todo lo anteriormente descrito podemos darnos cuenta que la CAH en PSP posee efectos importantes sobre el gasto cardíaco y la PPC. Posicionar a estos pacientes requiere de un trabajo coordinado en equipo, que no solo se preocupa de una buena exposición quirúrgica, sino también de tener el menor impacto hemodinámico posible.
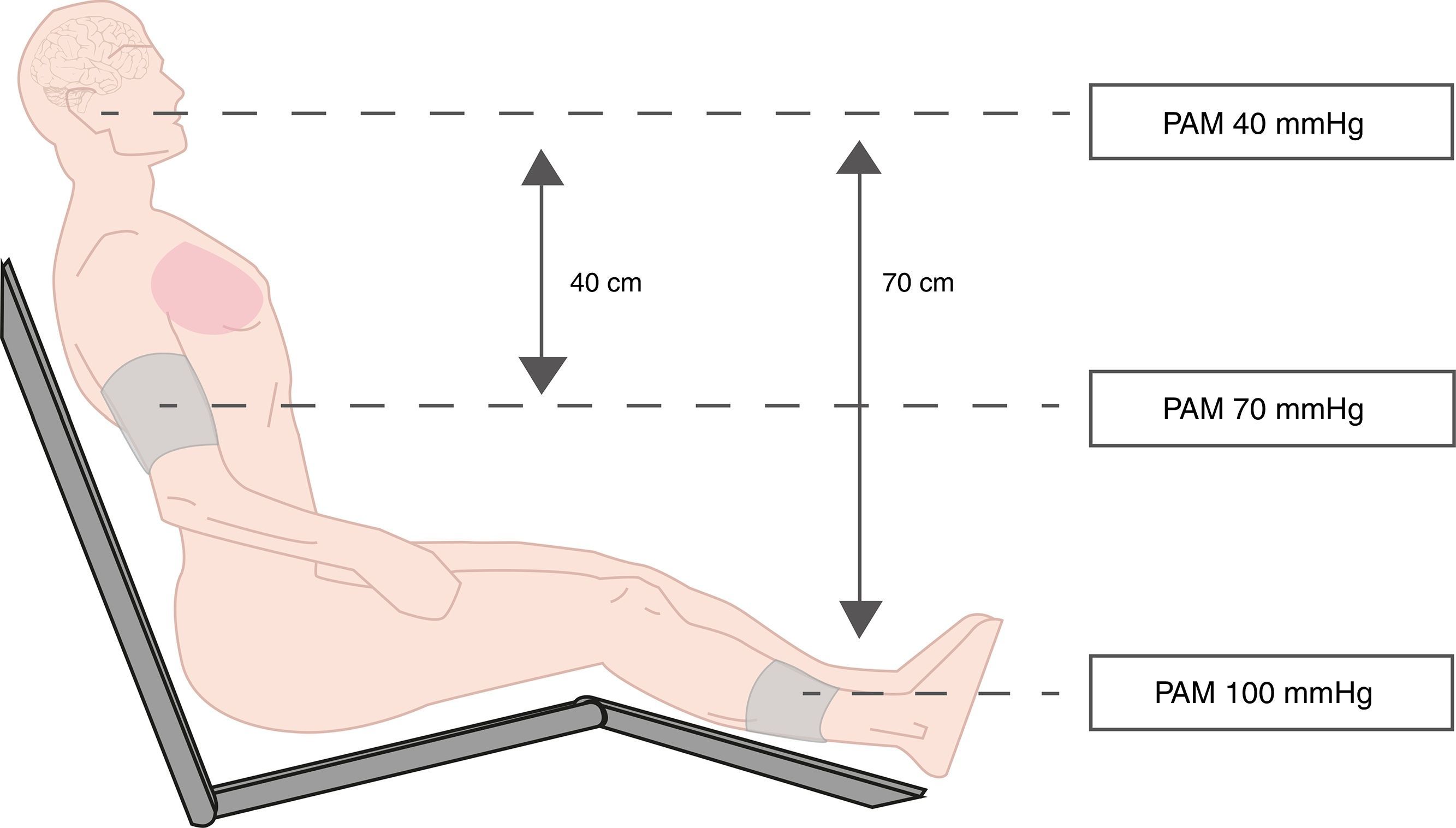
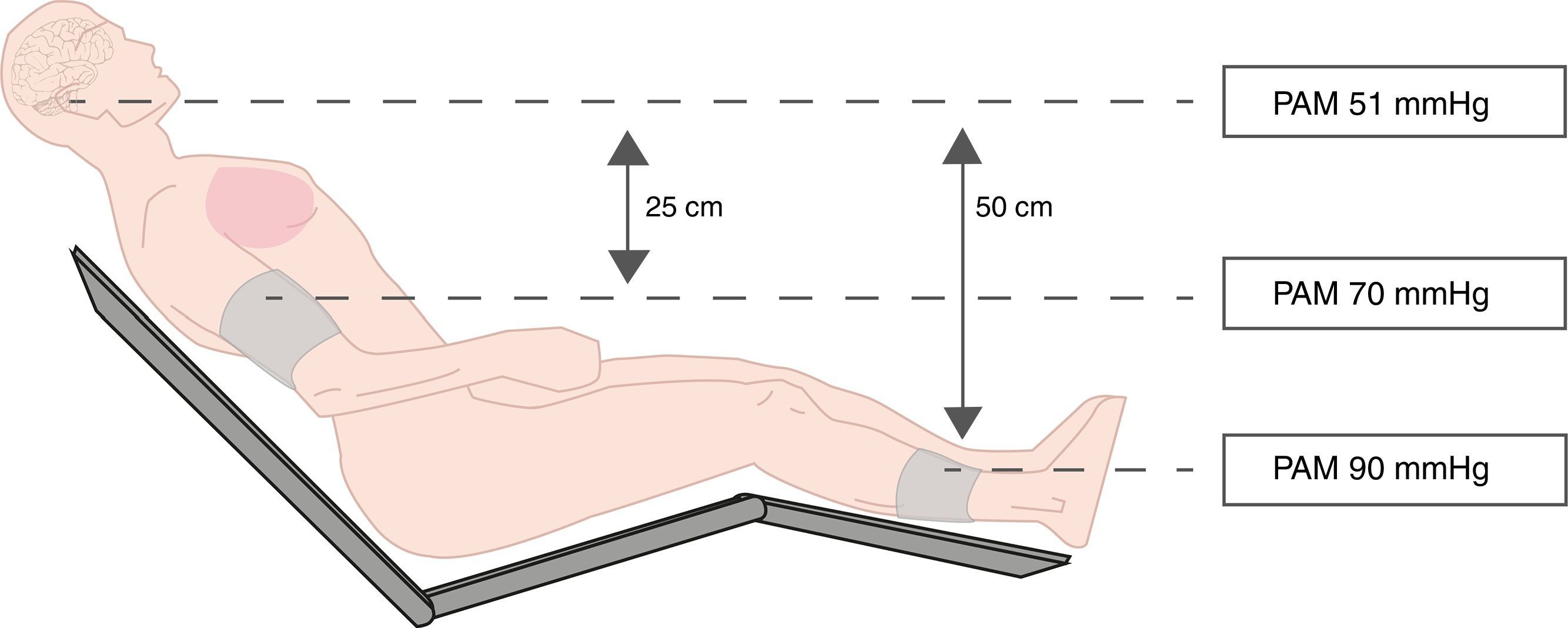
Medición de presión arterialLa pregunta que habría que plantearse es ¿por qué si la PA es un parámetro que se monitoriza permanentemente durante el período intraoperatorio, se reportan casos de isquemia cerebral? Probablemente la respuesta es que uno de los factores determinantes ha sido la hipotensión mantenida sin diagnóstico, por error en la lectura la PAM. Habitualmente la tendencia para no obstruir el flujo de la vía venosa y la lectura de la oximetría de pulso es poner el manguito de PA en la pantorrilla. Al sentar a un paciente anestesiado y tomar la PA en el brazo o en la pierna, se produce un gradiente hidrostático que origina una diferencia entre la presión existente en el cerebro y la obtenida más distalmente. A mayor distancia (en la línea vertical) entre el cerebro y el sitio donde está ubicado el manguito de presión, mayor será el gradiente y mayor la diferencia de presión obtenida (figs. 1 y 2). En decúbito lateral esta diferencia no es importante y entre el tobillo y el brazo la diferencia probablemente no superará los 5-10mmHg16.
Actualmente se aconseja hacer una corrección en la medición de la PA, considerando la distancia entre el cerebro y el sitio de medición. La presión debe ser medida a la altura del corazón o cerebro ya que el gradiente genera un diferencia de 0,77mmHg por cada 1cm de diferencia (o 1mmHg por cada 1,25cm)17–19. Por lo tanto, si en PSP existe una distancia de 30-40cm entre el conducto auditivo externo (CAE) y el punto medio del manguito de presión en el brazo, la diferencia de presión puede alcanzar 20-30mmHg, y si entre el CAE y la pantorrilla hay 60-70cm, la diferencia puede llegar a ser de 45-55mmHg. En otras palabras, para mantener una PAM cerebral de 60-70mmHg es necesaria una PAM braquial de 80-90mmHg. Sin embargo, no hay consenso entre los diferentes autores ya que existen 2 teorías al respecto: la teoría del circuito cerrado o «sifón» y la del circuito abierto o «cascada de agua». El circuito cerrado o «sifón» plantea la existencia de una columna constante de flujo tanto a nivel arterial como venoso y el efecto de la gravedad se compensa con el impacto sobre los 2 sistemas, lo que mantendría el flujo y la PAM sin variación, por lo que la corrección de la PA sería irrelevante. En cambio la teoría del «circuito abierto» o cascada de agua, que es la más aceptada, plantea que sí existe una diferencia según el gradiente hidrostático generado y la corrección de presión debe realizarse si la PA se mide en un lugar distante del cerebro15.
A mayor ángulo de posición, tendremos mayor impacto hemodinámico y mayor gradiente hidrostático entre el cerebro y el sitio de medición de PA (figs. 1 y 2). Si el gradiente aumenta y no se hace corrección en la lectura de la PA se estará sobrevalorando la PPC y el riego de isquemia aumenta.
Medición de la perfusión cerebralDurante la última década y posterior al reporte de los casos de isquemia cerebral en pacientes en PSP, se han publicado numerosos trabajos que han centrado el estudio en medir la disponibilidad de oxígeno al cerebro en relación con los cambios de posición20. La variable más frecuentemente evaluada es la ScO2, medida mediante métodos no invasivos como el uso del «near infra red spectroscopy» (NIRS) y/o también medición directa de saturación de oxígeno en el bulbo yugular.
El NIRS mide oxigenación cerebral regional a través de medición transcutánea. Los sensores son puestos en zonas vulnerables frente a los cambios de demanda y aporte de O2, como la corteza frontal, y se define como cambio significativo un caída mayor o igual al 20% del valor basal o menor al 55% como valor absoluto. Estos sensores determinan la saturación cerebral gracias a la cantidad de luz que absorbe la hemoglobina en el cerebro y nos dan información acerca de la perfusión cerebral en esa área puntual, ya que el flujo cerebral no necesariamente se mantiene homogéneo en todo el cerebro. El aparato analiza y mide la relación entre los 2 tipos de hemoglobina, realiza la sustracción entre la señal superficial y profunda para obtener como resultado la saturación regional de oxígeno de hemoglobina en la corteza frontal. En el cerebro la relación entre sangre venosa y arterial es de 85:15, la ScO2 mide más bien la saturación cerebral venosa, reflejando también el balance entre aporte y demanda cerebral. Los valores obtenidos de ScO2 dependen de las variables que influyen en el equilibrio entre la oferta y la demanda de oxígeno cerebral21,22. Existe discusión si NIRS realmente es capaz de predecir eventos isquémicos, ya que el valor calculado por el monitor asume una relación fija entre saturación arterial y venosa cerebral, valor que puede variar en PSP23. Se han reportado discordancias entre la medición de saturación de O2 cerebral medida en de bulbo yugular comparada con NIRS. Jeong et al. describieron que NIRS fue concordante solo en un 30% de los casos en que las mediciones de saturaciones venosas de bulbo fueron menores al 50%24.
Los distintos trabajos realizados para medir cambios en PSP han demostrado resultados dispares, pero esto puede estar dado por la variabilidad de factores presentes: momento de mediciones, número de mediciones, magnitud del ángulo de la posición, tipo de anestesia, variabilidad de PAM, lugar de medición de PAM, número pequeño de pacientes, etc. No obstante, por el momento la información disponible demuestra que hasta un 80% de la población en PSP bajo AG y ventilación mecánica puede evolucionar con caídas de saturación venosa cerebral mayor al 20%20–25.
Murphy et al.26 compararon 2 grupos de pacientes sometidos a CAH, 134 pacientes. Un grupo en decúbito lateral y otro en PSP (todos en ángulo de 80-90°; se eliminaron los pacientes en ángulos menores). Todos los pacientes recibieron AG y se les midió ScO2 con NIRS. El grupo PSP presentó un 80,3% de eventos de DcO2 comparado con un 0% en el grupo decúbito lateral. La duración de los períodos de DcO2 varió de 3seg a 9min. Ningún paciente evolucionó con signos de isquemia. Posteriormente estos mismos autores27 encontraron un 56% de DcO2 en pacientes en PSP y de estos el 68% coincidió con períodos de hipotensión. El 76% de los pacientes requirió fenilefrina para subir la PAM.
Tange et al.28 no encontraron diferencias en 30 pacientes en los que se midió ScO2 y en quienes la PAM se mantuvo sobre 60mmHg. Se midió ScO2 en decúbito supino, en el paciente sentado en ángulo de 30° y posteriormente en 60°. Probablemente estos resultados se pueden explicar porque no hubo ángulos mayores a 60° y porque la medición de ScO2 no fue continua, durando 5min en relación con cada cambio.
Moerman et al.29 encontraron una caída significativa de la ScO2, en el 80% de un grupo de 20 pacientes en PSP de ángulo de 60-70°. El 30% presentó además una caída menor del 50% de saturación. Hubo correlación con caída del CO2 telespirado.
Lee et al.30 midieron episodios de DcO2 en 27 pacientes bajo AG más hipotensión controlada, manteniendo PAM de 60-65mmHg medida a nivel del CAE. Encontraron que un 7,4% (2 pacientes) presentaron DcO2 en PSP, los 2 pacientes evolucionaron con PAM menores de 60mmHg al momento de la DcO2, lo que se revirtió al subir la PAM. El valor promedio de ScO2 en los pacientes anestesiados antes de sentarlos fue del 74% y en PSP fue del 67%. Al inducir hipotensión en PSP los valores de ScO2 se mantuvieron en un 66% y no hubo alteración en las pruebas neurocognitivas. La PAM sí presentó una caída importante al sentar a los pacientes y al inducir hipotensión. La baja incidencia de DcO2 se puede explicar por la definición de DcO2 que los autores plantearon (caída mayor al 80% sobre valor basal) y además porque la PA fue rigurosamente medida a nivel del CAE.
Pants et al. publicaron un metaanálisis que evaluó la utilidad del NIRS en CAH en PSP. Incluyeron 9 artículos, con un total de 340 pacientes. Encontraron una incidencia del 29% de DcO2 y establecieron una relación entre el número de eventos y el ángulo de PSP. A mayor ángulo mayor incidencia de eventos6.
Actualmente se considera que la monitorización con NIRS es una herramienta útil para pesquisar caídas de saturación de oxígeno cerebral y mayor riesgo de isquemia, sin embargo, hay que tener presente que este monitor posee limitaciones y no considera todas las variables que pudiesen favorecer una isquemia cerebral.
Impacto de la técnica anestésica sobre los resultadosTambién durante los últimos años, se han publicado trabajos que evalúan el impacto de las distintas técnicas anestésicas sobre los resultados, pero es difícil obtener datos «duros» en relación con una complicación tan poco frecuente y de etiología multifactorial.
En relación con la anestesia regional (AR) se ha tratado de demostrar su rol «protector» cuando se usa como técnica anestésica acompañado de sedación en ventilación espontánea. Lo anterior se ve reflejado en trabajos que demuestran un menor impacto hemodinámico sistémico y regional cerebral. Teóricamente habría una preservación de la autorregulación cerebral y una menor caída del retorno venoso al no estar presente el efecto de la ventilación mecánica y de altas concentraciones de fármacos vasodilatadores. Sin embargo, si el bloqueo de plexo interescalénico no logra dar una excelente calidad de anestesia o el paciente requiere de una sedación profunda, también pueden existir cambios hemodinámicos. La sedación además puede comprometer la ventilación, lo que puede sumarse a diversos grados de parálisis diafragmáticas secundarias al bloqueo interescalénico. Hay que tener presente que la literatura también reporta complicaciones propias del bloqueo de plexo interescalénico en el ámbito hemodinámico: hasta un 13-24% de la población puede evolucionar con hipotensión y bradicardia, llegando incluso a la asistolia. Lo anterior se debería a la activación del reflejo de Bezold Jarisch que también se describe en pacientes bajo anestesia raquídea31.
Aguirre et al.10 publicaron un trabajo en 90 pacientes, en que compararon la incidencia DcO2 mediante NIRS y su relación con cambios neurocognitivos en pacientes en PSP en 65°. Un grupo recibió AG y otro grupo bloqueo interescalénico más sedación con propofol y remifentanil (AR). En ambos grupos la PAM se mantuvo entre 100 y 80mmHg (medidas a nivel del corazón), lo que se logró mediante indicación de fármacos vasoactivos para subir o bajar dicho parámetro. La incidencia de DcO2 fue de un 71% para AG comparado con un 2,2% para AR. Estos autores incluso encuentran un incremento de la ScO2 que se describió al comparar el valor basal con el valor después de 5min de PSP en el grupo AR. El perfil hemodinámico fue favorable para el grupo AR al igual que los resultados neurocognitivos. Se demostró un claro deterioro de las pruebas neurocognitivas en el grupo con AG. Los pacientes que evolucionaron con DcO2 mostraron un mayor deterioro de los resultados en comparación con aquellos que no presentaron DcO2. Contrariamente a este grupo, otros autores no encontraron alteración de pruebas cognitivas en un grupo de 50 pacientes que recibieron AG con sevofluorano en PSP a pesar de un 18% de DcO232. Asimismo, Koh et al.33 compararon AG con AR más sedación con propofol en 60 pacientes en PSP, sin hipotensión controlada y con un protocolo de tratamiento implementado para tratar DcO2. Encontraron una incidencia del 57% de episodios de DcO2 en el grupo con AG, en comparación con el 0% en el grupo con AR.
Yadeau et al.34 evaluaron el impacto de la AR más sedación con propofol, sobre la ScO2 en 99 pacientes en PSP e hipotensión controlada. Encontraron una incidencia de hipotensión del 99%, pero solo un 10% presentó DcO2. Los autores explican que si bien hay impacto sobre la PAM, la autorregulación cerebral se mantendría y por eso la caída de ScO2 es menor que la reportada en pacientes bajo AG. Sin embargo, esta cohorte corresponde a un grupo de pacientes menores de 50 años y el protocolo de hipotensión controlada no se estandarizó y los vasoconstrictores se utilizaron según el criterio del anestesiólogo presente. En la línea de evaluar el efecto de la AR, Yadeau et al.35 analizaron 4.169 casos de CAH en PSP bajo régimen de cirugía ambulatoria del Hospital for Special Surgery de New York (3.000 casos retrospectivos y 1.169 prospectivos). El 96% de los pacientes se operaron con AR más sedación en ventilación espontánea, el 2,5% recibió AR más AG y el 1,5% solo con AG. El 61% recibió fármacos hipotensivos, siendo los más utilizados metoprolol y/o labetalol o hidralazina para obtener cifras de presión más bajas para que el cirujano tuviese mejor visualización. La PA se midió en forma no invasiva en el brazo contralateral, definiendo hipotensión como presión sistólica menor de 90mmHg, o PAM menor de 60mmHg o caída de más del 30% del valor basal. El 47% de los pacientes presentó hipotensión y no hubo reporte de casos de stroke. Posteriormente Rohrbaugh et al.36 no encontraron eventos neurológicos en 15.014 pacientes. Esta publicación reúne la experiencia de 11 años en CAH en PSP en pacientes bajo AR (bloqueo interescalénico), sedados con propofol y en ventilación espontánea. Los datos fueron obtenidos de la base de datos en que se registran todas las complicaciones asociadas a anestesia en los campus de la Universidad de Pittsburgh y desde la base de datos que registra las readmisiones no programadas.
En relación con la AG Jeong et al.24 compararon 2 técnicas diferentes de AG en pacientes en PSP. Un grupo recibió AG inhalatoria con sevofluorano y el otro grupo AG intravenosa con propofol. El primer grupo presentó una menor caída de la PAM después de sentar al paciente y un mejor perfil en las mediciones de saturación de oxígeno en bulbo yugular (en decúbito y en PSP) comparado con el segundo grupo. La caída de saturación venosa en bulbo yugular fue de un 16% en grupo con sevofluorano comparado con un 71% en el grupo con propofol. Ningún paciente presentó DcO2 menores al 40% (valor crítico asociado a isquemia cerebral) en el grupo con sevofluorano, comparado con un 29% del grupo con propofol. De los pacientes que presentaron caída de la saturación de oxígeno en bulbo yugular bajo el 50%, un 27% de los pacientes presentó hipotensión, un 27% tuvo caída de la ScO2 (NIRS) más hipotensión y un 7% solo caída de la SrO2. El 40% de los pacientes con saturación de oxígeno en bulbo yugular bajo el 50%, no presentó ni hipotensión ni caída de la ScO2.
También se han comparado grupos evaluando el efecto del aumento del CO2 telespirado y su relación con incidencia de DcO2. Murphy et al.27 compararon un grupo control con CO2 de 30-32mmHg frente a otro grupo con CO2 de 40-42mmHg. Describieron una incidencia de DcO2 del 56 y 9% respectivamente. Todos pacientes sentados en ángulo de 80 a 90°. Picton et al.37 compararon 2 estrategias de ventilación mecánica y midieron su impacto sobre la ScO2, encontrando que el aumento de la Fi02 de 0,3 a 1 en el paciente en PSP produjo un incremento de la ScO2 en un 5% y al subir la capnometrías de 30 a 45mmHg se produjo un incremento adicional de un 9% más. Este grupo no encontró diferencias entre la técnicas con desfluorano comparado propofol.
En suma, la AR más sedación en ventilación espontánea se asocia a menor incidencia de DcO2 en los trabajos publicados. De la misma forma, la estrategia de mantener CO2 telespirado sobre 40mmHg en pacientes bajo AG se asocia a menor caída de la ScO2. Probablemente la suma de hipotensión más hipocapnia contribuyeron en la aparición de casos de isquemia en PSP.
Conclusiones y sugerenciasLa isquemia cerebral en pacientes de CAH en PSP es una complicación grave, devastadora poco frecuente y de etiología multifactorial. Los pacientes bajo efecto de AG que adoptan PSP poseen caída del gasto cardíaco, de la PA y de la PPC. Si esta caída de presión se mantiene en el tiempo, estos pacientes poseen teóricamente mayor riesgo de hipoperfusión cerebral y daño isquémico. La decisión de sentar a un paciente debe considerar a todo el equipo quirúrgico conciliando una buena exposición quirúrgica con el menor impacto hemodinámico posible. La medición fidedigna de la PA es fundamental y se debe tener en mente que en PSP la PA medida distalmente no traduce en forma precisa la PPC. Especial cuidado se debe tener con pacientes con disminución conocida de la reserva cerebrovascular, pero no olvidando a los pacientes «sanos» que podrían tener también algún factor anatómico desconocido que predisponga a la isquemia. El rol protector de la AR no está del todo establecido, pero su menor impacto sobre la hemodinamia y sobre eventos de DcO2 podría asociarse a mejores resultados. El NIRS es una herramienta que nos sirve para pesquisar eventos de DcO2, pero su capacidad de predecir isquemia cerebral en PSP aún es discutida.
A la luz de la evidencia actual se puede establecer y sugerir:
- 1.
La PSP en pacientes bajo AG produce cambios hemodinámicos que afectan la PPC. La PAM debería mantenerse sobre 70mmHg y no deberían tolerarse caídas sobre el 20% del valor basal.
- 2.
La magnitud del ángulo de la PSP es un factor importante al favorecer mayores cambios hemodinámicos. Se sugieren ángulos menores a 45°.
- 3.
La medición de la PAM en PSP debe ser obtenida en la parte más cercana al cerebro. La PA NO debe medirse en las extremidades inferiores durante PSP.
- 4.
Frente a pacientes con factores de riesgo de hipoperfusión cerebral lo ideal es medir PA en forma invasiva y poner transductor a la altura del CAE.
- 5.
La cabeza debe ser posicionada con rigurosidad evitando compresiones externas e hiperflexiones en el sentido lateral y anteroposterior
- 6.
La AR es una buena alternativa anestésica ya que se asocia a menor porcentaje de DcO2, pero debe ser realizada en equipos con experiencia.
- 7.
El CO2 telespirado debería mantenerse sobre los 40mmHg en pacientes en ventilación mecánica ya que se asocia a menor incidencia de DcO2.
- 8.
La monitorización con NIRS es útil al detectar DcO2, pero su sensibilidad no es del 100%.
Los autores declaran no tener ningún conflicto de intereses.