Los tumores de células epitelioides perivasculares (PEComas) son neoplasias poco frecuentes de origen mesenquimal. Estos incluyen el angiomiolipoma epitelioide (EAML), una neoplasia con potencial maligno y cuya presentación simultánea con cáncer de tiroides es bastante rara.
Presentación del casoHombre de 40 años con masa de crecimiento rápido en relación con polo inferior derecho de tiroides e infiltración de tráquea. La TAC abdominopélvica contrastada muestra múltiples masas renales con masa dominante en polo superior izquierdo. El estudio histopatológico de tiroides evidenció una lesión en lóbulo derecho correspondiente a cáncer papilar de tiroides (PTC) de variante de células altas y una segunda neoplasia en el lóbulo contralateral correspondiente a PTC moderadamente diferenciado de variante clásica. En riñón se encontró una lesión correspondiente a EAML, con células de aspecto epitelioide equivalentes al 40%.
DiscusiónEl presente artículo corresponde al primero en la literatura en describir la presentación simultánea de EAML con PTC bilateral sincrónico (SBiPTC). Se describe una vía molecular común, que corresponde a la vía TSC/mTOR, la prevalencia de SBiPTC y los marcadores inmunohistoquímicos para diagnóstico de EAML.
Perivascular Epithelioid Cell Neoplasms (PEComas) are uncommon tumors of mesenchymal origin. These ones include the epithelioid angiomyolipoma (EAML), a tumor with malignant potential and whose simultaneous presentation with thyroid cancer is quite rare.
Presentation of caseForty years old man with fast-growing mass in relation to lower right thyroid pole and tracheal infiltration. Abdominopelvic contrast-enhanced CT shows multiple renal masses with dominant mass in the left upper pole. Thyroid histopathology showed a lesion in right lobe corresponding to tall cell variant of papillary thyroid cancer (PTC) and a second neoplasm in the contralateral lobe corresponding to classical variant of moderately differentiated PTC. In the kidney was found a tumor corresponding to EAML with epithelioid aspect cells equivalent to 40%.
DiscussionThis article corresponds to the first in the literature to describe the simultaneous presentation of EAML with synchronous bilateral PTC (SBiPTC) and its possible association. A common molecular pathway corresponding to the TSC/mTOR pathway is described, as well as SBiPTC prevalence and immunohistochemical markers for EAML diagnosis.
Los tumores de células epitelioides perivasculares (Perivascular Epithelioid Cell Neoplasms [PEComas]) son neoplasias poco frecuentes de origen mesenquimal y de predominio en mujeres1,2. Los PEComas más frecuentes comprenden el angiomiolipoma (AML), los tumores de células claras de pulmón (CCST) y la linfangioleiomiomatosis (LAM), entre otros1. La mayoría de los pacientes con AML solitario son asintomáticos, y si bien las características histopatológicas permiten en la mayoría de los casos establecer una adecuada aproximación diagnóstica, la realización de marcadores inmunohistoquímicos permite establecer un diagnóstico definitivo1,2. El AML puede ser de variante clásica o de variante epitelioide (EAML), constituyendo esta última un tumor del mesénquima renal, muy poco frecuente y de potencial maligno, aunque también puede encontrarse en otros órganos3. El tratamiento se basa en la resección quirúrgica del tumor1. El cáncer de tiroides es la neoplasia maligna de origen endocrino más frecuente; sin embargo, su asociación con PEComa es bastante rara. Existen 4 subtipos principales: el cáncer papilar de tiroides (PTC, 85%), la variante folicular (FTC, 5-10%), el cáncer medular (MTC, 5%) y el carcinoma anaplásico (ATC, 1%)4. La tiroidectomía quirúrgica convencional junto con la terapia de ablación con yodo radiactivo constituye el pilar del tratamiento para el cáncer derivado de células foliculares5. Se presenta un caso de EAML renal asociado con cáncer papilar de tiroides bilateral sincrónico (SBiPTC), y además se describe una vía molecular común para ambas neoplasias, explicando de forma objetiva una posible asociación entre estas dos lesiones.
Presentación del casoPaciente masculino de 40 años con clínica de 5meses de evolución caracterizada por masa en cuello de crecimiento rápido, asociada a disfonía, disfagia para sólidos y disnea de medianos esfuerzos. En la tomografía axial computarizada (TAC) de cuello contrastada se evidenció masa tumoral en relación con polo inferior derecho de tiroides de 48×50×60mm en sentido transversal, anteroposterior y longitudinal, respectivamente, con aparente compromiso de la tráquea. La aspiración con aguja fina de tiroides reportó BethesdaIII. La TAC abdominopélvica contrastada mostró múltiples masas renales bilaterales con masa dominante en polo superior izquierdo. No existía antecedente de esclerosis tuberosa ni había otras alteraciones que llevaran a considerar este diagnóstico. En los exámenes de laboratorio se encontró TSH: 1,5 (0,28-6,16) μUI/ml, T4L: 13,06 (9-20) pmol/l, PTH molécula intermedia: 52,6 (16-46) pg/ml, calcio iónico: 4,77 (4,49-5,25) mg/dl, ACE: 1,53 (0-3) ng/ml, cortisol: 10,56 (6-23) ng/ml, BUN: 10,95 (6-20) mg/dl, creatinina: 0,89 (0,67-1,17) mg/dl.
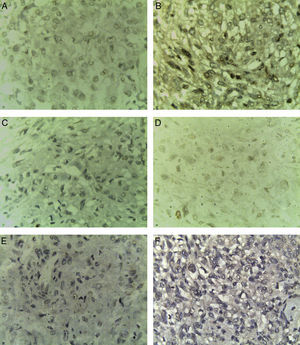
Se realizó tiroidectomía total +vaciamiento central +resección de tumor intratraqueal, encontrándose masa tumoral sólida en lóbulo derecho que infiltraba las paredes anterior y lateral de la tráquea con estenosis del 80% de la luz y compromiso del nervio laríngeo recurrente derecho. Requirió manejo postoperatorio en la unidad de cuidados intensivos (UCI). El estudio histopatológico confirmó una primera lesión en el lóbulo derecho de 5×3,5×3,3cm de diámetros mayores cruzados correspondiente a PTC de variante de células altas, multifocal, con extensión tumoral extracapsular, invasión vascular linfática y de tráquea, sin invasión perineural. En el lóbulo contralateral se observó una segunda neoplasia de color blancoamarillento bien delimitada de 2×1,7×1,4cm que desde el punto de vista histológico correspondía a PTC de variante clásica moderadamente diferenciado, con invasión vascular linfática, extensión extracapsular y sin invasión de perineuros, con presencia de 3/3 ganglios linfáticos de vaciamiento central y ganglio delfiano comprometidos por metástasis de este tumor, sin evidencia de células altas o citoplasma acidófilo.
Posteriormente es valorado en junta oncológica, en donde se decide manejo quirúrgico de masa renal izquierda. Se realizó nefrectomía y adrenalectomía izquierda, con hallazgos de masa en riñón de 8×10cm. El informe de patología confirmó una lesión tumoral que macroscópicamente midió 13,3×10,2×11,5cm, de color amarillo rojizo y aspecto carnoso; externamente era lisa y brillante, con áreas de necrosis y hemorragia central, de bordes irregulares en contraste con el parénquima renal adyacente y superficie de corte predominantemente homogénea y firme. Se localizaba fundamentalmente en el polo superior e involucraba la pelvis renal.
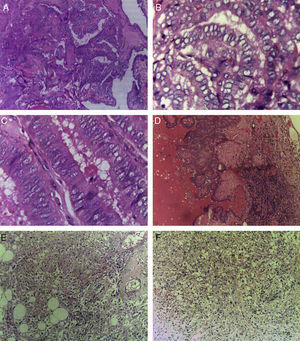
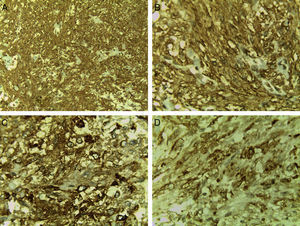
En cortes teñidos con hematoxilina-eosina se observó una neoplasia constituida en primer lugar por elementos celulares musculares grandes, poligonales, con abundante citoplasma acidófilo, núcleos vesiculosos, algunos multinucleados y con nucléolo prominente. Estas células presentaban un aspecto epitelioide en el 40% de la neoplasia y se disponían en un patrón arquitectural predominantemente sólido, con formación ocasional de sincitios y alrededor de numerosos vasos sanguíneos, dando un aspecto en empalizada. Los vasos presentaban marcado engrosamiento con hiperplasia de las células musculares que los conforman. Finalmente, había un tercer componente tumoral constituido por células adiposas maduras dispuestas en un patrón lobulado que se entremezclaban con los dos componentes celulares antes mencionados (fig. 1). Se observaron focos con extensas zonas de necrosis por coagulación tumoral. La neoplasia rompía la cápsula y se extendía al tejido adiposo perirrenal, sin compromiso de la glándula suprarrenal ipsilateral. Se realizaron estudios de inmunohistoquímica, encontrándose positividad fuerte y difusa para actina de músculo liso (SMA) y positividad focal para Melan-A y HMB-45 (fig. 2). El CD10, CD117, cóctel de citoqueratinas AE1/AE3, antígeno carcinoembrionario (ACE) y receptores de estrógenos fueron negativos en las células neoplásicas. El índice de proliferación celular, medido en el Ki-67, fue menor al 3% (fig. 3). Estos hallazgos soportaron el diagnóstico de EAML renal.
A)Carcinoma papilar de tiroides de variante clásica (H-E, ×10). B)Carcinoma papilar de tiroides, núcleos en vidrio esmerilado (H-E, ×40). C)Carcinoma papilar de tiroides de variante de células altas (H-E, ×40). D)Metástasis ganglionar de carcinoma papilar de tiroides de variante clásica (H-E, ×10). E, F)EAML; se observan elementos musculares, vasculares y adiposos (H-E, ×10).
La asociación entre PEComa y cáncer de tiroides no es clara y está poco descrita en la literatura, encontrándose solo algunos reportes de caso en donde se describe dicha asociación como fortuita6-8. Entre los casos informados se presenta un PEComa maligno originado de la serosa gástrica, con adenocarcinoma primario de pulmón pobremente diferenciado y PTC6; una LAM junto a un PTC con micrometástasis a pulmón7 y un caso de PTC de variante agresiva con metástasis a hueso y presencia de AML renal8. Aunque este último es similar al descrito en el presente artículo, el reporte de los autores se enfoca en las metástasis a hueso y el AML renal es solo un hallazgo incidental. El presente artículo corresponde al primero en la literatura en describir la presentación simultánea de EAML renal con SBiPTC y la posible asociación entre estas entidades patológicas.
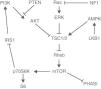
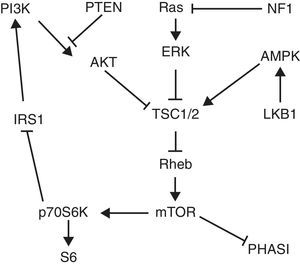
La asociación entre PEComa y complejo de esclerosis tuberosa (TSC) ha sido bien estudiada y se explica por mutaciones en los genes TSC1/2, transmitidas de forma autosómica dominante, aunque es mayor la prevalencia de PEComa de novo2. Generalmente la mutación se presenta en ambos alelos de un mismo gen2. La vía TSC/mTOR interviene en la tumorigénesis del PEComa y diversos estudios muestran un papel clave de los genes TSC1/2 en la regulación negativa de esta vía, como se muestra en la figura 4. Rheb es una GTPasa que al unirse a GTP interactúa con mTOR y lo activa, formando un complejo denominado mTORC1. A su vez, este complejo activa la quinasa p70S6K y el factor 4E-BP1 que conducen a la génesis de ribosomas y proteínas implicadas en el crecimiento celular2,9. La pérdida de PTEN se ha visto implicada en la tumorigénesis del PEComa, incluyendo el AML renal, debido a un aumento en la actividad de la vía PI3K/AKT que lleva a inhibición de TSC1/2. Además, las proteínas supresoras tumorales quinasa hepática B1 (LKB1) y neurofibromatosis1 (NF1) inhiben mTOR a través de su influencia sobre AMPK y la vía Ras/ERK9 (fig. 4).
Vía de señalización TSC/mTOR. La activación de PI3K/AKT conduce a la inhibición de la actividad TSC1/2, resultando en un aumento del nivel de Rheb-GTP y la activación aguas abajo de mTOR, que a su vez fosforila p70S6K y PHASI para promover la síntesis de proteínas. LKB1 fosforila AMPK para mejorar la inhibición TSC1/2 de mTOR. Actuando aguas abajo de Ras, ERK y RSK fosforilan TSC1/2 para reprimir su actividad GAP. En un bucle de retroalimentación negativa, p70S6K fosforila IRS1 para reducir la sensibilidad a la insulina y la actividad de AKT. Los genes supresores de tumores que inhiben la actividad de mTOR están en negrita. Imagen y texto tomados de Kenerson et al.9
Las alteraciones genéticas en la vía de señalización de la proteína quinasa activada por mitógenos (ERK o MAPK) y de la vía PI3K/AKT explican el desarrollo del PTC y FTC, respectivamente5. Estas vías, junto a la pérdida de LKB1 y TSC4, se encuentran comúnmente alteradas en el PTC y el PEComa. Además, la sobreactivación de mTORC1 y mTORC2 se presentan en el 81 y el 39% de los casos de PTC, respectivamente10.
La prevalencia de SBiPTC ha sido poco estudiada y está descrito que su presentación es rara. Sin embargo, Wang et al.11 encontraron que de 891 pacientes con PTC, el 19,9% tenían SBiPTC, siendo más prevalente en hombres; además, estos pacientes presentaron mayor tamaño tumoral, mayor invasión extratiroidea, mayor metástasis a ganglios linfáticos, menor periodo de supervivencia libre de enfermedad y se encontraron en estadios más avanzados de la enfermedad. Existe una controversia sobre el origen de estos tumores bilaterales; algunos autores, incluidos Wang et al.11, consideran que el tumor sincrónico contralateral es de origen monoclonal como resultado de una metástasis intratiroidea, pero otros autores consideran que tienen un origen independiente y corresponden a dos tumores primarios. Por las características histopatológicas de las neoplasias en el presente estudio, se considera que las masas tiroideas corresponden a dos tumores primarios de origen independiente. Solo en unos cuantos reportes de caso se ha descrito la presentación sincrónica bilateral de cáncer tiroideo de tipo histológico distinto, como es el caso de un paciente de 64años con PTC, FTC y ATC de forma sincrónica12.
Los principales marcadores inmunohistoquímicos para el diagnóstico de EAML son HMB45(+), vimentina(+), SMA(+), CD34(+) y CD68(+); del mismo modo, la presencia de CD10(−), antígeno epitelial de membrana (EMA)(−), S-100(−), CK(−) y un Ki-67 del 1-3% apoyan el diagnóstico3. En el presente caso se encontró positividad difusa y fuerte para SMA en el componente tumoral y positividad focal para Melan-A y HMB-45; además, el CD10 y el cóctel de citoqueratinas AE1/AE3 fueron negativos en el componente tumoral, siendo positivos en el parénquima renal normal. El Ki-67 fue menor al 3%. Pecorino B et al.13 reportaron un caso de PEComa uterino en donde el estudio inmunohistoquímico mostró HMB45(−); en este caso el tumor fue inoperable, la progresión de la enfermedad fue rápida y la paciente falleció después de 6meses. Por otro lado, los marcadores Mcl-1 y Ki-67 se expresan con alta frecuencia en el PTC14.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaramos que no tenemos ningún conflicto de intereses.