La mortalidad de la cirugía resectiva hepática es de 1-2%. Mejorar esto requerirá optimizar detalles que involucran a todos los encargados del cuidado de estos pacientes. El primero de estos puntos es la evaluación de la función hepática postoperatoria. Diversos métodos han sido utilizados para tratar de estimarla, sin resultados concluyentes respecto a cuál es el más adecuado. Estudios que evalúan la cantidad de parénquima residual y su relación con el desarrollo de falla hepática postoperatoria recomiendan que en presencia de un hígado sano debería quedar 20-25% del volumen hepático, 30-60% en casos de condiciones que deterioran la funcionalidad, y 40-70% en casos de cirrosis. El aporte de volumen y su relación con la morbilidad, el sangrado y el desarrollo de insuficiencia renal han sido muy estudiados. La restricción del volumen y el mantenimiento de presiones venosas bajas aparecen como estrategias recomendadas, pero no deben comprometer la perfusión sistémica. A diferencia de lo observado en pacientes críticos, especialmente sépticos, el uso de almidones aparece como una alternativa segura en pacientes sanos sometidos a procedimientos resectivos o trasplante hepático. Las alteraciones de exámenes de coagulación deben ser evaluadas y corregidas cuando corresponda, idealmente a través de métodos que permitan identificar la causa. El tromboelastograma aparece como una alternativa adecuada. La administración profiláctica de hemocomponentes no está indicada, pudiendo ser origen de morbilidad. La analgesia debe ser optimizada, siendo la peridural una buena alternativa en presencia de hígado sano y en procedimientos no mayores de una lobectomía.
The mortality of liver resection surgery is 1-2%. Improve this will require optimizing details involving all caregivers of these patients. The first of these points is the evaluation of postoperative liver function. Various methods have been used to estimate it, without conclusive results regarding what is the most appropriate. Several studies evaluating the amount of residual parenchyma and its relationship to the development of postoperative liver failure recommend that in the presence of a healthy liver should be 20-25% of liver volume, 30-60% in cases of conditions that impair the functionality and 40-70% in cases of cirrhosis. The contribution of fluids administration and its relationship with morbidity, bleeding and development of renal failure have been studied. The volume restriction, maintenance of low central venous pressures appear as recommended strategies but must not compromise systemic perfusion that can determine organ dysfunction. Unlike what was observed in critically ill patients, the use of starches appears as a safe alternative in healthy patients and those undergoing liver transplantation. Alterations in coagulation tests should be evaluated, ideally through methods that allow to identify the cause. The thromboelastography appears as a suitable alternative. Prophylactic administration of blood components is not indicated and can be a source of morbidity. Analgesia should be optimized, being epidural analgesia a good alternative in the presence of healthy liver and procedures involving no more than a lobectomy.
La cirugía hepática plantea numerosos problemas que requieren la interacción y adecuada comunicación de todos los involucrados, a fin de asegurar al paciente la máxima seguridad y las menores molestias. Problemas como la evaluación de la función hepática y sus implicancias para el postoperatorio, la interpretación y el manejo de alteraciones de los exámenes de coagulación, el manejo del aporte de volumen, y el tipo de analgesia van más allá de lo exclusivamente quirúrgico, tienen incidencia directa en el resultado y demandan por parte de cirujanos, anestesiólogos e intensivistas el conocimiento de los beneficios y problemas de las acciones implementadas.
En las última décadas la morbimortalidad de los pacientes sometidos a procedimientos resectivos hepáticos ha disminuido desde cifras mayores del 20% a cifras entre el 1-2%1. Esto se explica por importantes avances en todas las áreas relacionadas con el manejo de estos pacientes, lo que ha llevado a la realización de procedimientos cada vez más complejos y extensos. Como resultado de esto, la falla hepática postoperatoria ha aumentado como causa de muerte2-4. Se hace evidente, por lo tanto, la necesidad de poder evaluar la condición del hígado residual. A pesar de la existencia de numerosos test de evaluación funcional hepática, no se ha determinado cuál es el ideal para este objetivo. Los índices de Child-Pugh (CP) y MELD, aun cuando no fueron diseñados para ese objetivo como tampoco para el tipo de pacientes que se someten a una resección hepática, han sido utilizados para tratar de estimar el riesgo de falla hepática postoperatoria. Los resultados han sido contradictorios y no concluyentes respecto a su capacidad para determinar el riesgo de esta complicación5,6. En el caso de CP, los parámetros utilizados y su importancia fueron arbitrariamente asignados, y varios de ellos, como la ascitis, el estado nutricional y el grado de encefalopatía tienen un grado de subjetividad importante y restan utilidad a su uso. MELD presenta la ventaja de eliminar la subjetividad y de utilizar parámetros determinados a través de un análisis estadístico, que además asigna la importancia a cada uno. En general se considera que CP C está contraindicado para resección y los B solo toleran resecciones pequeñas. Para MELD, valores de 11 tendrían un alto valor predictivo de falla hepática postoperatoria7,8. La determinación de la volumetría determinada por tomografía computarizada se considera como el gold standard para la evaluación del volumen del hígado residual. Presenta, sin embargo, algunos problemas como la dificultad para trazar el contorno, los problemas para realizar esto en presencia de lesiones múltiples, pero probablemente lo más importante es la discrepancia que puede existir entre el volumen y la calidad funcional del parénquima residual8,9. Se ha determinado que en un hígado sano es posible dejar un volumen de 20-25% del parénquima, lo que equivale a 2 segmentos10,11. Además de la cantidad de parénquima que permanece, la calidad funcional de este es determinante para el pronóstico, lo cual está a su vez muy relacionado con la patología existente12,13. En presencia de condiciones que deterioran la funcionalidad, como la presencia de esteatosis o el antecedente de quimioterapia previa, la resección debiera limitarse a dejar un volumen del 30-60% y de un 40-70% en presencia de cirrosis establecida (tabla 1). Debe remarcarse que los volúmenes reportados y propuestos se basan en criterios arbitrarios, a veces difíciles de comparar de una serie a otra, pudiendo llegar hasta valores tan bajos como 10%14. La incidencia de insuficiencia hepática postoperatoria es de 0,7-9,1%, con una mortalidad por esta causa que puede llegar al 80%15-17. Resulta por lo tanto de gran importancia para evaluar el riesgo, conocer la magnitud de la resección y hasta cuándo sería tolerable resecar considerando la condición basal de la función hepática. Como factores determinantes de mayor riesgo de desarrollar falla hepática postoperatoria se han identificado la presencia de enfermedad hepática previa, la hepatotoxicidad por quimioterapia, el volumen residual hepático pequeño, el sangrado importante y la necesidad de transfusión, la hipoalbuminemia preoperatoria, la cirugía prolongada, el sexo femenino y una edad avanzada4,10,18-22.
El aporte de fluidos y su relación con la aparición de morbilidad, con la magnitud del sangrado y con la aparición de insuficiencia renal en el postoperatorio se encuentran estrechamente relacionados, siendo por lo tanto un punto muy importante del manejo perioperatorio. El exceso de fluidos se asocia a mayor morbilidad23,24, por lo cual resulta fundamental el evitar esta situación sin comprometer la perfusión tisular. La magnitud del sangrado ha sido relacionada con una mayor incidencia de falla hepática y renal postoperatoria4,10,18-20. La disminución de esto aparece por lo tanto como un objetivo clínico deseable, habiéndose difundido ampliamente la recomendación de disminuir la presión venosa central (PVC) bajo 5cm de agua durante la sección del parénquima25-27. Los reales beneficios y potenciales problemas de esto no están determinados. Algunos estudios no muestran este efecto sobre la disminución del sangrado comparado con pacientes en los cuales incluso no se midió la PVC28, y otros muestran la disminución del sangrado, pero con un aumento de la incidencia de insuficiencia renal postoperatoria29. Esto último se explicaría por un efecto sobre el gasto cardíaco (DC), lo cual no ha sido evaluado. La disminución del sangrado ciertamente es un efecto clínico deseable, sin embargo, no debe ser obtenido a expensas de un compromiso de la perfusión. Debe recordarse que la PVC es un muy mal indicador del estado del espacio intravascular30, por lo que su disminución podría asociarse a una disminución del llenado ventricular y del DC, con la consiguiente disminución de entrega de oxígeno a los tejidos. Como complicaciones secundarias a esto, la insuficiencia renal ha sido reportada hasta en un 15% de los pacientes sometidos a resecciones hepáticas, la cual, en caso de requerir algún tipo de terapia de reemplazo renal, puede alcanzar una mortalidad de 73%31. Resulta evidente la importancia de asegurar un aporte de volumen que asegure una óptima perfusión renal durante todo el perioperatorio. Si bien los efectos renales de la disminución de la PVC han sido evaluados y considerados seguros por Massicotte et al.26, los valores promedio en este estudio fueron superiores a los recomendados para obtener la disminución del sangrado. Por el contrario, Schroeder et al.29 encontraron una significativa mayor incidencia de falla renal al disminuir la PVC a los niveles que se recomienda para disminuir el sangrado. Ninguno de estos estudios mide el DC, y hasta donde sabemos esto no está estudiado, por lo cual deberíamos ser particularmente cuidadosos en pacientes con daño renal, cardíaco o hepático en los cuales disminuciones moderadas del retorno venoso pueden tener efectos impredecibles en el llenado ventricular, pudiendo determinar una caída importante del DC. En estos casos, la monitorización del DC con un método poco invasivo como la ecocardiografía transesofágica aparece como una alternativa que debe ser considerada. Desafortunadamente este no está exento de complicaciones, puede ser difícil contar con el equipo y requiere un operador entrenado, pero aporta importante información en situaciones hemodinámicas complejas difíciles de interpretar con la monitorización habitual32,33.
Recientemente, se ha cuestionado la seguridad de utilizar almidones por la posibilidad de aumentar el riesgo de desarrollar insuficiencia renal y aumento de los requerimientos transfusionales34,35. Esto sin embargo ha sido observado en pacientes críticos, principalmente sépticos, y no existen evidencias suficientes que cuestionen su seguridad en el perioperatorio36,37. Específicamente, en pacientes con hígados sanos no se ha demostrado deterioro de la función renal asociado a su utilización38, como tampoco en pacientes sometidos a trasplante hepático39.
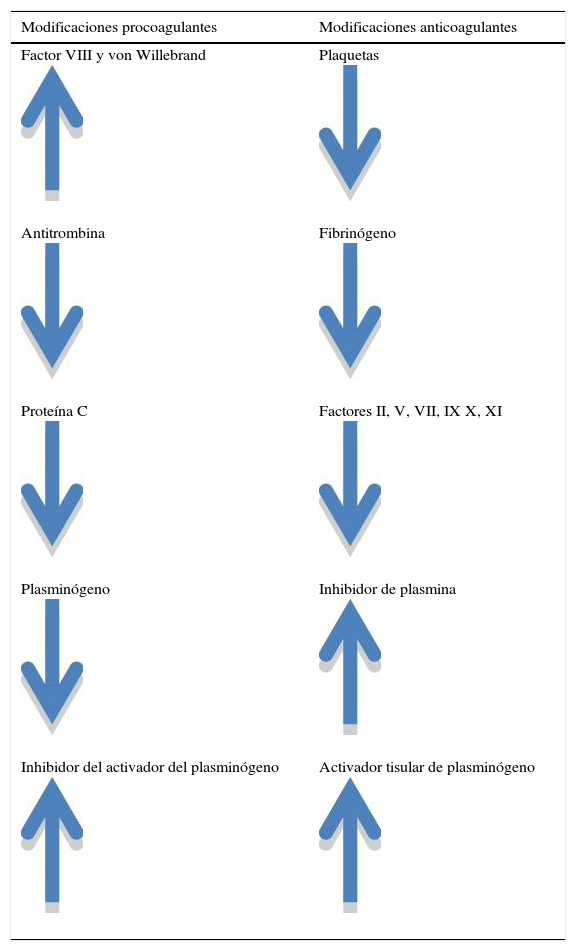
Con frecuencia, los pacientes con patología hepática presentan alteraciones de las pruebas de coagulación habitualmente utilizadas, las cuales son interpretadas como disminución de la capacidad de coagular. Esto ha demostrado ser una simplificación poco adecuada del problema, ya que si bien los factores procoagulantes efectivamente pueden disminuir, también pueden hacerlo los factores anticoagulantes como el plasminógeno, la proteína C, o incluso aumentar otros como el factor V y von Willebrand40,41 (tabla 2). El resultado de esto es un nuevo equilibrio hemostático cuyo punto de equilibrio resulta impredecible, pudiendo ir de un estado de hipo coagulación a protrombótico. Para complicar aún más el problema, esto no es evaluable por las pruebas de coagulación tradicionales. Estas miden solo una muy pequeña parte del proceso de coagulación, no consideran el efecto de la disminución de los factores anticoagulantes y no tienen capacidad de predecir la complicación hemorrágica. Cuando la capacidad de formar trombina es medida en condiciones que consideran el efecto de antitrombina y proteína C, esta es similar en pacientes con daño hepático crónico y sujetos normales. La decisión de aportar elementos de coagulación basada en las alteraciones de estas pruebas, o de manera profiláctica en el postoperatorio, no solo no tiene fundamento, sino que pudiera incluso estar involucrada en la aparición de sangrado al aumentar la hipertensión portal cuando está presente daño pulmonar agudo asociado a transfusión (TRALI), y otros tipos de reacciones transfusionales42. Los beneficios de la administración de hemocomponentes de manera profiláctica no están demostrados y puede generar morbilidad, por lo cual está contraindicada. A pesar de toda la información existente de las alteraciones de coagulación en los pacientes con daño hepático, existe escasa información fundamentada que permita guiar el manejo del sangrado en estos pacientes. Una evaluación más completa y precisa, identificando el real estado de coagulación de cada paciente puede realizarse con la tromboelastografía (TEG), la cual permite acercarse de manera más precisa a diagnosticar la presencia e identificar la causa de la alteración, permitiendo establecer un tratamiento más fundamentado43.
La ampliamente difundida conducta de administrar plasma fresco para tratar de corregir alteraciones de coagulación y disminuir el riesgo de sangrado, no tiene demostraciones que la sustenten, pudiendo esto incluso determinar morbilidad, por lo que una conducta expectante e identificación de la alteración aparecen como conductas más adecuadas44. La trombosis venosa es una complicación frecuente en estos pacientes, con una incidencia mayor que la población general, por lo que es fundamental su prevención. Históricamente, los pacientes con DHC no han recibido trombo profilaxis por la supuesta «anticoagulación natural» secundaria a su patología. Desafortunadamente, tampoco existen guías basadas en evidencia para el manejo de la prevención de trombosis en estos pacientes45,46.
Más allá de la incomodidad que el dolor representa, este puede ser la causa de alteraciones involucradas en el origen de la morbilidad, principalmente cardiovascular y respiratoria. La disminución de los volúmenes pulmonares y la alteración de la mecánica respiratoria determinadas por la cirugía y anestesia dificultan la eliminación de secreciones, aumentan el trabajo respiratorio, determinan hipoxemia y otras alteraciones asociadas a esta. Una técnica analgésica que facilite una adecuada eliminación de secreciones y expansión pulmonar resulta fundamental para atenuar los efectos de estos cambios. Frecuentemente, la peridural aparece como la alternativa más efectiva, sin embargo, se ve cuestionada por los posibles problemas de coagulación asociados a la posibilidad de aparición de falla hepática. Deben, sin embargo, aclararse 2 hechos. En primer lugar, la peridural, siendo una excelente alternativa analgésica, no es la técnica analgésica de elección, existiendo alternativas efectivas y no existiendo consenso de su capacidad de disminuir la morbilidad. En segundo lugar, las limitaciones dadas por la posible alteración de la coagulación deben ser evaluadas de acuerdo al estado preoperatorio del hígado y a la magnitud de la resección. En presencia de un hígado sano, la peridural puede usarse con seguridad hasta en lobectomías47. Más allá de esto o con hígado alterado no hay estudios que respalden su utilización, y probablemente parece mejor buscar otra alternativa analgésica.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.