Nuestro objetivo es analizar el metabolismo y la fisiopatología del depósito de hierro, describir la utilidad de la resonancia magnética (RM) con el empleo de secuencias específicas en la estimación de la sobrecarga hepática de hierro y evaluar las diferentes patologías que la generan en el abdomen, señalando también sus formas de presentación en la RM.
La sobrecarga de hierro en el hígado puede ser consecuencia de un trastorno genético (hemocromatosis primaria) o estar relacionada con múltiples transfusiones o enfermedades crónicas, como aumento de la absorción, mielodisplasia, talasemia, etc. (hemocromatosis secundaria).
La RM es un método no invasivo que permite detectar la sobrecarga de hierro y monitorear el tratamiento luego del diagnóstico, evitando la repetición de biopsias. Esto se debe a las propiedades paramagnéticas del hierro, cuya acumulación en los tejidos provoca distorsión local en los campos magnéticos, con disminución de la señal en los órganos afectados de forma proporcional a la cantidad de hierro depositado.
La RM convencional con secuencias en fase y fuera de fase detecta el depósito de hierro en el hígado, bazo y páncreas, aunque las formas leves pueden pasar inadvertidas si no se utilizan secuencias más sensibles, como las de eco de gradiente. Estas, según la técnica de Gandon et al., permiten estimar cuantitativamente la severidad.
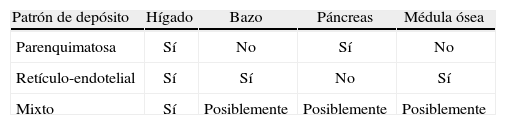
El depósito de hierro puede tener un patrón retículo-endotelial (secundario a múltiples transfusiones con depósito en hígado, bazo y médula ósea sin daño tisular), parenquimatoso (hígado y páncreas) o mixto.
La RM es fundamental en el diagnóstico de la hemocromatosis, especialmente en la fase subclínica. Contribuye a definir la severidad de la sobrecarga de hierro hepático y a valorar la respuesta al tratamiento, evitando procedimientos invasivos.
Our purpose is to analyze the metabolism and pathophysiology of iron deposition, to describe the usefulness of magnetic resonance imaging (MRI) in the estimation of hepatic iron overload using specific sequences, and to review the different pathologies leading to iron overload of the abdominal organs and its presentation in MRI.
Iron overload in the liver may be due to a genetic condition (primary hemo chromatosis), or due to multiple blood transfusions and chronic diseases like increased absorption, myelodysplasia, thalassemia, etc. (secondary hemochromatosis).
MRI is a noninvasive method to detect the presence of iron overload and to monitor treatment after diagnosis, avoiding repeated biopsies. This is due to the paramagnetic properties of iron accumulation in the tissues causing local distortion in the magnetic field. This phenomena is seen as a reduction of the MRI signal in the affected organs, being directly proportional to the amount of iron deposited.
The conventional in phase and out of phase MRI sequences can show iron deposition in liver, spleen and pancreas, although milder forms may go undetected if more sensitive sequences, like gradient echo sequence, are not used, according to the technique proposed by Gandon et al., which can estimate quantitatively the severity of iron deposition.
Iron deposition can show a reticuloendothelial type pattern (secondary to multiple transfusions where iron deposits in the liver, spleen and bone marrow without tissue damage), a parenchymal pattern (involving the liver and pancreas) and a mixed pattern.
MRI has a fundamental role in the diagnosis of hemochromatosis, especially in subclinical phase. It helps to stratify the severity of hepatic iron overload and assess response to treatment, avoiding invasive procedures.
La sobrecarga de hierro en el hígado puede deberse a un trastorno genético (denominado hemocromatosis primaria) o ser consecuencia de múltiples transfusiones o enfermedades crónicas, como aumento de la absorción, mielodisplasia, talasemia, etc. (hemocromatosis secundaria).
El diagnóstico clínico suele ser difícil de establecer, ya que los pacientes tienden a no presentar manifestaciones clínicas hasta estadios avanzados de la enfermedad. La resonancia magnética (RM) es un método no invasivo que permite detectar la presencia de sobrecarga de hierro y monitorear el tratamiento una vez realizado el diagnóstico, evitando la repetición de biopsias.
Nuestro objetivo es analizar el metabolismo y la fisiopatología del depósito de hierro, describir la utilidad de la RM con el empleo de secuencias específicas en la estimación de esta sobrecarga y evaluar las diferentes patologías que la generan en el abdomen, señalando también sus formas de presentación en la RM.
Metabolismo del hierro y hemocromatosisNormalmente, el cuerpo de un adulto contiene aproximadamente 4–5g de hierro, de los cuales 4g son funcionales y están localizados en la hemoglobina de los glóbulos rojos, en la mioglobina del músculo y en diversas enzimas (por ejemplo citocromos)1. El resto se almacena en los hepatocitos y en las células del sistema retículo-endotelial (que incluye las células de Kupffer del hígado, el bazo y la médula ósea)1.
La eritropoyesis medular requiere alrededor de 20mg de hierro por día. Sin embargo, solo 1–2mg de hierro son absorbidos de la dieta (esto es un 10% de lo ingerido)1,2. Por otro lado, lo que se absorbe equivale a lo que se pierde cada día a causa de la descamación del epitelio, la menstruación u otras formas de pérdida de sangre2.
El resto del requerimiento diario se obtiene a través de un adecuado mecanismo de reciclaje del hierro, que incluye la reutilización del que se encuentra en los eritrocitos senescentes. Así, la absorción es fisiológicamente bien controlada, mientras que la excreción no tiene un mecanismo efectivo3.
El hierro absorbido a través del intestino delgado (duodeno y yeyuno proximal) se une a una proteína encargada de transportarlo por la sangre: la transferrina 1,3,4. Una vez que esta proteína y el hierro se ligan, este se va depositando selectivamente en los hepatocitos, células rojas de la sangre (precursores formadores de tejidos de la sangre y eritrón) o, en menor grado, en otros tejidos que utilizan hierro, como el músculo3.
Las células del sistema retículo-endotelial, en cambio, acumulan el hierro derivado de la fagocitosis de los eritrocitos senescentes (un proceso conocido como hemólisis extravascular) 1,2. Este hierro procesado puede ser almacenado intracelularmente como ferritina o liberarse a la circulación en unión con la transferrina1.
El exceso de hierro puede ser consecuencia de un aumento de la absorción intestinal, o bien deberse a su administración por vía parenteral (transfusión sanguínea) (tabla 1)1–3. De esta forma, podemos clasificar las enfermedades por depósito de hierro en 2 grupos: primaria, que incluye la hemocromatosis genética, y secundaria, que engloba enfermedades crónicas o vinculadas a múltiples transfusiones (hemocromatosis secundaria) (tabla 2).
| Hemocromatosis primaria | Hemocromatosis secundaria |
| Enfermedad con herencia autosómica recesiva | Administración parenteral de hierro (transfusiones repetidas de sangre) |
| Aumento de la absorción intestinal, con ingesta normal en las cantidades de hierro | Sobrecarga de hierro en la dieta |
| Exceso en los depósitos de hierro en las células del hígado, páncreas, corazón, glándula pituitaria, tiroides y membrana sinovial | El hierro se deposita predominantemente en el sistema retículo-endotelial |
| Conduce a un daño celular, disfunción de órganos y desarrollo de tumores malignos | Menos tóxico |
| Hemocromatosis primaria (genética) |
| Hemocromatosis secundarias |
| Sobrecarga parenteral de hierro |
| Transfusiones |
| Hemodiálisis a largo plazo |
| Anemia aplásica |
| Depranocitosis |
| Síndromes mielodisplásicos |
| Leucemias |
| Inyecciones de hierro-dextrano |
| Eritropoyesis ineficaz con aumento de la actividad eritroide |
| β-Talasemia |
| Anemia sideroblástica |
| Déficit de piruvato cinasa |
| Aumento de la ingesta oral de hierro |
| Sobrecarga de hierro africana (siderosis de Bantú) |
| Hepatopatías crónicas |
| Hepatopatía alcohólica crónica |
| Porfiria cutánea tarda |
La hemocromatosis primaria es un trastorno autosómico recesivo que altera una proteína implicada en la regulación de la absorción de hierro3,5. La mayoría de estos pacientes son homocigotos o heterocigotos para esta mutación y la absorción de hierro es 2 ó 3 veces mayor que la de las personas no afectadas. Se considera que es la enfermedad genética más común en la población blanca, con una tasa de enfermedad de 0,2-0,5% para homocigotos y de hasta un 10% para heterocigotos2.
El hierro absorbido es transportado al hígado, donde inicialmente es incorporado en los hepatocitos periportales. Las células del sistema retículo-endotelial tienen una absorción normal del hierro de los eritrocitos, pero liberan rápidamente la ferritina intracelular, siendo incapaces de almacenar el exceso de hierro (al igual que las células de la mucosa intestinal)1.
El diagnóstico clínico suele ser difícil de establecer por 2 razones: en primer lugar, los pacientes tienden a permanecer asintomáticos durante la primera década de su enfermedad; pero además, los primeros signos y síntomas de disfunción hepática, diabetes mellitus, cardiomiopatía y/o artropatía son inespecíficos. De hecho, a menudo, estos se atribuyen a otras causas1,2,4.
Los valores de laboratorio utilizados en el diagnóstico de la hemocromatosis incluyen el nivel de ferritina y el índice de saturación de la transferrina, los cuales se encuentran aumentados en estos casos6. Sin embargo, ambas pruebas tienen baja sensibilidad y especificidad, con resultados falsos positivos en aquellos pacientes que abusan del alcohol, y con resultados falsos negativos en jóvenes con hemocromatosis2.
Si bien la biopsia hepática se considera el método estándar de referencia para el diagnóstico, es un procedimiento invasivo con riesgos potenciales, susceptible a errores de muestreo debido a la pequeña cantidad de tejido obtenido.
La RM, en este sentido, es un método no invasivo que permite detectar la presencia de sobrecarga de hierro y monitorear el tratamiento una vez hecho el diagnóstico, evitando la repetición de biopsias. Esto se debe a las propiedades paramagnéticas de los iones de hierro, cuya acumulación en los tejidos provoca distorsión local en los campos magnéticos, con la consiguiente disminución de la intensidad de señal en los órganos afectados de forma proporcional a la cantidad de hierro depositado.
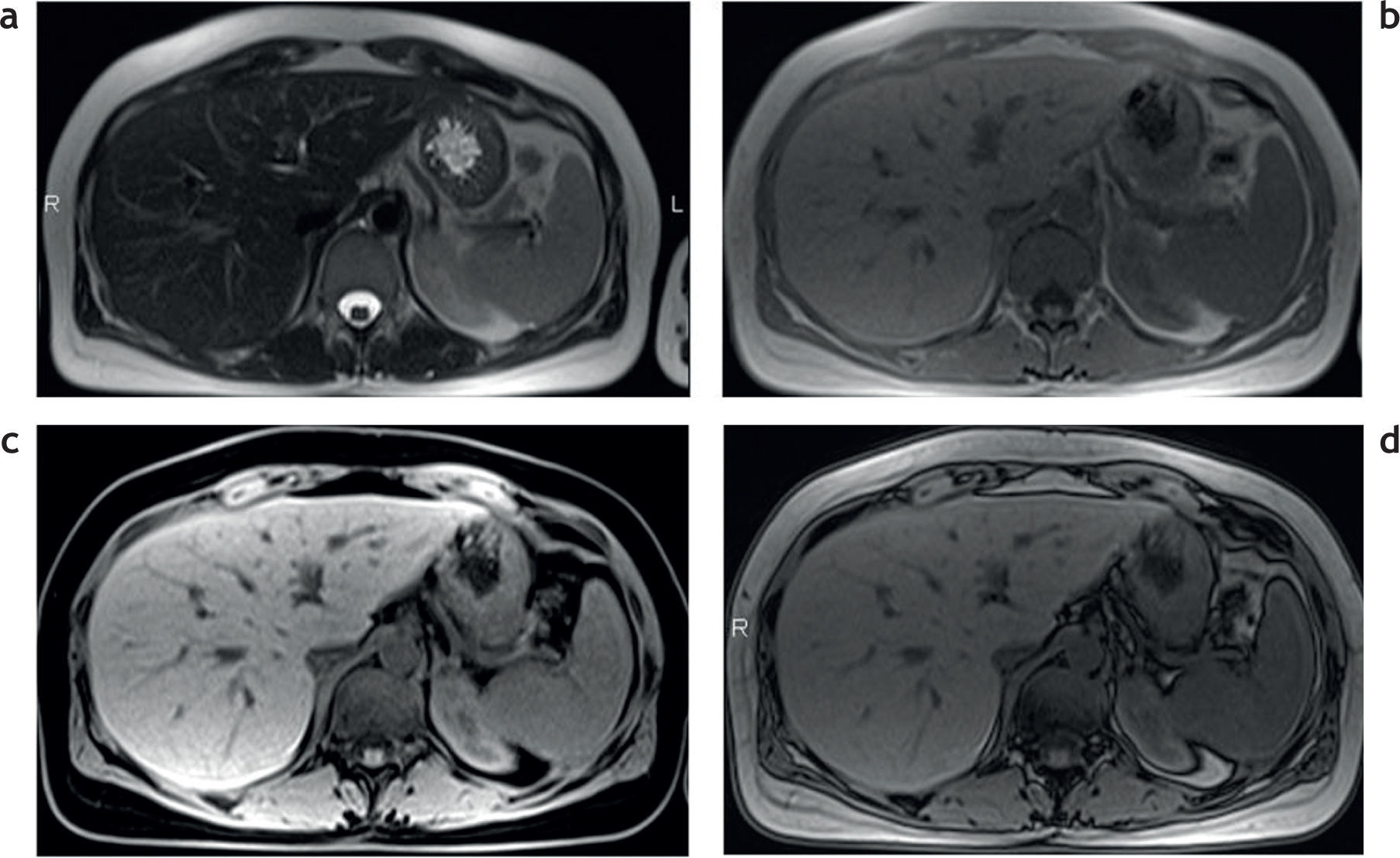
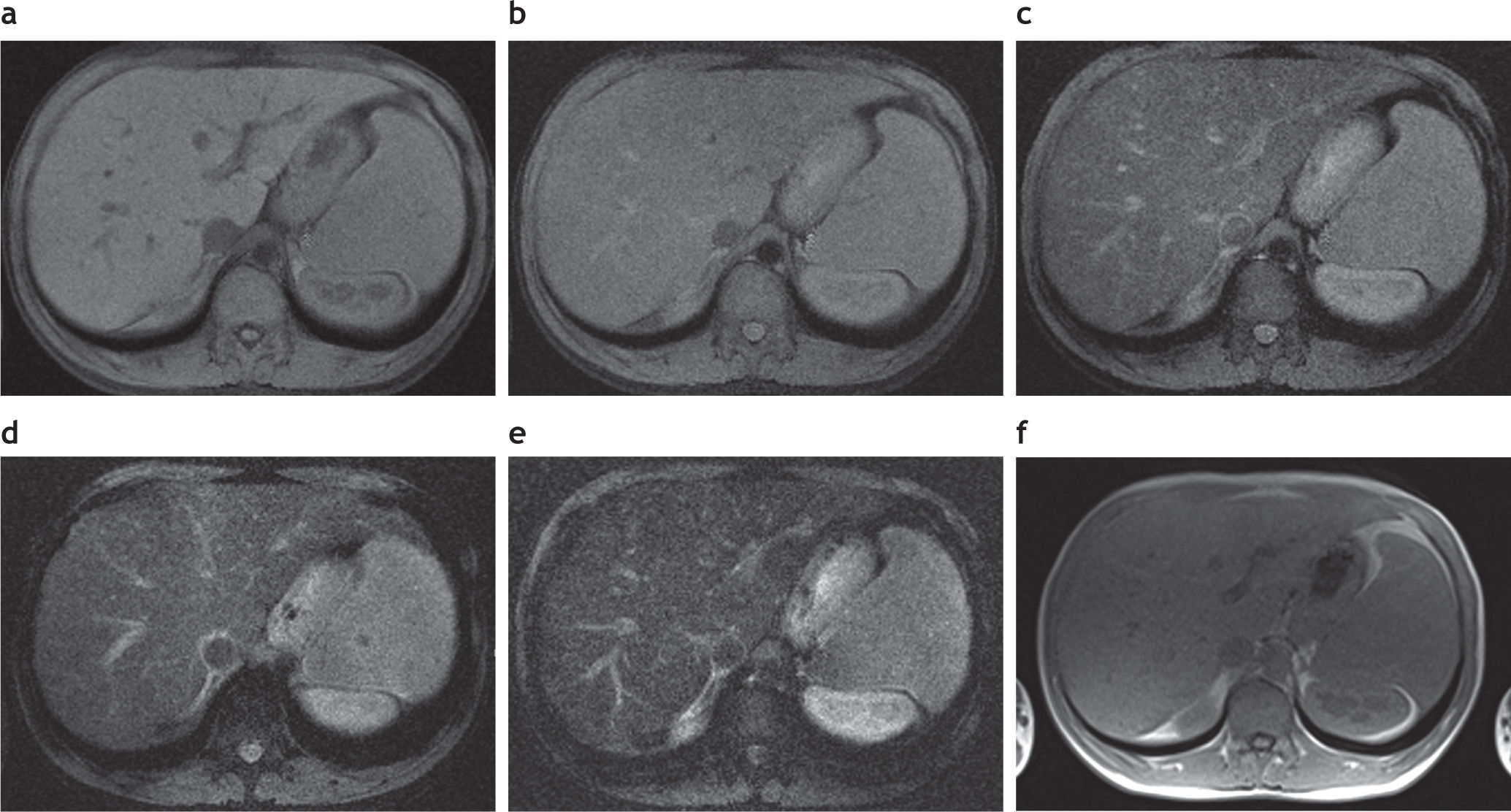
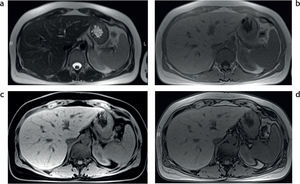
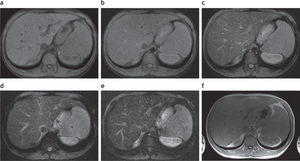
Sobrecarga hepática de hierro: detección y caracterización mediante secuencias eco de gradiente específicasEl estudio convencional del hígado con RM incluye una secuencia en ponderación T2, una secuencia ponderada en T1 con supresión grasa, una secuencia en fase y fuera de fase, y eventualmente una secuencia ponderada en T1 con supresión grasa, tras la administración del contraste endovenoso (fig. 1). Tal como se mencionó anteriormente, debido a las propiedades paramagnéticas de los iones de hierro acumulados en los tejidos, se produce una distorsión local en los campos magnéticos con la consecuente pérdida de intensidad de señal en los órganos afectados. Esta es proporcional al depósito de hierro2 (fig. 2).
Estudio convencional de resonancia magnética en un paciente joven con hemocromatosis secundaria a talasemia y múltiples transfusiones que fue esplenectomizado: secuencias (a) en ponderación T2, (b) en fase, (c) en ponderación T1 supresión grasa y (d) fuera de fase. Se aprecia una disminución en la intensidad de la señal hepática, todavía más evidente en la secuencia en fase (b). Nótese, además, la caída de señal, visible en el parénquima pancreático en esta secuencia (estrella) en relación con la secuencia fuera de fase (d). También existe una disminución en la intensidad de señal de las vértebras de la médula ósea en todas las secuencias, señalada en (a) con círculo.
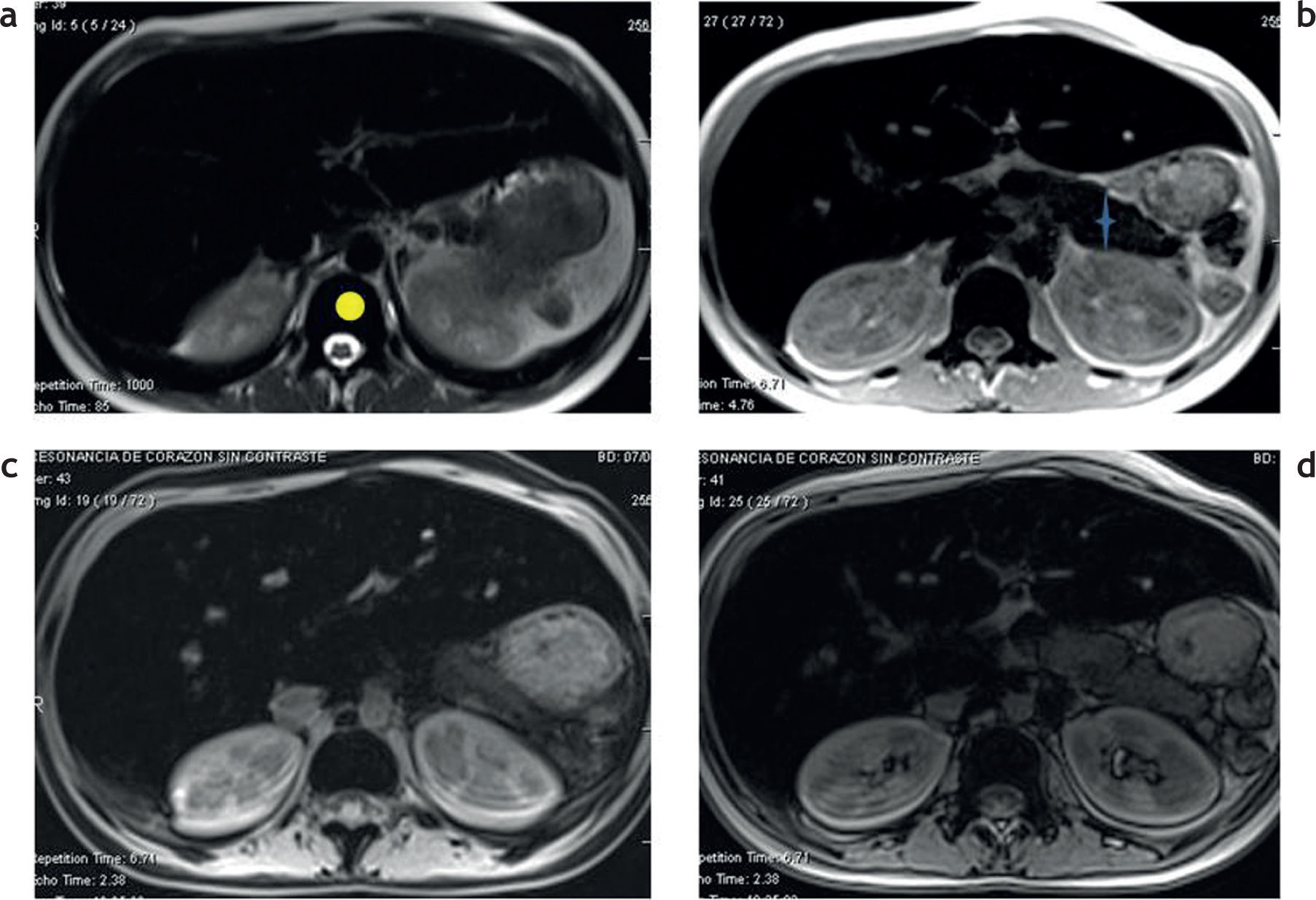
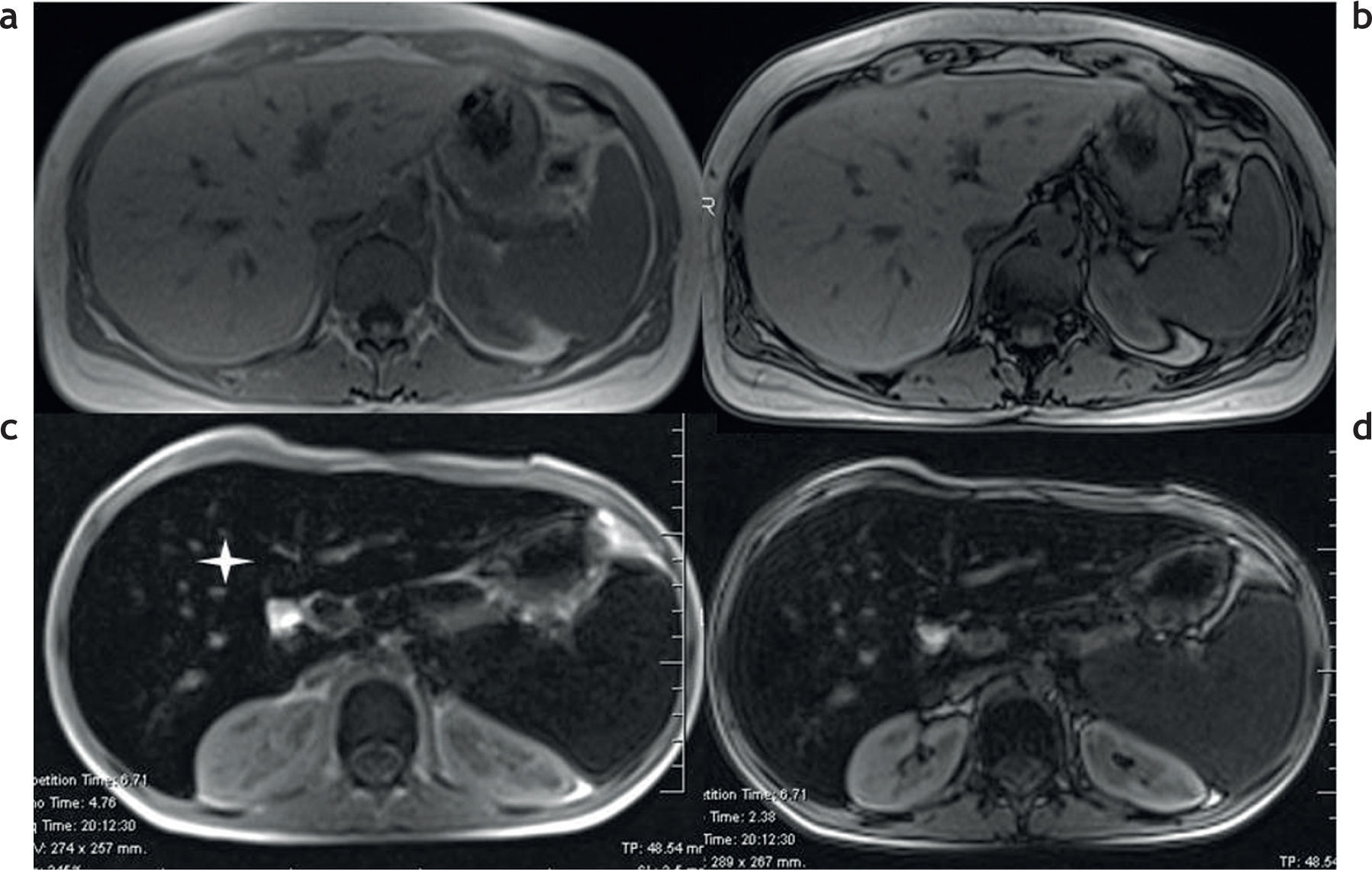
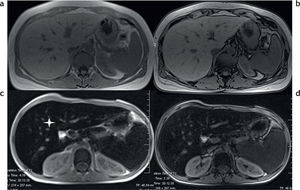
Con las secuencias en fase y fuera de fase es posible demostrar la presencia de sobrecarga hepática de hierro en los tejidos7,8 (fig. 3). En la secuencia en fase se aprecia una disminución de la intensidad de señal en los tejidos, en comparación con la secuencia fuera de fase. Este efecto, opuesto al observado en pacientes con esteatosis (fig. 4), se produce porque el tiempo de eco de la secuencia en fase es generalmente mayor que el de la secuencia fuera de fase y, por lo tanto, la secuencia de impulsos en fase es más sensible a los depósitos de hierro por el mayor efecto T2*.
RM en 2 pacientes distintos con secuencias en fase y fuera de fase. (a y b) Hemocromatosis secundaria con marcada hipointensidad difusa en el parénquima hepático en la secuencia en fase (a). (c y d) Esteatosis hepática, se aprecia una caída de la señal del parénquima hepático en la secuencia fuera de fase (d).
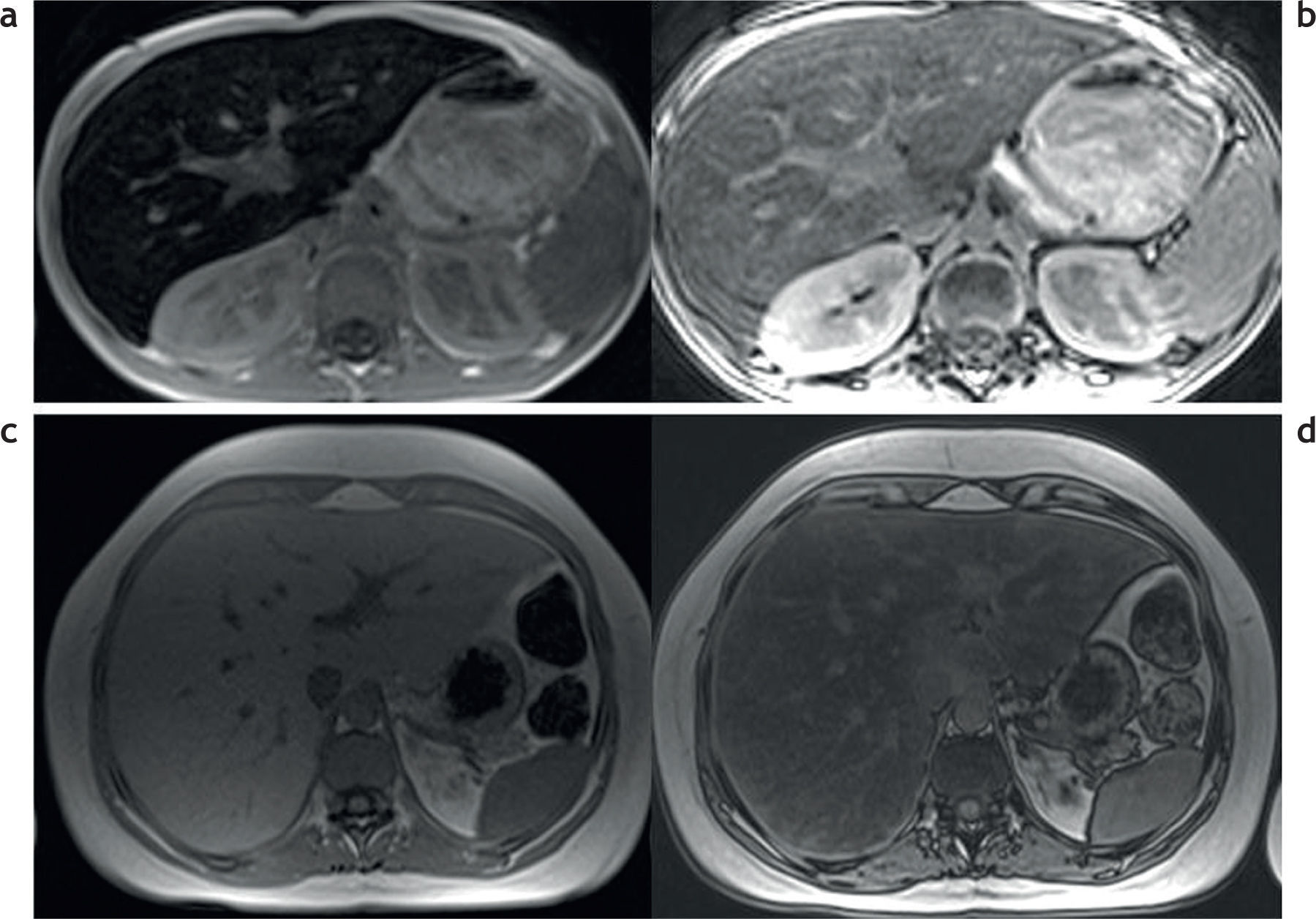
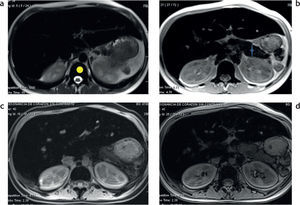
Si bien en el estudio convencional con secuencias en fase y fuera de fase se puede inferir la presencia de depósito de hierro en el hígado, bazo y páncreas, las sobrecargas leves pueden pasar inadvertidas si no se utilizan secuencias más sensibles, como las secuencias eco de gradiente (fig. 5). Estas, según la técnica propuesta por Gandon et al., permiten estimar de forma cuantitativa la severidad del depósito de hierro (fig. 6)9. Al utilizarlas con tiempos de eco cada vez más largos, el depósito de hierro se hace evidente, incluso en las sobrecargas leves, y mediante tablas de cálculos puede estimarse el valor aproximado9–11.
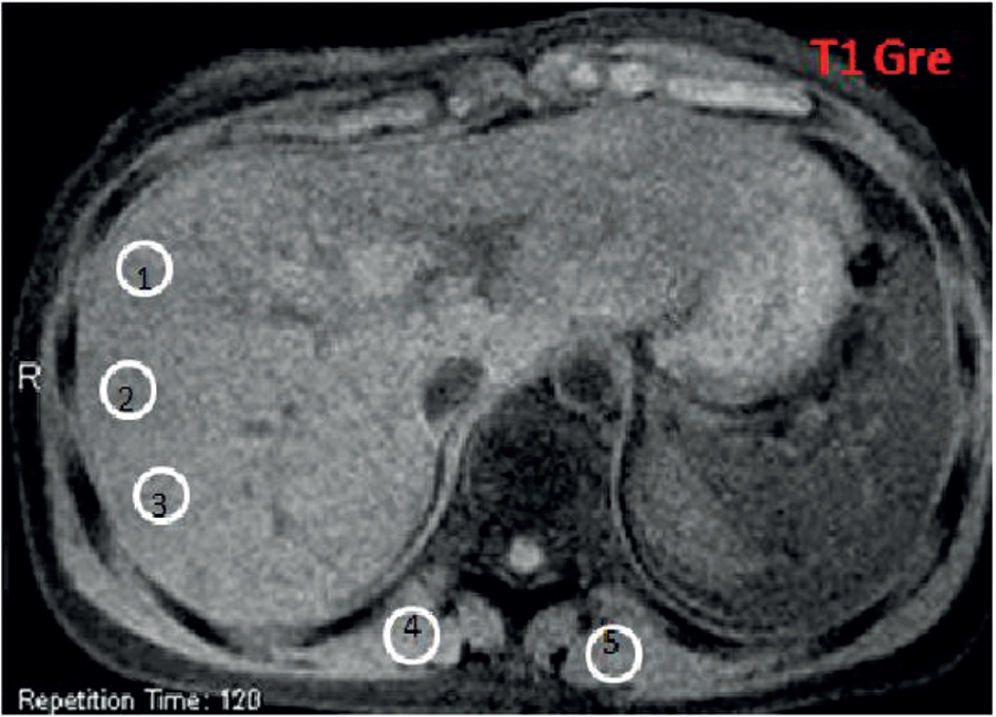
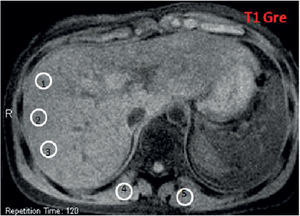
Secuencias eco de gradiente específicas en un paciente con sobrecarga hepática de hierro: (a) en ponderación T1 GRE 120/4/90; (b) DP GRE 120/4/20; (c) en ponderación T2 GRE 120/9/20; (d) en ponderación T2 + GRE 120/14/20; (e) en ponderación T2 ++ GRE 120/21/20. Nótese la disminución de la intensidad de señal en comparación con los músculos paraespinales. En la secuencia en fase (f) no se observa alteración en la intensidad de señal del hígado.
Mediciones en la intensidad de la señal realizadas con región de interés (ROI, en inglés region of interest). Presenta un área de 1 cm2 aproximadamente. Se deben colocar 3 ROI en la parte derecha del hígado para evitar los artefactos y 2 en los músculos paravertebrales (derecha e izquierda). El ROI debe colocarse en la misma imagen en todas las secuencia, con el fin de evitar variaciones globales de intensidad de señal. Al momento de ubicar el ROI en la imagen hay que intentar evitar los vasos hepáticos, áreas heterogéneas, artefactos y, en particular, la disminución de la intensidad de señal del músculo paravertebral adyacente a las bases pulmonares.
La estimación de la sobrecarga hepática de hierro puede realizarse con resonadores de 0,5, 1,5, 3 y 5 T9,12, adaptando los protocolos de estudio a cada equipo.
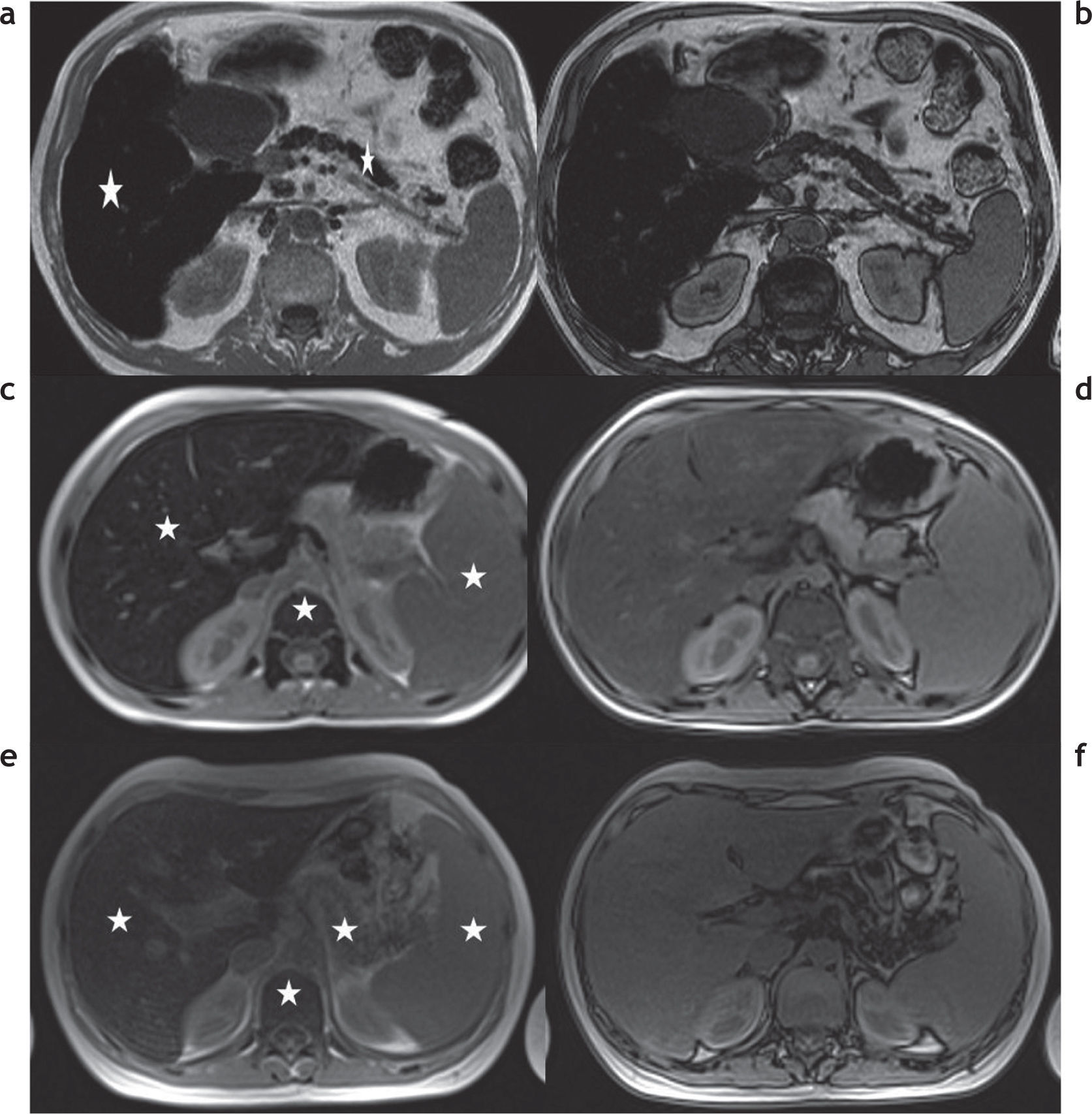
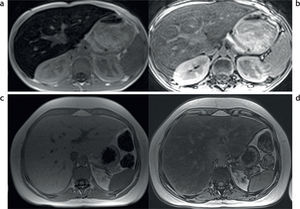
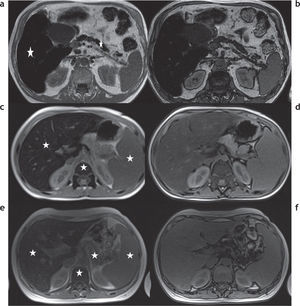
Además de la clasificación de las enfermedades por depósito de hierro en primarias o secundarias, estas pueden dividirse de acuerdo con los patrones de depósito en 3 tipos (tabla 3)2,13: parenquimatoso, reticulo-endotelial o mixto (fig. 7).
Clasificación de las enfermedades por sobrecarga hepática de hierro en función al patrón de depósito. RM en 3 pacientes distintos con secuencias en fase y fuera de fase: (a y b) patrón parenquimatoso, nótese la caída de señal en la secuencia en fase, tanto en el hígado como en el páncreas (estrellas), que traduce la presencia de depósito de hierro; (c y d) patrón retículo-endotelial, se aprecia depósito de hierro en el hígado, el bazo y la médula ósea (estrellas); (e y f) patrón mixto, en este paciente se observa depósito de hierro tanto en el hígado, el bazo y el páncreas como en la médula ósea (estrellas).
Este patrón se produce como consecuencia de una absorción aumentada de hierro. Se observa principalmente en pacientes con hemocromatosis primaria o en los casos de anemia crónica con eritropoyesis ineficaz (síndromes de talasemia, anemias congénitas diseritropoyéticas y anemias sideroblásticas). En un inicio, el exceso de hierro se acumula en los hepatocitos periportales y luego se extiende al resto del hígado, el páncreas y la tiroides, ocasionando daños en los tejidos.
En este patrón, la intensidad de señal disminuye en el hígado y el páncreas, mientras que se conserva en el bazo y la médula ósea. No obstante, en los pacientes jóvenes con sobrecarga leve, la intensidad de señal del páncreas puede estar preservada.
Patrón retículo-endotelialEn la sobrecarga secundaria a múltiples transfusiones, el depósito de hierro generalmente se produce en las células del sistema retículo-endotelial del hígado, el bazo y la médula ósea. A diferencia del patrón parenquimatoso, este tipo de acumulación no está asociado con un daño tisular.
La intensidad de señal del bazo y la médula ósea puede ser utilizada para evaluar el tipo de patrón del depósito, porque en la forma parenquimatosa normalmente no se observa ningún efecto sobre estas estructuras. Además, la intensidad de señal del páncreas habitualmente se preserva, excepto cuando la cantidad de hierro administrado (en forma de múltiples transfusiones) supera la capacidad de almacenamiento del sistema retículo-endotelial.
Patrón mixtoLos pacientes con anemias crónicas causadas por eritropoyesis ineficaz (como la talasemia) suelen requerir múltiples transfusiones. Esto puede generar patrones de distribución atípica (depósito parenquimatoso y retículo-endotelial).
ConclusiónLa hemocromatosis es una enfermedad con escasa repercusión clínica, por lo que el diagnóstico en estadios tempranos a veces resulta difícil. Sin embargo, el conocimiento de los hallazgos radiológicos, los patrones de distribución del hierro y las enfermedades asociadas pueden facilitar su reconocimiento. La RM tiene un rol fundamental, especialmente en la etapa subclínica, ya que contribuye a estratificar la severidad de la sobrecarga de hierro hepática y a valorar la respuesta al tratamiento, evitando los procedimientos invasivos.
Los autores declaran no tener ningún conflicto de intereses.