Objetivos de aprendizaje: El objetivo de este trabajo es proponer un algoritmo de estudio por imágenes de las lesiones suprarrenales que permita arribar a un diagnóstico correcto en el menor tiempo posible. Esto favorece la adopción de la conducta terapéutica más apropiada para cada patología y puede modificar en forma sustancial el tratamiento.
Aunque las características estructurales de las lesiones generalmente son inespecíficas, es posible, a través de las técnicas de imágenes actuales, diferenciar las lesiones compatibles con procesos benignos de las compatibles con procesos malignos y, con la colaboración del endocrinólogo y el laboratorio, también se pueden distinguir las lesiones funcionantes de las no funcionantes.
Revisión de tema: Se evaluaron en forma retrospectiva, entre mayo del 2009 y diciembre del 2011, 157 pacientes con patología suprarrenal. En total, eran 95 mujeres y 61 hombres, de 33 a 78 años (media: 55 años). El protocolo de estudio consistió en una tomografía computada (TC) sin contraste intravenoso (IV), con toma de la densidad de la lesión, seguida de una tomografía computada con contraste intravenoso y tiempo de lavado con toma de densidad de la lesión en tiempo portal y tardío a los 15 minutos (tiempo de lavado o wash-out).
Las mediciones y cálculos realizados fueron: tamaño de la lesión suprarrenal, densidad media de la misma durante las tres fases estudiadas y porcentajes de lavado relativo y absoluto. Se realizó resonancia magnética (RM) y tomografía computada por emisión de positrones con 18F-fluorodesoxiglucosa (FDG-PET/TC) sólo en aquellos pacientes que así lo requirieron. Además, se compararon los resultados con los de la literatura actualizada sobre el tema.
Hallazgos en imágenes: La conjunción de los datos clínicos, de laboratorio y las imágenes con el algoritmo propuesto permitió identificar 59 adenomas no funcionantes (49 unilaterales y 10 bilaterales), 29 adenomas funcionantes, 9 hiperplasias bilaterales, 4 mielolipomas (2 de ellos en una paciente con hiperplasia suprarrenal congénita virilizante simple), 2 quistes, 2 hematomas, 3 linfomas (2 secundarios y 1 primario bilateral), 30 metástasis, 5 carcinomas adrenocorticales, 12 feocromocitomas, 1 feocromocitoma maligno y 1 ganglioneuroma.
Conclusión: La utilización de un algoritmo de estudio adecuado, con las herramientas diagnósticas más apropiadas y accesibles, permite la correcta caracterización de las lesiones suprarrenales. A su vez, evita la pérdida de tiempo, el diagnóstico incorrecto, la irradiación excesiva del paciente y la mala utilización de los recursos.
Training Objectives: The aim of this study is to propose an algorithm for the evaluation of adrenal lesions in order to arrive at the correct diagnosis in the shortest possible time.
This method would be suitable for the most appropriate therapeutic procedures for each pathology, and may substantially modify a given treatment. In spite of the fact that the structural features of lesions are generally non-specific, with imaging techniques, it is possible to establish features which could help us differentiate benign from malignant lesions and with the contribution of the endocrinologist and the laboratory, to distinguish functional from non-functional ones.
Topic review: A retrospective evaluation from May 2009 to December 2011 has been carried out on 157 patients with adrenal diseases, including 95 females and 61 males, from 33 to 78 years of age (mean age 55). The study protocol consisted in non-contrasted intravenous computed tomography, with lesion density measurement, followed by contrasted intravenous computed tomography and wash out time with lesion density determination in portal time and delayed after 15 minutes wash out. Measurements and calculations were: adrenal lesion size, medium density and absolute and relative wash-out percentiles. Magnetic resonance and 18F-fluorodeoxyglucose positron emission tomography was only performed on those patients that required these techniques. A comparison of the present results with those in the literature is included.
Imaging findings: Fifty-nine patients with a non-functional adenoma were identified (49 unilateral and 10 bilateral), 29 functional adenomas, 9 with bilateral hyperplasia, 4 myelolipomas (2 in a female patient with simple virilizing congenital adrenal hyperplasia), 2 cysts, 2 hematomas, 3 lymphomas (2 secondary and 1 primary bilateral), 30 metastases, 5 adrenocortical carcinomas, 12 pheochromocytoma,1 malignant pheochromocytoma and 1 ganglioneuroma.
Conclusion: The use of an appropriate study algorithm, with proper diagnostic tools, enables adrenal lesions to be correctly differentiated. Moreover, this approach prevents loss of time, a wrong diagnosis, excessive irradiation of the patient, and incorrect use of resources.
Tumores suprarrenales benignos no adenomatosos
Mielolipoma
El mielolipoma es un tumor benigno, compuesto por los tejidos hematopoyético y adiposo maduro. Puede localizarse de forma asintomática en la glándula suprarrenal o ser extraadrenal, y por lo general se diagnostica en forma incidental.
Si existen síntomas, se generan por el efecto de masa (debido a su gran tamaño) o por una hemorragia intratumoral. Cuando sangran, pueden producir dolor, náuseas, vómitos o hipotensión.
En su mayoría son tumores no funcionantes y unilaterales (del 68 al 78%), de tamaño variable (entre 2 y 15 cm), con bordes bien definidos, alto contenido graso (de 50 a 90%) y áreas con densidad de partes blandas25,28-30.
La característica típica en una tomografía computada (TC) es la atenuación variable entre -30 y -115 UH (una densidad mucho menor que la de un adenoma). Algunos pueden presentar calcificaciones (20%), probablemente vinculadas a hemorragias anteriores. En la TC con contraste es posible observar un realce del componente de partes blandas que podría estar enmascarando la atenuación grasa.
Cuando el tumor ha sangrado, la TC puede detectar colecciones de alta o baja atenuación, dependiendo del estadio de la hemorragia18,19,23.
También es característica la imagen del mielolipoma en la resonancia magnética (RM), ya que por su componente adiposo es hiperintenso en secuencias ponderadas en T1. La utilización de técnicas con supresión grasa ayuda a confirmar el diagnóstico, dado que evidencia la pérdida de intensidad de señal en las áreas lipídicas18,23.
Estos tumores pueden clasificarse en tres grupos de acuer do a su comportamiento en la imágenes de la RM: a) homo géneos e hiperintensos en ponderación T1 y con señal intermedia en ponderación T2 (hallazgos que sugieren lesiones a predominio adiposo); b) heterogéneos con áreas de igual intensidad de señal que la grasa, mezcladas con otras de alta señal en ponderación T2, o que realzan con gadolinio en ponderación T1 (esto indica lesión mixta adiposa con elementos mieloides); c) nódulos hipointensos en ponderación T1 e hiperintensos en ponderación T2 con respecto al hígado, que realzan con gadolinio (lo que corresponde a lesiones en las que predomina el contenido mieloide)25,28-30.
En la ecografía la apariencia cambia en cada tumor por la relación existente entre el tejido graso y el hematopoyético. Con frecuencia presenta áreas hipo e hiperecogénicas, reflejando la cantidad variable de tejido graso y mieloide. Si el tumor contiene principalmente grasa, se observa una masa hiperecogénica uniforme; en cambio, si predomina el tejido mieloide, la masa es hipoecogénica.
Los mielolipomas que coexisten con otras condiciones patológicas son muy distintos de los mielolipomas aislados: tienen menor tamaño (promedio: 7 cm) con menor componente adiposo (por lo general < 10%), mayor prevalencia de calcificaciones (52%) y menor frecuencia de pseudocápsula30 (33%).
Debemos tener en cuenta que algunos tumores adrenales de diferente etiología pueden presentar focos macroscópicos de tejido adiposo, entre ellos los adenomas, feocromocitomas, carcinomas adrenocorticales y metástasis23,30-32.
Los tumores de colisión están formados por lesiones coexistentes de distinto origen histopatológico y tienen una apariencia atípica en las imágenes. En el caso del tumor de colisión, producto de la asociación de un adenoma funcionante y un mielolipoma, puede manifestarse con un síndrome hormonal por su componente adenomatoso. En nuestra casuística contamos con una hiperplasia congénita virilizante simple con mielolipomas bilaterales. Dado el síndrome hormonal concomitante, la paciente fue intervenida quirúrgicamente y se arribó al diagnóstico anatomopatológico de hiperplasia congénita virilizante simple con mielolipomas bilaterales.
Los mielolipomas son tumores que no captan con avidez la fluorodesoxiglucosa (FDG) en la tomografía computada por emisión de positrones (PET/TC); sin embargo, existen raros casos que sí muestran esta avidez porque su componente hematopoyético puede ser hipermetabólico33.
Hemangioma
Los hemangiomas adrenales son tumores benignos raros (existen menos de 30 casos en la literatura) y típicamente constituyen un hallazgo incidental.
En la TC sin contraste se observan como masas bien delimitadas, hipodensas o con atenuación heterogénea. En un tercio de los casos pueden presentar calcificaciones irregulares por hemorragias anteriores, trombosis o necrosis.
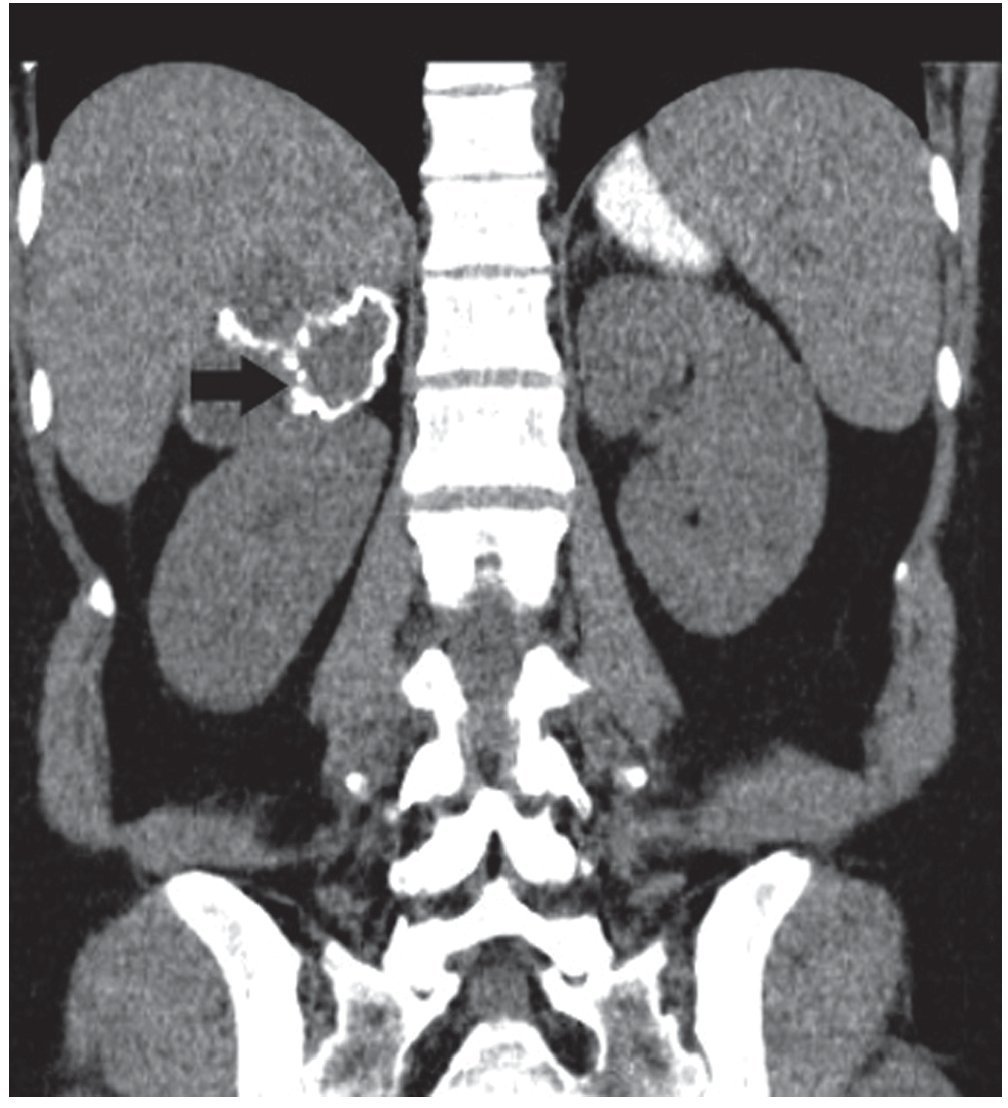
La presencia de flebolitos dentro de la lesión es característica del hemangioma.
En el caso de la TC con contraste, se muestran múltiples áreas nodulares periféricas de marcado realce y la persistencia de pools de contraste en la periferia de la lesión en tiempo tardío. Es raro que ocurra el fenómeno de realce centrípeto, descrito en los hemangiomas cavernosos hepáticos, debido a la presencia de necrosis, fibrosis y trombosis central9,13.
Ganglioneuroma
Los ganglioneuromas son tumores benignos de origen neurogénico que derivan de los ganglios simpáticos. Pueden crecer en cualquier sector de la cadena simpática paravertebral y, en ocasiones, se presentan en la médula de las glándulas adrenales. Están compuestos por células de Schwann maduras, células ganglionares y fibras nerviosas.
Los lugares donde se localizan con mayor frecuencia son el retroperitoneo (32-52%) y el mediastino posterior (39-43%), seguido por la región cervical34-36 (8-9%). En una serie de 46 pacientes con ganglioneuromas abdominales, el tumor se ubicó en el retroperitoneo extraadrenal en el 59% de los casos y en la glándula adrenal en el 41%34.
Los ganglioneuromas, a menos que sean de gran tamaño, son asintomáticos. Sus manifestaciones más frecuentes son el dolor abdominal o una masa palpable. Las formas hormonalmente activas producen secreción de catecolaminas, polipéptidos intestinales vasoactivos u hormonas androgénicas, lo cual explica los síntomas como hipertensión, diarrea o virilización34,36.
En la TC o RM, los ganglioneuromas retroperitoneales o adrenales aparecen como masas ovoideas o lobuladas, y bien circunscriptas. A su vez, tienden a rodear los vasos sanguíneos en forma total o parcial.
En la TC sin contraste estos tumores se muestran homogéneos con una atenuación menor a la del músculo. Pueden presentar calcificaciones discretas y puntiformes hasta en un 20% de los casos. Mientras, en la TC con contraste muestran diversos grados de realce, desde tenues hasta intensos (fig. 7).
Figura 7. Paciente normotensa con molestias de larga evolución en la región lumbar izquierda. Laboratorio normal, sin antecedentes familiares de relevancia. Lesión no adenomatosa en la glándula suprarrenal izquierda de 6 cm de diámetro, con densidad de 22 UH en la TC sin contraste (no se muestra). En la TC con contraste no incrementó mayormente su densidad (27 UH). La indicación quirúrgica se estableció por las características no adenomatosas y el tamaño de la lesión. Anatomía patológica: ganglioneuroma.
En la RM son homogéneos con una intensidad de señal de intermedia a baja en ponderación T1. La intensidad de señal ponderada en T2 depende de la proporción de estroma mixoide, células y fibras de colágeno que contenga el tumor. Los que tienen gran celularidad, fibras colágenas y sólo un escaso porcentaje de estroma mixoide tienen una señal de intermedia a alta en ponderación T1, mientras que en los hay una gran proporción de tejido mixoide, escasas células y tejido fibroso la señal es muy intensa en ponderación T2.
En los estudios de medicina nuclear, como la centellografía metayodobencilguanidina (MIBG) y con yodo-123, se pueden encontrar áreas con un incremento en la captación del radiotrazador que reflejan sitios de producción de catecolaminas.
La utilidad del estudio PET/TC en los ganglioneuromas no ha sido bien establecida y muchas veces se requiere una biopsia o una cirugía a fin de confirmar el diagnóstico de lesión benigna37-39.
En nuestra casuística contamos con un solo ganglioneuroma, inicialmente diagnosticado como incidentaloma. Debido a su tamaño y densidad, se decidió la resolución quirúrgica.
Quistes
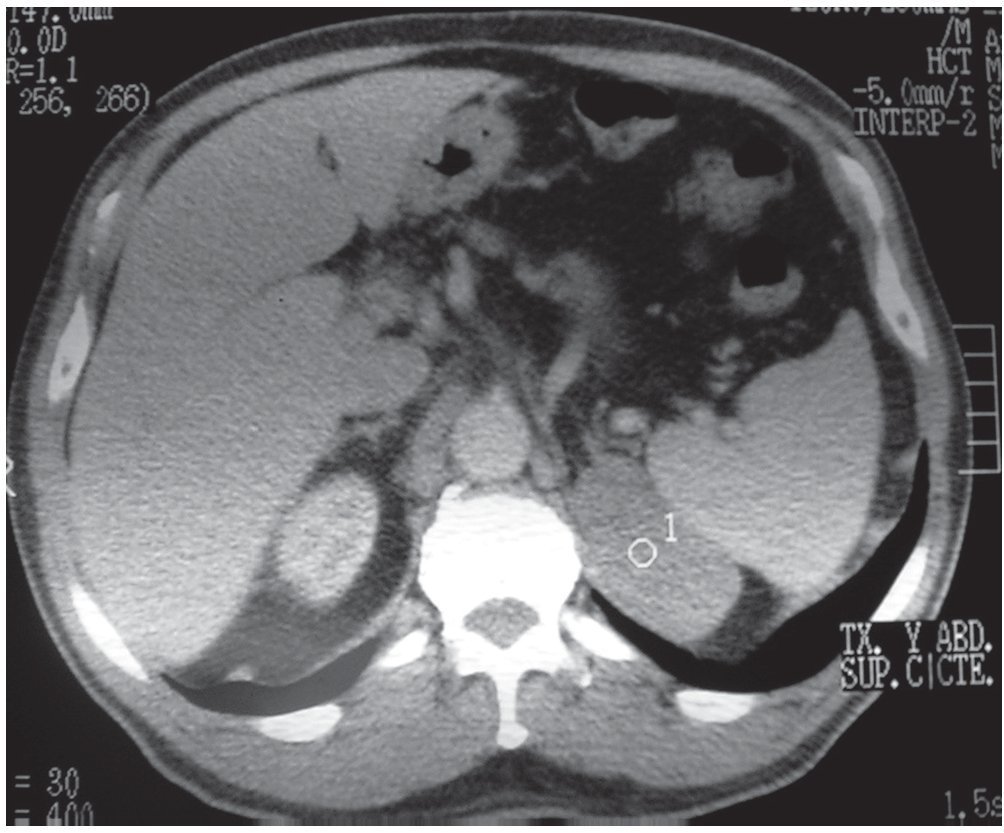
Los quistes adrenales son un hallazgo incidental en la TC, suelen ser unilaterales y solitarios, tienen una prevalencia en el sexo femenino de 3:1 y la mayoría se diagnostica entre los 50 y 60 años. Son asintomáticos, a menos que el quiste provoque un efecto de masa en las estructuras adyacentes o se complique con una hemorragia o una infección. Se clasifican en parasitarios (fig. 8) o no parasitarios.
Figura 8. Paciente asintomático con gran formación multiquística y groseras calcificaciones parietales. Diagnóstico quirúrgico: quistes hidatídicos en la suprarrenal derecha.
Las lesiones quísticas no parasitarias se dividen en tres categorías basadas en los hallazgos histológicos: endoteliales (48%), pseudoquistes (42%) y epiteliales (10%). Los endoteliales pueden ser angiomatosos o linfangiomatosos. Los más comunes son múltiples, pequeños (de 1 a 15 mm) y pueden ser loculados, siendo raro que se presenten lesiones grandes y solitarias. Los grandes quistes endoteliales linfangiomatosos se denominan linfangiomas quísticos1. Estas lesiones en la TC sin contraste son hipodensas, mientras que en la RM se observan paredes finas, hipointensidad en ponderación T1 e hiperintensidad en ponderación T2.
Por su parte, los pseudoquistes representan la variedad más frecuente de las formaciones quísticas adrenales. Pueden presentar septos, hemorragia o calcificaciones, y la mayoría es el resultado de hemorragias en una glándula normal o en un tumor adrenal con subsecuente organización del coágulo.
En el caso de los quistes epiteliales, estos incluyen a los inusuales adenomas quísticos y quistes de retención o remanentes embrionarios. En la TC muestran las características típicas de cualquier lesión quística: son hipodensos con paredes finas (menos de 3 mm) y tienen septos internos. Además, suelen ser redondeados u ovales y en ocasiones lobulados, así como también pueden presentar calcificaciones periféricas o curvilíneas en el 15% de los casos.
Aquellos quistes que no presentan calcificaciones pueden ser indistinguibles de los adenomas por su atenuación similar en la TC.
La TC con contraste y tiempo de lavado demuestra la verdadera naturaleza de los quistes adrenales, ya que estos no realzan con el contraste intravenoso. En menos del 20% de los casos, los quistes benignos pueden presentar hiperatenuación en la TC sin contraste (> 60 UH) debido a una hemorragia intraquística.
El único diagnóstico diferencial que podría plantearse es el adenocarcinoma adrenal quístico. Sin embargo, en tanto presentan áreas sólidas, estos tumores nunca son sólo quísticos18,40.
Feocromocitoma
El feocromocitoma es un tumor poco frecuente, secretor de catecolaminas, que se origina a partir de las células cromafines de la médula suprarrenal. La mayoría corresponde a una enfermedad ocasional, pero se ha reportado que entre el 10 y el 24% puede corresponder a una enfermedad familiar asociada a neoplasia endocrina múltiple (NEM), neurofibromatosis, síndrome de Von-Hippel-Lindau, síndrome de Sturge-Weber o esclerosis tuberosa41.
Por lo general, presenta manifestaciones clínicas y es unilateral. El 10% puede ser bilateral, maligno o extraadrenal, ubicándose a lo largo de la cadena ganglionar del sistema nervioso simpático15.
El diagnóstico de feocromocitoma depende de la detección de una masa suprarrenal con síntomas clínicos. El más frecuente es la hipertensión arterial acompañado de síntomas adrenérgicos y se confirma por alteraciones de laboratorio características. Un 20% de estos tumores no es detectado por el laboratorio y sólo el 10% es descubierto en forma incidental (aunque hay autores que hablan de hasta un 25%)4,42.
En la TC, la mayoría de las lesiones observadas son redondeadas, de bordes netos y con una atenuación similar a la de los tejidos blandos y lesiones malignas, y significativamente más alta que la de los adenomas adrenales. La atenuación media de los carcinomas de la corteza suprarrenal es de 39 ± 14 UH, la de los feocromocitomas de 44 ± 11 UH y la de los adenomas de 8 ± 18 UH43.
Las lesiones grandes suelen ser heterogéneas, necróticas o quísticas, y por lo general no funcionales. Se las llama «el gran simulador» por tener una presentación muy diversa en las imágenes.
Los valores de atenuación de las lesiones malignas y los feocromocitomas se incrementan después de la administración del medio de contraste intravenoso.
Las características del lavado son similares a las de las lesiones malignas y metástasis suprarrenales, tanto si el feocromocitoma es maligno como benigno15.
Tradicionalmente se pensaba que el uso del contraste intravenoso en la TC podía precipitar una crisis hipertensiva, pero el uso de medios no iónicos ha disminuido en forma importante este riesgo (tanto en nuestra casuística como en la bibliografía consultada). En nuestra experiencia y en coincidencia con otros autores, no hemos tenido efectos colaterales, como crisis hipertensivas41,45.
Entre los parámetros radiológicos de los feocromocitomas incidentales y sintomáticos no hay diferencia, pero ninguno de ellos presenta valores de atenuación menores de 10 UH en la TC sin contraste44.
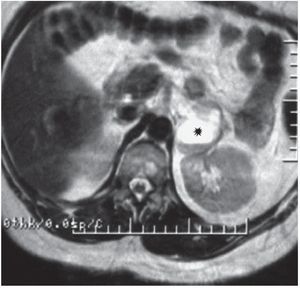
En la RM ponderada en T1 los feocromocitomas son isointensos con respecto al hígado, riñón y músculo41 y el 70% de las lesiones demuestra alta intensidad de señal en ponderación T2. Este hallazgo se considera característico de la patología y colabora en el diagnóstico de la enfermedad extraadrenal15 (fig. 9).
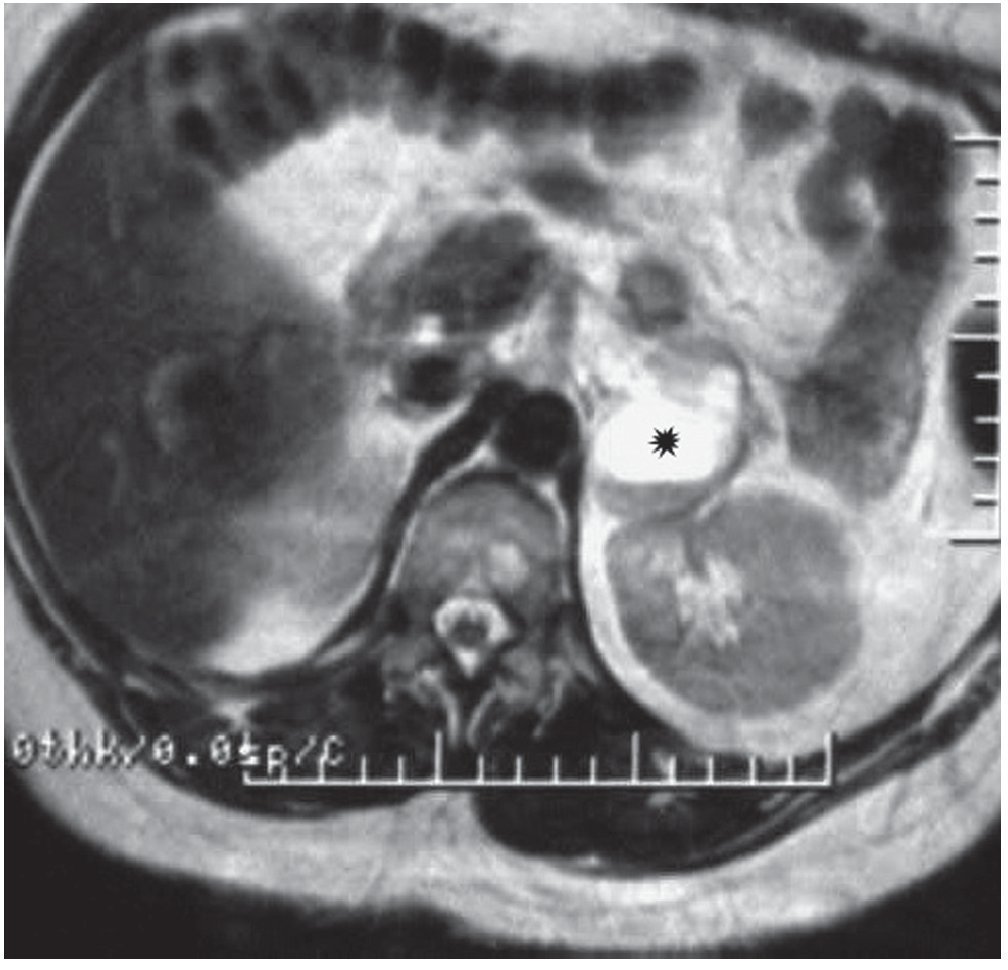
Figura 9. Paciente hipertensa con altos niveles de catecolamina y ácido vainillín mandélico. En la RM, secuencia ponderada en T2, se observó una lesión heterogénea con centro necrótico en la suprarrenal izquierda (asterisco). Diagnóstico anatomopatológico: feocromocitoma quístico en la suprarrenal izquierda.
Esta alta intensidad en ponderación T2 inicialmente se denominó «signo de la bombilla» y se consideró como una característica del feocromocitoma. Sin embargo, en la actualidad esto no es así debido a que al menos el 30% de estas lesiones muestra intensidad de señal moderada o baja en ponderación T2, con apariencia similar a otras patologías suprarrenales41,45.
Los feocromocitomas no suelen tener contenido lipídico significativo y, en general, suelen mantener su intensidad de señal en la fase de supresión grasa. De todos modos, puede haber excepciones, debido a la degeneración grasa que a veces se produce. La mayoría de las lesiones muestran realce intenso después de la inyección de contraste endovenoso41,44 (EV).
En la espectroscopia por RM se encontró un pico de colina de 6,8 ppm. Éste no se ve en los adenomas y se atribuye a la presencia de catecolaminas y sus metabolitos45.
Si bien la RM y la TC tienen alrededor de un 95% de sensibilidad y un 70% de especificidad para la detección de los feocromocitomas adrenales, la RM tiene mayor sensibilidad (90%) que la TC en la detección de las lesiones extraadrenales. Éstas se encuentran en un 97% en el abdomen, en un 2-3% en el tórax y en un 1% en el cuello41.
En estos casos la gammagrafía puede ser de gran ayuda en el diagnóstico, pues el yodo-123 MIBG o el yodo-131 se concentran en los feocromocitomas. Su uso también es útil en pacientes con una fuerte evidencia de tumor en los exámenes de laboratorio pero sin imagen tomográfica de la lesión y para la confirmación de un tumor extraadrenal o metastásico15,41.
La gammagrafía para el diagnóstico del feocromocitoma tiene casi un 100% de especificidad y un 95-100% de sensibilidad. No obstante, con la creciente disponibilidad del examen PET, su utilización ha disminuido45.
Los estudios de Shulkin45 demostraron que para la detección de los feocromocitomas benignos la sensibilidad de la gammagrafía con MIBG es del 83% y la del PET con FDG del 58%, mientras que para los malignos la gammagrafía tiene una sensibilidad del 88% y el PET del 82%. A pesar de que la MIBG mostró una mejor sensibilidad, todas las lesiones MIBG-negativas demostraron tener una captación ávida de FDG. Así, en el mencionado trabajo se concluyó que en la mayoría de los feocromocitomas se acumula FDG, aunque el porcentaje de captación es mayor en los malignos que en los benignos, y además los autores determinaron que el PET con FDG es especialmente útil para definir la distribución de los feocromocitomas en los que no se concentra MIBG.
Las imágenes de PET con fluorodopamina y carbono 11-hidroxiefedrina también han mostrado resultados iniciales prometedores para la detección y caracterización del feocromocitoma, ya que estos son captados tanto por los tumores benignos como por los malignos (si bien en estos últimos el aumento de captación es mayor)45.
Para los tumores de localización extraadrenal, los trazadores específicos para el sistema simpático, 11C-hidroxiefedrina (SUH) y 18F-dihidroxifenilalanina (18F-DOPA), están bajo investigación y han mostrado resultados promisorios45.
Hematomas
Los hematomas suprarrenales pueden ser de origen traumático (ocurren en contextos de traumatismos severos) o espontáneo. En el caso de los hematomas adrenales resultantes de traumas contundentes, estos se originan en la médula y se extienden a la corteza, manifestándose como lesiones redondas u ovoideas.
La lesión ocurre en un 90% de los casos del lado derecho. Esta localización ha sido atribuida a la compresión directa de la glándula por la columna vertebral y el hígado: se produce una rotura de las pequeñas venas perforantes de la cápsula adrenal, debido a la fuerza de desaceleración y al rápido aumento de la presión venosa intraadrenal, por la compresión de la vena cava inferior.
La TC sin contraste es el método de elección para la detección de la injuria adrenal, en especial en los hematomas. La presentación más común es el hematoma redondo u ovoide (83%), seguido de una hemorragia difusa e irregular que oblitera la glándula (9%) y el aumento uniforme del tamaño glandular (9%). La hemorragia periadrenal puede presentarse con una mala definición de los márgenes de la glándula, una infiltración periadrenal y el engrosamiento asimétrico de la crura diafragmática22,46.
Los hematomas varían en atenuación de acuerdo a su tiempo de evolución. Los agudos y subagudos muestran un aumento en los estudios sin contraste y alcanzan entre las 60 y 90 UH. En el seguimiento por TC, disminuyen en forma gradual su tamaño y atenuación, presentando un halo periférico hipodenso característico. Las calcificaciones se pueden desarrollar meses después de una hemorragia.
La RM es el método más sensible y específico para el diagnóstico de la hemorragia suprarrenal. Las características de las imágenes varían según el estadio del hematoma47-49.
Los espontáneos se asocian a la terapia anticoagulante o a situaciones de estrés causadas por procedimientos quirúr gicos, embarazo, sepsis, quemaduras o hipotensión. Mientras, los hematomas no traumáticos pueden ser uni o bilaterales, suelen ser redondos u ovoides, y puede haber una hemorragia periadrenal. La atenuación depende del tiempo de evolución del hematoma50-52.
Infecciones granulomatosas
La tuberculosis es la causa infecciosa más común de la enfermedad de Addison (10-30%). En la TC los hallazgos dependen del curso de la enfermedad o del grado de actividad del proceso inflamatorio. En períodos tempranos de la infección se observa una «adrenalitis», que consiste en un agrandamiento bilateral de la glándula con un área central de necrosis. Se evidencia con hipoatenuación y un anillo de realce periférico en los estudios de TC con contraste53.
En la etapa de curación las glándulas adrenales se calcifican y atrofian. En estos casos, la apariencia en la TC es similar a la de otras infecciones granulomatosas crónicas, hemorragias previas o calcificaciones idiopáticas22,40.
La histoplasmosis diseminada ocurre usualmente en áreas endémicas y en pacientes inmunocomprometidos por el virus de la inmunodeficiencia humana (VIH) o con neoplasias, linfomas, etc. Alrededor del 50% de los casos que presentan histoplasmosis diseminada desarrollan síndrome de Addison (si esta insuficiencia suprarrenal no se trata, es mortal). La TC revela un aumento bilateral y simétrico de las glándulas suprarrenales con hipoatenuación central y realce periférico con el contraste.
Con respecto a las glándulas adrenales afectadas, éstas pueden presentar distintos grados de calcificación, dependiendo del estadio de la infección.
El diagnóstico puede realizarse mediante punción aspiración con aguja fina bajo guía tomográfica y el patólogo debe ser advertido de la sospecha diagnóstica de una infección fúngica para utilizar las técnicas histológicas (Giemsa, PAS, Gomori-Grocott o hematoxilina-eosina), los cultivos (agar Sabouraud o micobiótico) o los métodos inmunológicos correctos54-57.
Tumores suprarrenales malignos
Carcinoma suprarrenal
El carcinoma adrenocortical (CAC) tiene preeminencia en la primera y cuarta década de la vida, y es más frecuente en la mujer (3:1). Representa el 0,02-0,2% de todas las muertes por cáncer y tiende a ser funcionante (50%). Produce más de una hormona esteroidea (glucocorticoides + mineralocorticoides o glucocorticoides + andrógenos), manifestándose como síndrome de Cushing, feminización, virilización o patrones mixtos (Cushing — virilización).
Los pacientes pueden presentarse con un cuadro clínico de hipertensión o con síntomas locales, como dolor, masa palpable o malestar gastrointestinal.
En general, los CAC son tumores de gran tamaño (mayores de 6 cm). Esta característica, asociada al crecimiento rápido y la aparición de metástasis, constituye un criterio de malignidad.
La incidencia de metástasis incrementa al 71%, si la lesión es mayor de 4 cm o crece dentro del año en el que se realizó su diagnóstico.
Ante una lesión de crecimiento rápido y cuando el paciente no tiene antecedentes de un tumor maligno primario en otra localización, se debe pensar en un CAC, ya que es poco probable que una lesión maligna no tratada permanezca estable más de 6 meses13,14.
En la TC sin contraste este tipo de carcinoma puede ser heterogéneo (debido a la presencia de zonas de necrosis) y su densidad suele ser superior a 30 UH. Luego de la inyección del contraste EV, realza en forma heterogénea, por lo general de manera periférica, con un fino anillo de realce capsular en algunos casos.
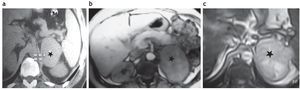
En la TC con tiempo de lavado, el porcentaje de lavado relativo (PLR) es menor del 40%. Sin embargo, el gran tamaño y el rápido crecimiento de la lesión son los indicadores más confiables para su diagnóstico (fig. 10a y 10b).
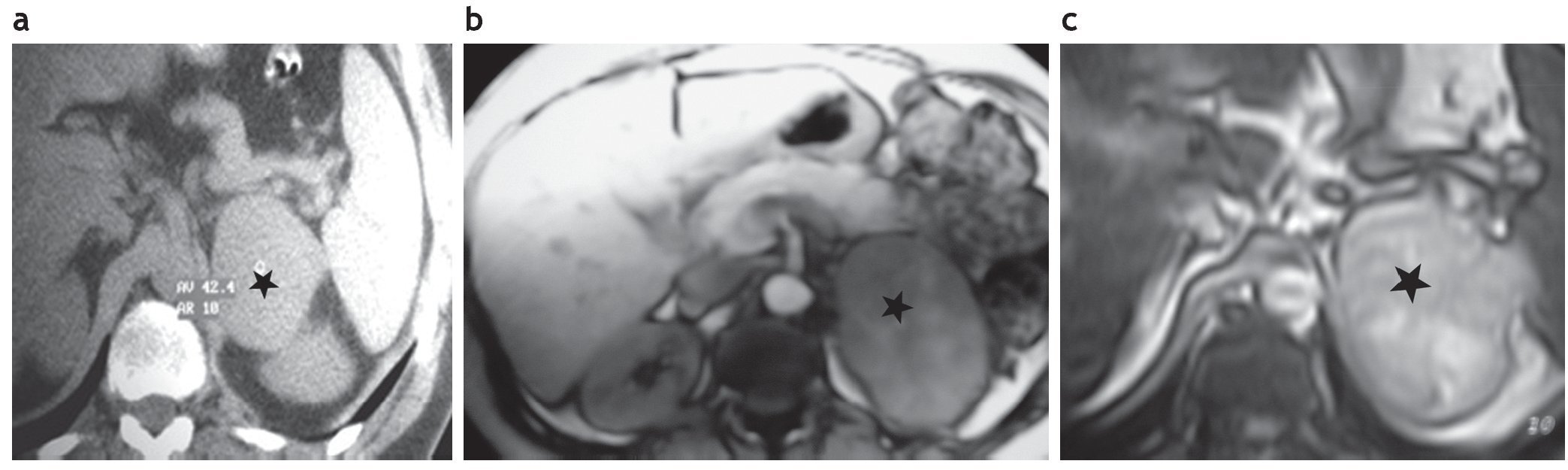
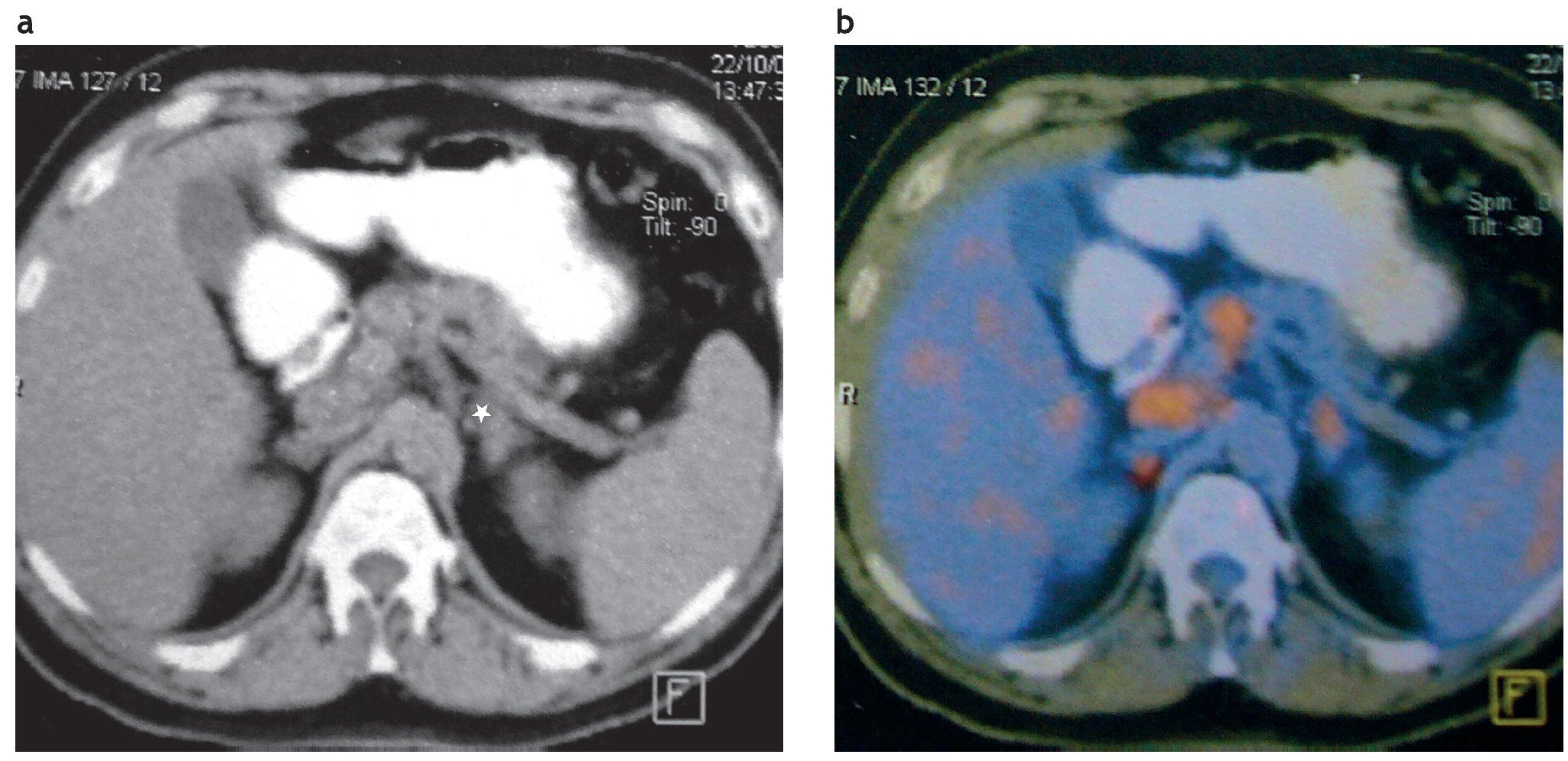
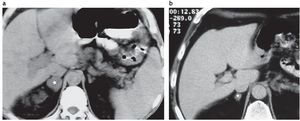
Figura 10. (a) Paciente de 42 años con disnea, irritabilidad, aumento de peso e hipertensión arterial de 6 meses de evolución. Examen físico: obesidad central, estrías rojo-vinosas de 2 meses de evolución en el abdomen. PA: 170/110. Lesión sólida en suprarrenal izquierda. En la TC sin contraste su densidad es de 42 UH, el tamaño de la lesión medido en la TC es de 6,4 cm × 6,9 cm (asterisco). (b) Mismo paciente: en la RM en secuencia ponderada en T1 con contraste se observa realce de la lesión (asterisco). (c) Mismo paciente, en la RM en secuencia de desplazamiento químico fuera de fase la lesión es hiperintensa con respecto al bazo, evidenciando la ausencia de contenido graso (asterisco). Diagnóstico anatomopatológico: carcinoma adrenocortical. Sobre vida del paciente: 8 meses.
En un 19-33% de los casos se identifican calcificaciones (en particular microcalcificaciones)16,43.
En la RM en secuencia de desplazamiento químico fuera de fase, los CAC se caracterizan, como todos los procesos malignos, por presentar un aspecto hiperintenso con respecto al bazo debido a la ausencia de grasa intracitoplasmática (fig. 10c).
El hígado es el órgano donde metastatiza con mayor frecuencia, pero existen otros sitios como el pulmón y los ganglios linfáticos, además de la extensión directa y la trombosis tumoral. La invasión de la vena cava inferior es una complicación conocida de este tumor y produce dolor abdominal, edema de miembros inferiores o embolia pulmonar.
La citología es de escaso valor, por lo que la punción biopsia percutánea con aguja fina (PAAF) no está indicada. Cuando los tumores de topografía adrenal son muy extensos, puede resultar dificultoso determinar su origen.
El estudio FDG-PET/TC es un método muy efectivo para categorizar y estadificar los CAC por su marcada avidez por la FDG, así como también resulta eficaz para detectar sus metástasis en el 30% de los pacientes. El uso de este examen modifica el manejo del protocolo en el 20% de los pacientes22,58.
El único tratamiento factible es el quirúrgico, cuando la lesión es pequeña y no se detectan metástasis. El pronóstico es muy malo (0% de supervivencia a los 5 años).
Feocromocitoma maligno
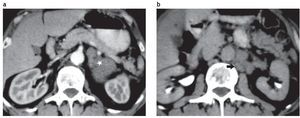
Es más frecuente en los síndromes familiares de MEN II y tumores múltiples. Se caracteriza por la invasión de la cápsula adrenal, el pedículo vascular y las metástasis en los ganglios adyacentes retroperitoneales, el hígado y el hueso (fig. 11).
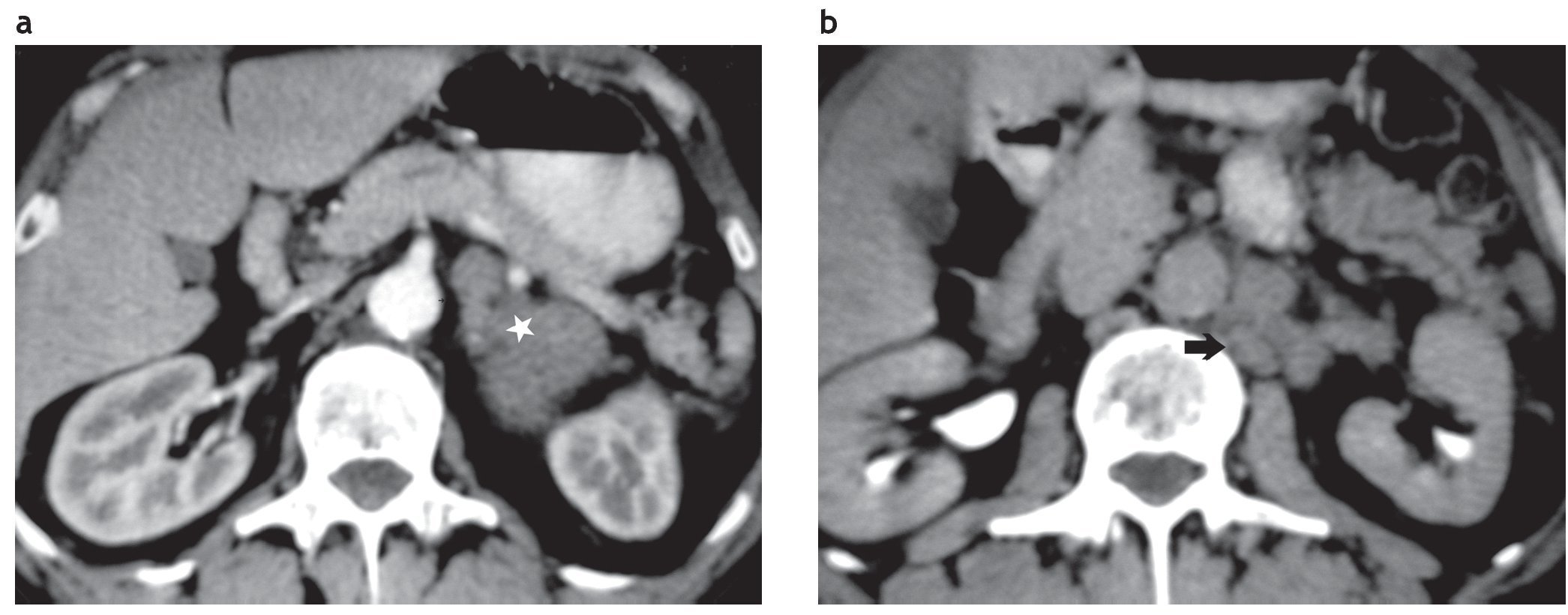
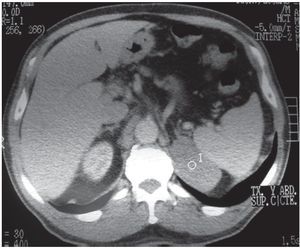
Figura 11. (a) Paciente hipertenso con altos niveles de catecolaminas. Lesión suprarrenal izquierda de 5,3 cm de diámetro, con densidad de 37 UH en la TC sin contraste (no se muestra) y escaso realce en la TC contrastada (asterisco). Su borde interno es irregular. (b) Mismo paciente. En el retroperitoneo látero-aórtico se observan adenomegalias interpretadas como metástasis (flecha). Diagnóstico anatomopatológico: feocromocitoma maligno con metástasis en los ganglios regionales.
Las imágenes de PET/TC con FDG, fluorodopamina y carbono 11-hidroxiefedrina también han mostrado resultados iniciales prometedores para la detección y caracterización de los feocromocitomas, debido a que son captados tanto por los tumores benignos como malignos (la intensidad de captación es mayor en estos últimos)7. De todos modos, lo único que confirma la existencia de un feocromocitoma maligno es la presencia de metástasis.
Los estudios de Shulkin sostienen que para la detección de los feocromocitomas benignos la sensibilidad de la gammagrafía con MIBG es del 83% y la del PET con FDG del 58%. En el caso de los malignos, la gammagrafía tiene una sensibilidad del 88% y el PET del 82%.
Ciertas drogas —como el labetalol, los bloqueantes cálcicos, algunos antidepresivos o los ansiolíticos, entre otros— pueden inhibir el fenómeno de captación de MIBG, por lo que deben suspenderse al menos una semana antes de la realización del estudio.
A pesar de que la MIBG tiene una mayor sensibilidad, todas las lesiones MIBG-negativas demostraron tener una captación ávida de FDG. Por ello, Shulkin concluye que en la mayoría de los feocromocitomas se acumula FDG, aunque la captación se encuentra en un mayor porcentaje de tumores malignos que benignos, y que el PET con FDG es útil para definir la distribución de los feocromocitomas en los que no se concentra la MIBG45.
Para los tumores de localización extraadrenal los trazadores específicos para el sistema simpático, 11C-hidroxiefedrina (SUH) y 18F-DOPA están bajo investigación y han mostrado resultados prometedores45.
Linfoma
El linfoma no Hodgkin presenta localizaciones extralinfáticas con mayor frecuencia que el linfoma Hodgkin.
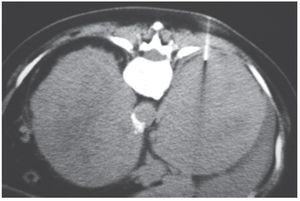
La glándula suprarrenal puede ser una localización primaria o secundaria del linfoma no Hodgkin. La forma prima ria es mucho menos frecuente que la secundaria y, en general, es bilateral16 (fig. 12). En esos casos puede estar comprometida la función suprarrenal con el desencadenamiento de una insuficiencia suprarrenal aguda, por lo que debe evaluarse con cortisolemia basal y posestímulo con hormona adrenocorticotrófica (ACTH).
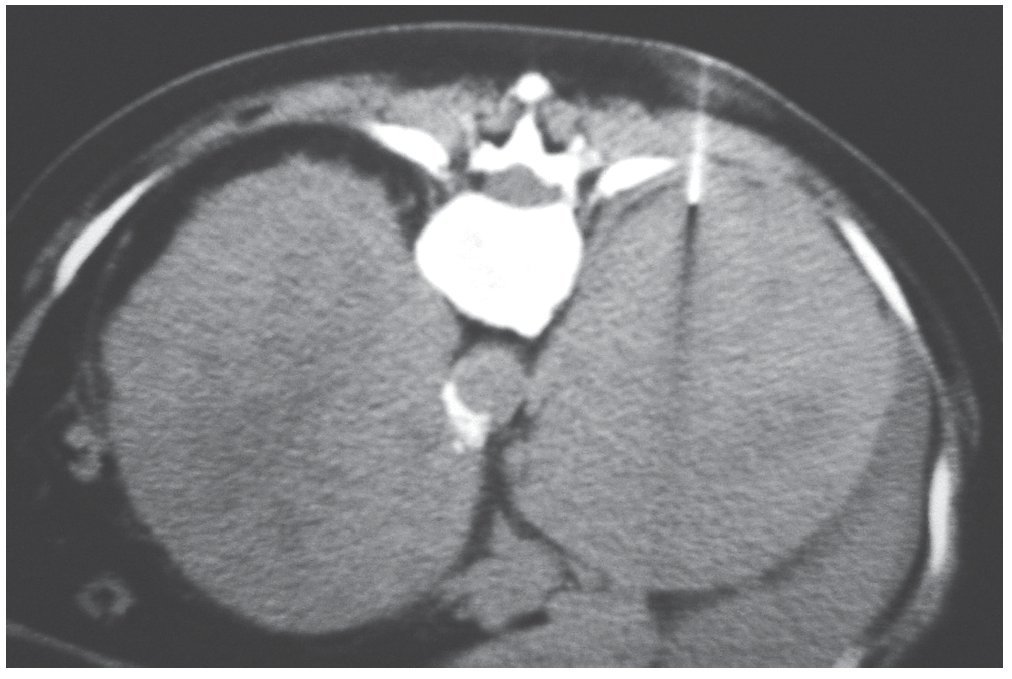
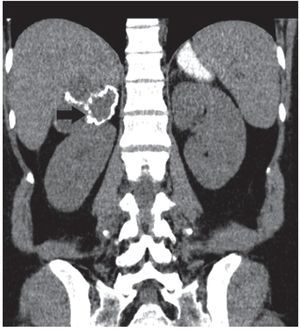
Figura 12. Paciente de sexo femenino de 62 años con disminución de peso y febrículas nocturnas. En la TC de abdomen sin contraste se observan formaciones suprarrenales bilaterales de 12 cm de diámetro anteroposterior. Su densidad es de 38 UH (derecha) y 41 UH (izquierda). Se realizó PAAF con el diagnóstico presuntivo de metástasis. La anatomía patológica reveló un linfoma primario a células B bilateral.
Un tercio de los pacientes con linfoma no Hodgkin presenta una extensión extranodal en el momento de su presentación, siendo mucho más frecuente la forma difusa que la nodular.
Es habitual que el linfoma suprarrenal responda al tratamiento de la misma forma que las otras localizaciones extraadrenales (fig. 13). Si hay falta de respuesta al tratamiento de una masa adrenal en un paciente con linfoma no Hodgkin cuando las localizaciones extraadrenales reducen su tamaño, se debe pensar en otra patología19.
Figura 13. (a) Paciente con un linfoma no Hodgkin y un nódulo suprarrenal derecho (asterisco). (b) Mismo paciente: el tratamiento instituido disminuyó el tamaño de las lesiones torácicas, abdominales y la suprarrenal (asterisco).
Según la literatura, el 4% de los casos de linfoma no Hodgkin presenta un linfoma adrenal secundario (de los cuales el 43% es bilateral). En las autopsias el 25% de los pacientes con linfoma no Hodgkin ha tenido una infiltración adrenal59,60.
Los linfomas primarios y secundarios son hipermetabólicos. Por este motivo, el examen FDG-PET/TC es muy útil en su diagnóstico, estadificación y evaluación de la respuesta al tratamiento.
Metástasis
Es muy importante reconocer el aspecto y tamaño de las glándulas suprarrenales cuando se estudia a los pacientes con cáncer. Los tumores primarios que metastatizan con mayor frecuencia en la glándula suprarrenal son: el cáncer de pulmón, mama y estómago, el melanoma y el linfoma. Los pacientes con linfoma, cáncer colorrectal, de estómago o próstata pueden desarrollar metástasis adrenales hasta 5 años después del diagnóstico de su tumor primario19.
El 56% de las lesiones secundarias corresponde a adenocarcinomas y el 15% a carcinomas de células escamosas. El resto está constituido por tumores hematopoyéticos, sarcomas y melanomas.
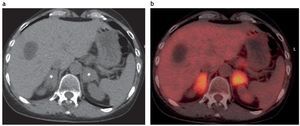
Las metástasis en el 50% de los casos son bilaterales y pre sentan una atenuación mucho mayor que los adenomas en los cortes de TC sin contraste (> 30 UH). En el tiempo de lavado las metástasis lavan < del 60% en el porcentaje de lavado absoluto (PLA) y < 40% en el PLR19,23,25, y son hipermetabólicas en el FDG-PET/TC con un standard uptake value (SUV) superior al del hígado (fig. 14).
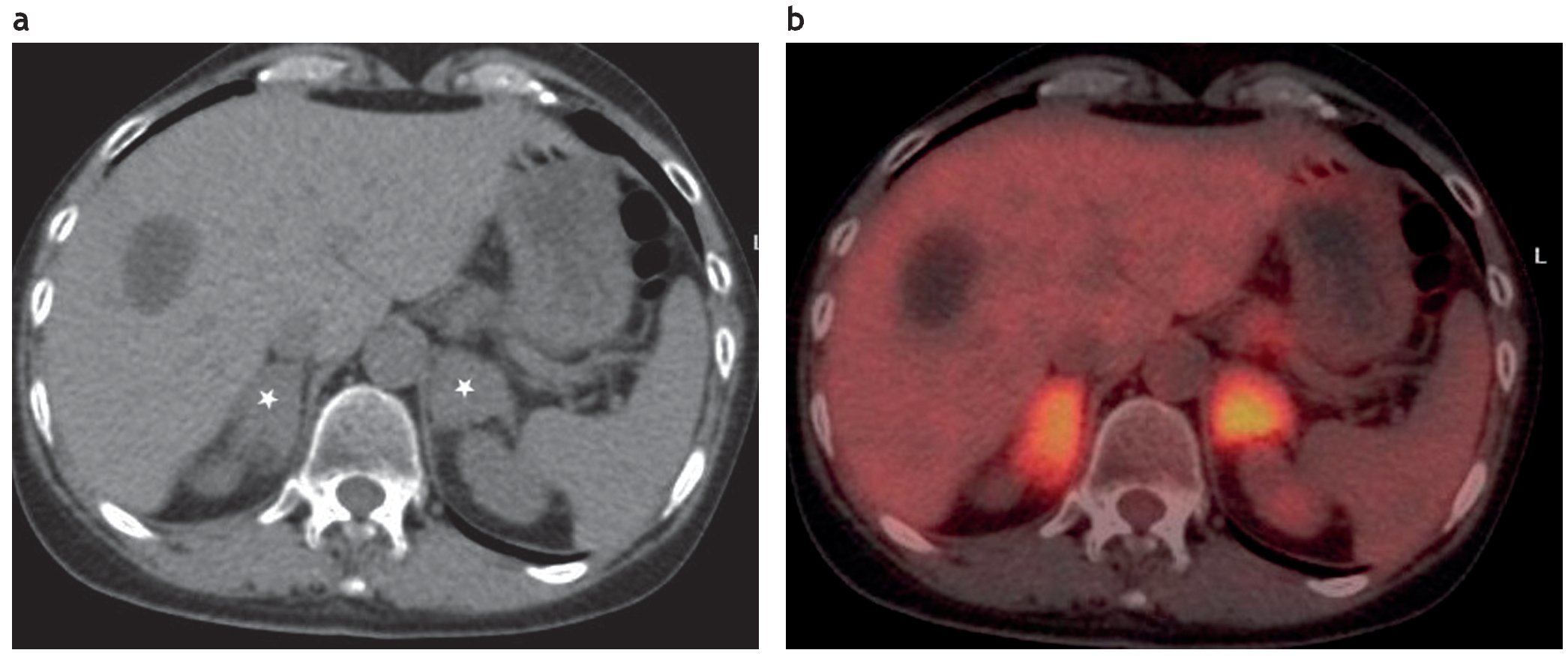
Figura 14. (a) Paciente con lesión primaria en el pulmón. En la estadificacion se evidencia un quiste hepático y formaciones sólidas, con densidad mayor de 28 UH en ambas suprarrenales (asteriscos). (b) El examen FDG-PET/TC reveló lesiones hipermetabólicas bilaterales, compatibles con metástasis. (Agradecimiento al Dr. Christian González, Gabriel Bruno y Yamila Blumenkrantz, Fundación Diagnóstico Nuclear).
Las metástasis hipervasculares se impregnan en forma similar a los feocromocitomas, en particular el hipernefroma.
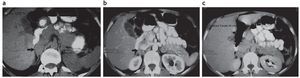
En el caso de una lesión primaria conocida, la disminución del porcentaje de lavado en la TC contrastada (PLA < 60% y PLR < 40 %), acompañada de una intensidad de señal igual o mayor a la esplénica en la RM (secuencia de desplazamiento químico fuera de fase), inclina al diagnóstico de metástasis (fig. 15).
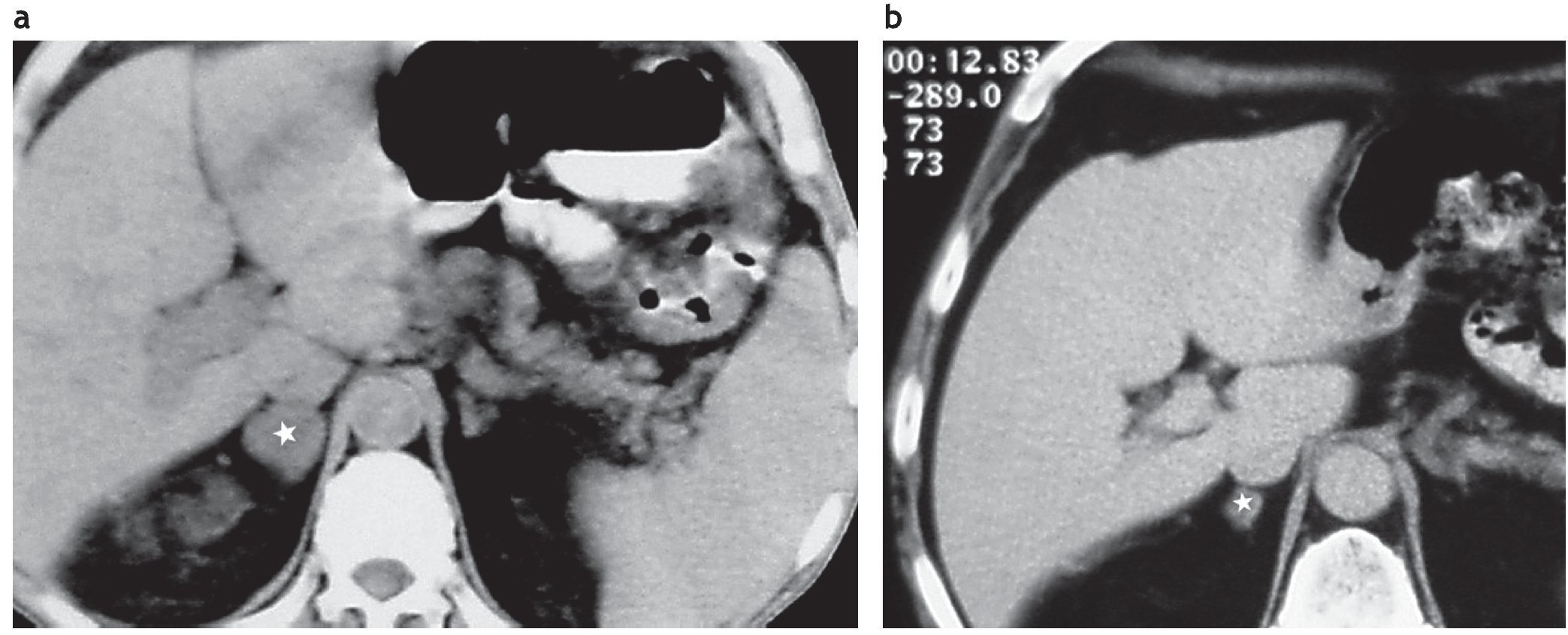
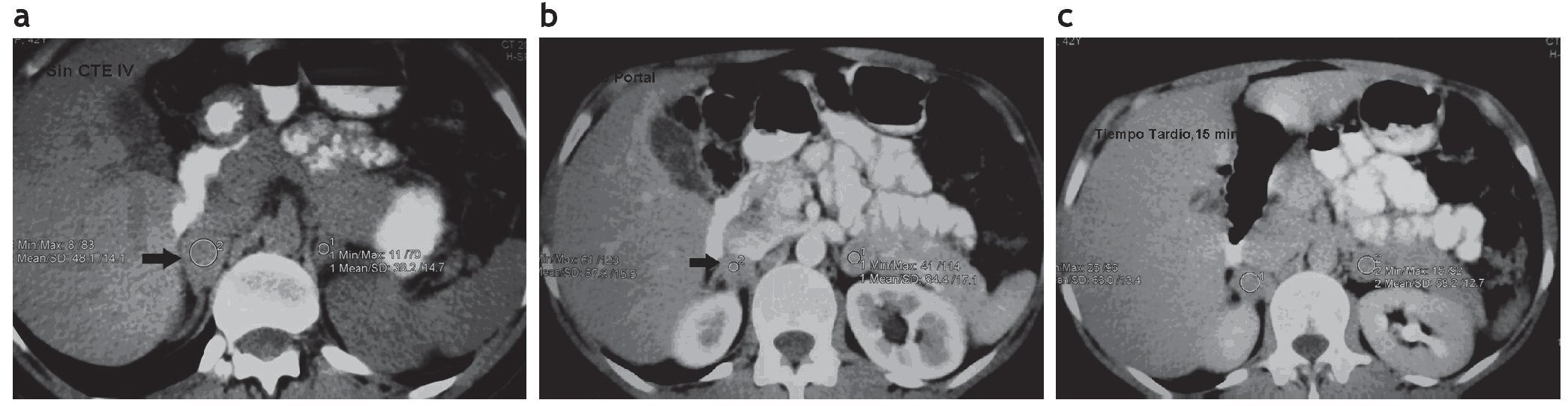
Figura 15. (a) Paciente con cáncer de pulmón. TC de suprarrenales sin contrate IV. La lesión suprarrenal derecha tiene una densidad de 48,1 UH y la izquierda de 38,2 UH (flecha). (b) y (c) Con contraste intravenoso y tiempo de lavado, se evidencia un lavado inferior al 60% en las lesiones bilaterales (flecha). Diagnóstico: metástasis suprarrenales bilaterales.
El examen FDG-PET/TC es de suma utilidad para detectar metástasis hipermetabólicas. La presencia de una necrosis central puede determinar falsos negativos, como así también las metástasis menores de 1 cm o las del carcinoma bronquioloalveolar, carcinoides, tumores mucinosos e hipernefromas10,59,60.
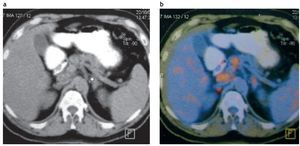
Debemos tener presente que el 50% de las lesiones suprarrenales en un paciente con un tumor primario son benignas, por lo que la lesión debe ser muy bien caracterizada antes de indicarse una biopsia10 (fig. 16).
Figura 16. (a) Paciente con linfoma no Hodgkin y una lesión suprarrenal izquierda (asterisco). (b) Mismo paciente. El estudio FDG-PET/TC demostró un bajo nivel hipermetabólico de la lesión suprarrenal, similar al hígado. El seguimiento evidenció una ausencia de crecimiento de la lesión a los 24 meses. Diagnóstico: adenoma suprarrenal no funcionante.
La PAAF sólo debe llevarse a cabo ante la sospecha de una metástasis (si la clínica y las imágenes no son concluyentes o si el tumor primario es de origen desconocido), pero no hay que practicarla ante la sospecha de un CAC, ya que éste repite la histología de la glándula y, por lo tanto, no resulta de utilidad diagnóstica.
Conclusión
El pequeño tamaño de la glándula suprarrenal no refleja su importancia fundamental en la medicina. Las imágenes, en este sentido, juegan un rol decisivo en la detección y caracterización de su patología.
Las técnicas imagenológicas que tenemos a nuestro alcance en la actualidad nos permiten realizar el diagnóstico diferencial entre una imagen compatible con una lesión benigna o maligna. Además, es de destacar el valor del trabajo en equipo, pues el aporte del endocrinólogo y del laboratorio nos permite determinar si la lesión es funcionante o no.
La utilización de un algoritmo diagnóstico facilita la caracterización de la lesión en el menor tiempo posible, disminuye la irradiación del paciente, optimiza los recursos al evitar repeticiones o estudios innecesarios y permite planificar el tratamiento.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses, excepto la Dra. Binda que declara como posible conflicto de interés ser editora asociada de la RAR.
qContinuación de la RAR. 2013;77(3):218-25.
Recibido octubre de 2012;
aceptado julio de 2013
http://dx.doi.org/10.7811/rarv77n4a03
* Autor para correspondencia.
Correo electrónico:bindadavila@hotmail.com (M.C. Binda).