La esclerosis tuberosa es una enfermedad neurocutánea, caracterizada por la aparición de una tríada clínica (tríada de Vogt): retraso mental, convulsiones y lesiones cutáneas (adenoma sebáceo). Presenta hallazgos intracraneanos típicos que permiten orientar su diagnóstico.
El presente artículo tiene como propósito mencionar, describir y dar ejemplos de los hallazgos intracraneanos característicos de la esclerosis tuberosa, utilizando imágenes provenientes de nuestra casuística.
Tuberous sclerosis is a neurocutaneous disease characterized by the clinical triad (Vogt triad) of mental deficiencies, seizures and skin lesions (sebaceous adenoma). It is also characterized by typical intracranial findings that lead to its diagnosis.
This article is an iconographic essay that will describe and give examples of findings characteristic of intracranial tuberous sclerosis using illustrations from our experience.
Introducción
Este ensayo iconográfico tiene como propósito mencionar, describir y dar ejemplos de los hallazgos intracraneanos característicos de la esclerosis tuberosa (ET), utilizando imágenes provenientes de nuestra casuística.
La ET es un síndrome neurocutáneo que fue descrito por Bourneville en 18801 (por ello, también se la conoce como enfermedad de Bourneville). Es una entidad de herencia autosómica dominante, en la cual existe una mutación o deleción de dos genes: uno, localizado en el cromosoma 9, que se llama TSA 1 o CET 1; y otro, ubicado en el cromosoma 16, que se denomina TSA 2 o CET 22.
Esta enfermedad neurocutánea se caracteriza por la presencia de una tríada clínica (tríada de Vogt) compuesta por: retraso mental, convulsiones y lesiones cutáneas (adenoma sebáceo o también llamado angiofibroma facial). Los tres síntomas se encuentran en el 30% de los casos.
El diagnóstico del complejo de esclerosis tuberosa (CET) es clínico y para su detección se utilizan criterios mayores y menores3 (tabla 1). Teniendo en cuenta estos parámetros, se establece que el diagnóstico clínico es:
• Definitivo: cuando se presentan dos criterios mayores o un criterio mayor y dos criterios menores.
• Probable: cuando existe un criterio mayor y uno menor.
• Posible: cuando se observa un criterio mayor o dos o más criterios menores.
En nuestro trabajo solo se detallan los hallazgos intracraneanos.
Dentro de los signos y síntomas neurológicos, las crisis convulsivas son las más frecuentes (82%). Estas pueden ser de cualquier tipo, excepto del denominado petit mal (ausencias).
En lo que respecta al retraso mental, este ocurre en el 48% de los casos y es posible que llegue a ser muy severo, principalmente en los pacientes que comenzaron con crisis convulsivas a una edad muy temprana. Existe una correlación entre el número y volumen de los túberes corticales, la edad de inicio de las convulsiones y el grado de retraso mental: cuanto antes aparecen los túberes corticales, más temprano comienzan las crisis convulsivas y, por ende, mayor es el retraso mental del paciente. El número y la localización anatómica de los túberes corticales pueden jugar un rol importante en el desarrollo del retraso mental4.
De todos modos, existen individuos con ET que nunca tuvieron una crisis y que su coeficiente intelectual es normal, así como también pueden presentarse otros hallazgos neurológicos, como hiperactividad, trastornos de conducta, autismo y déficit en la atención.
Desarrollo
La principal anormalidad cerebral en la ET está relacionada con las células germinales displásicas, las cuales originan neuronas y células displásicas de la glía. Estas células no pueden diferenciarse, migrar u organizarse de manera adecuada5.
Hamartomas subependimarios
También llamados nódulos subependimarios, estos hamartomas son pequeñas lesiones que histológicamente contienen células gigantes con características de neuronas y astrocitos. Se ubican en la pared de los ventrículos laterales y su aspecto en la tomografía computada (TC) y resonancia magnética (RM) cambia según la edad del paciente. Su tamaño es variable, pero no mayor de los 10 mm de diámetro.
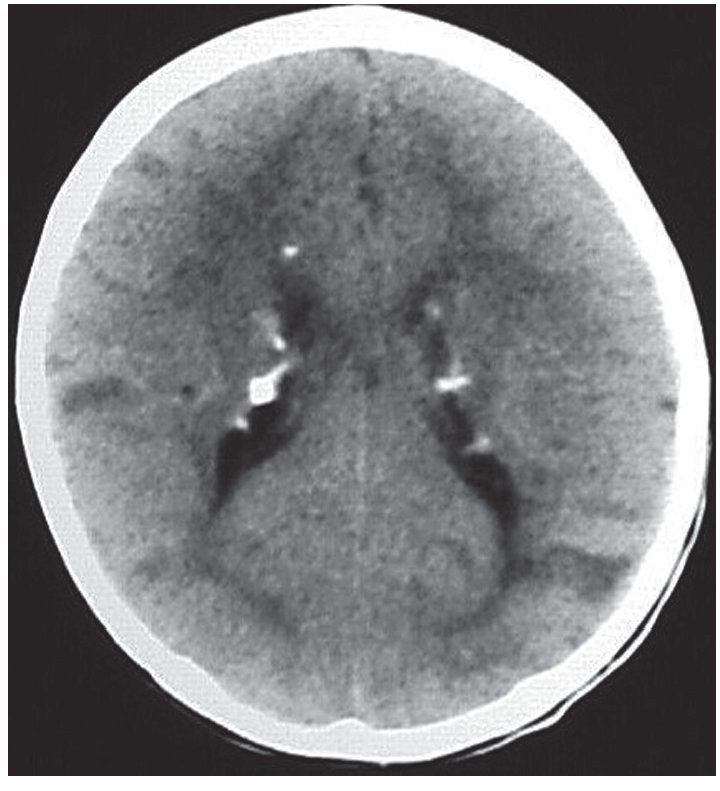
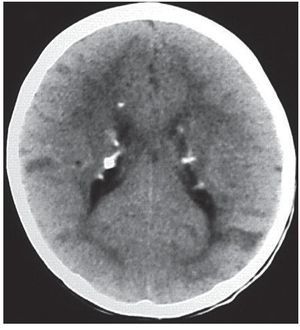
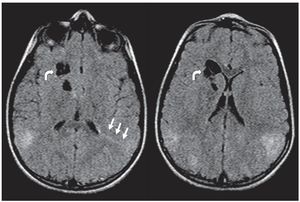
En la TC son isodensos con respecto a la sustancia blanca, pero en pacientes mayores pueden calcificarse y ser hiperdensos (fig. 1). Si bien los hamartomas se calcifican progresivamente durante las dos primeras décadas de la vida, difícilmente se encuentre un nódulo calcificado en menores de 1 año. En cuanto a su ubicación, los hamartomas se proyectan hacia los ventrículos laterales o están «sumergidos» en los márgenes de los núcleos caudados. En el 95% de los casos, son bilaterales.
Figura 1. Tomografía computada, corte axial, de un paciente de sexo masculino de 1 año de edad. Se identifican imágenes nodulillares hiperdensas y calcificadas, de localización subependimaria, compatibles con hamartomas subependimarios, e imágenes hipo densas corticales compatibles con túberes.
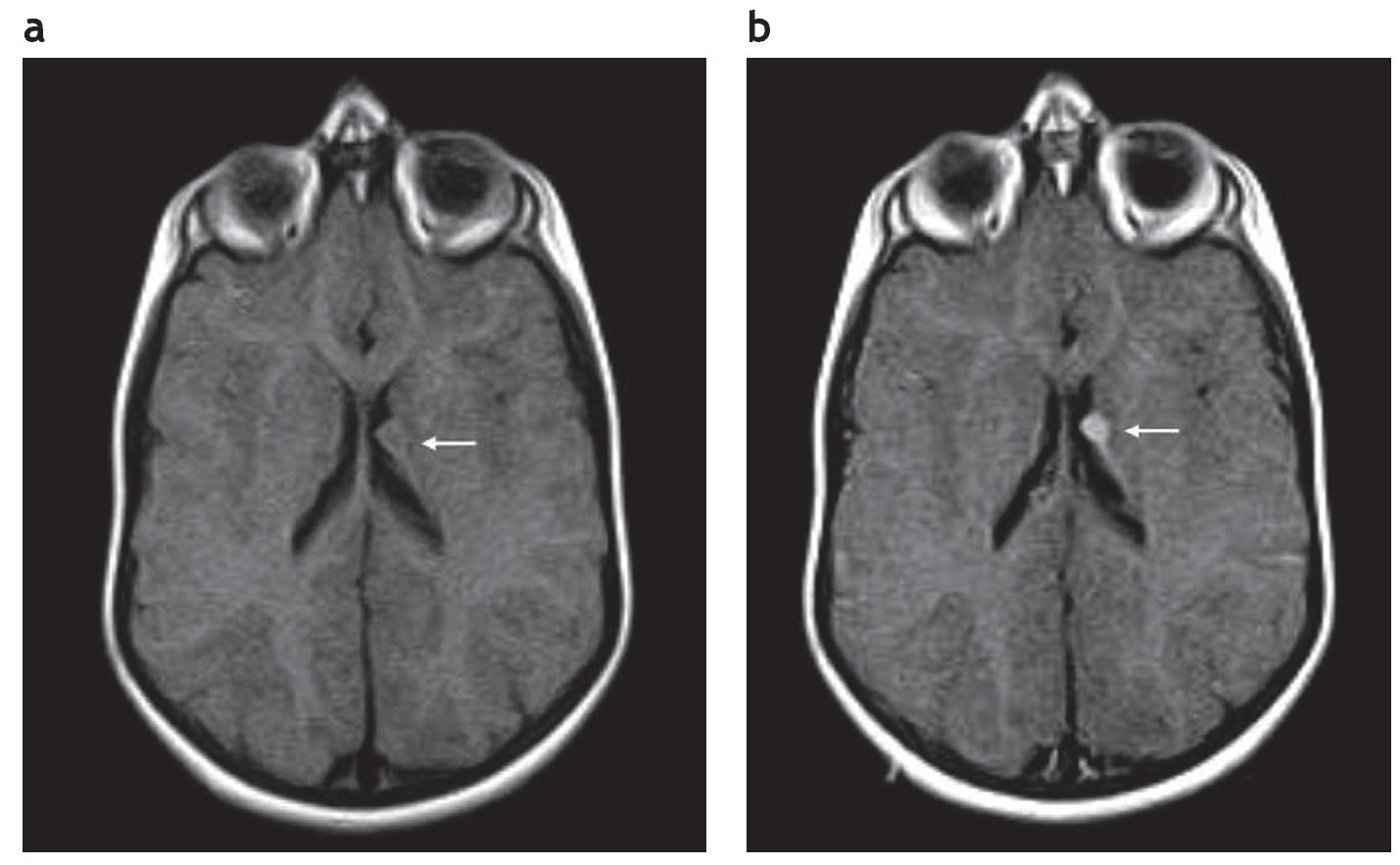
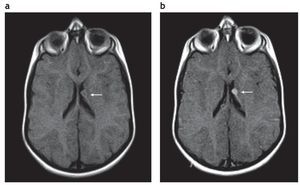
En la RM los hamartomas subependimarios de los recién nacidos son ligeramente hiperintensos en ponderación T1 con respecto a la sustancia blanca y de intensidad heterogénea en ponderación T2, debido a la hipomielinización de la sustancia blanca. A medida que ocurre la mielinización, los nódulos se tornan isointensos en ponderación T1 y T2 en relación con esta. Si se calcifican, son marcadamente hipointensos en secuencias de eco de gradiente (GRE). La captación poscontraste paramagnético es variable (fig. 2), siendo más frecuente la ausencia de realce1,2.
Figura 2. Resonancia magnética, plano axial en ponderación T1 (a) sin contraste y (b) con gadolinio, de un paciente de sexo masculino de 2 años de edad que presenta un hamartoma subependimario que realza poscontraste (flecha).
Astrocitomas subependimarios
Los astrocitomas subependimarios de células gigantes son tumores histológicamente benignos, formados por células gigantes que presentan características de astrocitos y neuronas. La edad de aparición es entre los 8 y 18 años, y su localización típica es cerca de los agujeros de Monro. Pueden provocar hidrocefalia obstructiva.
En comparación con los hamartomas subependimarios, los astrocitomas son más grandes y tienden a crecer lentamente. Su diagnóstico y seguimiento es importante, ya que si crecen y provocan hidrocefalia obstructiva, pueden tener indicación quirúrgica.
En la TC y RM son similares a los hamartomas subependimarios. A pesar de tener un mayor tamaño, suelen realzar en el poscontraste paramagnético y pueden calcificarse y presentar sangrados.
El diagnóstico diferencial con los hamartomas subependimarios está determinado por el «control evolutivo», dado que los astrocitomas subependimarios crecen y los hamartomas no1,2.
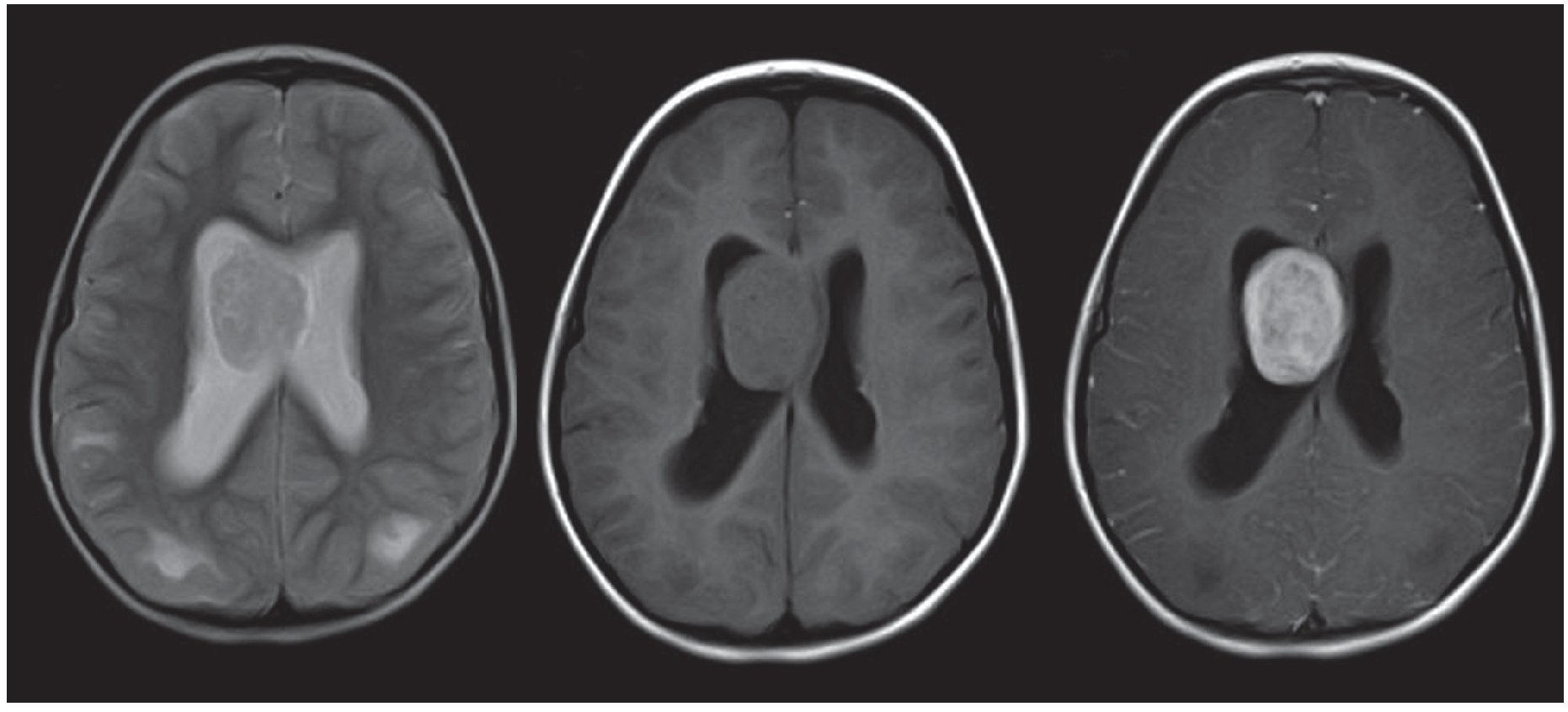
Los astrocitomas subependimarios también pueden identificarse como grandes masas intraventriculares heterogéneas que realzan poscontraste endovenoso (fig. 3).
Figura 3. Resonancia magnética, corte axial, de una paciente de 7 años de edad. Se observa una masa voluminosa intraventricular, ovoidea y sólida, ubicada en el ventrículo lateral derecho. Es hiperintensa en ponderación T2, isointensa en ponderación T1 y realza en forma significativa luego de la administración del contraste paramagnético. La imagen resulta compatible con un astrocitoma subependimario de células gigantes.
Túberes corticales
Los túberes corticales son lesiones hamartomatosas benignas que rara vez malignizan. Pueden ser únicos o múltiples (más frecuente) y el sitio más común de aparición es en los lóbulos frontales, seguido de los lóbulos parietales, occipitales y temporales (en orden decreciente). Histológicamente están compuestos por células gigantes bizarras, gliosis fibrilar densa y bandas de mielina desordenada.
En la TC los túberes se evidencian hiperdensos en los recién nacidos y lactantes, mientras que los espacios subaracnoideos adyacentes suelen estar ensanchados. No obstante, con el paso de los años se tornan hipodensos. También pueden calcificarse.
En la RM, en los primeros años de vida los túberes corticales son ligeramente hiperintensos en secuencias ponderadas en T1 con respecto a la sustancia blanca e hipointensos en ponderación T2. A medida que el encéfalo se mieliniza, se tornan iso-hipointensos en ponderación T1 e hiperintensos en ponderación T2. La secuencia FLAIR, por su parte, posee una sensibilidad aumentada en el diagnóstico de los túberes corticales, tanto en niños como en adultos. Las imágenes se identifican como hiperintensas y presentan límites difusos en el sitio donde se encuentran las lesiones1,2. Cuando los túberes se calcifican, suelen verse hipointensos en la secuencia GRE y levemente hiperintensos en ponderación T1.
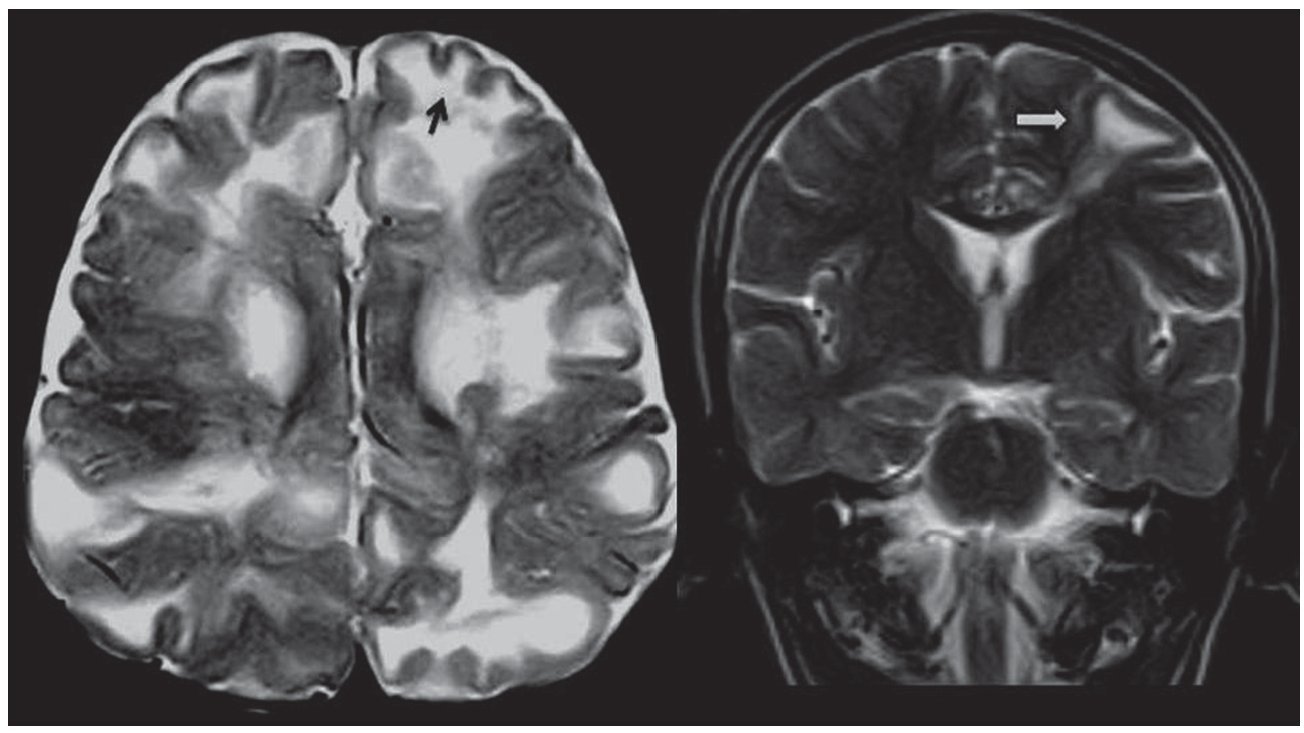
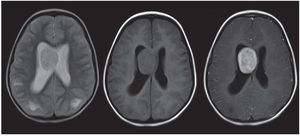
Algunos autores diferencian a los túberes corticales en 2 tipos (fig. 4): gyral core y sulcal island6-8. El gyral core (signo del centro del giro) es una lesión hiperintensa en ponderación T2 e hipointensa en ponderación T1, que se encuentra en el centro de una circunvolución expandida (ensanchada), cuya corteza es de espesor normal. Por otro lado, el sulcal island (signo de la isla de surcos) es una lesión en la cual la sustancia blanca subcortical es hiperintensa en ponderación T2 e iso-hipointensa en ponderación T1 y compromete dos circunvoluciones adyacentes. Su corteza es de espesor conservado.
Figura 4. Túberes corticales. En el plano axial en ponderación T2, se observa una lesión en la sustancia blanca subcortical frontal izquierda hiperintensa que compromete dos circunvoluciones adyacentes y se denomina sulcal island (flecha negra). En el plano coronal en ponderación T2, se evidencia una lesión hiperintensa, localizada en el centro de una circunvolución expandida, que se llama gyral core (flecha blanca).
En el cerebelo también pueden existir túberes de similares características a los identificados a nivel supratentorial. Estos son hiperintensos en ponderación T2 e iso-hipointensos en ponderación T1. Según diversas series, se presentan en el 10-24,1% de los casos9.
Quistes parenquimatosos
Si bien estas lesiones suelen localizarse en cualquier sitio, se encuentran con mayor frecuencia en la sustancia blanca periventricular. Su importancia clínica es desconocida2.
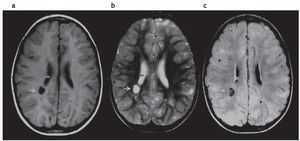
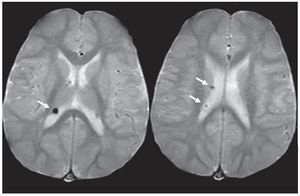
En la TC se identifican como imágenes hipodensas redondeadas y en la RM se observan como imágenes hiperintesas en ponderación T2 e hipointensas en ponderación T1 y FLAIR (fig. 5).
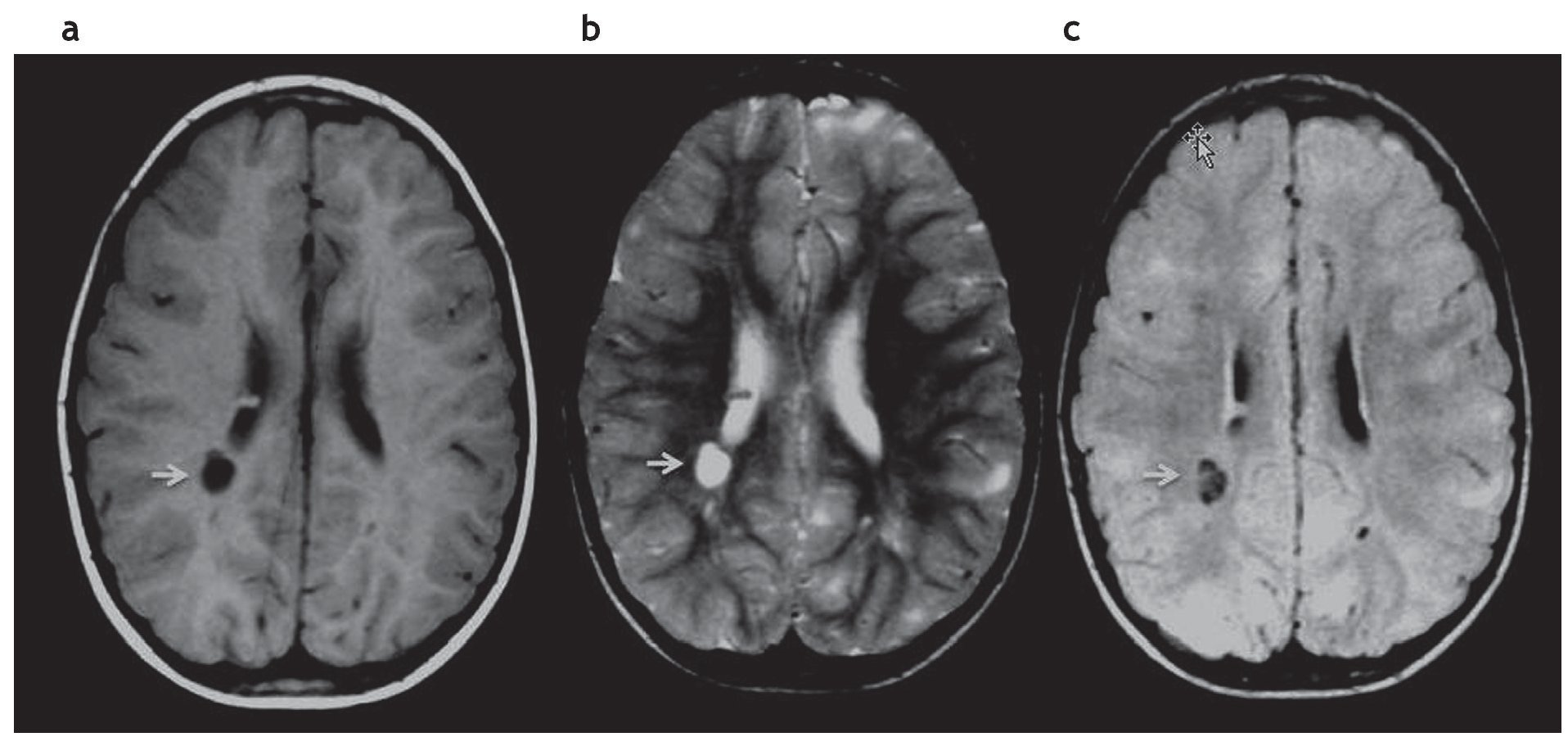
Figura 5. Quiste parenquimatoso. Imagen quística (b) hiperintensa en ponderación T2 e hipointensa en (a) ponderación T1 y (c) FLAIR, ubicada en la sustancia blanca periventricular, adyacente a la prolongación occipital del ventrículo lateral derecho (flechas).
Hamartomas de sustancia blanca
Estas lesiones están formadas por células gigantes, cuyo volumen es 5-10 veces más grande que el de los astrocitos. Tienen características de neuronas y células de la glía.
Su tamaño es variable. Mientras las pequeñas son lesiones de tipo puntiforme, hiperintensas en ponderación T2 y FLAIR, las grandes presentan diversos aspectos: pueden ser lineales, tener forma de cuñas o integrar un conglomerado. Sin embargo, la presentación más habitual es el patrón lineal, que se extiende desde la región periventricular hasta la corteza y se denomina «líneas de migración radial».
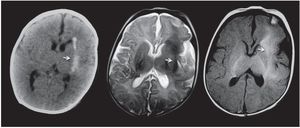
En la TC pueden ser levemente hipodensas y también suelen calcificarse (fig. 6), mientras que en la RM se identifican como imágenes hiperintensas en ponderación T2 y FLAIR (figs. 7 y 8). Rara vez realzan poscontraste.
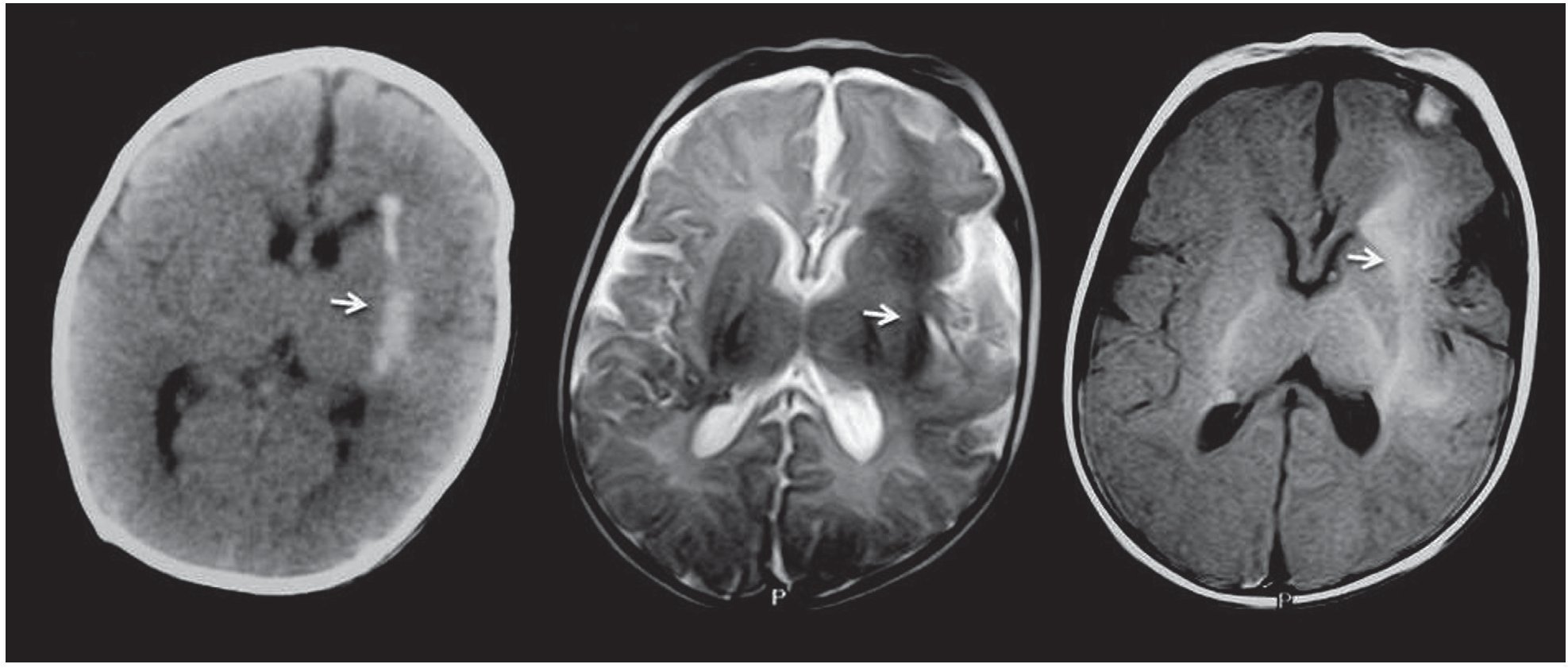
Figura 6. Hamartomas de sustancia blanca. Tomografía computada y resonancia magnética de un paciente de 2 meses de edad que presenta una lesión en la sustancia blanca, ubicada en la cápsula externa izquierda (flechas). En la tomografía computada se constata que la lesión es hiperdensa en correlación con la calcificación, mientras que en la resonancia magnética es hipointensa en ponderación T2 e hiperintensa en ponderación T1.
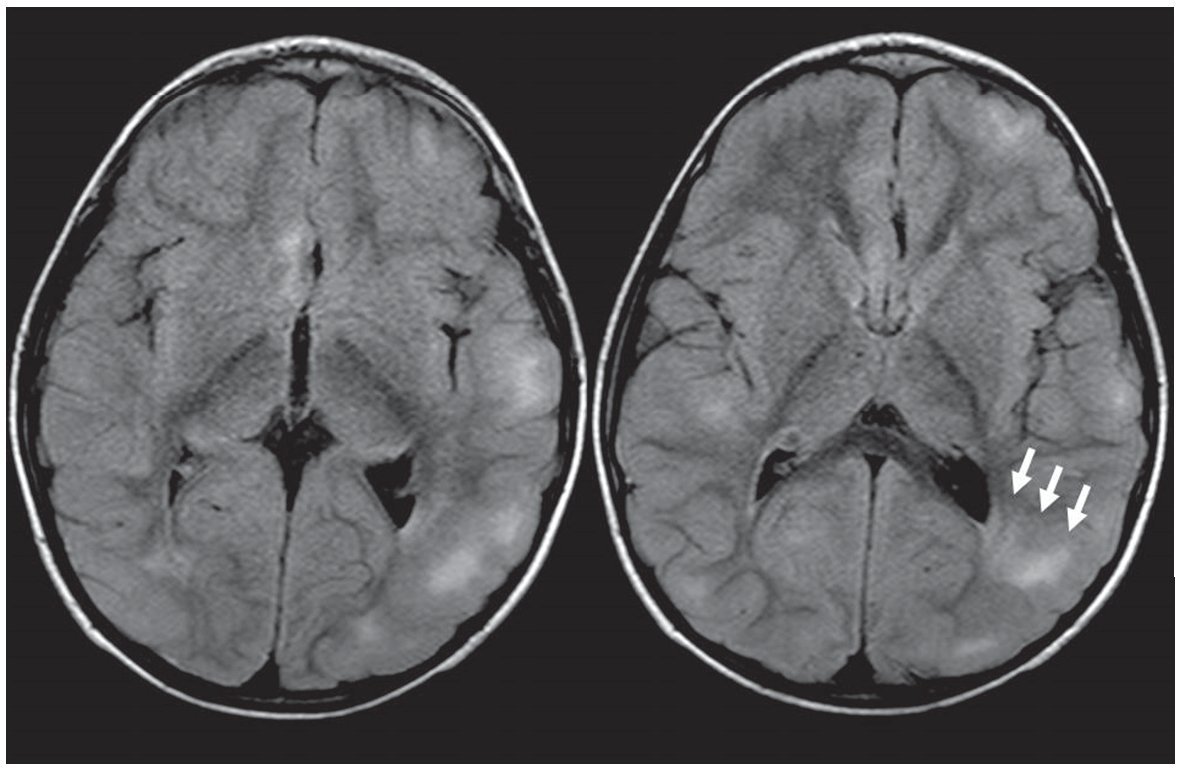
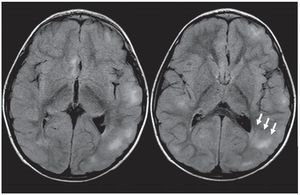
Figura 7. Líneas de migración radial. Secuencia FLAIR donde se observa, a nivel de la sustancia blanca periventricular adyacente a la prolongación occipital del ventrículo lateral izquierdo, una línea hiperintensa que se extiende hacia la corteza (flechas rectas). También se presentan quistes parenquimatosos (flechas curvas). Ambos hallazgos son característicos de esclerosis tuberosa.
Figura 8. Lesión de sustancia blanca. En la secuencia FLAIR se nota una banda gruesa hiperintensa que se extiende desde la sustancia blanca periventricular hasta la corteza (flechas).
Algunos autores refieren que estas lesiones son idénticas a las displasias corticales transmanto10.
Secuencias FLAIR y de susceptibilidad magnética
En la RM, las secuencias FLAIR y GRE cumplen un papel fundamental. Por un lado, la secuencia FLAIR es más sensible que la ponderación T2 para el diagnóstico de los túberes corticales (los cuales se ven hiperintensos y con límites difusos a nivel subcortical) y también identifica con mejor definición las lesiones de la sustancia blanca. En cuanto la secuencia GRE, esta se destaca por permitir el diagnóstico de las lesiones calcificadas. Mientras en ella el calcio se muestra hipointenso, en el resto de las secuencias convencionales puede verse de cualquier intensidad de señal e incluso no verse. Sin embargo, en la actualidad existen secuencias nuevas de susceptibilidad magnética, conocidas como susceptibility weighted imaging (SWI) y susceptibility weighted angiography (SWAN), que tienen más sensibilidad que el eco de gradiente para la detección de calcificaciones.
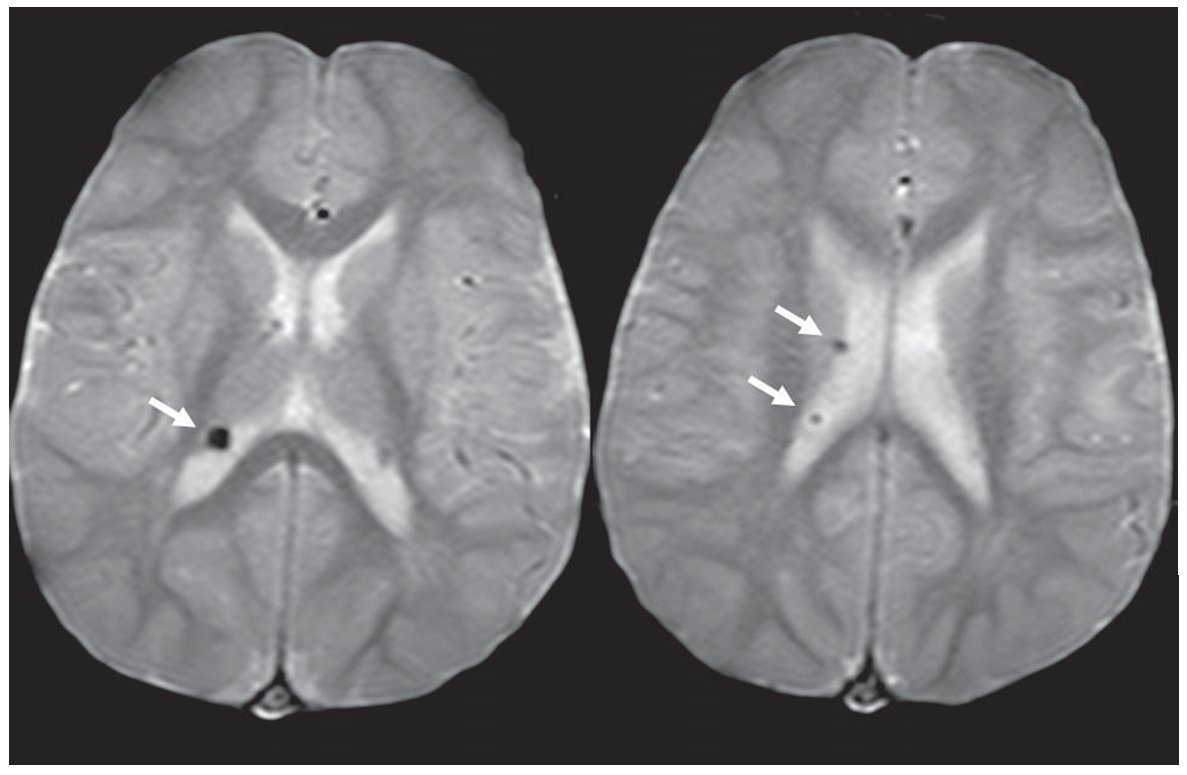
En la secuencia GRE los hamartomas subependimarios suelen identificarse como lesiones nodulillares hipointensas en las paredes de los ventrículos laterales, cuando estos están calcificados (fig. 9).
Figura 9. Secuencia eco de gradiente. Se constatan imágenes nodulillares hipointensas en la pared del ventrículo lateral derecho, correspondientes a hamartomas subependimarios calcificados (flechas).
Difusión y espectroscopia por resonancia magnética
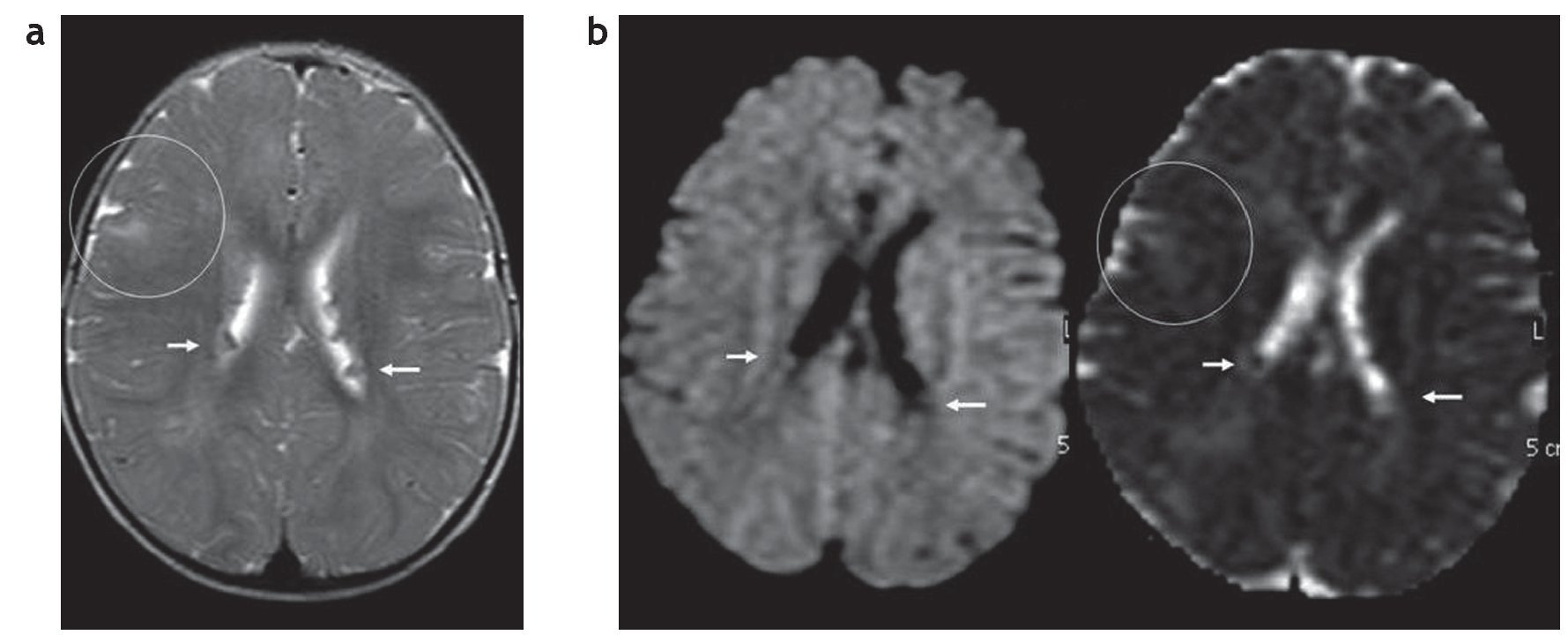
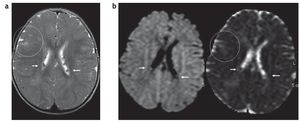
En la difusión por resonancia magnética (DWI), los túberes corticales presentan un incremento del coeficiente de difusión aparente (ADC), que expresa una expansión del espacio extracelular y se debe a la presencia de astrogliosis e hipomielinización11. A su vez, los hamartomas subependimarios pueden tener cambios en la difusión como producto de una calcificación. Generalmente se los observa isointensos en DWI y ADC, en relación con el parénquima sano (fig. 10).
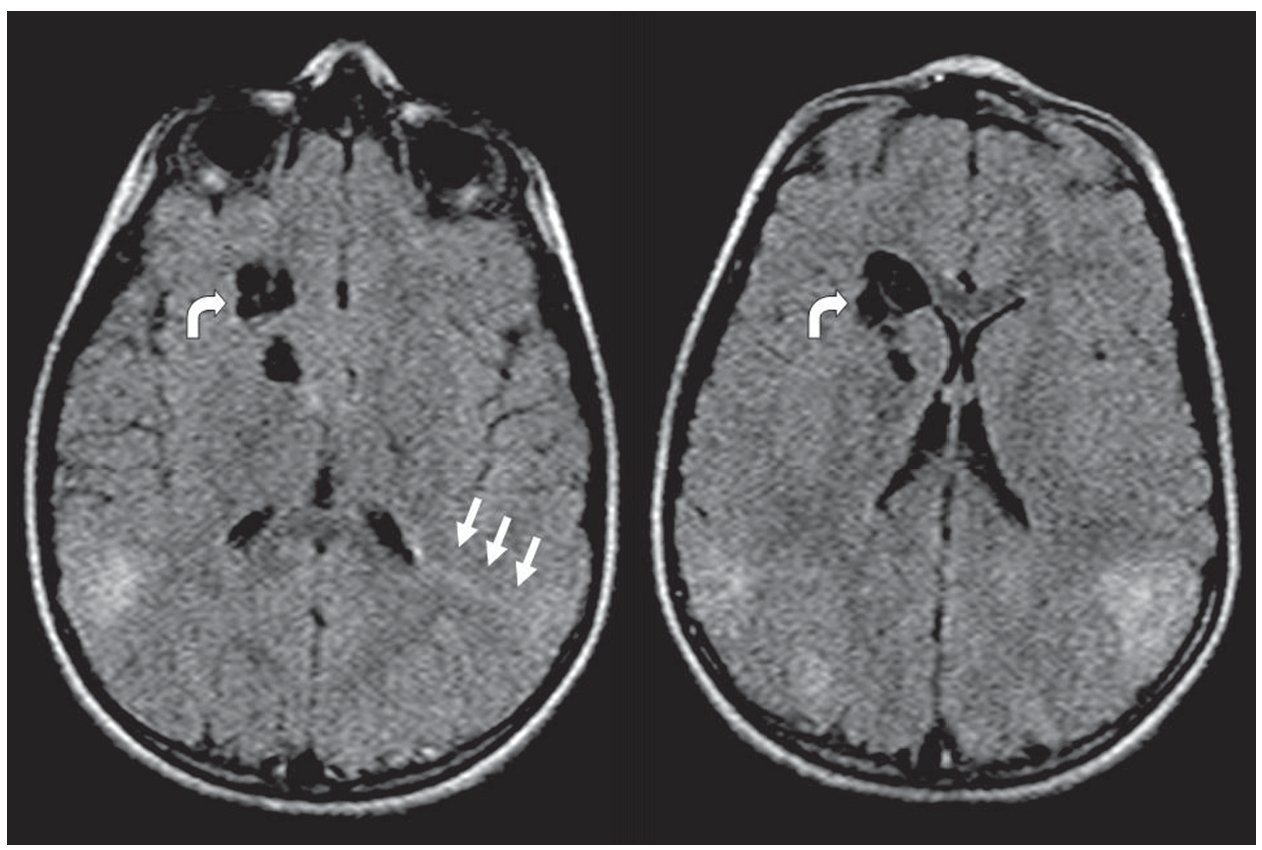
Figura 10. (a) Secuencia en plano axial y ponderación T2 de un paciente de 1 año de edad que presenta hamartomas subependimarios en ambos ventrículos laterales (flechas blancas) y túberes corticales (círculo). (b) En la difusión los hamartomas subependimarios son isointensos con respecto a la sustancia blanca (flechas), mientras que en el coeficiente de difusión aparente son isointensos o levemente hipointensos con respecto a la sustancia blanca (flechas). Esto podría estar en relación con su calcificación. Los túberes corticales son hiperintensos en el coeficiente de difusión aparente (círculo), presentando difusión facilitada.
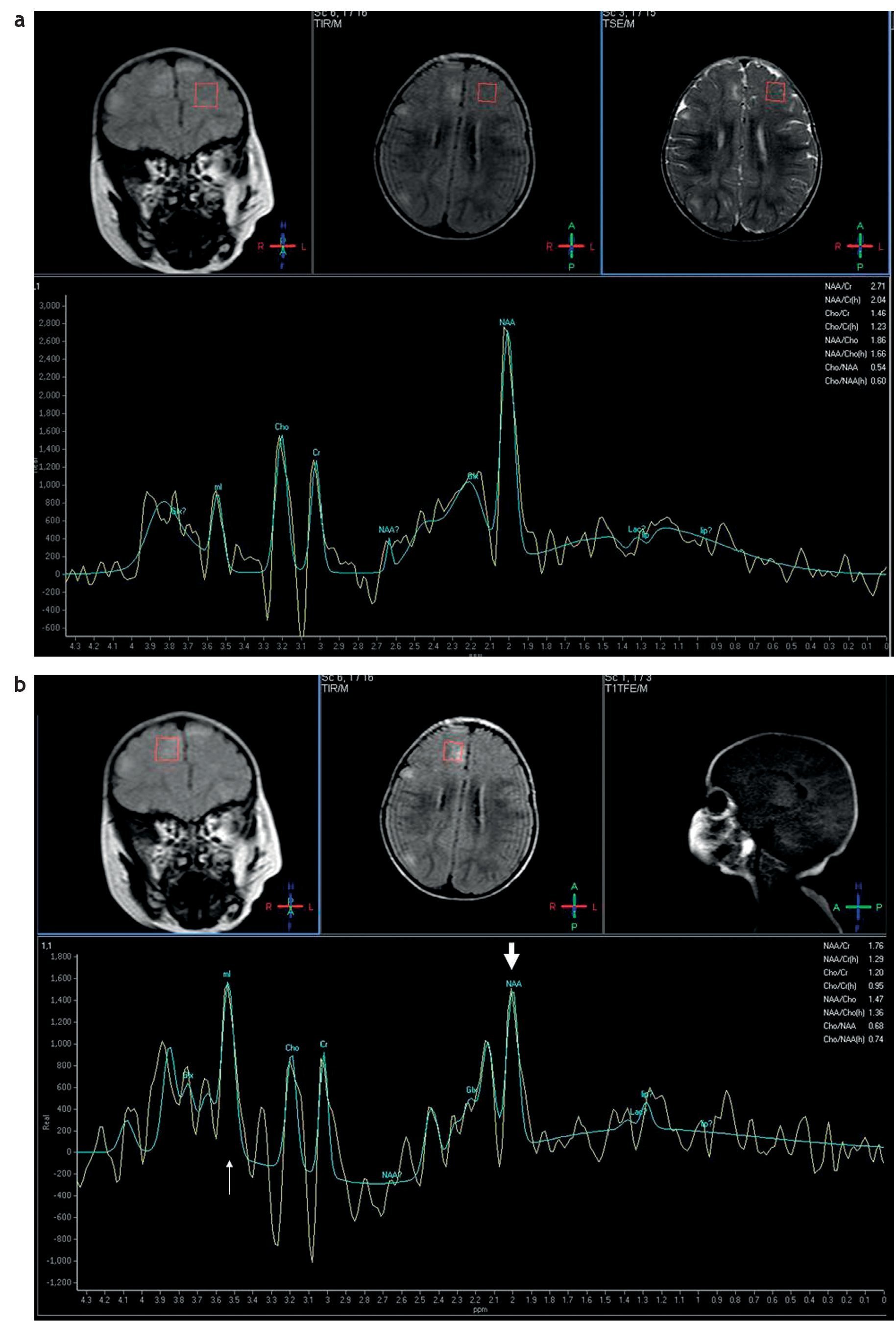
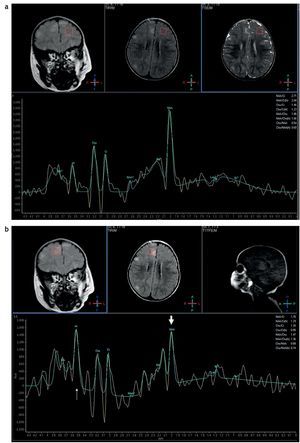
Con respecto a la espectroscopia por resonancia magnética se ha visto que en la evaluación de los túberes corticales no hay un aumento de la colina (Cho) que sugiera aumento de mitosis, pero sí se ha identificado un descenso significativo de las relaciones N-acetil aspartato/creatina (NAA/Cr) y NAA/(Cho+Cr) a expensas de un descenso del NAA (fig. 11). La reducción del NAA se debe a que las células que forman los túberes corticales producen menos NAA que las neuronas12.
Figura 11. Espectroscopia monovoxel con secuencias PRESS y tiempo de eco de 25 ms: corresponde (a) al lado normal y (b) a la evaluación de un túber cortical, donde se observa un descenso del pico del N-acetil aspartato, un incremento del pico de mioinositol y un pico normal de colina.
También se ha encontrado un incremento del mioinositol en los túberes corticales que se explicaría por la presencia de gliosis o inmadurez neuronal13.
Los hamartomas subependimarios no pueden ser evaluados por espectroscopia debido a su localización periven tricular, ya que el líquido cefalorraquídeo altera el espectro.
Conclusión
Hay que tener presente y conocer cuáles son los hallazgos característicos que podemos encontrar en el endocráneo cuando estamos frente a una esclerosis tuberosa, ya que estos son criterios mayores y menores de diagnóstico de la entidad.
Los hallazgos intracraneanos más frecuentes son los hamartomas subependimarios y los túberes corticales. También debe tenerse en cuenta que la presencia de un astrocitoma intraventricular de células gigantes puede causar hidrocefalia y que este suele ubicarse cerca de los agujeros de Monro, provocando su oclusión.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Recibido mayo de 2013;
aceptado septiembre de 2013
http://dx.doi.org/10.7811/rarv77n4a05
* Autor para correspondencia.
Correo electrónico:docampojorge@hotmail.com (J. Docampo).