Convocadas por la Academia Nacional de Medicina, por intermedio del Instituto de Estudios Oncológicos y ante la iniciativa de la Asociación Argentina de Mastología, las entidades autoras, miembros del Programa Argentino de Consensos de Enfermedades Oncológicas y del Programa Nacional de Consensos Intersociedades, avalan este consenso multidisciplinario que aúna los criterios propuestos por los profesionales que se encuentran involucrados en la prevención, diagnóstico y tratamiento del cáncer de mama.
Las instituciones autoras se comprometen a difundir y promover el uso del contenido de este documento en todas las áreas y entidades responsables del manejo de la salud, institutos nacionales, provinciales, municipales, PAMI, colegios médicos, entidades de medicina prepaga, obras sociales, mutuales, en la Superintendencia de Seguros de Salud de la Nación, hospitales universitarios y comunales, y demás entidades relacionadas, así como su aplicación por todos los especialistas del país
El cáncer de mama (CM) es considerado en la actualidad una entidad multifactorial, donde herencia, ambiente y hábitos de vida interaccionan sobre los individuos con grados variables de susceptibilidad1–4. Este fenómeno se traduce, epidemiológica y clínicamente, en la presencia de diferentes estratos de riesgo en una misma población. Los cánceres de mama pueden ser clasificados en tres grandes grupos, según cuáles sean los factores más importantes que determinan su aparición: esporádico, familiar o hereditario.
La gran mayoría de los casos (70-75%) son esporádicos y en general ocurren a edades mayores y en personas que no presentan antecedentes familiares. En los cánceres esporádicos, las alteraciones genéticas relacionadas con la carcinogénesis solo están presentes en el tejido mamario afectado. La adquisición de estas mutaciones se produce por factores ambientales, el estilo de vida o por azar, como parte del proceso normal de envejecimiento celular.
En menor proporción, alrededor del 25-30% muestra una predisposición familiar a desarrollar la enfermedad. Esto significa que algunos factores genéticos débiles (no identificables), actuando junto con el estilo de vida y el ambiente, hacen a los miembros de estas familias más susceptibles. En estos casos, debe aplicarse una prevención empírica.
El 5-10% de todos los casos de cáncer de mama se producen por mutaciones heredadas que se transmiten de padres a hijos y de generación en generación, originando los llamados síndromes de cáncer hereditario. En general, una mutación en un gen determinado aumenta el riesgo de aparición de más de un tumor, y es por esto que cada síndrome posee un espectro de distintos tumores sobre los que se focaliza la prevención.
Una correcta caracterización de los casos a lo largo de esta línea de susceptibilidad variable permite determinar con mayor precisión el riesgo de aparición de la enfermedad, para luego adecuar las estrategias preventivas correspondientes. Forma parte del estándar de cuidado que todo especialista debe ofrecer como parte de la práctica clínica habitual.
La radioterapia torácica previa y las lesiones mamarias proliferativas con atipia son factores personales de alto riesgo, independientemente de los antecedentes heredo-familiares.
El proceso de evaluación, estudio y categorización del riesgo de desarrollar CM de un individuo o familia se encuentra dentro del marco del Asesoramiento Genético en Oncología (AGO) y debe ser realizado por profesionales específicamente entrenados para tal fin.
Cáncer de mama heredo-familiar: evaluación, riesgos y abordajeCáncer de mama familiarUn tercio de los casos de CM presenta agregación familiar, es decir, que aparecen en dos o más individuos pertenecientes a una misma genealogía.
De todos los factores conocidos que aumentan el riesgo de aparición de CM, la historia familiar es uno de los factores con más peso, principalmente en familiares cercanos2. La presencia de un familiar de primer grado con CM aumenta el riesgo de padecer la enfermedad entre 1,5 y 3 veces por sobre la población general. Estos riesgos pueden ser aún mayores mientras más temprana es la edad de aparición en el familiar afectado y mayor el número de casos en la genealogía.
El riesgo familiar a desarrollar CM puede ser calculado de forma empírica, utilizando la información clínica familiar y la magnitud de riesgo en relación con los antecedentes familiares. Este ha sido evaluado en distintos estudios5–9 (tabla 1).
Riesgos empíricos según antecedentes familiares
| Historia familiar | RR (95% IC) |
|---|---|
| Familiar de primer grado con CM (hijos, padres y hermanos) | |
| Cualquier edad | 2,1 (95% IC 2-2,2) |
| Afectado con CM ≥ 50 años | 1,8 (95% IC 1,6-2) |
| Afectado con CM<50 años | 2,3 (95% IC 2,2-2,5) |
| 30-39 años | 3,28 (95% IC 1,91-4,65) |
| 40-49 años | 2,56 (95% IC 1,89-3,24) |
| Familiar de segundo grado con CM (tíos, sobrinos, nietos y abuelos) | 1,5 (95% IC 1,4-1,6) |
CM: cáncer de mama; IC: intervalo de confianza; RR: riesgo relativo
Cuando la aparición del CM está asociada a la herencia de un gen mutado deficitario en su función (CM hereditario) los riesgos a los que están expuestos estos individuos son mayores, con valores que pueden rondar hasta el 80% a lo largo de la vida, según el síndrome y el gen involucrados.
Otra característica observada es la alta incidencia de nuevos CM o de afección bilateral, con riesgos que pueden superar el 50%, pasados los 10 años del primer diagnóstico.
Los casos de CM hereditario provocados por la alteración de genes puntuales explican entre el 15-35% de la agregación familiar del CM10,11.
Introducción al manejo de los individuos con alto riesgo de cáncer de mamaEl manejo de los casos con mayor riesgo de CM forma parte del abordaje integral de los individuos y sus familias, donde están incluidas no solamente las estrategias específicas de prevención aplicadas al CM, sino también todos los demás componentes del AGO. Este proceso comienza con la correcta estratificación del riesgo del caso, sigue con la evaluación de la necesidad de realizar estudios moleculares y su adecuada interpretación, y finaliza con la elaboración de una estrategia de contención y prevención que abarque todos los riesgos involucrados (no solamente de CM, sino también de otros órganos) y los aspectos psicosociales. Esto solamente puede llevarse a cabo a través del accionar de varios profesionales y en forma multidisciplinaria.
Por este motivo, el seguimiento de individuos con alto riesgo de CM debe estar siempre ligado a un correcto asesoramiento genético y a un manejo multidisciplinario, donde intervenga un equipo de profesionales que aborden todas las implicancias involucradas.
Generalidades del manejo del CM de alto riesgoLas mutaciones responsables de los síndromes de cáncer hereditario son denominadas “germinales”. Se encuentran en el individuo desde el momento de su concepción en todas las células de su cuerpo y, por lo tanto, pueden ser identificadas en individuos sin cáncer a partir de un análisis de sangre en la mayoría de los casos. Estas mutaciones hacen al individuo más susceptible a desarrollar CM cuando otras mutaciones adicionales se adquieren a lo largo de la vida en las células del órgano blanco.
El patrón de herencia de la gran mayoría de los síndromes de CM hereditario corresponde al denominado “autosómico dominante”. Esto significa que solo es necesario heredar una mutación en alguna de las dos copias del gen, ya sea la materna o la paterna, para que el riesgo de desarrollar CM aumente. De esta manera, cada hijo o hermano de un individuo que posea una mutación tiene el 50% de probabilidades de heredar la mutación y el 50% de no heredarla. Dado que la localización de estos genes es autosómica, la herencia puede ocurrir tanto por la rama materna como por la paterna, con lo cual la historia familiar del padre es igualmente relevante para el análisis. Los individuos de la familia que no heredan la mutación responsable del síndrome presentan riesgos bajos de desarrollar la enfermedad, similares a los de la población general.
La probabilidad que tiene un individuo portador de una mutación de desarrollar CM es denominada “penetrancia”. Esta aumenta con la edad y varía según las poblaciones estudiadas, dado que no está establecida en valores rígidos. Si bien el rango de riesgo puede ser amplio, los valores siempre son significativamente más elevados que los de la población general.
Evaluación de riesgo y sospecha clínicaLa cuantificación del riesgo al que está expuesto un individuo con antecedentes personales o familiares de CM es una parte fundamental del proceso de evaluación. Este ayuda a comprender la magnitud que la patología tiene para el individuo y su familia, fundamenta la indicación de un estudio molecular y adecúa las estrategias preventivas aplicadas.
Estratificación de riesgoEl proceso de evaluación de riesgo utiliza toda la información clínica relevante (individual y familiar), los cálculos empíricos y los estudios moleculares necesarios, con el objeto de caracterizar a ese individuo/familia en un estrato de riesgo determinado.
Si bien de acuerdo con los conocimientos actuales la predisposición genética a desarrollar CM podría ser considerada única y diferente para cada individuo, a los fines prácticos se pueden agrupar los casos evaluados en tres estratos o niveles principales de riesgo: familias de bajo riesgo, familias de riesgo moderado y familias de alto riesgo.
Familias de bajo riesgoSe caracterizan por tener un riesgo equivalente al de la población general. Son familias con pocos casos, no relacionados entre sí (aislados), que no cumplen criterios para ningún síndrome definido y no siguen un patrón de herencia determinado. La evaluación de riesgo en estos casos involucra la sugerencia de estrategias de prevención aplicadas a la población general, según las recomendaciones locales vigentes.
Familias de riesgo moderadoEn estos casos se evidencia agregación familiar (agrupación de casos), pero sin un patrón de transmisión definido ni criterios que evidencien un síndrome en particular. Los individuos pertenecientes a estas familias presentan un riesgo mayor que la población general, determinado por el número de casos y las edades de diagnóstico en la genealogía. Las medidas preventivas instauradas surgen de recomendaciones empíricas y solo se dirigen a lo evidenciado por el cuadro clínico familiar.
Este grupo intermedio es el más difícil de definir, ya que encontramos aquí situaciones variables con riesgo empírico muy diverso. Hay casos con escasa agregación familiar donde el riesgo empírico es levemente superior al de la población general (por ej. dos casos de CM posmenopaúsico en familiares de segundo grado o dos casos en distintas ramas de la familia) y en el otro extremo están aquellos casos con mayor agregación familiar o inusuales por edades tempranas de diagnóstico, con estudios moleculares que no encuentran una mutación responsable del cuadro y cuyo riesgo empírico es sustancialmente mayor.
A los fines prácticos algunas guías internacionales definen rangos de riesgo moderado a aquellos comprendidos entre el 15 y el 25% (riesgo de desarrollar CM a lo largo de la vida a los 70-80 años)12.
Familias de alto riesgoSon aquellas familias donde el patrón de aparición de cáncer es altamente sugestivo de un síndrome de cáncer hereditario, ya sea por la aparición de múltiples casos o por edades tempranas de diagnóstico con criterios definidos de sospecha que orienten a una entidad específica.
Las familias donde una mutación puntual ya ha sido identificada pertenecen también a este grupo, y todos los familiares que no hayan sido estudiados genéticamente para conocer su estado de portación también deben ser considerados de alto riesgo hasta que se realicen el estudio.
Aun en casos donde los estudios moleculares no evidencian una mutación causal, si la sospecha clínica del síndrome es alta, el grupo familiar debería ser considerado de alto riesgo y las medidas preventivas a aplicar, las pertinentes al síndrome sospechado.
Al igual que en el grupo anterior, existen valores internacionalmente consensuados que consideran alto riesgo de CM a los que superan el 25-30% a lo largo de la vida, como corte para considerar estrategias específicas de prevención de alto riesgo12,13.
Cálculos empíricos de riesgoExisten modelos empíricos de predicción que toman en cuenta las características personales y familiares del caso, para así determinar los riesgos a los que están expuestas estas familias. Estos modelos pueden ser utilizados en individuos que ya han desarrollado cáncer y también en familiares asintomáticos.
Dependiendo del modelo empleado, se puede calcular la probabilidad de ser portador de una mutación deletérea o el riesgo de desarrollar la enfermedad, según antecedentes individuales y familiares. Estas herramientas sirven, además, para elaborar recomendaciones empíricas de prevención en aquellas familias en las que no se encuentran mutaciones o cuando el estudio genético no es realizado.
Los modelos de riesgo actualmente utilizados están basados en distintos estudios poblacionales que solo se consideran precisos cuando las poblaciones estudiadas son comparables. Los valores de riesgo obtenidos con estos modelos son aplicables a individuos de poblaciones similares a aquellas de donde el modelo fue extraído.
En el caso de nuestra población, la aplicabilidad de estos modelos aún no ha sido validada, y por ello el valor de riesgo que arrojan debería ser tomado con cuidado en el proceso de comunicación médico-paciente.
Dentro de los modelos más utilizados están: Claus, BRCAPRO, Tyrer-Kuzick, BOADICEA, etc. Si bien el BRCAPRO es el modelo más comúnmente utilizado, la correcta evaluación del riesgo es un concepto más amplio y debe ser realizada dentro del marco de un asesoramiento genético formal14–17.
Nota: el modelo de Gail no es considerado adecuado para el cálculo de riesgo de cáncer de mama en estos casos:
- -
Familias con cáncer de ovario (CO)
- -
Familias con afectados de segundo y tercer grado
- -
Familias con segregación de la enfermedad por rama paterna
- -
En casos de CM esporádico el riesgo está sobreestimado
- -
En casos de CM hereditario el riesgo está subestimado
Comparados con los CM esporádicos, los casos familiares y hereditarios suelen presentar características clínicas distintivas, que deben ser tomadas en cuenta para una evaluación más profunda del caso individual y familiar.
Además de las características relacionadas con el CM, existen otras pautas de sospecha particulares que dependen del síndrome involucrado y que es necesario tener en cuenta para la evaluación de riesgo de los pacientes.
Existen numerosos algoritmos propuestos con criterios de sospecha que ayudan a detectar pacientes con posible alto riesgo de CM y propician su derivación a una consulta de AGO especializado. Si bien estos algoritmos varían según la sociedad médica involucrada, la gran mayoría resalta las pautas enumeradas en la tabla 218–21.
Pautas de derivación a asesoramiento genético en oncología (AGO)
| Generales de CM |
| CM antes de los 50 años |
| CM bilateral o multicéntrico (sincrónico o metacrónico) |
| CM en el hombre |
| CM en etnia de riesgo (ej. judía askenazí, etc.) |
| Dos o más casos de CM en familiares cercanos (primer y segundo grado) |
| CM y otro tumor primario en el mismo individuo |
| CM triple negativo (menor de 60 años) |
| Específicas de síndrome (asociadas a otros tumores) |
| Cáncer de ovario o carcinoma de trompa o carcinoma peritoneal primario |
| Familias con CM, cáncer de endometrio y/o carcinoma tiroideo |
| Familias con CM y tumores pediátricos, como sarcomas, leucemias y tumores del sistema nervioso central |
| Familias con CM y afección gastrointestinal, como pólipos hamartomatosos, cáncer gástrico difuso, cáncer de colon, etc. |
CM: cáncer de mama.
Nota: algunas características histológicas han sido reportadas con mayor frecuencia en pacientes con cáncer de mama asociado a mutaciones genéticas. Por ejemplo, el cáncer de mama asociado a mutación BRCA1, en un 75% de los casos, se caracteriza por presentar receptores hormonales (receptores de estrógeno y progesterona) y Her 2 neu negativos (“triple negativo”). Si bien no existe total acuerdo con respecto a la edad de las pacientes con diagnóstico de cáncer de mama triple negativo y su evaluación de riesgo, consideramos, en acuerdo a las principales guías internacionales, evaluar a todas las pacientes menores de 60 años con este diagnóstico22–24.
Introducción al manejo de los individuos con alto riesgo de cáncer de mamaEl manejo de los casos con mayor riesgo de CM forma parte del abordaje integral de individuos y sus familias, donde están incluidas no solamente las estrategias específicas de prevención aplicadas al CM, sino también todos los demás componentes del proceso de AGO.
Este proceso comienza con la correcta estratificación de riesgo del caso, evalúa la necesidad de realizar estudios moleculares y su adecuada interpretación, y elabora una estrategia de contención y prevención que abarque todos los riesgos involucrados (no solamente de CM, sino también de otros órganos) y los aspectos psicosociales. Esto solamente puede llevarse a cabo a través del accionar de varios profesionales y en forma multidisciplinaria.
Por este motivo, el seguimiento de individuos con alto riesgo de CM debe estar siempre ligado a un correcto asesoramiento genético y a un manejo multidisciplinario donde intervenga un equipo de profesionales que aborden todas las implicancias involucradas.
Generalidades de manejo del cáncer de mama de alto riesgoActualmente las mujeres con alto riesgo de CM cuentan con diferentes opciones para reducir el riesgo de desarrollar cáncer o para disminuir las probabilidades de morir por él.
Las estrategias eficaces de prevención en estos casos incluyen desde la vigilancia de alto riesgo (prevención secundaria) hasta las cirugías de reducción del riesgo y la farmacoprevención (prevención primaria). Si bien todas son opciones a considerar, la decisión de adoptar una u otra deberá siempre realizarse en base a un correcto AGO y al abordaje interdisciplinario, donde se evalúen los pro y los contra de cada elección, así como las diferentes implicancias involucradas.
Teniendo en cuenta lo expuesto, se consideran individuos o familias de alto riesgo para manejo clínico, a aquellos que se encuentren dentro de los siguientes grupos:
- -
Individuos portadores de mutaciones en algún gen asociado a CM hereditario
- -
Familiares cercanos (primer y segundo grado) de portadores de mutaciones, que no hayan hecho estudio molecular
- -
Familias con riesgo empírico elevado (alta sospecha clínica), que no hayan hecho estudio molecular o cuyo resultado haya dado negativo
Nota: se considera riesgo empírico elevado a todo aquel que supere el 25% de acuerdo con los modelos de evaluación de riesgo de cáncer de mama que incluyan la historia familiar12,13.
Dado que el riesgo elevado involucra aquellos casos asociados a síndromes específicos de predisposición hereditaria, y también a aquellos donde no puede evidenciarse una causa puntual pero el cuadro familiar lo justifica, el manejo de cada una de estas instancias dependerá de cada caso. Se seguirán recomendaciones específicas de cada síndrome o recomendaciones empíricas de alto riesgo, según si se ha identificado o no la causa del cuadro.
Síndromes de cáncer de mama hereditarioLos distintos síndromes de CM hereditario se caracterizan por presentar riesgo elevado de desarrollar CM y, además, se asocian a la aparición de otras neoplasias, conformando un espectro tumoral característico (tabla 3). Cada uno de estos síndromes posee criterios clínicos diagnósticos, estrategias de análisis molecular y pautas de manejo específicos.
Principales síndromes hereditarios con alto riesgo de cáncer de mama
| Genes | Síndrome | Riesgo CM | Órganos/tumores asociados |
|---|---|---|---|
| BRCA1/BRCA2 | HBOC | 54-87%* | Ovario, páncreas, melanoma, próstata, CM hombre, etc. |
| p53 | Li Fraumeni | 55% a 45 años >90% a 70 años | Sarcomas, colon, ca. adrenal, leucemias, tumores cerebrales, osteosarcomas, etc. |
| PTEN | Enfermedad de Cowden | 30-85%* | Tiroides, endometrio, genitourinarios, etc. |
| STK11/LKB1 | Peutz-Jeghers | 45-57%* | Intestino delgado, colon, útero, testículo, etc. |
| CDH1 | Ca. gástrico hereditario | 39-52%* | CM lobar, carcinoma gástrico difuso, etc. |
CM: cáncer de mama; HBOC: síndrome de cáncer de mama/ovario hereditario; ca: carcinoma.
Valores de riesgo obtenidos de las referencias 25–36.
El conocimiento detallado de estudio, diagnóstico genético y manejo de estas entidades no forma parte de la consulta ginecológica u oncológica habitual, sino que es de incumbencia del genetista o profesional a cargo del AGO, que se desempeña como parte del equipo multidisciplinario de atención de alto riesgo. Por este motivo, estos conceptos no serán abordados en detalle en el presente documento.
Situación del cáncer de mama hereditario en ArgentinaEn el año 2011 se creó el Plan Nacional de Tumores Familiares y Hereditarios (PROCAFA), dependiente del Instituto Nacional del Cáncer de Argentina (INC), cuyo principal objetivo es “mejorar la detección, manejo y prevención de los grupos de alto riesgo de cáncer a nivel nacional” (ver: http://bit.ly/1eBo301).
Una de sus primeras iniciativas fue la realización de un diagnóstico de situación actual en Argentina mediante el Censo Nacional de Recursos Humanos y Moleculares en Cáncer Hereditario, realizado durante los años 2012 y parte del 2013 (http://bit.ly/REmfM0).
De acuerdo con los resultados obtenidos en el Censo Nacional, y convocando al recurso humano relevado, a fines del año 2013 se formó la Red Argentina de Cáncer Familiar (RACAF), actualmente en funcionamiento activo y progresivo crecimiento.
Esta red se conforma por profesionales e instituciones que realizan consultas de AGO a lo largo de todo el territorio nacional y responde a los siguientes objetivos principales: unificación de pautas de detección y manejo de casos, capacitación profesional de nodos nuevos, registro unificado de casos, mejoramiento en la accesibilidad de la población a los estudios moleculares, promoción de la realización de trabajos colaborativos regionales.
El listado completo de los miembros integrantes de RACAF y los materiales informativos para profesionales y comunidad general se encuentran disponibles en el sitio web del INC: http://bit.ly/1eBo301.
Bibliografía recomendada
- -
National Comprehensive Cancer Network (NCCN). Guidelines genetic/familial high risk assessment: breast and ovarian. Disponible en: http://bit.ly/1ifrFZB (consultado Mayo, 2014).
- -
Pagon R, ed. GeneReviews. Seattle (WA): University of Washington; 1997-2016.
- -
Núñez LM, ed. Asesoramiento genético en Oncología. Manual para la práctica clínica. Buenos Aires: Instituto Nacional del Cáncer; 2013.
- -
National Institute for Health and Cancer Excellence. Familial Breast Cancer: classification, care and managing breast cancer and related risks in people with a family history of breast cancer; 2013. Disponible en: http://bit.ly/1iHeTla (consultado Mayo, 2014).
El antecedente de cambios proliferativos documentados por biopsia constituye un factor de riesgo preponderante para el desarrollo del cáncer de mama.
DefiniciónLas lesiones proliferativas constituyen un grupo de entidades con cambios citológicos y arquitecturales, originadas y confinadas a la unidad terminal ducto-lobulillar. Están asociadas con un riesgo incrementado de diferentes magnitudes para el desarrollo subsecuente de carcinoma, siendo algunas de ellas consideradas como indicadores de riesgo y otras como verdaderos precursores1.
Una lesión verdaderamente precursora es aquella de la que se origina el carcinoma invasor, en ese mismo lugar y a partir de ese precursor.
Un marcador de riesgo es aquella lesión que predispone al desarrollo ulterior de un carcinoma invasor, no siempre en el mismo lugar en el que se diagnosticó el marcador de riesgo, pudiendo ocurrir en otro lugar de la mama ipsilateral o en la mama contralateral.
ClasificaciónLas lesiones proliferativas intraductales de la mama usualmente se clasifican en tres categorías (tabla 4): hiperplasia ductal usual (HDU), hiperplasia ductal atípica (HDA) y carcinoma ductal in situ (CDIS).
Características morfológicas para distinguir la hiperplasia ductal usual de la hiperplasia ductal atípica y del carcinoma ductal in situ1,5
| Características | Hiperplasia ductal usual | Hiperplasia ductal atípica | Carcinoma ductal in situ |
|---|---|---|---|
| Arquitectura | Irregular | Rígida | Rígida |
| Citología | Múltiples | Uniforme | Uniforme |
| Extensión | Variable | Compromiso parcial en múltiples espacios o compromiso completo en 2 espacios o de 2mm de extensión mayor | Compromiso completo o mayor de 2 espacios o mayor de 2mm de extensión |
| Riesgo | Generalizado bilateral Relativo | Moderado Bilateral | Alto Regional |
Estudios de seguimiento clínicos indican que las lesiones proliferativas intraductales están asociadas con diferentes niveles de riesgo para el desarrollo subsecuente de carcinoma invasor.
Las lesiones proliferativas lobulillares incluyen la forma típica de proliferación lobulillar, que se denomina adenosis lobulillar, y las formas atípicas o neoplasia lobulillar. Estas últimas incluyen la hiperplasia lobulillar atípica (HLA) y el carcinoma lobulillar in situ (CLIS).
El riesgo de desarrollar un carcinoma luego del diagnóstico de estas lesiones es de 1,5-2 veces más que en la población general para la HDU y para algunas formas de adenosis (como la esclerosante); de 3-5 veces más para las hiperplasias atípicas (ductal y lobulillar); y de 8-10 veces más para los carcinomas in situ (en el caso del carcinoma ductal in situ, solo para las formas de “no alto grado”).
Se detalla el incremento de riesgo relativo para carcinoma invasor asociado a las lesiones benignas no proliferativas y a las lesiones proliferativas sin y con atipia, diagnosticadas en biopsia previa1–4,7.
Incremento de riesgoLas lesiones se pueden dividir entre las que no incrementan el riesgo, las de bajo riesgo, las de moderado riesgo y las de alto riesgo. Se exponen las que forman parte de cada grupo:
- -
No incrementa el riesgo: adenosis, ectasia ductal, fibroadenoma, fibrosis, mastitis, hiperplasia leve sin atipia, quistes macro o microscópicos, y metaplasia apocrina.
- -
Bajo incremento del riesgo (de 1,5 a 2): fibroadenoma complejo, hiperplasia moderada o florida sin atipia, adenosis esclerosante y papiloma solitario sin hiperplasia atípica.
- -
Incremento moderado del riesgo (de 4 a 5): hiperplasia ductal atípica e hiperplasia lobulillar atípica.
- -
Incremento alto del riesgo (de 8-10): carcinoma ductal in situ (no alto grado) y carcinoma lobulillar in situ.
En las pacientes con antecedentes familiares, el riesgo aumentaría al doble.
Hallazgos clínicosEl rango de edad de las mujeres con lesión proliferativa intraductal es amplio, siendo extremadamente rara antes de la pubertad. El pico diagnóstico del CDIS es entre los 50 y 59 años. Esta lesión es predominantemente unilateral y solo el 22% de las pacientes desarrolla CDIS o carcinoma invasor (CI) en la mama contralateral.
Las lesiones proliferativas corresponden a lesiones no palpables, sin expresión macroscópica. Pueden expresarse como microcalcificaciones radiológicas, por lo que la mamografía (Mx) de la pieza quirúrgica es relevante en la detección de estas lesiones en el material de biopsia. El 85% de los CDIS tienen esta forma de presentación.
El cribado mamario resulta en un incremento del diagnóstico de estas lesiones proliferativas, especialmente las que muestran bajo grado citológico de atipia con proliferación intraluminal (HDA y CDIS) o sin ella, como la atipia epitelial plana (AEP).
Aspectos biológicosLos CDIS constituyen un grupo heterogéneo de lesiones, que difieren en su modo de presentación, hallazgos histopatológicos, marcadores biológicos, anormalidades genéticas y moleculares, y riesgo de progresión a carcinoma invasor. El diagnóstico diferencial entre la HDA y el CDIS de bajo grado puede ser problemático y su diferenciación debe basarse en criterios histopatológicos estandarizados5.
Recientes estudios genomoleculares proveen nuevos hallazgos sobre la relación entre estas lesiones proliferativas. El concepto de la progresión lineal del epitelio HDU - HDA - CDIS - CI es considerado en la actualidad un tanto simplista, ya que la relación entre estas lesiones es mucho más compleja. La HDU comparte pocas similitudes con HDA - CDIS y CI; mientras que la HDA es una lesión clonal similar al CDIS de bajo grado. Tanto los CDIS de bajo como de alto grado son lesiones clonales, pero representan entidades genéticamente distintas, que progresan a distintas formas de CI. El CDIS de bajo grado es más parecido a la HDA que al CDIS de alto grado. Por su parte, la AEP representa una lesión clonal con hallazgos morfológicos, inmunohistoquímicos y moleculares similares a la HDA y el CDIS de bajo grado.
En cuanto a la HDU, esta no es un factor de riesgo y en la mayoría de los casos no es un precursor. Algunos hallazgos genómicos sugieren que una pequeña proporción de HDA se origina de las HDU.
Reproducibilidad diagnósticaLa clasificación tradicional de las proliferaciones epiteliales mamarias resulta en una variabilidad interobservador que ha sido extensamente discutida, particularmente en los casos de HDA y CDIS de bajo grado. El diagnóstico diferencial entre estas dos entidades ha sido motivo de discusión entre los distintos autores. Se ha propuesto clasificar a las proliferaciones intraductales como neoplasia intraepitelial ductal (DIN), reservando el término de carcinoma para los tumores invasores. Esta terminología no está ampliamente aceptada, también debido a su falta de reproducibilidad interobservador. Los análisis moleculares apoyan la clasificación tradicional.
Una buena reproducibilidad diagnóstica se basa en la aplicación de criterios morfológicos de diagnóstico estandarizados, en particular entre HDA y CDIS de bajo grado7. Cuando los criterios cualitativos no son suficientes, se aplican criterios cuantitativos1.
Las cirugías de reducción de riesgo para cáncer de mama son aquellas que, realizadas sobre las mamas, los ovarios o ambos órganos, disminuyen notoriamente la aparición de un cáncer de mama.
Cirugías en la mamaLa mastectomía de reducción de riesgo bilateral (MRR) para cáncer de mama es una de las alternativas que se ofrecen a mujeres con alto riesgo de desarrollar un cáncer de mama a fin de prevenir su aparición.
Las mujeres con alto riesgo que no tienen antecedentes personales de cáncer de mama pueden considerar la mastectomía bilateral como un medio de prevención primaria. Las pacientes con diagnóstico de cáncer de mama y, por lo tanto, con mayor riesgo de desarrollar un segundo carcinoma en la mama contralateral, pueden considerar la mastectomía de reducción de riesgo contralateral como una estrategia de prevención.
El primero en nombrar este procedimiento con el término MRR fue Michael Stefanek1 en el año 2001. La denominación está relacionada con el beneficio de disminuir el riesgo en grupos predeterminados. La reducción de riesgo está estimada en 90-95%, por lo que no es correcto utilizar el término “mastectomía profiláctica”, como anteriormente se hacía, debido a que hay evidencia de que en pacientes con MRR entre el 1 y el 10% puede presentar un carcinoma de mama en el tejido mamario residual1-4.
La MRR es un procedimiento invasivo, irreversible y no exento de complicaciones, que puede causar morbilidad física y psicológica, afectando la calidad de vida de la mujer. Por ello, la paciente deberá ser evaluada por un equipo multidisciplinario integrado por un mastólogo, un genetista, su médico de cabecera, un psicólogo y un cirujano oncoplástico, a los fines de una adecuada selección y evaluación del riesgo.
La MRR para cáncer de mama es una opción válida para mujeres con mutaciones genéticas BRCA1 y BRCA2, pero debe ser analizada en el contexto general de la mujer, que comienza por su edad y llega hasta su estado psicológico, para afrontar tanto los disturbios físicos como los emocionales que producen la cirugía a pesar de la reconstrucción inmediata.
Mastectomía de reducción de riesgo bilateralUn análisis de los resultados de Hartmann determinó que el número de mujeres con muy alto riesgo de cáncer de mama necesario a tratar con MRR bilateral para prevenir un caso de cáncer de mama es 65,6. De estos trabajos y otros, se desprende el apoyo del National Comprehensive Cancer Network (NCCN) y la Society of Surgical Oncology a la MRR bilateral para pacientes seleccionadas que deseen el procedimiento.
Según las guías de práctica clínica del NCCN, la MRR bilateral debe ser considerada en:
- -
Mujeres con mutaciones genéticas comprobadas (BRCA1/2) y otros genes
- -
Mujeres con fuerte historia familiar que haga sospechar la existencia de una mutación genética (múltiples familiares de primer grado y/o múltiples generaciones sucesivas con cáncer de mama y/u ovario, múltiples familiares con cáncer de mama bilateral, en mujeres premenopáusicas o en hombres)
- -
Pacientes con historia de CLIS
- -
Pacientes con antecedentes de radioterapia torácica antes de los 30 años de edad6
La Society of Surgical Oncology incluye pacientes con historia de hiperplasia ductal atípica o hiperplasia lobulillar atípica, y casos de difícil seguimiento, como mamas densas y microcalcificaciones difusas; todos en el contexto de historia familiar de cáncer de mama7.
También puede sospecharse la existencia de una mutación genética en mujeres con historia familiar de cáncer de mama y/u ovario a edad temprana (< 40 años).
Mastectomía de reducción de riesgo contralateralLa MRR contralateral es motivo de controversia. En la actualidad es cada vez más frecuente, a pesar de que el riesgo de desarrollar un carcinoma contralateral está disminuyendo, probablemente gracias a la utilización de terapias adyuvantes que reducen el riesgo de su desarrollo y mejoran la sobrevida tanto en pacientes portadores de cáncer de mama receptores positivos como negativos8–10.
El diagnóstico de cáncer de mama en la población general confiere de por sí un aumento del riesgo de cáncer de mama contralateral (0,5 a 1% anual), mientras que en pacientes portadoras de mutación BRCA1 y 2 el riesgo de cáncer en la mama contralateral llega al 35-40%11–13.
Numerosos estudios han demostrado una reducción del 95% en la incidencia de cáncer de mama contralateral en pacientes con historia personal de cáncer de mama que fueron sometidas a MRR contralateral, pero el impacto en la reducción de la mortalidad no está claro aún14–21. En una revisión del Cochrane donde se analizaron seis trabajos retrospectivos, se concluyó que la MRR contralateral disminuye el riesgo de desarrollar un carcinoma contralateral, aunque eso no tiene un reflejo en la sobrevida21. Sin embargo, es probable que una mejora en la sobrevida pueda darse en algún grupo de pacientes seleccionados. En este sentido, Bedrosian et al.15 observaron un impacto positivo en la supervivencia de un grupo de pacientes con cáncer de mama temprano, menores de 50 años y receptores hormonales negativos, a los que se les había realizado MRR contralateral.
El aumento de la utilización MRR contralateral (150% entre 1993 y 2003) es a expensas de pacientes portadoras de cáncer de mama esporádico, en estadios iniciales, que son quienes poseen el mínimo riesgo de desarrollar un carcinoma de mama contralateral22. Por esta razón, la MRR contralateral debería considerarse en pacientes con alto riesgo de desarrollar un carcinoma contralateral (ejemplo: portadoras de mutaciones BRCA1 y 2)10.
Es fundamental que el mastólogo explique a cada paciente el riesgo real que posee de desarrollar un carcinoma contralateral y sus implicancias clínicas, para que la decisión de la realización del procedimiento no sea el resultado de una sobreestimación.
En el 2007, la Society of Surgical Oncology estableció las potenciales indicaciones de MRR contralateral en pacientes con cáncer de mama unilateral7:
*Reducción de riesgo en pacientes de alto riesgo:
- -
por historia familiar: pacientes con mutaciones BRCA1 y 2, o pacientes con historia familiar consistente con predisposición genética sin mutación demostrada
- -
por factores histológicos de alto riesgo: hiperplasia ductal atípica, hiperplasia lobulillar atípica o carcinoma lobulillar in situ
*Dificultad de seguimiento: mamas densas o microcalcificaciones difusas difíciles de evaluar.
*Motivos reconstructivos: para lograr simetría en casos de mamas voluminosas o ptósicas.
Técnicas de mastectomíasLas técnicas que pueden utilizarse para la MRR son:
- -
Mastectomía simple
- -
Mastectomía con conservación de piel (skin sparing mastectomy [SSM])
- -
Mastectomía con conservación de aréola (areola sparing mastectomy [ASM])
- -
Mastectomía con conservación de complejo aréola-pezón (nipple sparing mastectomy [NSM])
En todos estos procedimientos (SSM o NSM) es imprescindible que el equipo quirúrgico tenga experiencia en la técnica, que se seleccionen correctamente a las pacientes (estadios, tratamientos adyuvantes, etc.) y que se evalúe la morbilidad previa (tabaquismo, radioterapia)2,6.
La mastectomía con conservación del complejo aréola y pezón (CAP) es la más utilizada. A través de una incisión radiada en el cuadrante súpero-externo, prolongada o no hacia la aréola, diseca entre la superficie glandular y el plano del celular subcutáneo, secciona los conductos galactóforos en la base del pezón y deja de 3 a 5mm de glándula para no comprometer la vitalidad del complejo aréola-pezón. Una vez completada toda el área superficial, separa el plano profundo de la glándula mamaria de la aponeurosis superficial del músculo pectoral mayor. Estos procedimientos deben ir acompañados de una reconstrucción mamaria inmediata (RMI).
Dado que la mama es una parte del cuerpo de la mujer que influye en múltiples aspectos de su vida, la reconstrucción mamaria en las pacientes de alto riesgo es un punto de suma importancia para consensuar entre el paciente y el equipo tratante. Esta debe ser realizada por cirujanos entrenados en técnicas de cirugía oncoplástica y se debe explicar a la paciente que el método reconstructivo y la calidad del resultado será el de su caso particular. También se debe advertir la cantidad de tiempo quirúrgico que el procedimiento podrá necesitar, las complicaciones y sus implicancias (nuevas cirugías, pérdida de resultado etc.).
Las técnicas de reconstrucción mamaria pueden clasificarse según se utilicen tejidos autólogos o heterólogos (implantes). Al respecto, se aconseja ver el consenso de cirugía oncoplástica2.
*Reconstrucción mamaria con implantes
- -
Prótesis
- -
Expansores
*Reconstrucción mamaria con tejido autólogo
- -
Colgajo dorsal ancho
- -
Colgajo TRAM
- -
Colgajos libres microquirúrgicos: TRAM libre, DIEP, SIEA.
- -
Lipotransferencia
La técnica de reconstrucción más utilizada para la MRR es la colocación directa de prótesis cuando la cobertura cutánea de la paciente lo permite, o expansores y recambio por prótesis en un segundo tiempo. Raramente se usan colgajos miocutáneos.
Los mejores resultados estéticos se logran con la combinación de mastectomías con conservación de piel y RMI, o mastectomías con conservación del complejo aréola-pezón e implante protésico.
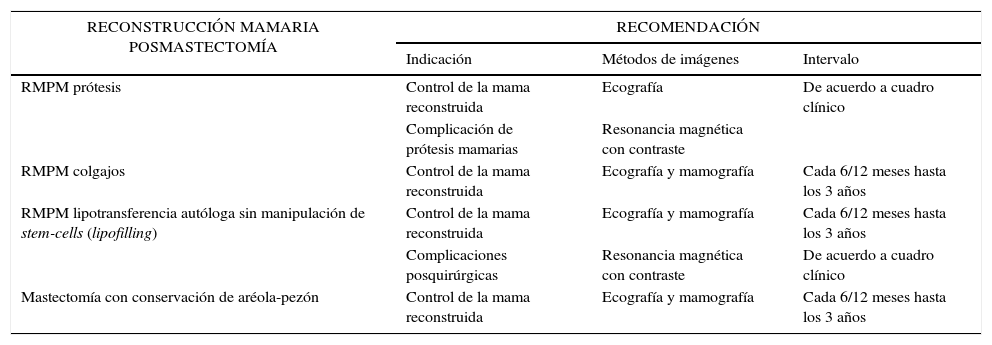
La tabla 5 expone el seguimiento de la mama reconstruida posmastectomía2.
Seguimiento de la mama reconstruida posmastectomía
| RECONSTRUCCIÓN MAMARIA POSMASTECTOMÍA | RECOMENDACIÓN | ||
|---|---|---|---|
| Indicación | Métodos de imágenes | Intervalo | |
| RMPM prótesis | Control de la mama reconstruida | Ecografía | De acuerdo a cuadro clínico |
| Complicación de prótesis mamarias | Resonancia magnética con contraste | ||
| RMPM colgajos | Control de la mama reconstruida | Ecografía y mamografía | Cada 6/12 meses hasta los 3 años |
| RMPM lipotransferencia autóloga sin manipulación de stem-cells (lipofilling) | Control de la mama reconstruida | Ecografía y mamografía | Cada 6/12 meses hasta los 3 años |
| Complicaciones posquirúrgicas | Resonancia magnética con contraste | De acuerdo a cuadro clínico | |
| Mastectomía con conservación de aréola-pezón | Control de la mama reconstruida | Ecografía y mamografía | Cada 6/12 meses hasta los 3 años |
Consenso Nacional Intersociedades sobre Cirugía Oncoplástica en Cáncer de Mama (mayo 2012). Disponible en: http://www.samas.org.ar/archivos/consensoCAmama.pdf
Como se mencionó anteriormente, la MRR no elimina completamente el riesgo de desarrollar un cáncer de mama. Debe ser advertido a las mujeres y continuar con su vigilancia. En todos los casos, el examen físico es semestral.
Mastectomía de reducción de riesgo y biopsia de ganglio centinelaLa biopsia de ganglio centinela en la MRR no está recomendada en forma rutinaria, por la baja tasa de carcinoma invasor oculto hallado en las piezas de mastectomía (del 1,4 al 1,7%)23,24.
Existe controversia en el caso de MRR contralateral en pacientes con carcinoma localmente avanzado, carcinoma lobulillar invasor o carcinoma lobulillar in situ. Algunos grupos, en estos casos, proponen realizar la biopsia del ganglio centinela14,23–26.
Este año el National Cancer Institute estima 232.670 nuevos casos de cáncer de mama para las mujeres y 2.360 para los hombres, con una mortalidad de 40.000 y 430, respectivamente. En lo que respecta al cáncer de ovario, estima 21.980 nuevos casos con una mortalidad de 14.270.
Función ováricaLos ovarios son órganos endocrinos, que durante el período reproductivo producen estradiol, progesterona y andrógenos (testosterona y androstenediona).
La anexectomía bilateral en la premenopausia origina una menopausia quirúrgica como consecuencia de la pérdida inmediata y significativa de hormonas (estradiol, progesterona y andrógenos). Se diferencia de la menopausia natural, ya que esta última no se asocia a cambios significativos en los niveles circulantes de testosterona, debido a que los ovarios continúan produciendo andrógenos hasta los 80 años aproximadamente.
La androstenediona se convierte en estrona en el tejido graso y en los músculos. Por otra parte, la estrona y testosterona se convierten en estradiol1–3.
La anexectomía bilateral electiva en pacientes menores de 50 años con indicación de histerectomía por patologías benignas está asociada con un incremento de la enfermedad coronaria, disfunción sexual, osteoporosis, fracturas de caderas, enfermedad de Parkinson y alteración de la función cognitiva; mientras que en mujeres posmenopáusicas puede reducir la tasa de cáncer de ovario sin un impacto aparentemente significativo en las manifestaciones sistémicas antes descritas4,5.
Anexectomía bilateral de reducción de riesgo para cáncer de ovarioEl riesgo estimado para la población general de padecer cáncer de ovario es de 1,4%; esto es, 1 de cada 70 mujeres a lo largo de la vida. Este riesgo se incrementa en el síndrome de Lynch, llegando hasta un 14% y en las mujeres con mutaciones de los genes BRCA1-2 oscila entre un 13 y un 46%.
El cáncer de ovario representa la quinta causa de muerte de las mujeres en los Estados Unidos de Norteamérica, ocupando el cuarto lugar entre los 40 y los 59 años.
Un 75% de los casos se diagnostican en estadios tardíos (III y IV) con una sobrevida promedio a los 5 años del 44%.
Debido a la ausencia de métodos de cribado efectivos para esta patología, pareciera ser que la anexectomía bilateral electiva, al momento de la histerectomía por causa de patología benigna, es una opción de prevención; mientras que para la población de riesgo, mujeres con BRCA1 y 2 mutados, la anexectomía bilateral disminuye en forma significativa la tasa de mortalidad por cáncer de trompas de Falopio y ovario6–8.
La revisión Cochrane referente a la anexectomía bilateral electiva para la población general determinó que no hay suficiente evidencia científica para apoyar o contraindicar su práctica9. Por su parte, el Colegio Americano de Obstetras y Ginecólogos (ACOG) recomienda preservar los ovarios en pacientes premenopáusicas que no presenten riesgo genético aumentado para cáncer de ovario, e indicar la cirugía en mujeres con BRCA mutados (población de riesgo) a partir de los 40 años y con deseos genésicos cumplidos. Asimismo, la indicación de las mujeres posmenopáusicas que no presenten riesgo genético aumentado al tiempo de una histerectomía debería ser evaluada individualmente.
Anexectomía bilateral de reducción de riesgo para cáncer de mamaLa anexectomía de reducción de riesgo electiva para la población general, en mujeres menores de 45 años, disminuye la incidencia de cáncer de mama, sin tener impacto en la tasa de mortalidad por esta patología10. Sin embargo, para las mujeres con BRCA1 mutados (población de riesgo) entre los 40 y 50 años, reduce el riesgo de cáncer de mama hasta en un 50% y para aquellas menores de 40 años disminuye hasta un 64%6,7,11,12.
El ACOG recomienda la anexectomía bilateral para las mujeres con BRCA1 o 2 mutados, una vez alcanzados sus deseos genésicos.
Basados en las curvas de incidencia para cáncer de mama y en las publicaciones que expresan una reducción del riesgo de hasta un 50% después de la anexectomía, varios autores con estudios prospectivos y randomizados hallaron una disminución de nuevos casos en las mujeres portadoras de la mutación del BRCA2 y, por el contrario, observaron más casos de los esperados en las portadoras de BRCA1.
Una explicación de esta diferencia es que el efecto de la anexectomía de disminución de riesgo podría ser menos marcada en las portadoras de mutaciones BRCA1, debido a que sus cánceres de mama son a menudo receptores hormonales negativos,tanto para estrógenos como para progesterona (ER y PR).
Otras explicaciones para el hallazgo de más casos de cáncer de mama de lo esperado pueden ser: la intensificación del cribado con mamografías y/o RM, aunque esta hipótesis se debilita en las mujeres con BRCA2 mutado; que la anexectomía de reducción de riesgo es la elegida por las mujeres con historia familiar y cáncer de mama previo; y por último, el empleo de la terapia de reemplazo hormonal después de la anexectomía de reducción de riesgo13,14.
Otros autores informan que la cantidad de ovulaciones en la vida de la mujer se asocia al riesgo de cáncer de mama. Así, la edad de la menopausia y la prolongación de la lactancia serían inversamente proporcionales al riesgo de padecer un cáncer de mama. El hecho de que la anexectomía luego de la menopausia reduzca el riesgo de cáncer de mama los lleva a plantear la hipótesis de que los andrógenos ováricos tendrían acción directa sobre el riesgo de cáncer mamario por conversión periférica a estrógenos, una hipótesis que, de confirmarse, implicaría nuevas propuestas en la prevención de esta entidad15.
La reducción del riesgo de cáncer mamario mediante la anexectomía conlleva una reducción de la calidad de vida, determinada por la dispareunia, los sofocos y la disminución del deseo y satisfacción sexual. Estos síntomas no siempre se corrigen mediante las terapias de reemplazo hormonal, aunque los estudios evidencian que el uso de la terapia de reemplazo hormonal no interfiere en el efecto de la anexectomía sobre la mama. De todos modos, se sugiere que estas pacientes deben ser monitorizadas16–20.
Los beneficios de la anexectomía de reducción de riesgo disminuiría la mortalidad para cáncer de mama en un 56% y para cáncer de ovario en un 79%, debiéndose informar a las pacientes todas la morbilidades ocasionadas por la ausencia de los anexos21,22.
En conclusión, la incidencia de cáncer de mama después de la anexectomía de reducción de riesgo en mujeres premenopáusicas portadoras del gen BRCA2 es significativamente menor. Aún faltan estudios para aclarar su beneficio en las mujeres premenopáusicas portadoras del gen BRCA1. Si bien reconocemos que la anexectomía sigue siendo la estrategia de prevención primaria más fundamentada en este grupo etario, al no poder reproducir el porcentual de reducción de los riesgos publicados anteriormente, el cribado continuo con la mamografía y la resonancia magnética para prevenir el cáncer de mama en las mujeres portadoras de BRCA1 y 2 aún anexectomizadas se justifica23.
La quimioprevención es la rama más aplicada de la fármaco-prevención primaria para el cáncer de mama. Se define así a la acción de sustancias que previenen el desarrollo de tumores, al ser capaces de impedir (bloquear) o revertir (suprimir) el proceso de la carcinogénesis.
Etapas de la carcinogénesisIniciaciónEs el proceso inicial de alteración de una célula a nivel de su genoma en tres procesos celulares fundamentales: metabolismo, reparación del ADN y proliferación celular. La alteración de cualquiera de estos tres procesos puede iniciar el proceso de la carcinogénesis. El compuesto químico implicado en este proceso es muy escaso y se lo denomina agente iniciador, siendo aquel que solo es capaz de iniciar a las células.
Algunos de los mecanismos moleculares y celulares responsables de la iniciación de la carcinogénesis son: mutaciones en el genoma como pequeñas deleciones, mutaciones puntuales de protooncogenes y/o oncogenes y mutaciones en genes implicados en la transducción de señales celulares, las cuales pueden producir alteraciones fenotípicas.
Las características morfológicas y biológicas de este proceso son: irreversibilidad, la célula afectada no se distingue morfológicamente de la célula normal (es necesario que se produzca al menos un ciclo celular completo con división de la misma para que se “fije” el daño inducido), y la eficiencia del proceso de iniciación, que puede ser modulada por agentes exógenos y/u hormonas endógenas.
PromociónUna vez que una célula ha sido mutada por un iniciador, es susceptible a los efectos de los promotores. Estos compuestos promueven la proliferación de la célula, dando origen a un gran número de células hijas que contienen la mutación creada por el iniciador. Los promotores no tienen efecto cuando el organismo en cuestión no ha sido tratado previamente con un iniciador.
Los promotores comúnmente son específicos para una especie o tejido en particular, gracias a su interacción con receptores presentes, en distintas cantidades y en distintos tipos de tejido.
ProgresiónEl agente de progresión es el compuesto químico capaz de convertir una célula iniciada o en estado de promoción en una célula potencialmente maligna.
La progresión de la carcinogénesis se puede producir también mediante la incorporación en el genoma de información genética exógena (por ejemplo, de virus) o alteraciones cromosómicas espontáneas. Esta también es una etapa irreversible1.
En síntesis, las etapas de la carcinogénesis comprenden:
- -
Iniciación: cuando se inicia la modificación del ADN de la célula.
- -
Promoción: duplicación de células mutadas.
- -
Progresión: cuando un clon ya está establecido.
Los agentes quimiopreventivos requieren de un prolongado tiempo de acción para ejercer sus efectos protectores. Sus propiedades deben brindar un beneficio, con mínima toxicidad y excelente tolerancia.
Numerosos ensayos prospectivos han mostrado las ventajas de la quimioprevención: el National Surgical Adyuvant Breast And Bowel Project (NSABP), Breast Cancer Prevention Trial (BCPT) P1 fue el primer estudio publicado en el año 1998 que demostró el beneficio de la quimioprevención empleando tamoxifeno en una población de más de 13.000 mujeres con los factores de riesgo reconocidos en el modelo de Gail (edad, menarca</=11años, primer nacido vivo>/=30 años, nuliparidad, lobulillar in situ, antecedente de cáncer de mama en primer grado, antecedente de biopsia de mama e hiperplasia atípica). En este ensayo se empleó tamoxifeno 20mg por día versus placebo por 5 años y los resultados mostraron: una disminución del riesgo de cáncer invasor del 49%; un incremento de la aparición de riesgo de cáncer de endometrio RR de 2,53; incremento de enfermedad tromboembólica pulmonar RR de 3,01; incremento de trombosis venosa profunda RR de 1,60; incremento de trombosis cerebrovascular RR de 1,59; y disminución de la aparición de fracturas2.
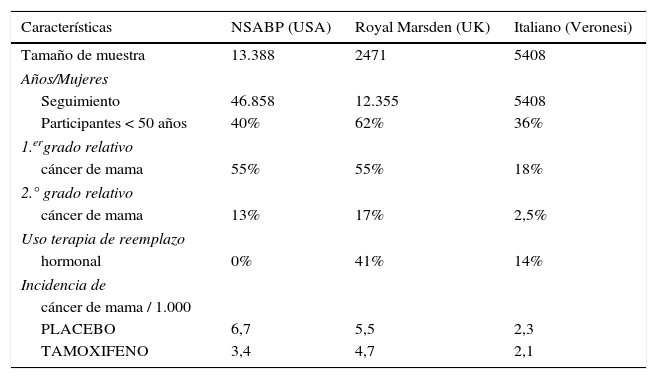
A este ensayo americano de prevención siguieron el estudio del Royal Marsden del Reino Unido y el italiano3,4. Ambos compararon el efecto del tamoxifeno vs. placebo (los factores de riesgo seleccionados pueden observarse en la tabla 6). A esos ensayos se les criticó que la población era insuficiente y que se habían incluido pacientes a las que se les había permitido el empleo de terapia de reemplazo hormonal (41% en la población británica y 14% en la población italiana), por lo que el beneficio con tamoxifeno podría haber estado afectado.
Comparación de los ensayos de quimioprevención con tamoxifeno
| Características | NSABP (USA) | Royal Marsden (UK) | Italiano (Veronesi) |
|---|---|---|---|
| Tamaño de muestra | 13.388 | 2471 | 5408 |
| Años/Mujeres | |||
| Seguimiento | 46.858 | 12.355 | 5408 |
| Participantes < 50 años | 40% | 62% | 36% |
| 1.ergrado relativo | |||
| cáncer de mama | 55% | 55% | 18% |
| 2.° grado relativo | |||
| cáncer de mama | 13% | 17% | 2,5% |
| Uso terapia de reemplazo | |||
| hormonal | 0% | 41% | 14% |
| Incidencia de | |||
| cáncer de mama / 1.000 | |||
| PLACEBO | 6,7 | 5,5 | 2,3 |
| TAMOXIFENO | 3,4 | 4,7 | 2,1 |
Si bien en su primera publicación los ingleses e italianos no mostraron diferencias en relación con el grupo que había recibido tamoxifeno, posteriormente se observó en el ensayo del Royal Marsden Hospital, tras un seguimiento a 20 años, una reducción estadísticamente significativa en la incidencia de cáncer de mama en el grupo de mujeres con receptores de estrógenos positivos (RE+) que habían recibido tamoxifeno (HR: 0,48; 95% IC: 0,29-20,79).
El estudio italiano de prevención con tamoxifeno extendió su análisis de 5 años a 11, y en el análisis postratamiento también se observó una reducción estadísticamente significativa en la incidencia de cáncer de mama RE+en las mujeres con alto riesgo en el grupo con tamoxifeno (RR: 0;24; 95% IC: 0,1 a 10,59). Las mujeres de alto riesgo fueron seleccionadas en base a varios criterios, entre ellos: la edad de la menarca, no tener antecedentes de embarazo ni de ooforectomía bilateral (se permitió al menos un ovario intacto).
El análisis a largo plazo de estos ensayos europeos mostró que el tamoxifeno también beneficiaba la reducción de la aparición del cáncer de mama en el período postratamiento.
En el año 2006 se conocieron los resultados del Study of Tamoxifen and Raloxifene (STAR) NSABP – P2, donde se comparaba el uso de tamoxifeno 20mg/día durante 5 años vs. el raloxifeno 60mg/día durante 5 años. Participaron 22.000 mujeres entre 35 y 59 años con factores de riesgo (modelo de Gail), mujeres posmenopáusicas y mujeres mayores de 60 años con cáncer lobulillar in situ con Gail igual o mayor 1,67%, donde el end point primario era la reducción de la incidencia del cáncer de mama invasor.
En los resultados tamoxifeno vs. raloxifeno, no se observó diferencia en la aparición de cáncer de mama invasor entre los dos grupos. Por ello, se dedujo que el raloxifeno es una alternativa efectiva al tamoxifeno, para reducir la incidencia de cáncer invasor en mujeres posmenopáusicas. Sin embargo, con raloxifeno se observó una menor incidencia de cáncer de endometrio, fenómenos de trombosis venosa y embolia pulmonar.
En el año 2010 se realizó un análisis actualizado del ensayo STAR con un seguimiento de 81 meses. En esta nueva evaluación no hubo diferencia estadísticamente significativa entre el raloxifeno y el tamoxifeno en la incidencia de cáncer de mama invasor (RR: 1,24; 95% IC: 1,05-1,47), pero sí se observó una disminución en la incidencia de la enfermedad no invasiva, que se acercó a la significación estadística (RR: 1,22; 95% IC: 0,95-1,59).
Además, en el análisis a largo plazo, las mujeres en el grupo con raloxifeno tuvieron un riesgo significativamente menor de cáncer de endometrio, un resultado no observado en el estudio inicial (RR: 0,55; 95% IC: 0,36 a 30,83)5.
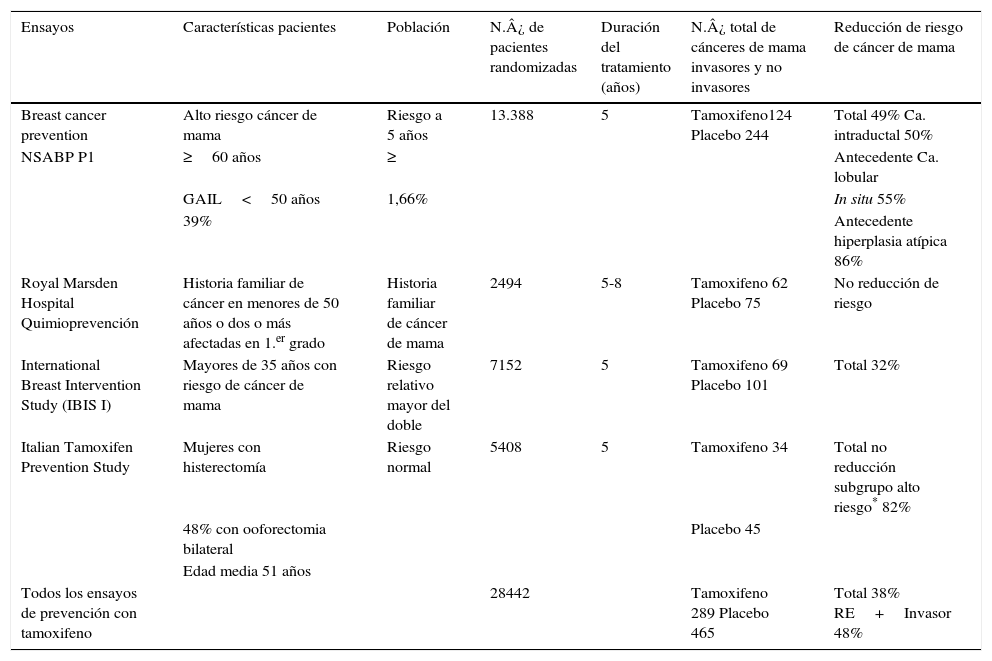
Otro estudio sobre quimioprevención fue el International Breast Cancer Intervention Study I (IBIS-I), que mostró una reducción del riesgo de cáncer de mama con tamoxifeno en una muestra de 7152 pacientes entre 35-70 años. El diseño fue tamoxifeno vs. placebo en mujeres con incremento de riesgo de desarrollar cáncer de mama, con historia familiar de cáncer de mama y biopsias previas. En la tabla 7 se resumen los resultados de todos los ensayos6.
Resumen de los resultados de todos los estudios de quimioprevención
| Ensayos | Características pacientes | Población | N.¿ de pacientes randomizadas | Duración del tratamiento (años) | N.¿ total de cánceres de mama invasores y no invasores | Reducción de riesgo de cáncer de mama |
|---|---|---|---|---|---|---|
| Breast cancer prevention | Alto riesgo cáncer de mama | Riesgo a 5 años | 13.388 | 5 | Tamoxifeno124 Placebo 244 | Total 49% Ca. intraductal 50% |
| NSABP P1 | ≥60 años | ≥ | Antecedente Ca. lobular | |||
| GAIL<50 años | 1,66% | In situ 55% | ||||
| 39% | Antecedente hiperplasia atípica 86% | |||||
| Royal Marsden Hospital Quimioprevención | Historia familiar de cáncer en menores de 50 años o dos o más afectadas en 1.er grado | Historia familiar de cáncer de mama | 2494 | 5-8 | Tamoxifeno 62 Placebo 75 | No reducción de riesgo |
| International Breast Intervention Study (IBIS I) | Mayores de 35 años con riesgo de cáncer de mama | Riesgo relativo mayor del doble | 7152 | 5 | Tamoxifeno 69 Placebo 101 | Total 32% |
| Italian Tamoxifen Prevention Study | Mujeres con histerectomía | Riesgo normal | 5408 | 5 | Tamoxifeno 34 | Total no reducción subgrupo alto riesgo* 82% |
| 48% con ooforectomia bilateral | Placebo 45 | |||||
| Edad media 51 años | ||||||
| Todos los ensayos de prevención con tamoxifeno | 28442 | Tamoxifeno 289 Placebo 465 | Total 38% RE+Invasor 48% |
El estudio de The National Cancer Institute of Canada, denominado Clinical Trials Group MAP.3: an international breast cancer prevention trial (NCIC CTG MAP.3)7, fue un ensayo doble ciego de 4560 mujeres posmenopáusicas con una edad media de 62,5 años y un riesgo de Gail con score 2,3% de incremento de riesgo de cáncer de mama. Las mujeres se randomizaron al recibir: exemestano 25mg por día por 5 años vs. placebo 1 comprimido por 5 años. El end point primario fue la incidencia de cáncer de mama invasivo. Se excluyó a las mujeres premenopáusicas que tenían un historial de cáncer de mama invasivo o intraductal (CDIS) tratadas con tumorectomía, o que presentaran mutación del BRCA1 o BRCA2.
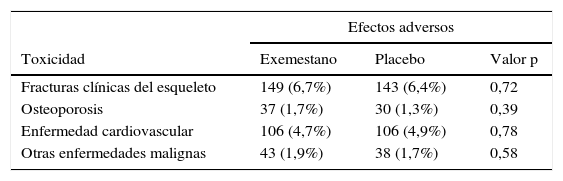
En el MAP.3 el exemestano redujo en un 65% las probabilidades de contraer cáncer de mama. La incidencia anual de cáncer de mama invasivo y no invasivo (carcinoma ductal in situ) fue del 0,35% con exemestano y de 0,77% con placebo (hazard ratio [HR] 0,47; 95% IC 0,27-0,79; p=0,004). Los eventos adversos se presentaron en el 88% del grupo con exemestano y en el 85% del grupo placebo, por lo que no hubo diferencia significativa (tabla 8).
Una muy reciente publicación sobre la calidad de vida de las pacientes que participaron en este ensayo clínico ha mostrado que el grupo que recibió exemestano tuvo leves efectos adversos que repercutieron en los síntomas vasomotores, sexuales y el dolor (producido sobre todo en los primeros 6 meses a 2 años después de la asignación aleatoria). Los eventos de importancia clínica provocados por el exemestano fueron 8% más en el dominio vasomotor y 4% más en el área sexual y del dolor. No se observaron otras diferencias entre los dos grupos. La calidad de vida se vio afectada un poco más en el grupo con exemestano (32%) que en el grupo placebo (28%).
En el Simposio de Cáncer de Mama de San Antonio de 2013, el Dr. Jack Cuzik presentó el estudio IBIS-II. Este ensayo se inició para investigar si el anastrozol se podía utilizar con eficacia para prevenir el cáncer de mama8,9. En este, se incluyeron 3864 mujeres posmenopáusicas entre 40 y 70 años con riesgo elevado de desarrollar cáncer de mama, en función de una serie de criterios de inclusión, entre los cuales figuraban tener dos o más familiares consanguíneos con cáncer de mama, tener una madre o hermana con antecedente de cáncer de mama antes de los 50 años, o tener una madre o hermana con antecedente de cáncer de mama bilateral. De las participantes, a 1920 se les asignó aleatoriamente la terapia con anastrozol 1mg por día y a 1944 un placebo durante cinco años.
Al completar el seguimiento a cinco años, 40 mujeres en el grupo de anastrozol (2%) y 85 en el grupo placebo (4%) habían desarrollado cáncer invasor de mama. La incidencia acumulada prevista para después de 7 años de seguimiento fue de 5,6% de mujeres con cáncer de mama en el grupo con placebo frente al 2,8% en el grupo con anastrozol.
Los resultados iniciales tras cinco años de seguimiento muestran que para las mujeres posmenopáusicas que tienen un alto riesgo de desarrollar la enfermedad, el anastrozol reduce la incidencia de cáncer de mama en un 53% en comparación con las mujeres asignadas a placebo. Además, se notificaron muy pocos efectos secundarios, en su mayoría pequeños aumentos de dolores musculares y sofocos. La incidencia de cáncer de mama entre mujeres posmenopáusicas con alto riesgo de desarrollar la enfermedad se redujo significativamente con anastrozol, indicando que el fármaco puede ser una nueva opción eficaz para la prevención del cáncer de mama para este grupo de mujeres
Así, el estudio NCIC CTG MAP.3 determinó que el tratamiento con exemestano consigue reducir un 65% las probabilidades de contraer cáncer de mama, mientras que el estudio IBIS II estableció que el anastrozol reduce la incidencia de cáncer de mama en un 53% en comparación con las mujeres que ingirieron placebo.
Los expertos han revisado los nuevos datos sobre el uso preventivo del tamoxifeno y el raloxifeno para la quimioprevención del cáncer de mama. Entre ellos, se destacan: el US Preventive Services Task Force (USPSTF), el National Institute for Health and Care Excellence (NICE, junio 2013), la Sociedad Americana de Oncología Clínica (ASCO), Kala Visvanathan (según la revisión de ensayos controlados randomizados y metaanálisis publicados entre junio de 2007 y junio de 2012) y la National Comprehensive Cancer Network (NCCN, 2014)7,10–13.
Por todo lo referido, y siguiendo recomendaciones de diferentes sociedades y trabajos internacionales presentados, se concluye que la indicación de quimioprevención está recomendada en pacientes de alto riesgo5,7,14-25: en mujeres de 35 años o más con incremento de riesgo de cáncer de mama hay que indicar tamoxifeno 20mg por día por 5 años; y en mujeres posmenopáusicas se debe indicar tamoxifeno 20mg por día por 5 años o raloxifeno 60mg por día por 5 años, o exemestano 25mg por día por 5 años.
Se considera como incremento de riesgo absoluto individual proyectado a 5 años ≥ 1,66% (según el National Cancer Institute BC Risk Assessment Tool, o una medición equivalente) o mujeres con diagnóstico de carcinoma lobular in situ.
Hay acuerdo sobre la necesidad de conversar con las mujeres con alto riesgo de cáncer de mama, los beneficios de la quimioprevención y también los efectos adversos. Actualmente no existe evidencia que avale el uso de quimioprevención en mujeres portadoras de la mutación BRCA1, mientras que en las mujeres portadoras de la mutación BRCA2, un pequeño subgrupo de análisis en el estudio NSABP-P1 mostró un beneficio significativo con quimioprevención en la reducción de riesgo de cáncer de mama.
Recomendación de quimioprevenciónMujeres de alto riesgoPremenopáusicas:
- -
tamoxifeno 20mg por día durante 5 años
Posmenopáusicas:
- -
tamoxifeno 20mg por día durante 5 años
- -
raloxifeno 60mg por día durante 5 años
- -
exemestano 25mg por día durante 5 años
Recientes revisiones de metaanálisis han examinado la incidencia global de cáncer en pacientes con diabetes que tomaban metformina. Muchos de los estudios incluidos fueron retrospectivos y han sugerido que los pacientes con diabetes tratados con metformina tienen aproximadamente un tercio de reducción en la incidencia global de cáncer, con un riesgo relativo de 0,67 (95% IC: 0,53 - 0,85).
La metformina, que estimula el ingreso de glucosa a las células con disminución de los niveles de insulina, se ha asociado con una menor incidencia del cáncer colorrectal.
Los estudios de cáncer hepatocelular, de páncreas y de mama han mostrado que la mortalidad específica y la mortalidad global en los pacientes por cáncer es más baja en los pacientes con diabetes a los que se prescribe metformina, en comparación con aquellos que no la utilizan (HR 0,66; 95% IC: 0,55 a 0,79/ HR 0,62; 95% IC: 0,46-0,84, respectivamente).
Si bien las conclusiones de los estudios observacionales son provocativas, es necesario tener precaución en su traslación a la práctica clínica. No recomendamos el uso de la metformina como un agente anticancerígeno (en la prevención o en el de tratamiento del cáncer de mama) hasta tener información más convincente disponible. Hay por lo menos tres ensayos randomizados en fase III en curso que involucran metformina. Estos deberían proporcionar una información definitiva sobre sus efectos anticancerígenos1,2.
Las carnes rojas pueden incrementar el riesgo de cáncer de mama. El consumo de carnes rojas durante la premenopausia puede incrementar el riesgo de cáncer de mama si se compara con mujeres que consumen en su dieta proteínas provenientes de aves de corral, pescado, huevos, nueces y legumbres. El análisis de 90.000 mujeres fuertes consumidoras de carnes rojas se asoció con un riesgo relativo del 22% más que las mujeres consumidoras de bajos niveles de carnes rojas1.
En marzo de 2007, en la décima conferencia internacional “Tratamiento Primario del Cáncer Inicial de Mama”, que se desarrolló en Saint Gallen (Suiza), se mencionaron las propiedades que tenían algunos principios activos del té verde. Al respecto, se refirieron al impacto en estudios experimentales de uno de sus componentes biológicos activos que suprime factores de crecimiento en las células de cáncer de mama. Por su parte, en enero de 2010, I-Hsin Lin hizo expresa referencia en la American Association for Cancer Research-International y en la Association for the Study of Lung Cancer (AACR-IASLC): “El té verde contiene antioxidantes que llamamos polifenoles y que en el caso del té tienen efectos inhibidores de la carcinogénesis, es decir, de la aparición o proliferación de las células malignas y del crecimiento del tumor”2.
También se han reconocido los beneficios preventivos del consumo de fitoestrógenos. Estos tienen acciones antioxidantes, antiestrógenicas y antiproliferativas. Los productos ricos en fitoestrógenos son: cebada, trigo, cereza, zanahoria, col, aceite de coco, canela, apio, avena, aceite de oliva, lima, hinojo, aceite de maní, ginseng, arroz, tilo, nueces, lúpulo, ciruela, papas, soja y semillas de lino y de sésamo.
Por el contrario, el consumo de grasas animales y la alta ingesta de alcohol se asocian con un incremento de riesgo de cáncer de colon, recto y, probablemente, de próstata y mama.
Las dietas ricas en vegetales, frutas, granos y nueces disminuyen el riesgo de enfermedades coronarias y diabetes tipo II3. Siempre llamó la atención que la población de los países mediterráneos, sobre todo los griegos, padecieran mucho menos cánceres respecto de otras poblaciones del mundo. Por ello, se empezó a estudiar el aceite que consumían, esto es, el aceite de oliva, que es rico en ácido oleico, es decir, grasas monoinsaturadas que disminuyen notoriamente los riesgos de enfermedades oncológicas.
Modificaciones en el estilo de vidaEn relación con la dieta, el aumento de peso, las actividades físicas y el consumo de alcohol se consideran algunos de los componentes modificables del riesgo del cáncer de mama.
La obesidad aumenta el riesgo de cáncer de mama en mujeres posmenopáusicas y hace tiempo se sabe que contribuye al riesgo de varias enfermedades no transmisibles, como la diabetes o las del corazón. Recientemente, la atención se ha centrado en la relación entre la obesidad y el cáncer, con estudios que han demostrado que las personas obesas tienen un riesgo significativamente mayor de desarrollar y morir de cáncer, en comparación con los no obesos. Más de 40.000 diagnósticos de cáncer cada año se atribuyen a la obesidad y el sobrepeso4–10.
La actividad física recreativa fue asociada con una disminución de riesgo del cáncer invasor de mama, con más de 6 horas por semana de actividad recreacional intensa (odds ratio: reducción 23% de cáncer invasor de mama [p=0,05; 95% IC: 0,65-0,92], en comparación con mujeres sin actividad recreacional [p=0,02, reducción de riesgo limitada a mujeres sin historia familiar de primer grado])11–15.
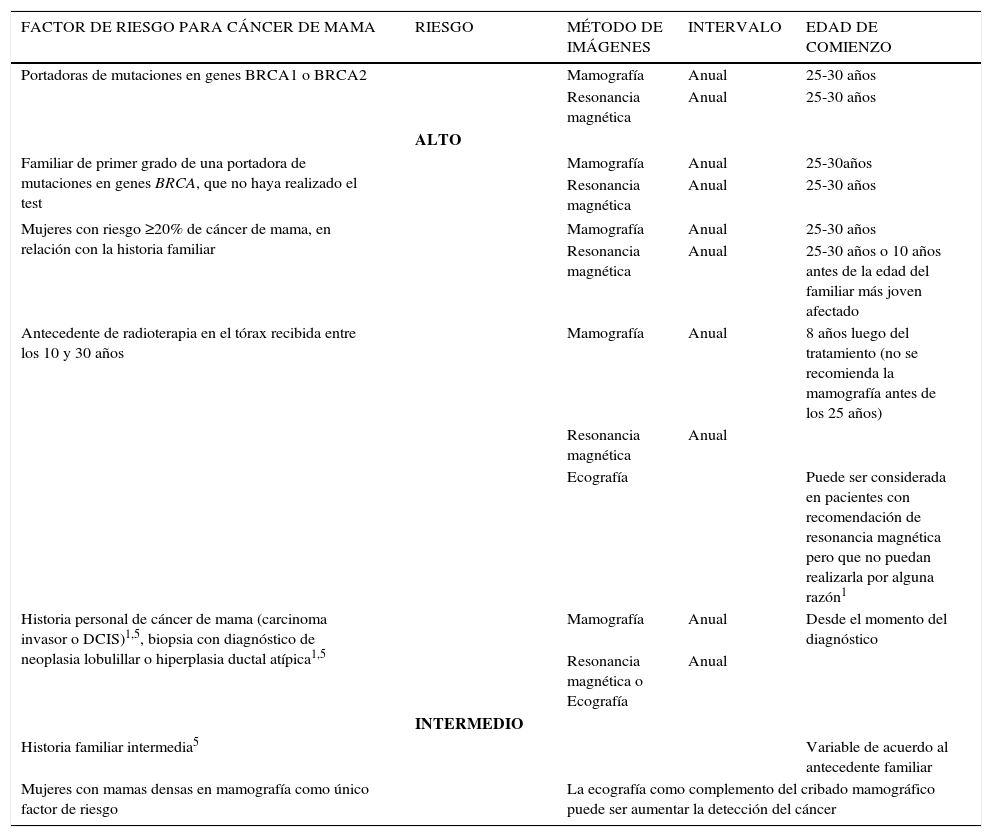
En las mujeres con alto riesgo de cáncer de mama, se han agregado otros métodos de cribado junto con la mamografía, particularmente en aquellas con riesgo hereditario, para las cuales el cribado mamográfico puede tener baja sensibilidad.
En la actualidad la RM es el método de cribado recomendado, más la mamografía, para las mujeres con alto riesgo de cáncer de mama, es decir, mayor o igual a 20-25%1–5.
Dentro del grupo de alto riesgo, se consideran candidatas al cribado mediante Mx+RM a:
- -
Mujeres portadoras de mutaciones para cáncer de mama hereditario: mutaciones en genes BRCA1 y/o 2, o familiares de primer grado que no cuentan con el test genético, síndromes de Li-Fraumeni, Cowden, Bannayan-Riley-Ruvalcaba, o familiares de primer grado.
- -
Mujeres con riesgo de 20-25% (o mayor) definido por la prueba BRCAPRO u otros tests, que dependen en gran medida de los antecedentes familiares.
- -
Antecedentes de radioterapia en el tórax recibida antes de los 30 años.
- -
La combinación de los criterios antes mencionados.
Las sociedades que recomiendan la utilización de la RM junto con la Mx en mujeres de alto riesgo para cáncer de mama, son la Sociedad de Imágenes de la Mama (SBI), el Colegio Americano de Radiología (ACR), la Sociedad Americana del Cáncer (ACS), la Sociedad Europea de Especialistas en Cáncer de Mama (EUSOMA) y la Sociedad Europea de Imágenes de la Mama (EUSOBI)1–4.
Desde finales de la década del 90, la RM es parte del cribado en mujeres con alto riesgo de cáncer de mama2. En los últimos 10 años se han realizado varios estudios prospectivos no randomizados para analizar los resultados de la implementación de la RM en el cribado de este grupo poblacional. La RM demostró una sensibilidad dos veces mayor que la Mx en los estudios multicéntricos con el número de pacientes más significativo5–10. Sardanelli et al.11 y Warner et al.12 realizaron un análisis combinado de 5 estudios prospectivos (3571 pacientes) y la revisión de 11 estudios, mostrando similares resultados: una sensibilidad del 81% para la RM y del 40% para la Mx en el estudio de Sardanelli, mientras que el de Warner fue del 77% y 39%, respectivamente. La tasa de cáncer de intervalo fue inferior al 10% en todos los estudios y casi todos los cánceres de mama ocurrieron en portadoras de mutaciones. Por lo tanto, varios estudios prospectivos han demostrado que la utilización de la RM en el cribado de mujeres con alto riesgo de cáncer de mama familiar incrementó la detección de la enfermedad, en comparación con el cribado mamográfico6-9,13,14. Todos estos estudios han demostrado mayor sensibilidad para el cribado por RM, comparado con el mamográfico y ecográfico en el grupo de alto riesgo.
Entre las ventajas de utilizar la RM en el grupo de mujeres de alto riesgo se encuentran: el aumento de cánceres detectados (mayor sensibilidad); el tamaño tumoral significativamente más pequeño, al igual que el número de tumores con compromiso axilar, traduciéndose en tumores detectados en estadios más bajos; una tasa más baja de cáncer de intervalo; y un costo aceptable5.
El número de casos diagnosticados por RM+Mx en mujeres con alto riesgo fue del 93%, en comparación con el uso solo de Mx (36%) y Mx+US (52%)5. La RM, como único método, mostró una sensibilidad muy alta (71-100%) y un valor predictivo positivo de 17-63%15.
El tamaño promedio de los cánceres detectados por RM fue pequeño (7-18mm) y el compromiso axilar se encontró en el 15-16% de los casos, comparado con el 30-45% en el cribado mamográfico5. La tasa promedio de cáncer de intervalo fue 5,4%, comparado con el 43-60% del cribado mamográfico5.
Algunos estudios concluyeron que el cribado con Mx+RM en mujeres con alto riesgo es costo-efectivo5,16-18. Las tasas de mujeres citadas nuevamente (8-17%), de biopsia (3-15%) y de seguimiento (7-11%) se encontraron dentro de valores aceptables5.
En relación con las mujeres de riesgo intermedio (es decir, 15-20%), el cribado por RM es aún un interrogante1. La ACS no se mostró ni a favor ni en contra de su utilización1,2. Sin embargo, tanto la ACS como el ACR y la SBI coinciden en que el cribado por RM de las mujeres con riesgo promedio de cáncer de mama (menor de 15%) es inapropiado.
Existen requerimientos técnicos para la realización de una RM de mama. El examen debe realizarse en equipos 1.5 o 3 Tesla, con bobina dedicada de mama. Con el fin de reducir el riesgo de falsos positivos, se recomienda la realización de la RM en las mujeres premenopáusicas, entre los días 6-13 del ciclo menstrual, aun con el uso de anticonceptivos orales19.
Varios estudios que compararon la Mx, el US y la RM han demostrado una mayor sensibilidad de la RM para la detección del cáncer en mujeres con alto riesgo7,9,20. La utilización del US en el cribado de este grupo poblacional no agrega ningún beneficio adicional con respecto al cribado con Mx+RM1. Sin embargo, el US puede tener un rol complementario en el cribado de las mujeres de alto riesgo cuando existe una contraindicación para la realización de la RM o en mujeres con alto riesgo menores de 34 años, ya que existe evidencia a favor de una mayor radiosensibilidad1,3,21. Al respecto, el EUSOMA recomienda que en las menores de 34 años la Mx se evite, debido a que no se ha comprobado que el beneficio supere el riesgo de radiación de la Mx3,21. En consecuencia, aconsejan RM+US anual en mujeres de 25-35 años y RM+Mx anual en mayores de 35 años. Por el contrario, las guías norteamericanas (ACS, ACR, SBI, NCCN) recomiendan Mx+RM en mujeres menores de 35 años, argumentando que la radiación de la Mx en portadoras de mutaciones en genes BRCA no está asociada a un gran incremento en el riesgo de cáncer de mama22. En mujeres portadoras de mutaciones en p53 (síndrome de Li-Fraumeni) entre 20-29 años, se recomienda el cribado anual solo con RM (preferentemente) o Mx si la RM no está disponible o individualizado en relación con la edad del familiar más joven afectado23.
Estudios multicéntricos recientes, como el EVA24 y el italiano HIBCRIT25, han evaluado el rol de los diferentes métodos de imágenes en las mujeres con alto riesgo y concluyeron de manera similar que la tasa de detección de la RM no aumenta significativamente cuando se la combina con la Mx, US o ambas y que la mayoría de los cánceres son detectados en el cribado anual (no se detectó cáncer de intervalo en el estudio EVA y en el italiano el porcentaje fue de 0,2%)24,25. El análisis EVA demostró que el US adicional a los 6 meses de intervalo no contribuyó en la detección de cánceres adicionales24.
En mujeres con alto riesgo a las que no se les realizó una mastectomía reductora de riesgo luego del diagnóstico del cáncer primario, se recomienda el seguimiento con RM debido al alto riesgo de un segundo tumor. Las portadoras de mutaciones en los genes BRCA tienen un riesgo de 29,5% de cáncer contralateral a 10 años y un riesgo en el tiempo de vida del 40%5.
En la actualidad el debate se centra en la recomendación de seguimiento en aquellas mujeres con mayor riesgo de cáncer de mama, pero que no cumplen los criterios para la indicación de la RM como método de cribado y en las que la Mx puede tener una sensibilidad limitada5. Se considera dentro de este grupo a aquellas con15:
- -
historia personal de cáncer de mama,
- -
diagnóstico histológico previo de carcinoma lobulillar in situ, hiperplasia lobulillar atípica o hiperplasia ductal atípica,
- -
historia familiar intermedia,
- -
mamas densas en Mx.
Las mujeres con historia familiar intermedia de cáncer de mama tienen un riesgo del 15-20% de padecer la enfermedad, según la definición de BRCAPRO y otros tests. Las principales sociedades europeas y americanas no incluyen específicamente la recomendación de la RM como método complementario en este grupo poblacional. El ACS y la EUSOMA sostienen que no existe evidencia suficiente para la recomendación de la RM junto con el cribado con Mx, mientras que la SBI y el ACR concluyen que la RM puede ser considerada en mujeres con riesgo de 15-20%, teniendo en cuenta la historia familiar de cáncer de mama u ovario5.
En relación con las mamas densas por Mx, aproximadamente el 50% de las mujeres menores de 50 años y un tercio de las mayores de 50 tienen mamas densas en la Mx15. El grado de densidad mamográfica tiene características de riesgo intermedio y es, a su vez, el predictor mas importante de la sensibilidad Mx a cualquier edad26,27. Tanto Berg28, en una revisión de estudios de diferentes centros, como dos estudios multicéntricos (Corsetti29 y ACRIN 666630, este último en pacientes de alto riesgo), reportaron que el cribado suplementario con US en pacientes con mamas densas tiene un rendimiento adicional para la detección de cáncer. El uso de la US junto con la Mx aumenta la sensibilidad para la detección del cáncer en un 20%29. Por otra parte, hasta la actualidad, no existe evidencia suficiente para la recomendación del uso de la RM como método de cribado en pacientes de riesgo intermedio, según el ACS, EUSOMA y EUSOBI5. De todas formas, debe resaltarse que la RM tiene la mayor sensibilidad y conserva una alta especificidad5.
Resumen manejo imagenológico*Por factor de riesgo: recomendaciones del ACR y SBI1 (tabla 9).
Tabla 9.Manejo imagenológico por factor de riesgo1
FACTOR DE RIESGO PARA CÁNCER DE MAMA RIESGO MÉTODO DE IMÁGENES INTERVALO EDAD DE COMIENZO Portadoras de mutaciones en genes BRCA1 o BRCA2 Mamografía Anual 25-30 años Resonancia magnética Anual 25-30 años ALTO Familiar de primer grado de una portadora de mutaciones en genes BRCA, que no haya realizado el test Mamografía Anual 25-30años Resonancia magnética Anual 25-30 años Mujeres con riesgo ≥20% de cáncer de mama, en relación con la historia familiar Mamografía Anual 25-30 años Resonancia magnética Anual 25-30 años o 10 años antes de la edad del familiar más joven afectado Antecedente de radioterapia en el tórax recibida entre los 10 y 30 años Mamografía Anual 8 años luego del tratamiento (no se recomienda la mamografía antes de los 25 años) Resonancia magnética Anual Ecografía Puede ser considerada en pacientes con recomendación de resonancia magnética pero que no puedan realizarla por alguna razón1 Historia personal de cáncer de mama (carcinoma invasor o DCIS)1,5, biopsia con diagnóstico de neoplasia lobulillar o hiperplasia ductal atípica1,5 Mamografía Anual Desde el momento del diagnóstico Resonancia magnética o Ecografía Anual INTERMEDIO Historia familiar intermedia5 Variable de acuerdo al antecedente familiar Mujeres con mamas densas en mamografía como único factor de riesgo La ecografía como complemento del cribado mamográfico puede ser aumentar la detección del cáncer *Resonancia magnética en mujeres de alto riesgo: recomendaciones del ACR, SBI, ACS, EUSOMA y EUSOBI1–4 (tabla 10).
Tabla 10.Resonancia magnética en mujeres de alto riesgo1–5
RECOMENDACIONES DE LA RESONANCIA MAGNÉTICA JUNTO CON LA MAMOGRAFÍA EN EL CRIBADO DE MUJERES CON RIESGO ≥ 20-25%. Mujeres portadoras de mutaciones para cáncer de mama hereditario: portadoras de mutaciones en los genes BRCA 1 y/o 2, o familiares de primer grado que no hayan realizado el test. Basada en la evidencia Mujeres con riesgo de 20-25% (o mayor) definidos por BRCAPRO (u otros tests), que dependen en gran medida de los antecedentes familiares. Basada en la evidencia Mujeres portadoras de mutaciones para cáncer de mama hereditario: síndromes de Li-Fraumeni, Cowden, Bannayan-Riley-Ruvalcaba, o familiares de primer grado. Basada en la opinión de un consenso de expertos Historia de radioterapia recibida antes de los 30 años (aumenta 8 veces el riesgo de cáncer de mama, luego de la radioterapia en el tórax). Basada en la opinión de un consenso de expertos Combinación de los criterios mencionados.
La psicooncología es una subespecialidad de la psiquiatría de enlace, incorporada a la medicina en el proceso de atención de los pacientes con cáncer. Ha tenido un desarrollo creciente en los últimos 20 años1. Las pacientes y familias con alto riesgo de cáncer de mama presentan una serie de particularidades, respecto a otros pacientes con cáncer, que aumenta su vulnerabilidad y repercusión emocional2–4. Estas son:
*Historia familiar de cáncer: como testigos directos de la enfermedad, esto puede generar experiencias traumáticas o situaciones no resueltas, que serán un condicionante en el miedo a desarrollar cáncer5–7.
*Percepción de riesgo alta: es el temor que el sujeto tiene a tener cáncer, fuertemente determinado por aspectos psicosociales. Es por esta razón que se habla de percepción de riesgo (PR) emocional o afectivo, más que una valoración cognitiva objetiva. Es determinante en las decisiones de las medidas dirigidas a prevenir la enfermedad y, en ocasiones, puede afectar las recomendaciones de vigilancia. En general las personas que acuden al AGO sobreestiman su riesgo a desarrollar cáncer. En consecuencia, pueden tomar decisiones drásticas, de extrema precaución, para reducir el riesgo, como la realización de una mastectomía de reducción de riesgo, cuando su riesgo de desarrollar cáncer es menor que el que ellas estiman. Se ha demostrado que si bien el AGO mejora la PR, es probable que persistan errores de estimación por fallas en la comprensión o factores emocionales5,7–13.
*Tomar decisiones de riesgo: es una serie de decisiones vinculadas a su condición de pacientes y familias con alto riesgo de cáncer de mama y/o potencial mutación genética. Implica un proceso en el que deben tomar decisiones y que les genera un importante estrés, ya desde el momento que se decide iniciar la consulta en la unidad de AGO:
- -
Concurrir a la consulta
- -
Realizar o no la prueba genética
- -
Informar a la familia
- -
Adoptar medidas de prevención, de reducción del riesgo o vigilancia de alto riesgo
- -
Es importante que se comprenda que no son decisiones urgentes y que se puede y debe deliberar sobre la información que se va recibiendo. Algunas de estas serán irreversibles (conocer el resultado del test genético o las cirugías de reducción de riesgo)5,7,8,11,14.
El 43% de los individuos que completan la entrevista inicial no se realizan el test o no continúan. La aprehensión emocional acerca del impacto que les causaría el resultado fue la principal razón para declinar (Instituto Nacional del Cáncer de USA).
*Culpa por ser transmisores del riesgo a sus hijos.
*Factores psicológicos: ansiedad, preocupación por el cáncer y miedos, se relacionan estrechamente con la experiencia de cáncer en la familia. Los altos niveles de ansiedad pueden afectar el cumplimiento de las medidas de prevención, así como interferir en la comprensión de la información7,9.
*Factores sociodemográficos: tener hijos pequeños, ser joven5,7,11.
*Compromiso intenso con el sistema de salud.
*Riesgo de segundos tumores.
Asesoramiento genético oncológico. Aspectos psicosocialesEl proceso comunicacional del AGO debe ser realizado por profesionales capacitados y con habilidades y competencias en el área comunicacional, adecuándose siempre a las necesidades y deseos de saber de cada paciente. Deberá conocer los aspectos psicológicos y emocionales del proceso, y saber que constituye una importante fuente de estrés, independientemente de la realización del test genético. Para el abordaje integral de los pacientes y familias, deberá constituirse un equipo multidisciplinario7,8,11.
Siempre se debe valorar el nivel de información que tienen los pacientes y comprobar si estos comprendieron los conceptos transmitidos. Tras el AGO, el nivel de información adecuada aumenta hasta un 66%5,7-10,12.
Dentro de los temas psicosociales del AGO se priorizan5,7-9:
- -
El manejo del estrés y la ansiedad
- -
La discusión acerca de la comunicación familiar
- -
La culpa
Existe un acuerdo general sobre los beneficios del asesoramiento acerca del riesgo, sin que esto induzca o aumente la morbilidad psicológica3-5,7,9,11,15.
El AGO tiene efectos positivos en forma global en la disminución de las preocupaciones y ansiedad ante el cáncer, en el nivel de estrés y ansiedad general, y no produce efectos negativos en la calidad de vida de los participantes5,9,15.
No obstante, para algunos sujetos recibir un resultado positivo para una mutación, cuando no hay un tratamiento eficaz, puede desencadenar descompensaciones desde el punto de vista psicosocial. Por ello, resulta de suma importancia detectar este grupo de riesgo y derivarlo al psicooncólogo.
Los efectos psicológicos observados durante el proceso de AGO son variados, según el resultado del estudio molecular, y no estables a lo largo del tiempo, desde que se inicia la primera consulta hasta un año después de recibir los resultados12,13,16.
Los participantes con resultados positivos muestran mayor morbilidad psicológica. Se genera un aumento de la ansiedad y del nivel de preocupación por el cáncer en el período posterior a la comunicación de los resultados, normalizándose habitualmente después de un año3,5,7-11,13,16,17.
Aquellos con resultados no informativos pueden verse afectados negativamente8,16–18. Las pacientes con resultados negativos tienen un menor nivel de malestar emocional (distrés) y percepción de riesgo a lo largo del seguimiento (seis años)8.
El estrés será mayor en algunas situaciones1,3-5,7–13,15,17,19:
- -
Mujeres con diagnóstico de cáncer reciente (menos de 1 año)
- -
Cuando se declina continuar luego de la primera visita5
- -
Cuando el resultado del estudio implica la toma de una decisión terapéutica
- -
Mujeres con hijos pequeños
- -
Primeros probandos
- -
Resultado diferente del de otros familiares
- -
Inmediatamente después del resultado positivo
- -
Familias con fallecimientos por cáncer hereditario8
- -
Mujeres implicadas en el tratamiento oncológico de su madre o hermana
Algunos de los efectos psicosociales esperables, en relación con los posibles resultados surgidos en el proceso del AGO5,7:
° Resultado verdadero negativo
*Efectos negativos
-Dificultades para adaptarse a una vida sin riesgo
-Culpa del sobreviviente
-Dudas sobre el resultado, creerlo erróneo, falso negativo
-Infravaloración del riesgo de población general
-Alteraciones en las relaciones familiares
*Beneficios
-Alivio, disminución de la ansiedad
-Reducción de la incertidumbre acerca de la posibilidad del cáncer hereditario.
-Alivio por la disminución del riesgo en los hijos
° Resultado no informativo o inconcluso
*Efectos negativos
-Sensación de falso reaseguro sobre el riesgo
-Reacción de frustración y enojo
-Ansiedad por el alto grado de incertidumbre no aclarada.
° Resultado positivo para mutación
*Efectos negativos
-Aumento transitorio del estrés, síntomas depresivos y ansiosos
-Elevado nivel de preocupación por el cáncer
-Culpa por la transmisión o por haber iniciado el proceso
-Sentirse extraño, rechazado, enfermo, mutante
-Incertidumbre en relación al futuro
-Dificultades o dudas en la transmisión de la información
-Pérdida de la privacidad
-Miedo a la discriminación social, laboral, etc.
*Beneficios
-Fin de la incertidumbre, tranquilidad porque hay una causa
-Beneficio de poder informar a la familia, conducta altruista
-Posibilidad de aplicar estrategias preventivas
Mastectomía de reducción de riesgo (MRR)La mastectomía se trata de una decisión compleja, personal e irreversible. Representa un cambio en la apariencia física, que afecta la sexualidad e interfiere en la lactancia. Sin embargo, la MRR es una opción que aumenta en aceptación en los diagnósticos recientes de cáncer de mama. De hecho, muchos trabajos concluyeron que la principal razón para realizar la MRR fue disminuir la ansiedad por el riesgo de desarrollar cáncer y, así, evitar la repetición de la historia familiar. Otra de las razones fue la preocupación por el cáncer y la percepción de riesgo10,15,20,21. La adaptación a la cirugía es alta, con una satisfacción de hasta del 95%. La mayoría de las pacientes volvería a tomar la decisión de realizarla.
Inserción del psicooncólogo en el equipo multidisciplinarioResulta indispensable que el psicooncólogo que forma parte del equipo multidisciplinario tenga conocimientos médicos. Debe estar integrado e interactuar en forma activa con el resto de los miembros del equipo.
La mitad de los pacientes necesita o desea una ayuda psicológica, aunque el modo de intervención o tratamiento psicoterapéutico puede ser individual y/o familiar, extendiéndose el tiempo que sea necesario5,8,22. El tipo de terapia será de apoyo, psicodinámica, cognitivo-conductual, y puede asociarse a un tratamiento psicofarmacológico8.
El apoyo psicológico habitual no es necesario para la mayoría de los pacientes con una historia familiar de cáncer, pero el acceso a los servicios debe estar disponible para aquellos que presenten un malestar elevado19. Los criterios o pautas de alarma para derivación a una intervención psicooncológica son5,8,19,23:
- -
Petición explícita del paciente y/o de miembros de la familia
- -
Sintomatología psicopatológica/psiquiátrica (detectada por los profesionales o los familiares), cuando excede lo esperable a la reacción vivencial transitoria, en duración o intensidad.
- -
Si existen antecedentes psiquiátricos
- -
Para evitar medidas de vigilancia
- -
Sobreestimación o negación del riesgo de desarrollar cáncer
- -
Diagnóstico reciente de cáncer o recurrencia el último año
- -
Experiencias negativas o traumáticas de cáncer en la familia
- -
Dificultades en la comunicación
- -
Muerte reciente por cáncer en un familiar o duelo no resuelto
- -
El consultante declina recibir el resultado o continuar el proceso
- -
Participantes cuyo resultado del test no coincide con lo esperado
- -
Participantes en determinada etapa del desarrollo evolutivo (jóvenes, con hijos pequeños, parejas jóvenes con planes de tener hijos)
- -
Ante cirugía profiláctica (mastectomías, ooforectomías, colectomía total, etc.)
El proceso de evaluación, estudio y categorización del riesgo de desarrollar cáncer de mama de un individuo o familia se encuentra dentro del marco del asesoramiento genético en oncología, que debe ser realizado por profesionales específicamente entrenados para tal fin.
Cualquier caso con sospecha de riesgo mayor para la enfermedad debería ser evaluado mediante una consulta específica, de acuerdo con las pautas de sospecha (tabla 11).
Pautas de derivación a asesoramiento genético
| Generales de CM |
| CM antes de los 50 años |
| CM bilateral o multicéntrico (sincrónico o metacrónico) |
| CM en el hombre |
| CM en etnia de riesgo (ej.: judía askenazí, etc.) |
| Dos o más casos de CM en familiares cercanos (primer y segundo grado) |
| CM y otro tumor primario en el mismo individuo |
| CM triple negativo (menor de 60 años) |
| Específicas de síndrome (asociadas a otros tumores) |
| Cáncer de ovario o carcinoma de trompa o carcinoma peritoneal primario |
| Familias con CM, cáncer de endometrio y/o carcinoma tiroideo |
| Familias con CM y tumores pediátricos (ej.: sarcomas, leucemias y tumores del SNC) |
| Familias con CM y afección gastrointestinal (ej. pólipos hamartomatosos, cáncer gástrico difuso, cáncer de colon, etc.) |
CM: cáncer de mama; SNC: sistema nervioso central.
Un tercio de los casos de cáncer de mama presenta agregación familiar (CM familiar), con riesgos de aparición moderados o altos según el cuadro, y hasta el 10% de los casos de los cáncer de mama están asociados a la herencia de un gen mutado deficitario en su función (CM hereditario), alcanzando valores que pueden rondar hasta el 80% a lo largo de la vida, según el síndrome y el gen involucrados.
El manejo y seguimiento de individuos con alto riesgo debe estar siempre ligado a un correcto asesoramiento genético y a un manejo multidisciplinario donde intervenga un equipo de profesionales que aborden todas las implicancias involucradas.
PatologíaLas lesiones histológicas de moderado y alto riesgo para cáncer de mama son:
Moderado riesgo (incremento del riesgo de 4 a 5 veces):
Hiperplasia ductal atípica
Hiperplasia lobulillar atípica
Alto riesgo (incremento del riesgo de 8 a 10 veces):
Carcinoma ductal in situ
Carcinoma lobulillar in situ
- -
La cirugía de reducción de riesgo de cáncer de mama solo debe ser ofrecida a mujeres con alto riesgo, tanto a aquellas que no hayan tenido cáncer de mama como a las que tienen cáncer de mama de un lado y riesgo aumentado en un futuro de cáncer de la mama contralateral.
- -
La MRR es un procedimiento invasivo, irreversible y no exento de complicaciones que puede causar morbilidad física y psicológica, afectando la calidad de vida de la mujer.
- -
La técnica quirúrgica más empleada es la mastectomía con conservación del complejo aréola y pezón, seguida de la reconstrucción inmediata.
- -
La biopsia de ganglio centinela en la MRR no está recomendada en forma rutinaria. Existe controversia en el caso de la MRR contralateral en pacientes con carcinoma localmente avanzado, carcinoma lobulillar invasor o carcinoma lobulillar in situ. Algunos grupos, en estos casos, proponen realizar la biopsia del ganglio centinela.
- -
De acuerdo con los conocimientos actuales, es más aconsejable la anexectomía que la ooforectomía.
- -
De realizarse, es aconsejable luego de la paridad cumplida.
- -
La práctica tiene más impacto en la reducción del riesgo de padecer cáncer de ovario y de morir por esta causa.
- -
La anexectomía de reducción de riesgo puede ocasionar disfunción sexual, síntomas vasomotores, trastornos cardiovasculares, accidente cerebrovascular, alteración cognitiva, etc.
- -
Si bien reconocemos que la anexectomía bilateral sigue siendo la estrategia de prevención primaria más fundamentada en pacientes premenopáusicas con alto riesgo de cáncer de mama, al no poder reproducir el porcentual de reducción de los riesgos publicados anteriormente, el cribado continuo con la mamografía y la resonancia magnética para prevenir el cáncer de mama en las mujeres portadoras de BRCA1 y BRCA2, aún anexectomizadas, se justifica.
La quimioprevención solo está indicada en mujeres con alto riesgo de cáncer de mama en las que no se haya optado por la cirugía. Las recomendaciones son:
*Premenopáusicas
Tamoxifeno 20mg por día durante 5 años
*Posmenopáusicas
Tamoxifeno 20mg por día durante 5 años
Raloxifeno 60mg por día durante 5 años
Exemestane 25mg por día durante 5 años
Imagenología- -
En mujeres con alto riesgo de cáncer de mama (≥ 20-25%), la resonancia magnética con contraste endovenoso es en la actualidad el método de cribado recomendado, junto con la mamografía, siendo el algoritmo más conveniente en la práctica la mamografía y luego la resonancia.
- -
En mujeres portadoras de mutaciones en genes BRCA1 y 2, el cribado anual con resonancia magnética con contraste endovenoso y mamografía comienza a los 25-30 años, al igual que en familiares de primer grado de una portadora de mutaciones en genes BRCA, que no se hayan realizado el test.
- -
En mujeres con riesgo ≥ 20% de cáncer de mama en relación con la historia familiar, la edad de comienzo del cribado anual con resonancia magnética con contraste endovenoso y mamografía, es a los 25-30 años o 10 años antes de la edad del familiar más joven afectado, lo que sea primero. No se recomienda la realización de mamografía en mujeres menores de 25 años.
- -
En las mujeres con antecedente de radioterapia en el tórax recibida entre los 10 y 30 años, el cribado anual con resonancia magnética con contraste endovenoso comienza 8 años después de finalizado el tratamiento radiante, no recomendándose la mamografía antes de los 25 años.
- -
La ecografía puede utilizarse en mujeres con alto riesgo de cáncer de mama cuando, por algún motivo (falta de disponibilidad, contraindicación para la realización de la RM), no pueden realizar una resonancia magnética con contraste endovenoso (se le realizará mamografía+ecografía), en mujeres menores de 25 años con antecedentes de radioterapia en el tórax, en las que no se recomienda la mamografía (se le realizará resonancia magnética+ecografía), en mujeres portadoras de mutaciones en p53 (síndrome de Li-Fraumeni) entre los 20-29 años, en las que se recomienda el cribado anual solo con RM (preferentemente) o Mx si la RM no está disponible o individualizado en relación con la edad del familiar más joven afectado, o en mujeres menores de 25 años con riesgo ≥ 20% de cáncer de mama en relación con la historia familiar (se le realizará resonancia magnética+ecografía).
Las pacientes y familias con alto riesgo de cáncer de mama presentan particularidades que aumentan su vulnerabilidad y repercusión emocional. El proceso comunicacional del asesoramiento genético oncológico constituye una importante fuente de estrés, independientemente de la realización del test genético. Hay un acuerdo general de que el asesoramiento acerca del riesgo puede ser beneficioso, sin que induzca o aumente la morbilidad psicológica.
Los participantes con resultados positivos muestran mayor morbilidad psicológica.
Atención psicosocialLa mitad de los pacientes necesitan o desean una ayuda psicológica. Es importante conocer los criterios o pautas de alarma para la derivación a una intervención psicooncológica: petición del paciente o familia, síntomas psicosociales manifiestos, evitación en las medidas de vigilancia, sobreestimación del riesgo, diagnóstico reciente o recurrencia de cáncer, experiencias familiares traumáticas, muerte de un familiar reciente por cáncer hereditario, resultado del test no coincidente con lo esperado, cirugía profiláctica.