Las causas de obstrucción en el vaciamiento gástrico (OVG) pueden ser intrínsecas, de la pared o extrínsecas. En Pediatría, la más frecuente es la estenosis hipertrófica del píloro. El objetivo de este trabajo es mostrar la utilidad del ultrasonido (US) en el diagnóstico de OVG de causa poco común.
El estómago es fácilmente visualizable con US, cuando la luz se distiende adecuadamente con líquido. El protocolo de estudio incluye la realización de cortes en los planos transversal y longitudinal, evaluando la pared (normalmente de 3mm aprox.) y el vaciamiento gástrico.
Presentamos una serie de 7 pacientes, entre los 9 meses y 12 años de edad, con síntomas de OVG, que fueron estudiados en nuestro hospital entre 2009 y 2012. El US mostró engrosamiento de la pared, ocupación de la cavidad gástrica o alguna imagen en íntimo contacto con la pared, sin plano de clivaje. Los diagnósticos fueron: enfermedad granulomatosa crónica, duplicación con heterotopia gástrica y metaplasia intestinal focal, gastritis crónica, linfoma de Burkitt, quiste de duplicación con ectopia pancreática y tricobezoar.
En los niños con vómitos alimenticios y sospecha de OVG debemos hacer un estudio ecográfico minucioso de la región antropilórica para valorar la pared, el contenido y las relaciones extrínsecas, de modo de orientar el diagnóstico y sugerir en cada caso qué estudios realizar para confirmarlo. La endoscopia con biopsia generalmente es concluyente, evitando la seriada esófago gastroduodenal (SEGD) y, en muchos casos, se utiliza la tomografía computada (TC), por lo menos antes del diagnóstico histológico de certeza.
The stomach is easily observed in an ultrasound (US) exam when is filled with liquid. The US scan protocol includes longitudinal and transversal views of the stomach, evaluating the muscular wall thickness (normal up to 3mm) and the gastric outlet.
Causes of gastric outlet obstruction can be intrinsic, extrinsic or from the stomach wall. In children, the commonest cause is the hypertrophic pyloric stenosis.The aim of this work is to show the usefulness of ultrasonography (US) in the diagnosis of gastric outlet obstruction of uncommon cause.
We present 7 patients from 9 months to 12 years old, studied in our hospital between 2009 and 2012, who presented gastric outlet obstruction symptoms. US showed thickening of the stomach muscular wall, filling of the stomach lumen or a mass in close relationship with the stomach wall.
Granulomatous disease, gastric duplication with heterotopy, focal intestinal metaplasia, chronic gastritis, Burkitt lymphoma, duplication cyst, pancreatic ectopic tissue and bezoar were found in our serie.
Gastric outlet obstruction (nonbilius emesis) in children is an entity that must be studied with detail through US including the pyloric channel and the gastric antrum. Endoscopy guided biopsy is conclusive in most of the cases avoiding the need for an Upper GI study and, in many cases, the need for a CT scan.
La obstrucción en el vaciamiento gástrico (OVG) en Pediatría abarca un amplio espectro de condiciones que impiden el paso del contenido gástrico hacia el duodeno. Las náuseas y los vómitos no biliosos son los síntomas característicos1.
La entidad puede deberse a lesiones congénitas, como atresia y membranas del antro y el píloro, duplicaciones gástricas y tejido pancreático aberrante; o bien a causas adquiridas, como estenosis hipertrófica pilórica, piloroespasmo, vólvulo gástrico, cuerpos extraños, tumores gástricos, enfermedad ulcerosa péptica, gastritis crónica o intususcepción duodenogástrica retrógrada2. En Pediatría, la causa más frecuente es la estenosis hipertrófica del píloro1.
El objetivo de nuestro trabajo es presentar una serie de casos con OVG de etiología poco frecuente en Pediatría y remarcar la utilidad del ultrasonido (US) como método orientador en el diagnóstico de pacientes que presentan la sintomatología señalada. El estudio fue realizado por diferentes ecografistas con más de tres años de experiencia, no siendo esto un aspecto importante en el resultado.
El estómago se puede evaluar por ecografía, cuando la luz se distiende adecuadamente con líquido. En nuestra serie, la cantidad de líquido utilizada dependió de la edad y tolerancia del paciente, siendo en promedio de 200ml. En los casos que presentaban intolerancia gástrica al momento del estudio, la administración fue a través de una sonda nasogástrica (SNG).
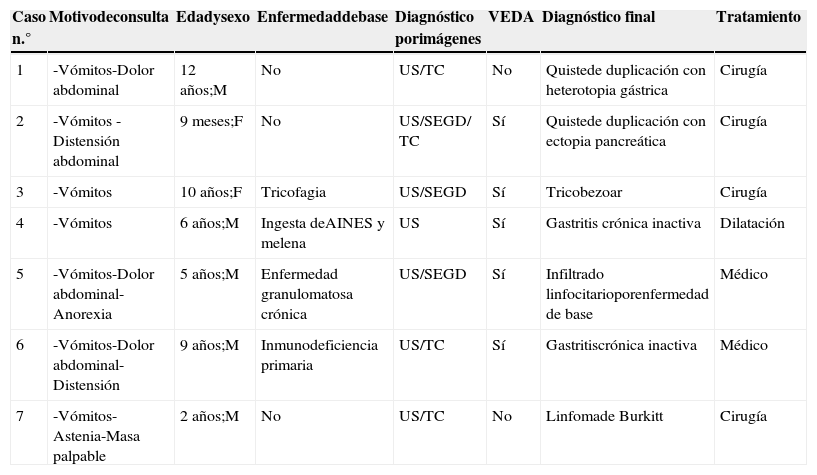
Presentamos una serie de 7 pacientes, con edades comprendidas entre los 9 meses y 12 años de edad, que tenían OVG de etiología infrecuente. Fueron estudiados en nuestro hospital entre 2009 y 2012, y se revisaron las imágenes obtenidas, el diagnóstico y el tratamiento realizado (tabla 1).
Características de la población estudiada
| Caso n.° | Motivodeconsulta | Edadysexo | Enfermedaddebase | Diagnóstico porimágenes | VEDA | Diagnóstico final | Tratamiento |
|---|---|---|---|---|---|---|---|
| 1 | -Vómitos-Dolor abdominal | 12 años;M | No | US/TC | No | Quistede duplicación con heterotopia gástrica | Cirugía |
| 2 | -Vómitos -Distensión abdominal | 9 meses;F | No | US/SEGD/ TC | Sí | Quistede duplicación con ectopia pancreática | Cirugía |
| 3 | -Vómitos | 10 años;F | Tricofagia | US/SEGD | Sí | Tricobezoar | Cirugía |
| 4 | -Vómitos | 6 años;M | Ingesta deAINES y melena | US | Sí | Gastritis crónica inactiva | Dilatación |
| 5 | -Vómitos-Dolor abdominal-Anorexia | 5 años;M | Enfermedad granulomatosa crónica | US/SEGD | Sí | Infiltrado linfocitarioporenfermedad de base | Médico |
| 6 | -Vómitos-Dolor abdominal-Distensión | 9 años;M | Inmunodeficiencia primaria | US/TC | Sí | Gastritiscrónica inactiva | Médico |
| 7 | -Vómitos-Astenia-Masa palpable | 2 años;M | No | US/TC | No | Linfomade Burkitt | Cirugía |
M: masculino; F: femenino; SEGD: seriada esófago gastroduodenal; TC: tomografía computada; US: ultrasonido; VEDA: videoendoscopia digestiva alta.
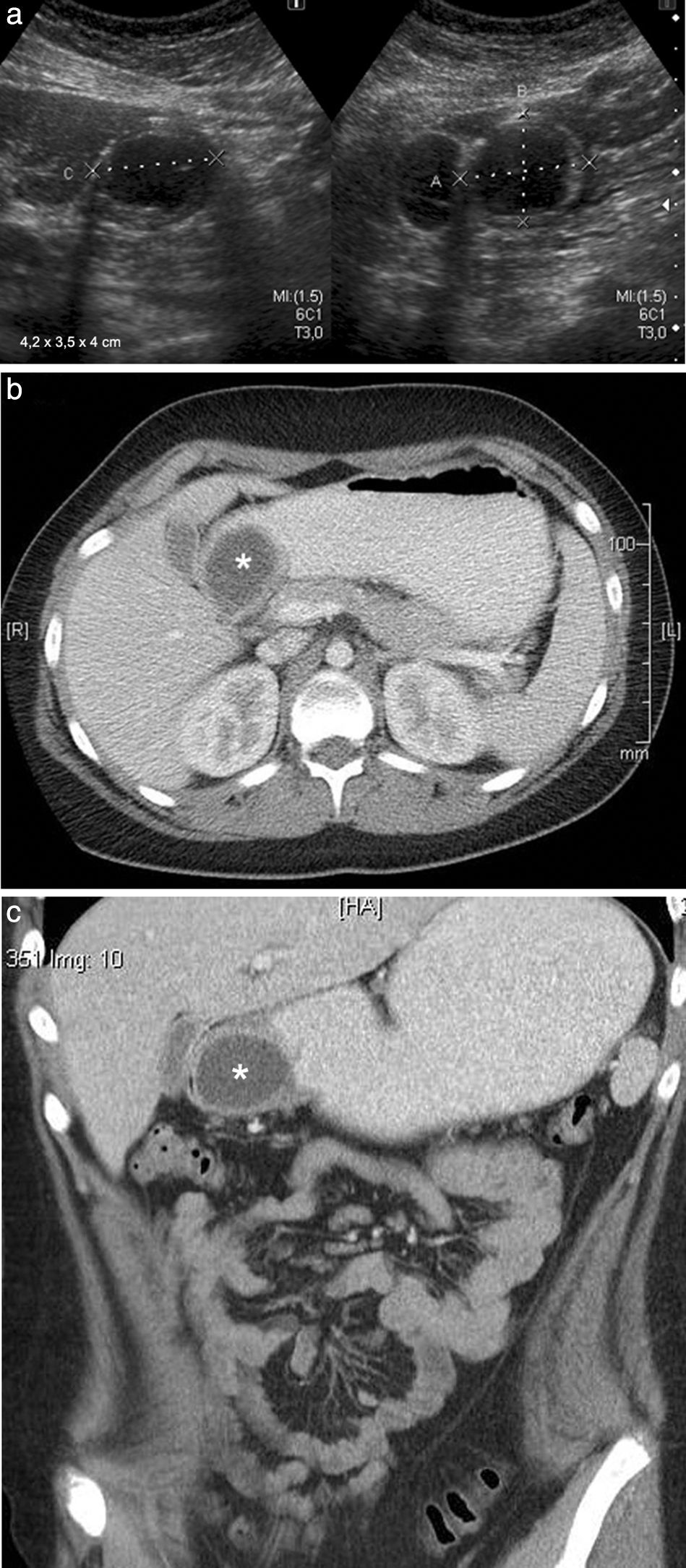
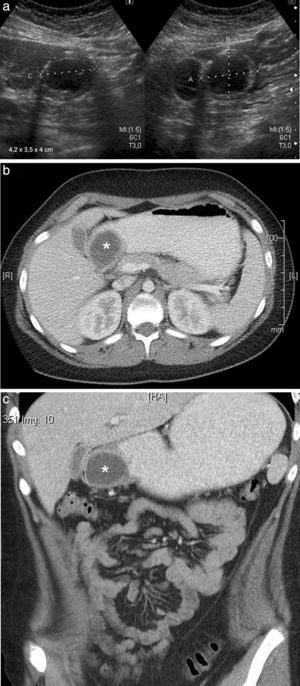
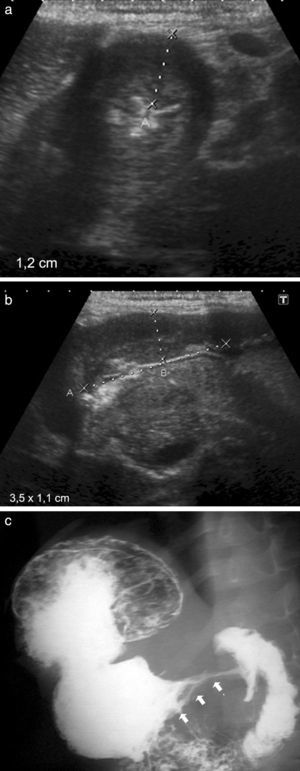
Niño de 12 años presentaba vómitos alimenticios y dolor abdominal de 23 horas de evolución. Se le realizó una ecografía abdominal en la que se detectó una imagen quística, epigástrica y extrahepática, de 4,2 x 3,9 x 4cm, con una pared que poseía una capa hipoecoica periférica y una capa ecogénica central, con contenido anecoico. Era compatible con un quiste de duplicación.
Se completó el estudio con una tomografía computada (TC) que confirmó la formación quística con contenido líquido y pared gruesa. Esta realzaba con el contraste endovenoso y se ubicaba en la pared posterior de la región antropilórica, desplazando hacia adelante y comprimiendo la luz de dicha región. No se observó el pasaje del contraste oral a la zona distal.
Se llevó a cabo la resección por cirugía laparoscópica y se confirmó por anatomía patológica un quiste de duplicación con heterotopia gástrica y metaplasia intestinal focal (fig. 1).
Niño de 12 años con un quiste de duplicación en la región antropilórica. (a) La ecografía, en corte transversal a nivel del epigastrio, muestra una imagen quística con pared gruesa, en contacto con la pared posterior del antro gástrico. (b y c) La TC de abdomen superior, corte axial y coronal, muestra la imagen quística con pared gruesa que realza con contraste endovenoso, en contacto con la pared posterior del antro pilórico (asteriscos).
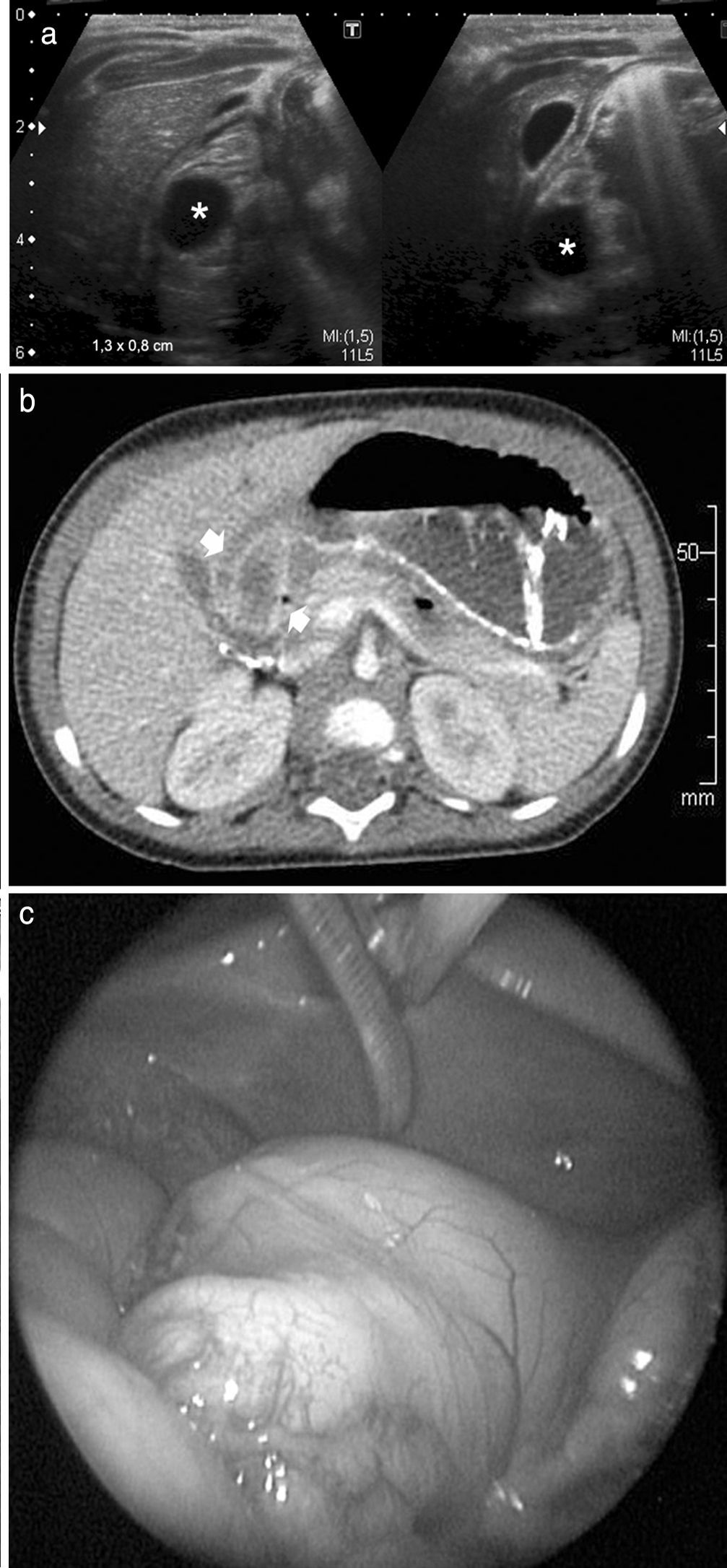
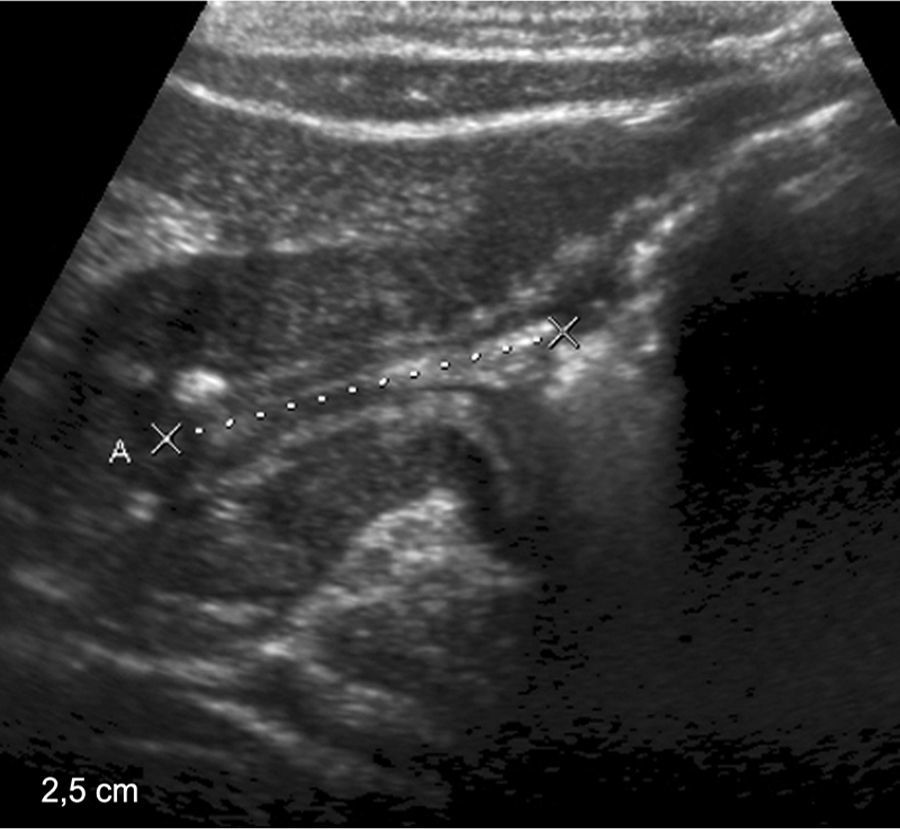
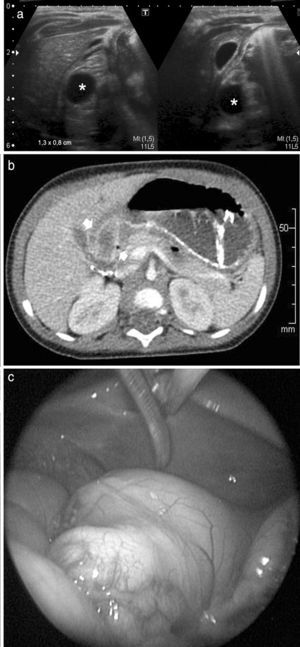
Niña de 9 meses de edad presentaba vómitos y distensión abdominal. En la ecografía se observó una imagen de aspecto quístico, redondeado y anecoico, de 1,3 x 0,8cm aproximadamente, en contacto con la pared posterior del píloro, que generaba dilatación con retención del contenido gástrico. El hallazgo era compatible con un quiste de duplicación.
Además, se le realizó una seriada esófago gastroduodenal (SEGD), que mostró un estómago con movimientos peristálticos y antiperistálticos, y luego una TC, que evidenció en la región antropilórica una imagen quística, en íntimo contacto con la pared posterior. Finalmente, se efectuó una endoscopia donde se detectó una formación redondeada que protruía hacia la luz en la región antropilórica.
Se llevó a cabo la cirugía y resección, con diagnóstico de quiste de duplicación con ectopia pancreática (fig. 2).
Niña de 9 meses de edad con un quiste de duplicación con ectopia pancreática. (a) La ecografía, con corte transversal y longitudinal del epigastrio, muestra una imagen redondeada y anecoica, de aproximadamente 1,3 x 0,8cm, en la región antropilórica (asteriscos). (b) El corte axial de la TC evidencia una imagen quística en íntimo contacto con la pared posterior del antro pilórico (flechas). (c) Imagen endoscópica.
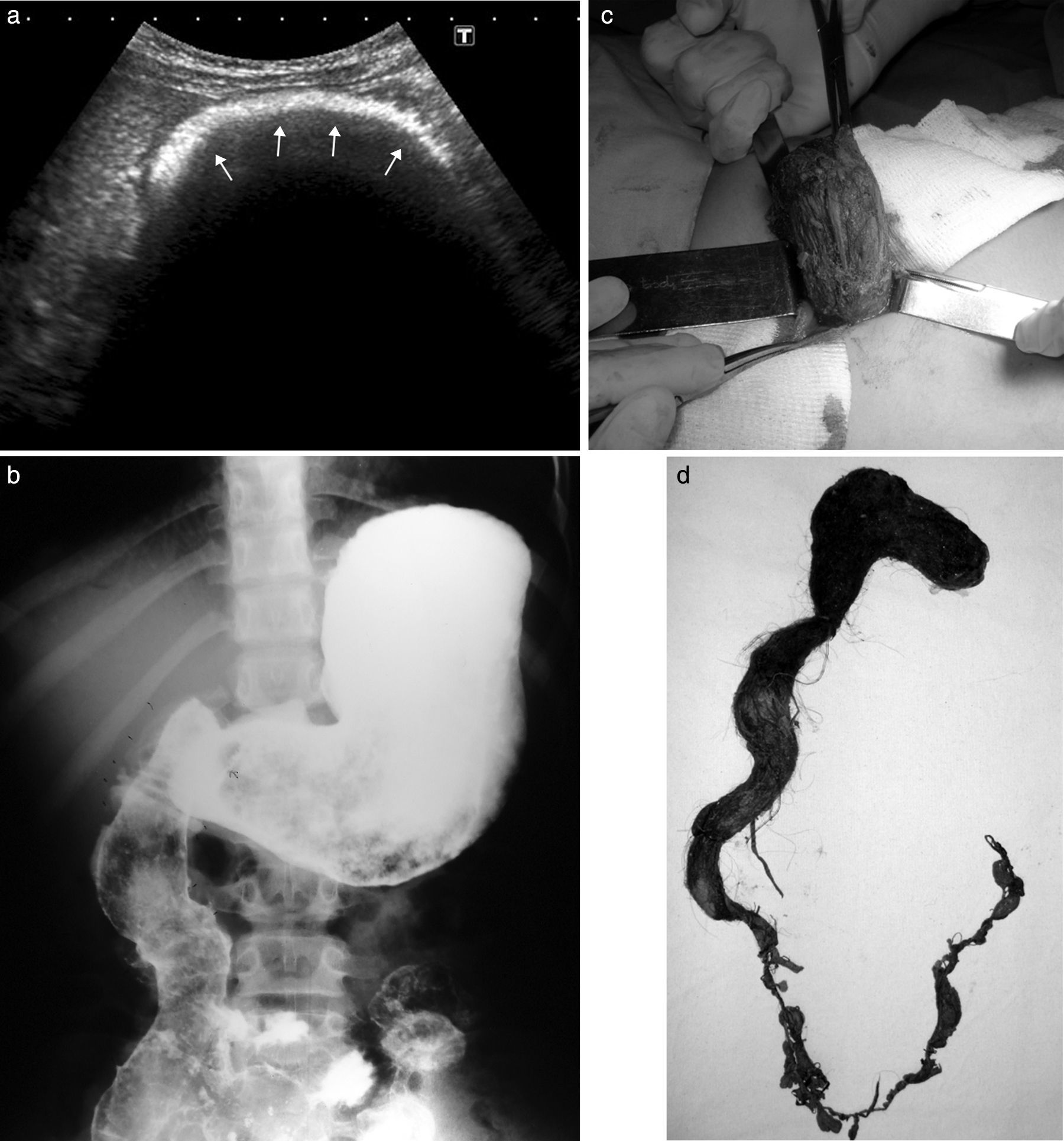
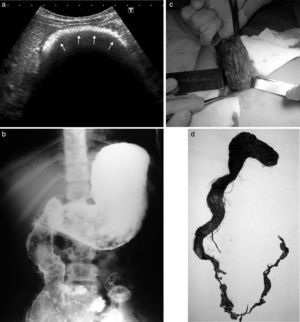
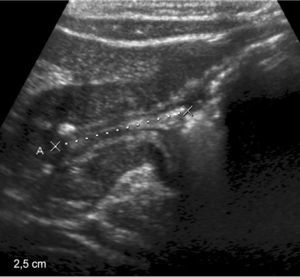
Niña de 10 años presentaba vómitos y antecedentes de tricofagia. En la ecografía se observó una imagen ecogénica con sombra acústica a nivel del epigastrio. El estudio se complementó con una SEGD, donde se detectó un defecto del relleno, a nivel de la cámara gástrica, que se movilizaba con los movimientos extrínsecos (hallazgos compatibles con bezoar).
En la videoendoscopia digestiva alta (VEDA) el bezoar no pudo fraccionarse, por lo que se procedió a su extracción quirúrgica. Resultó un tricobezoar de 19 x 5cm (fig. 3).
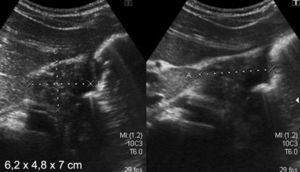
Caso 4Niño de 6 años presentaba vómitos alimenticios y antecedentes de ingesta de antiinflamatorios y melena de 3 meses de evolución. En el US se observó un aumento del espesor del músculo pilórico (5,6mm) y de la longitud del canal (2,4cm). La VEDA mostró estenosis antral infranqueable y se le realizó una dilatación. El resultado de la biopsia fue gastritis crónica inactiva, por lo que se instauró tratamiento médico (fig. 4).
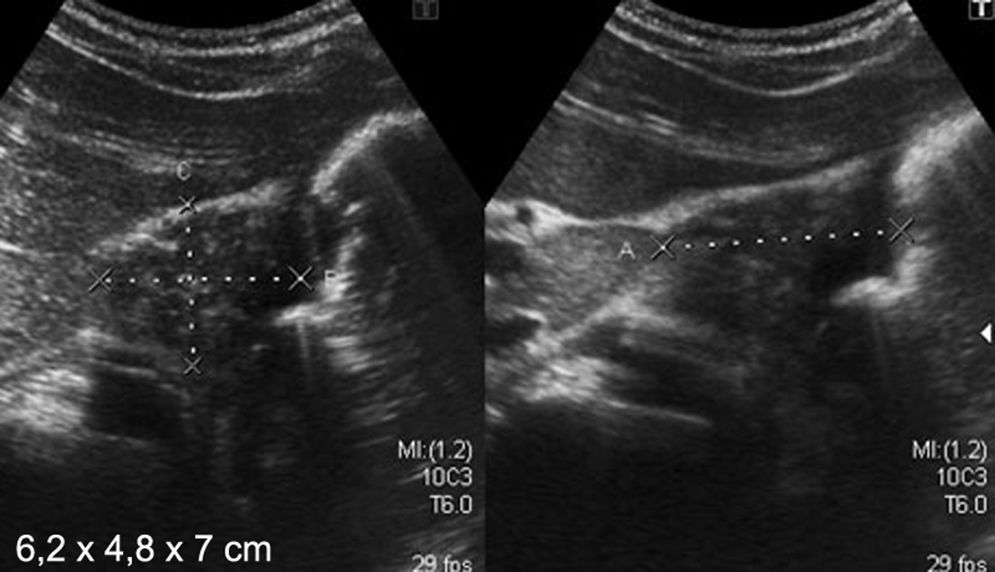
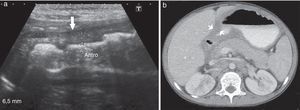
Niño de 9 años con antecedentes de inmunodeficiencia primaria y diagnóstico de gastritis crónica. (a) La ecografía abdominal muestra un engrosamiento de la pared gástrica en la región antropilórica (flecha), mientras que (b) la TC, en corte axial del hemiabdomen superior, revela los mismos hallazgos que la ecografía (flechas).
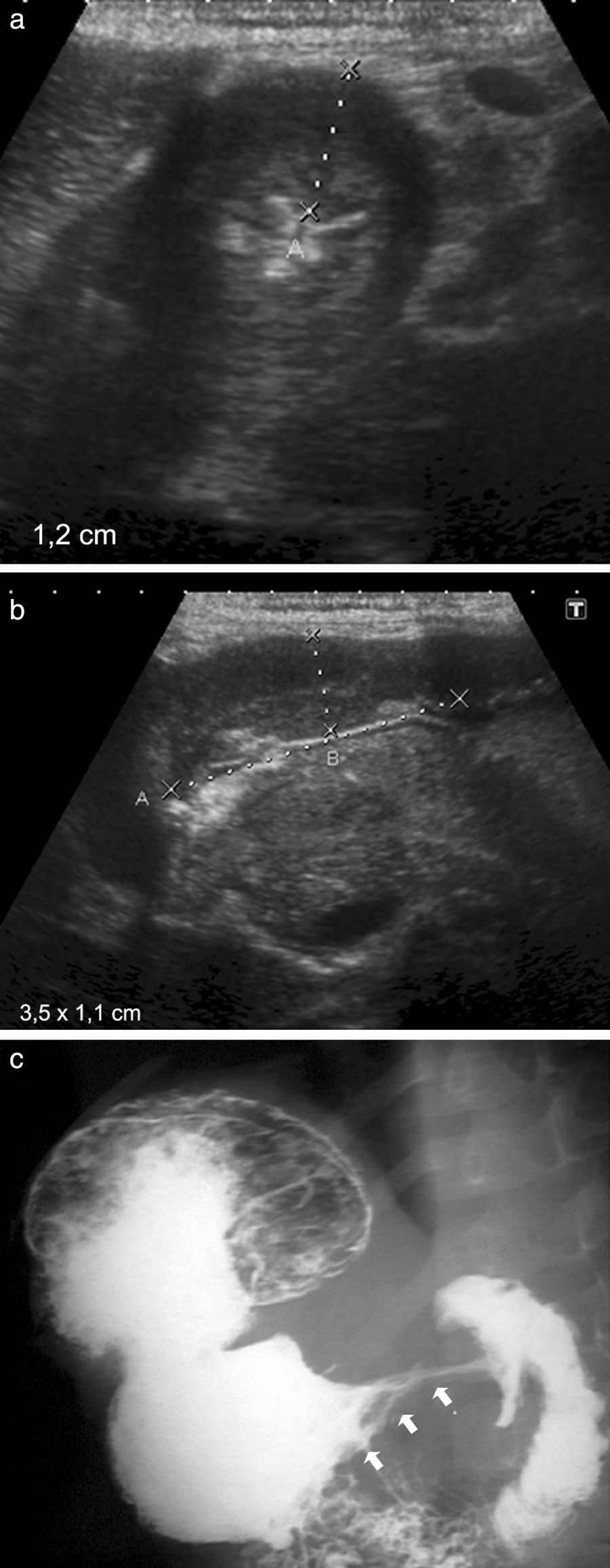
Niño de 5 años presentaba dolor abdominal en el epigastrio, anorexia y decaimiento de 15 días de evolución. Tenía antecedentes de enfermedad granulomatosa crónica y registraba 3 vómitos por día en la última semana. En la ecografía abdominal se evidenció un engrosamiento de la pared antropilórica con disminución de la luz. Su diámetro longitudinal era de 3,5cm y su espesor de 1,2cm.
Se complementó el estudio con una SEGD, donde se observó un antro de morfología tubular, con engrosamiento de los pliegues. La motilidad antropilórica se encontraba disminuida, con pasaje filiforme al duodeno. Por su parte, la VEDA reveló deformación y rigidez del antro pilórico, con pliegues engrosados y edematosos. La biopsia informó un infiltrado linfocitario en lámina propia, característico de la enfermedad de base.
Se instauró un tratamiento médico con dieta fraccionada, corticoides y profilaxis antibiótica (fig. 5).
Niño de 5 años con enfermedad granulomatosa crónica. (a y b) La ecografía abdominal, en corte transversal y longitudinal, muestra un engrosamiento de la pared antropilórica con disminución de la luz. (c) En la SEGD se detecta un antro y un píloro de morfología tubular, con engrosamiento de los pliegues (flechas).
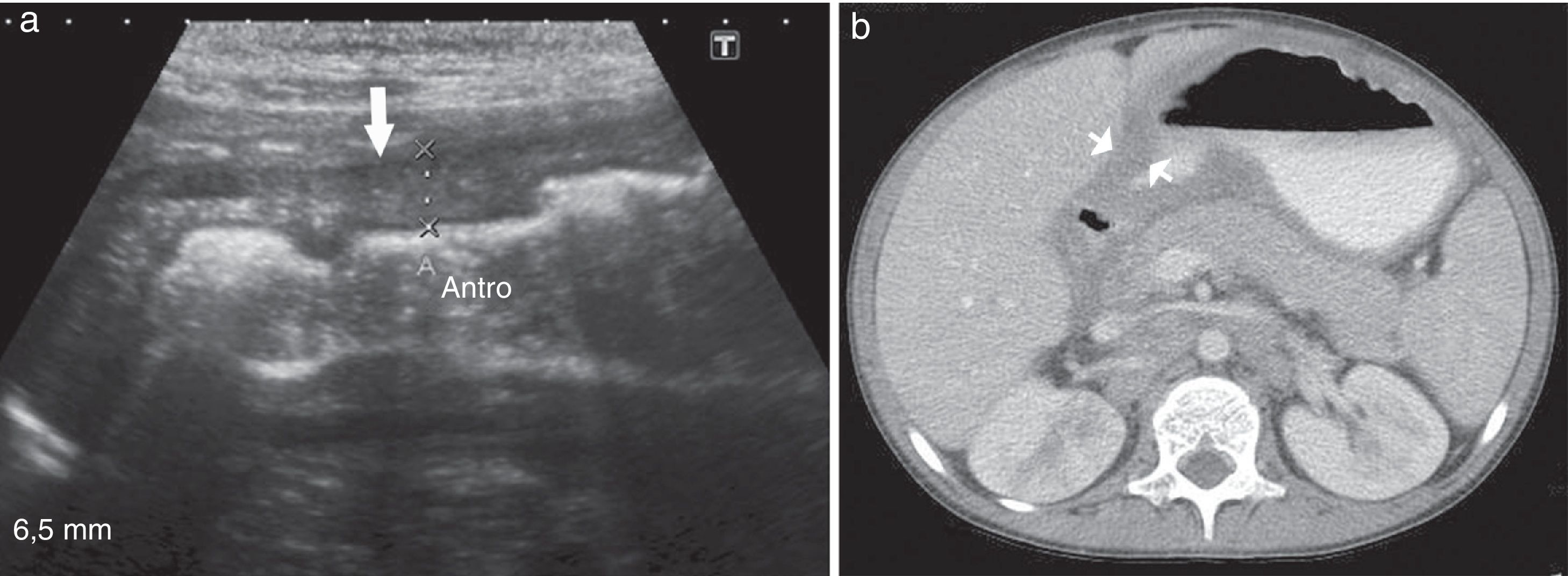
Niño de 9 años, con antecedentes de inmunodeficiencia primaria (déficit de la cadena B1 del receptor de IL12), presentaba vómitos, dolor abdominal y distensión. La ecografía abdominal mostró un engrosamiento de la pared gástrica en la región antropilórica de 0,8cm de espesor y múltiples adenopatías retroperitoneales. A su vez, en la TC se visualizaron múltiples adenopatías en las regiones intercavoaórtica, paraaórtica y peripancreática, así como en el hilio renal, el mesenterio y ambas regiones inguinales, y un engrosamiento de la pared gástrica en la región antropilórica. Por su parte, la VEDA reveló un eritema y erosiones aftoides en el antro. Las biopsias realizadas informaron gastritis crónica inactiva y se instauró tratamiento médico (fig. 6).
Caso 7Niño de 2 años presentaba vómitos, astenia y masa palpable. En la ecografía se observó una imagen polilobulada hipoecoica en la región antropilórica, que se extendía hacia el retroperitoneo. Medía 6,2 x 4,8 x 7cm.
La TC de abdomen confirmó la imagen hipodensa entre el borde hepático posterosuperior izquierdo y el estómago en la topografía de la transcavidad de los epiplones.
Se llevó a cabo una cirugía con toma de biopsia y el diagnóstico fue linfoma de Burkitt (fig. 7).
DiscusiónEn esta serie de casos, el primer método por imágenes utilizado para aproximarnos al diagnóstico fue el US. En 4 pacientes se visualizó un aumento del espesor de la pared de la región antropilórica (confirmando la etiología intrínseca de la pared gástrica), mientras que en 2 pacientes se observaron estructuras que comprimían la pared, provocando una obstrucción de causa extrínseca. En un paciente, se detectó una formación de origen intraluminal.
El estómago se puede evaluar por ecografía cuando la luz se distiende adecuadamente con líquido. El cuerpo del estómago, el antro y la región pilórica se examinan mejor con el paciente en decúbito lateral derecho, usando el lóbulo derecho del hígado como ventana acústica. Se realizan cortes en los planos transversal y longitudinal: con el primero se observa el antro gástrico en el eje largo, mientras que con el segundo se obtiene una vista transversal de la región antropilórica.
En el eje corto, el antro gástrico tiene la apariencia de un objetivo u ojo de buey: su centro es anecoico por la presencia de fluido en el lumen gástrico, la capa adyacente ecogénica es la submucosa y el borde exterior hipoecoico constituye la capa muscular propia. Por su parte, en el eje largo el antro es una estructura tubular. El espesor normal de la pared es de 3mm o menos, midiéndola desde el borde interno de la submucosa ecogénica hasta el exterior de la capa muscular hipoecoica (que solo debe tener 2mm de diámetro o menos)3. Las mediciones del espesor de la pared muscular deben obtenerse con el antro distendido por el líquido para no simular un engrosamiento anormal del músculo4.
En nuestra experiencia, en 3 pacientes se realizó una SEGD que permitió evaluar el grado de vaciamiento gástrico, mientras que en 4 pacientes se llevó a cabo una TC con contraste oral endovenoso, en la que se confirmaron los hallazgos ecográficos, permitiendo una mejor definición anatómica de la patología. La VEDA, practicada en 5 pacientes, fue útil para valorar las imágenes descritas en los estudios anteriores, toma de biopsias y/o tratamiento (tabla 1).
Entre las patologías halladas podemos describir brevemente algunas de ellas:
Quiste de duplicaciónSon malformaciones congénitas infrecuentes, localizadas en o adyacentes a la pared del tracto digestivo. Histológicamente, contienen músculo liso en su pared y están revestidas por mucosa5. En la macroscopía constituyen masas quísticas esféricas (80%) o estructuras tubulares (20%), ubicadas dentro o de forma adyacente al tubo digestivo (con frecuencia en el borde mesentérico). Comparten la pared muscular y la irrigación, y están separadas por mucosa6. Su localización más común es el íleon, seguido del esófago, el colon, el yeyuno, el estómago y el duodeno.
Las masas quísticas no comunican con el lumen, mientras que la variedad tubular, frecuente en el intestino delgado y el colon, sí lo hace. En el caso de las colónicas, estas pueden comunicar al exterior5.
Los quistes de duplicación gástricos son poco comunes (4-7%). Por lo general, se presentan antes del año de vida con síntomas de obstrucción, dolor, sangrado o ulceración, y son dos veces más comunes en las niñas1. Con mayor frecuencia se encuentran a lo largo de la curvatura mayor6 y no comunican con la luz del estómago5. El tejido pancreático y la mucosa gástrica ectópicos son hallazgos usuales dentro de las duplicaciones gástricas1.
BezoaresLa palabra bezoar deriva del persa pâdzahr, que significa “antídoto”. En la antigüedad se pensaba que los bezoares (piedras que se pueden encontrar en las entrañas de diferentes animales, como ungulados o simios) podían neutralizar el veneno. Actualmente, un bezoar gástrico es un conglomerado de material dentro del estómago que no se digiere fácilmente. Cuando su tamaño limita el paso normal de los contenidos gástricos, genera una obstrucción de la salida1.
Los bezoares pueden estar compuestos por una variedad de materiales que incluyen: pelo (tricobezoares), medicamentos (farmacobezoares, aunque es raro en niños), leche espesa (lactobezoares, en niños que toman leche de fórmula) y materia vegetal (fitobezoares)4.
Los tricobezoares se producen principalmente en niñas con tricolomania y tricofagia. El síndrome de Rapunzel es un tricobezoar que se extiende desde el estómago hasta el intestino delgado, y muy a menudo se observa en las mujeres jóvenes con trastornos mentales y tricofagia7,8.
Las características imagenológicas de los bezoares varían en función del tipo de material. Sin embargo, pueden ser diagnosticados por casi todos los métodos de imágenes1,7. En particular, la ecografía muestra un arco ecogénico con sombra acústica4.
Una endoscopia con fraccionamiento y extracción de la masa puede ser suficiente para el tratamiento, aunque muchos pacientes requieren extirpación quirúrgica7.
Gastritis y enfermedad ulcerosaLa infección por Helicobacter pylori es la causa más común de gastritis en niños. Los síntomas son dolor abdominal, náuseas y vómitos, y los hallazgos ecográficos incluyen engrosamiento de la pared antral, mucosa gástrica ecogénica, retardo en el vaciado gástrico y cráter ulceroso2. La ecografía también podría usarse para el seguimiento terapéutico9.
Enfermedad granulomatosa crónicaEs una rara inmunodeficiencia primaria hereditaria. Su etiología no ha sido del todo aclarada, pero se cree que no es infecciosa, sino solo inflamatoria. En ella, existe un defecto en la actividad bactericida y fungicida de los fagocitos, que genera infecciones recurrentes, inflamación y formación de granulomas. Los síntomas aparecen en el primer año de vida10,11.
Los sitios más afectados son el pulmón, la piel, el tracto gastrointestinal y los ganglios linfáticos; y por siembra hematógena puede producir abscesos hepáticos y osteomielitis.
El pronóstico es incierto y la terapia, multifactorial. Esta abarca profilaxis antibiótica, tratamiento de infecciones, drenajes percutáneos y terapia con interferón gama12.
El estrechamiento del antro con obstrucción del vaciamiento ocurre en el 16% de los pacientes.
Histológicamente aparecen granulomas e infiltración de histiocitos cargados de lípidos que invaden la lámina propia, la submucosa, el músculo liso y la serosa. No suelen aislarse microorganismos10.
El tratamiento es médico conservador, con soporte nutricional, corticoides y antibióticos, y tiene buena respuesta en pocas semanas13.
LinfomaLos tumores malignos primarios del estómago son extremadamente raros en los niños. En particular, los linfomas representan el 1-7% de todas las neoplasias malignas del estómago, aunque su incidencia está en aumento, y el estómago se ha convertido en el sitio más común del linfoma extranodal primario.
Este incremento se debe al papel demostrado del Helicobacter pylori en el desarrollo del linfoma gástrico. Si bien normalmente no hay tejido linfoide en la mucosa gástrica, la infección crónica por Helicobacter pylori está asociada con el desarrollo del tejido linfoide en la lámina propia. La mayoría de los linfomas gástricos primarios derivan de este tejido linfoide asociado a mucosas MALT (malignant lymphoma of mucosa- associated lymphoid tissue), por lo que se los clasifica en linfomas MALT de bajo y alto grado. Mientras los de bajo grado son sensibles a la terapia con antibióticos, los de alto grado no responden a la erradicación del Helicobacter pylori y pueden requerir la extirpación completa del tumor, y quimioterapia y/o radioterapia posoperatoria2,14.
El linfoma de Burkitt es el subtipo más común del linfoma no Hodgkin en la infancia y constituye un tumor de rápido crecimiento. La afectación gástrica es rara y suele presentarse como una infiltración difusa de la pared o, con menor frecuencia, como una masa focal en la pared15.
Como conclusión, consideramos que en pacientes pediátricos con síntomas de eventual compromiso del tracto digestivo alto debería realizarse una ecografía como primer método para orientar el diagnóstico. En este sentido, el examen tiene que ser minucioso en el estudio de la pared de la región antropilórica, el contenido gástrico y las relaciones extrínsecas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.