Describir los efectos de la restricción moderada del sueño en las regiones cerebrales involucradas en los procesos de inhibición cognitiva, función motora y fluidez fonológica, utilizando imágenes por resonancia magnética funcional (RMf).
Materiales y métodosSe estableció una condición de sueño habitual y otra de restricción moderada en 12 estudiantes diestros de pre y posgrado de Medicina, de entre 20 y 40 años. En ambos estados se utilizó la prueba psicológica de atención d2 e imágenes de RMf con paradigmas de función motora, fluencia fonológica y atención del tipo inhibición de la función ejecutiva Stroop. La restricción moderada de sueño fue de al menos el 63% con respecto al sueño habitual.
ResultadosSe encontraron diferencias significativas en la activación cerebral con RMf para la función motora (p<0,05) entre el ciclo de sueño regular y el de restricción moderada. La actividad cerebral en RMf con los paradigmas de atención Stroop y fluidez fonológica no mostró diferencias significativas, así como tampoco la prueba psicológica de atención d2.
DiscusiónSe encontró interferencia en las activaciones cerebrales de representación motora con la restricción moderada de sueño, pero no se hallaron diferencias significativas en las activaciones de atención tipo Stroop, ni en la tarea de fluencia fonológica o las pruebas de atención d2. Esto podría deberse a una insuficiente restricción del sueño o a eficientes mecanismos de compensación en los sujetos de este estudio.
ConclusiónExisten diferencias en las activaciones cerebrales de representación motora en la restricción moderada del sueño medidas con RMf.
To describe the effects of moderate sleep deprivation in brain regions involved in cognitive inhibition processes, motor function, and phonological fluency using functional Magnetic Resonance Imaging (fMRI).
Materials and methodsA sample of 12 under-graduate and post-graduate medical students, between 20 and 40 years, were subjected to a follow-up of the number of hours of regular sleep in order compare to a moderate sleep deprivation after a nightshift. The d2 attention test and fMRI studies were used in both groups in order to evaluate motor function, verbal fluency and cognitive inhibition, or Stroop paradigms. The moderate sleep deprivation was at least 63% with respect to the regular sleep pattern during the previous week.
ResultsSignificant differences in brain activity were found in fMRI to measure motor function (P<0.05) comparing regular sleep cycle and moderate sleep deprivation. The brain activity with fMRI Stroop paradigms and phonological fluency showed no significant differences between the two conditions, likewise with the psychological attention test d2.
DiscussionThe fMRI showed interference on motor representation activations in moderate sleep deprivation. No significant differences in fMRI were found in the processes of cognitive inhibition or Stroop paradigms, in phonological fluency, or in the psychological attention test d2. These could be attributed to inadequate sleep deprivation or efficient compensation mechanisms in the subjects of this study.
ConclusionThere is a difference showed in fMRI on motor representation activations in moderate sleep deprivation.
La privación del sueño tiene efectos negativos sobre la atención, las habilidades motoras y los procesos cognoscitivos. Sus consecuencias se han relacionado con el aumento de errores, los accidentes de trabajo y una menor productividad1,2. En personas que padecen crónicamente la falta de sueño debido a turnos nocturnos, como los trabajadores de la salud, las repercusiones se reflejan en la disminución de la velocidad de respuesta, la memoria y la capacidad de aprendizaje3. A su vez, la reducción del horario laboral en los estudiantes de Medicina tiene resultados positivos en la duración del sueño y el descenso de errores de atención (medidos con oculografía) que ocurren en la jornada nocturna4. Por su parte, en estudiantes de Anestesiología se ha establecido que la privación de una noche de sueño provoca un retardo del 15% en la velocidad de respuesta ante una labor que requiere atención y que, en el caso de tareas con mayor demanda de concentración, este enlentecimiento llega hasta el 53%5. Asimismo, en internistas de urgencias, tras una noche sin dormir o varios turnos nocturnos, también se ha hallado un peor desempeño en las tareas de reconocimiento que requieren atención tipo Span (esto es, el tiempo que se atiende a una labor sin distraerse) y una menor capacidad de memoria visual6.
La resonancia magnética funcional (RMf) se ha utilizado para evaluar los efectos de la privación de sueño y se ha encontrado un aumento en el tiempo de respuesta a estímulos, una alteración en las capacidades y habilidades motoras, un enlentecimiento en las funciones visuales y, principalmente, alteraciones en los procesos de atención7,8. Además, la prueba de atención d2, usada en este trabajo, se ha convertido en una de las formas más empleadas para medir la atención, por su alta confiabilidad interna, validez y valor predictivo, demostrado por diversos estudios9.
La RMf constituye una herramienta no invasiva que visualiza la actividad metabólica del cerebro a través de su consumo de oxígeno mediante secuencias denominadas BOLD (Blood Oxygen Level Dependent)10. Este método permite observar la actividad del cerebro, ya sea durante tareas específicas o en estado de reposo cuando existe actividad cerebral. Para generar la activación de las diferentes áreas durante la RMf se les dan a las personas distintas tareas denominadas paradigmas11. Así, el estudio resulta efectivo para detectar los cambios y evaluar las modificaciones en la actividad cerebral como resultado de la privación del sueño12.
Existen diversos paradigmas para medir la atención, fluidez fonológica y función motora. Para valorar la atención selectiva visual se conoce la prueba Stroop que, en este trabajo, se transformó en un paradigma de la RMf. En ella la tarea o paradigma consiste en la nominación de un color en el que aparece una palabra que, a su vez, describe también un color pero que puede estar escrita en el mismo tono o no. Esta acción requiere mayores recursos atencionales que la lectura, la cual es considerada un proceso más automático13. Se cree que el efecto de interferencia generado ocurre en una etapa perceptual como una función de la atención selectiva visual14. Adicionalmente, se evalúan las áreas cerebrales motoras, involucradas con el movimiento de oposición de los dedos de la mano derecha, y las áreas cerebrales del lenguaje por medio del paradigma de fluidez verbal fonológica11.
La hipótesis de este trabajo se basó en la idea de que la RMf, junto con la prueba psicológica d2, podía demostrar los efectos de la restricción del sueño que experimentan los médicos en entrenamiento, como resultado de sus turnos, en las funciones motoras, de atención y de lenguaje. El objetivo, entonces, fue determinar las consecuencias de la privación del sueño sobre la actividad cerebral en las tareas motoras, de atención y de generación de lenguaje mediante RMf en estudiantes de Medicina. A su vez, se buscó determinar cómo afecta esta privación del sueño en el desempeño de los estudiantes a través de la prueba psicológica de atención d2.
Materiales y métodosDiseño del estudioEl estudio se desarrolló bajo un esquema observacional de cohorte longitudinal cruzado de un brazo de evaluación de intervención. Para ello, se planteó como fase control un ciclo de sueño regular y como fase condición un estado con restricción moderada del sueño. El trabajo fue aprobado por los comités de ética de la institución universitaria y del hospital universitario, y se realizó según los protocolos de los establecimientos.
Cálculo de muestraPara determinar si existe una diferencia significativa en la activación cerebral con y sin privación del sueño en la RMf se aplicó un modelo de efectos mixtos con análisis de conjunción15 y paradigmas con un error tipo I alfa de 0,05 (intervalo de confianza [IC] de 95%) y tipo II beta de 0,20 (poder 80%) en una serie de 12 personas16. El cálculo de la muestra fue realizado asumiendo la magnitud de la asociación de un cambio porcentual de señal en los voxels activados de 0,5%, bajo un suavizado de 5mm de anchura a media altura (FWHM). Al respecto, se han hecho estudios longitudinales en RMf con paradigmas de atención17, memoria16 y lenguaje18, con características similares a los paradigmas de Stroop y fluidez fonológica, con un muestreo de 12 personas en dos sesiones.
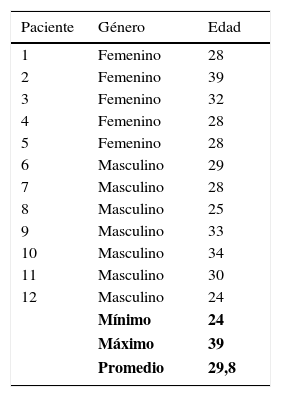
SujetosSe seleccionaron estudiantes de pre y posgrado de Medicina que rotaban en el departamento de Imágenes Diagnósticas y que voluntariamente aceptaron participar del estudio, por lo que se utilizó el método no probabilístico de conveniencia. Se incluyeron 12 personas diestras, 6 hombres y 6 mujeres, con edades entre los 20 y 40 años (media: 29,72 años) y jornadas nocturnas habituales (una vez por semana como mínimo) (tabla 1). Todos firmaron el consentimiento informado para la realización de las resonancias y la prueba psicológica.
Los criterios de inclusión fueron: ser estudiante de Medicina de pre o posgrado, diestro y tener una edad comprendida entre los 20 y 40 años; mientras que los de exclusión se basaron en la presentación de alteraciones o enfermedades del sistema nervioso central, desórdenes médicos en el sueño, abuso de sustancias que pudiesen afectar el patrón habitual del sueño, uso de marcapasos o bombas de insulina, claustrofobia y peso superior a los 135 kilogramos.
Los participantes completaron un diario de sueño durante los 5 días previos al primer examen, que permitió calcular el número de horas que dormían durante el ciclo regular, así como también lo llenaron el día y noche previos al segundo examen donde ocurrió la restricción moderada por el turno nocturno. Así, se calcularon las horas de sueño promedio en las dos condiciones y el porcentaje de restricción comparando ambos ciclos. El tiempo promedio del ciclo regular diario fue de 6,54 horas, mientras que el de la restricción moderada fue de 2,5 horas (lo cual equivale a un 63% de restricción de sueño).
PruebasTest de atención d2La prueba de atención d2 es una de las pruebas psicológicas de atención más ampliamente utilizadas por su alta confiabilidad interna, validez, valor predictivo, de criterio y de constructo9. Originalmente fue desarrollada para medir y comparar la habilidad de los conductores19. Consiste en una planilla con 14 líneas que tienen, cada una, 47 caracteres para un total de 658 estímulos en la forma de una d o p marcadas con 1, 2, 3 o 4 puntos. El ejercicio radica en revisar las líneas en un tiempo limitado (20 segundos por cada una), señalando las d con dos marcas (estímulo relevante), mientras se ignoran los demás caracteres.
El examen se enfoca en la atención selectiva o sostenida (esta última es la capacidad de mantener una actividad de atención durante un tiempo prolongado) y mide la capacidad de centrar la atención en tres estímulos relevantes distintos a medida que se suprimen deliberadamente los estímulos distractores. Tiene componentes de medición de velocidad de procesamiento, de precisión en la selección visual y de concentración. En cuanto a la función cognoscitiva y los exámenes de atención, se ha visto que aquellas pruebas que evalúan la vigilancia y precisión de selección son marcadores sensibles a los efectos de la restricción moderada del sueño20.
En nuestro estudio, todos los participantes fueron evaluados con el test de atención d2, tanto en los ciclos de sueño regulares como en los de restricción moderada. Cada uno revisó las líneas de la prueba en el tiempo estipulado (20 s), señalando las d con dos marcas (estímulo relevante) y no los demás caracteres, ya sea d o p marcados con una, tres o cuatro marcas o p con dos marcas.
Resonancia magnética funcionalEn las dos condiciones, los estudiantes fueron evaluados durante la ejecución de 4 paradigmas: motor de la mano derecha o dominante, fluidez fonológica y Stroop en dos versiones. Para la obtención de las imágenes de la RMf se utilizó un equipo Signa 1.5 Tesla (General Electric, Milwaukee, WI, EE.UU.) con una antena de cuadratura para cabeza de 4 canales de tamaño estándar. Para que el sujeto visualizara las instrucciones de los paradigmas se utilizó una proyección con videobeam desde el comando del resonador que transmitía la imagen a un telón y que se reflejaba en el espejo de la antena de cabeza dentro del equipo.
Se emplearon secuencias BOLD para los diferentes registros funcionales, una secuencia anatómica volumétrica tridimensional (3D), una de inversión recuperación con información en ponderación T1 y una secuencia eco de espín con información en ponderación T1 en el plano transversal (utilizadas para superponer las activaciones).
En el procesamiento de las imágenes se utilizó una computadora portátil MacBook Pro y el fMRI Software Library (FSL) con la herramienta FEAT, usando un modelo de bloques con doble gamma RHF, un umbral de Z de 2,3 y un p=0,0521,22.
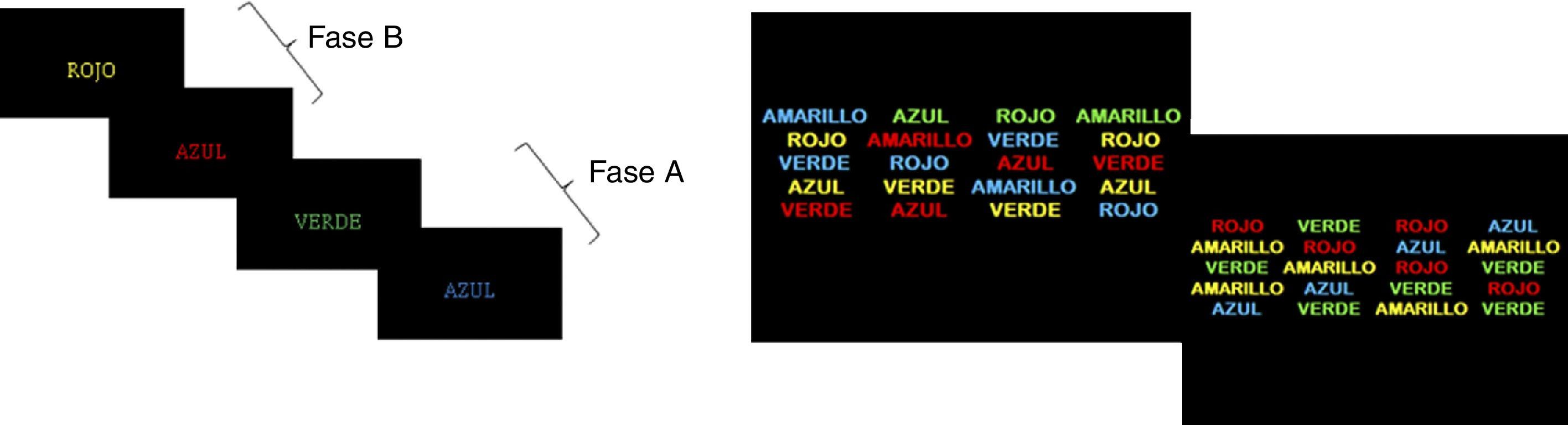
ParadigmasSe construyeron 4 paradigmas bajo el esquema de bloques A-B. El bloque A consistía en una actividad relacionada con el descanso o el reposo, y la indicación era “Concéntrese en su respiración al ver en la pantalla un punto rojo”; mientras que el B se basaba en una actividad relacionada con el paradigma a evaluar. Cada evento duraba 30 segundos y era repetido 4 veces. Las actividades solicitadas en los 4 paradigmas fueron:
*Motor mano derecha: para lograr la activación del área motora primaria, uno de los paradigmas más populares es el tapping. Este consiste en un movimiento rápido de oposición del dedo pulgar con los demás dedos de la mano dominante, generalmente la derecha en las personas diestras. Así, en el estudio se pidió oponer secuencialmente los dedos de la mano derecha manteniendo un ritmo, mientras en la pantalla se observaba la instrucción “Mueva la mano derecha”.
*Fluidez verbal fonológica: para activar las áreas del lenguaje, este paradigma presenta una letra a partir de la cual el sujeto debe pensar en palabras que tengan esa inicial. En nuestro caso, la consigna fue: “Piense en todas las palabras que pueda que comienzan con la letra que ve en la pantalla”. Se mostraron la A, la C, la D y la O.
*Stroop: los paradigmas Stroop normal y Stroop lista fueron desarrollados por el grupo de investigadores que adaptaron el estudio neuropsicológico de Stroop y lo probaron anteriormente en voluntarios23. La tarea era nombrar el color con el cual estaba escrita una palabra que era el nombre de un color, ya que esto requiere mayores recursos de atención que la lectura de la palabra misma13.
Así, el paradigma consistió en presentarle al sujeto palabras congruentes en las que el nombre de un color estaba escrito con una tinta de ese tono (p. ej., rojo escrito en tinta roja) y palabras no congruentes (p. ej. rojo escrito en color verde), y pedirle que siempre piense en el color y no en el nombre de la palabra. Como se cree que el efecto de interferencia ocurre en una etapa perceptual, como una función de la atención selectiva visual, de este modo se busca activar las áreas cerebrales relacionadas con la función ejecutiva de la atención14.
- -
Stroop normal (SN): estaba compuesto por los bloques A y B sin período de descanso, con la instrucción “Piense en el color de la tinta con la que está escrita la palabra”. En las fases A, de 30 segundos, se presentaron 15 términos escritos con colores congruentes; mientras que en las fases B la palabra no correspondía al color de la tinta, produciendo el efecto de interferencia (p. ej. rojo escrito en tinta azul). Se realizaron cuatro bloques de 15 palabras con intervalos de 2 segundos.
- -
Stroop lista (SL): similar al SN en la forma de construcción de los bloques, en este paradigma el participante debía pensar en el color de la tinta con la que estaba escrita la palabra. La presentación de los estímulos eran listas de términos (fig. 1), en un bloque con palabras escritas en colores incongruentes y en otro con colores congruentes.
Los datos del examen de atención d2 se analizaron con la prueba no paramétrica de rangos de signos de Wilcoxon para muestras pareadas, con un valor alfa de 0,05.
En cuanto a las neuroimágenes, se analizaron los grupos. Primero, se procesó cada paradigma con el modelo de efectos mixtos FLAME 1+2 en FSL, que permite una mayor precisión en la localización de las activaciones24,25, empleando análisis grupales (12 voluntarios por grupo) o de segundo nivel para muestras pareadas. A su vez, esta misma herramienta fue aplicada para los análisis comparativos entre los dos ciclos de sueño. Ya obtenidas las imágenes grupales de cada paradigma y las comparativas entre las dos condiciones, se graficaron los principales grupos de activación superpuestos a las imágenes en corte axial de RMf y los Z máximos con coordenadas de Talairach (uno de los atlas comúnmente utilizados para la localización de las activaciones en el cerebro en RMf). Los resultados fueron corregidos por medio del false discovery rate (FDR), el valor alfa se estableció en 0,05 y las hipótesis estadísticas planteadas fueron de dos colas.
ResultadosAnálisis estadístico del examen de atención d2No se encontraron resultados estadísticamente significativos. Es decir, entre los grupos comparados no hubo diferencias en cuanto a la efectividad total de la prueba, el índice de concentración y de variación, y el total de respuestas, aciertos, omisiones y comisiones.
Resonancia magnética funcional: análisis de grupoEn los análisis de grupo para cada paradigma, se usó la imagen de resonancia magnética con las zonas de activación superpuestas y una tabla de los Z máximos con coordenadas de Talairach. En un primer análisis se vieron en diferente color las activaciones: el ciclo normal de sueño en rojo y el de restricción moderada en azul.
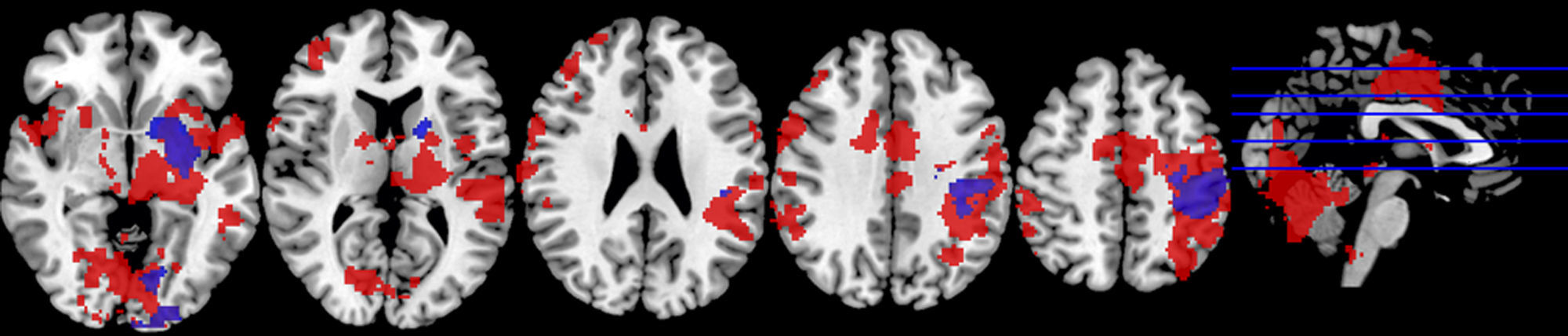
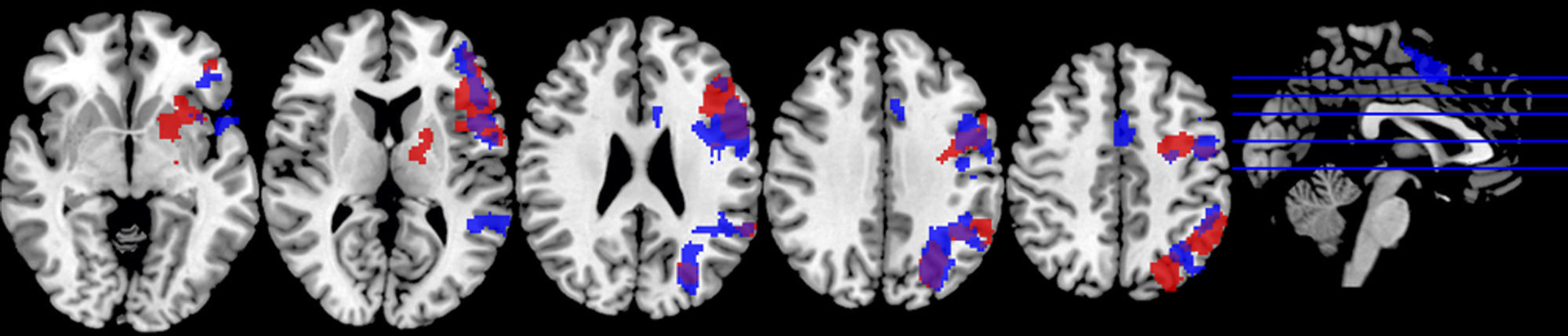
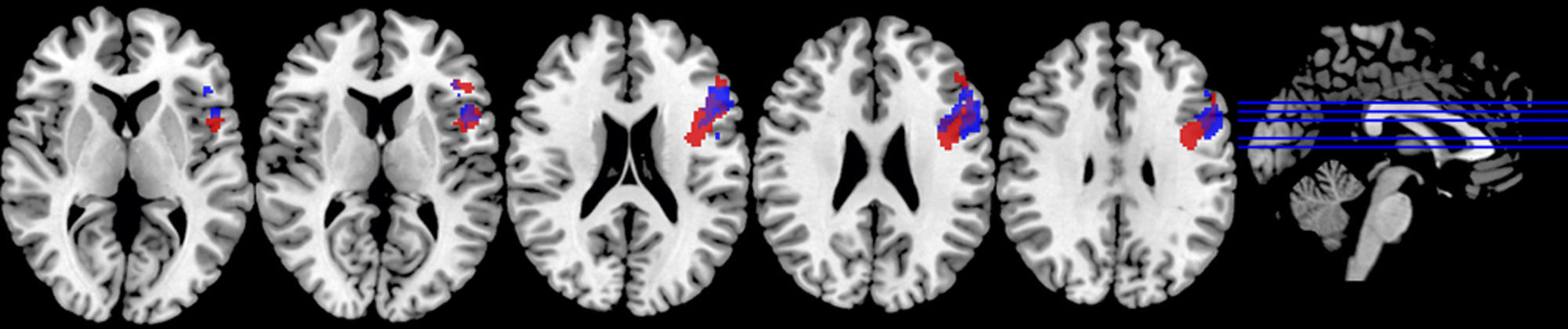
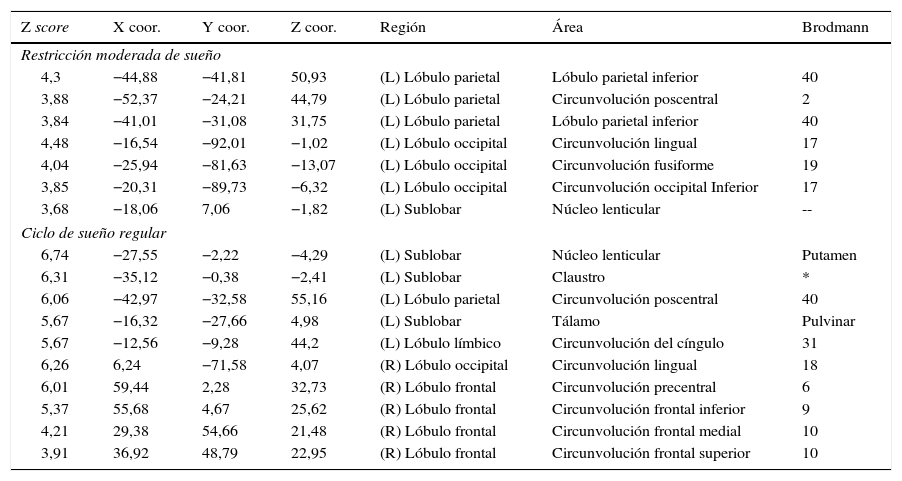
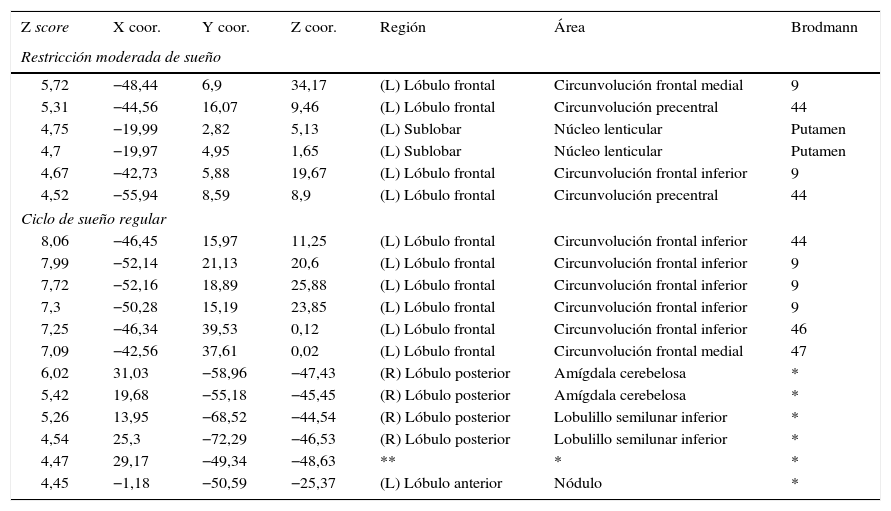
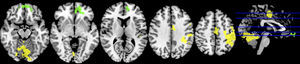
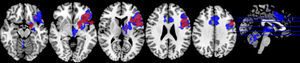
Motor mano derechaEl análisis de grupos en la condición de sueño regular mostró una activación de las regiones pre y poscentrales, mientras que en la restricción de sueño parcial predominó la activación de la circunvolución precentral, pero en menor magnitud en comparación con la condición de sueño regular. En cuanto a las circunvoluciones frontales únicamente se activaron en la condición de sueño regular, al igual que los ganglios basales, el núcleo lenticular y el tálamo (fig. 2; tabla 2).
Activaciones en paradigma motor mano derecha
| Z score | X coor. | Y coor. | Z coor. | Región | Área | Brodmann |
|---|---|---|---|---|---|---|
| Restricción moderada de sueño | ||||||
| 4,3 | −44,88 | −41,81 | 50,93 | (L) Lóbulo parietal | Lóbulo parietal inferior | 40 |
| 3,88 | −52,37 | −24,21 | 44,79 | (L) Lóbulo parietal | Circunvolución poscentral | 2 |
| 3,84 | −41,01 | −31,08 | 31,75 | (L) Lóbulo parietal | Lóbulo parietal inferior | 40 |
| 4,48 | −16,54 | −92,01 | −1,02 | (L) Lóbulo occipital | Circunvolución lingual | 17 |
| 4,04 | −25,94 | −81,63 | −13,07 | (L) Lóbulo occipital | Circunvolución fusiforme | 19 |
| 3,85 | −20,31 | −89,73 | −6,32 | (L) Lóbulo occipital | Circunvolución occipital Inferior | 17 |
| 3,68 | −18,06 | 7,06 | −1,82 | (L) Sublobar | Núcleo lenticular | -- |
| Ciclo de sueño regular | ||||||
| 6,74 | −27,55 | −2,22 | −4,29 | (L) Sublobar | Núcleo lenticular | Putamen |
| 6,31 | −35,12 | −0,38 | −2,41 | (L) Sublobar | Claustro | * |
| 6,06 | −42,97 | −32,58 | 55,16 | (L) Lóbulo parietal | Circunvolución poscentral | 40 |
| 5,67 | −16,32 | −27,66 | 4,98 | (L) Sublobar | Tálamo | Pulvinar |
| 5,67 | −12,56 | −9,28 | 44,2 | (L) Lóbulo límbico | Circunvolución del cíngulo | 31 |
| 6,26 | 6,24 | −71,58 | 4,07 | (R) Lóbulo occipital | Circunvolución lingual | 18 |
| 6,01 | 59,44 | 2,28 | 32,73 | (R) Lóbulo frontal | Circunvolución precentral | 6 |
| 5,37 | 55,68 | 4,67 | 25,62 | (R) Lóbulo frontal | Circunvolución frontal inferior | 9 |
| 4,21 | 29,38 | 54,66 | 21,48 | (R) Lóbulo frontal | Circunvolución frontal medial | 10 |
| 3,91 | 36,92 | 48,79 | 22,95 | (R) Lóbulo frontal | Circunvolución frontal superior | 10 |
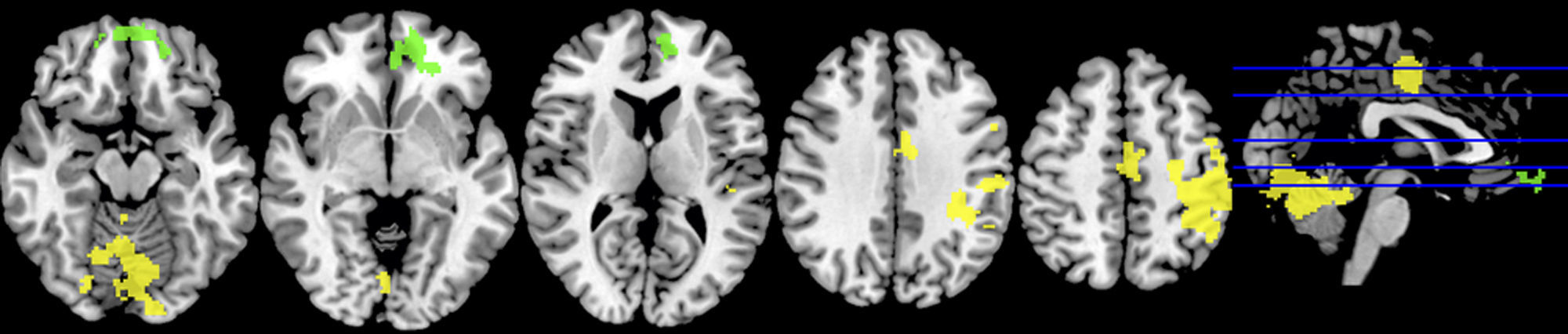
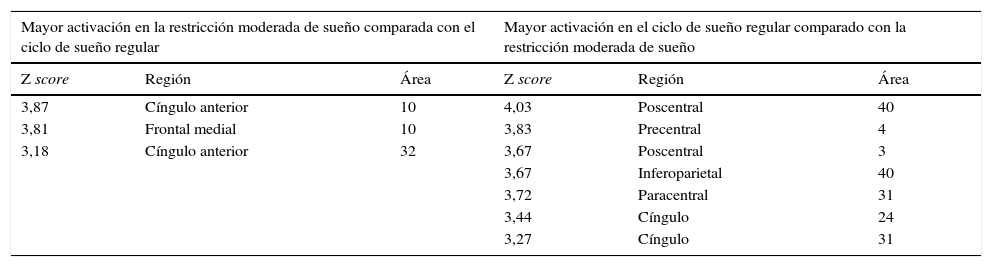
En un segundo análisis, se hizo el cálculo para que se mostraran en un color las activaciones que únicamente ocurrían en cada estado. Así, se observó en verde la activación de la condición restricción moderada del sueño, cuando era mayor en esta que en la del ciclo regular, y en amarillo aquella predominante en la condición del ciclo regular de sueño. Al utilizar esta segunda herramienta, se evidenció que en los sujetos con restricción moderada de sueño, a pesar de que había una menor activación de las áreas motoras primarias y suplementarias, se promovía la activación de las regiones del cíngulo anterior y la circunvolución medial frontal en las áreas de Brodmann 10 y 32 (fig. 3; tabla 3).
Gráfico de las diferencias de grupos en el paradigma motor mano derecha. En verde se observan las regiones mayormente activadas en la restricción moderada de sueño y en amarillo aquellas predominantes en el ciclo de sueño regular. No se muestran las activaciones compartidas, sino únicamente las distintivas de cada condición.
Resultados del contraste entre grupos paradigma motor mano derecha con false discovery rate y p<0,05. Áreas de activación asociadas con restricción moderada de sueño y áreas de activación asociadas con ciclo de sueño regular
| Mayor activación en la restricción moderada de sueño comparada con el ciclo de sueño regular | Mayor activación en el ciclo de sueño regular comparado con la restricción moderada de sueño | ||||
|---|---|---|---|---|---|
| Z score | Región | Área | Z score | Región | Área |
| 3,87 | Cíngulo anterior | 10 | 4,03 | Poscentral | 40 |
| 3,81 | Frontal medial | 10 | 3,83 | Precentral | 4 |
| 3,18 | Cíngulo anterior | 32 | 3,67 | Poscentral | 3 |
| 3,67 | Inferoparietal | 40 | |||
| 3,72 | Paracentral | 31 | |||
| 3,44 | Cíngulo | 24 | |||
| 3,27 | Cíngulo | 31 | |||
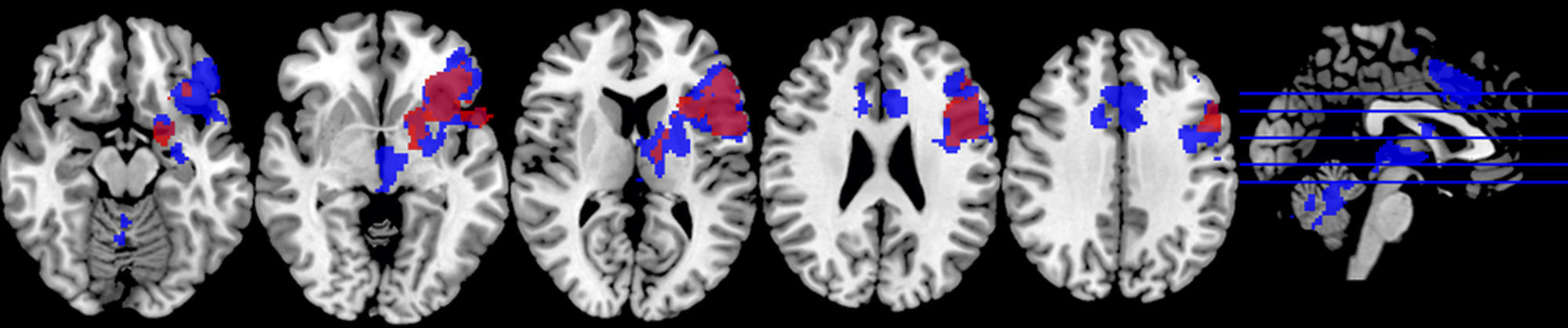
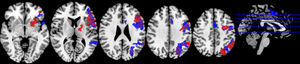
El análisis demostró que en ambas condiciones se activaron regiones típicamente implicadas en el lenguaje en la circunvolución frontal inferior y medial, principalmente en las áreas 44, 46 y 9 de Brodmann (fig. 4; tabla 4). Sin embargo, no se demostraron diferencias significativas en las regiones activadas al comparar las dos condiciones.
Zonas de activación en el paradigma de fluencia fonológica para restricción moderada de sueño y ciclo de sueño regular
| Z score | X coor. | Y coor. | Z coor. | Región | Área | Brodmann |
|---|---|---|---|---|---|---|
| Restricción moderada de sueño | ||||||
| 5,72 | −48,44 | 6,9 | 34,17 | (L) Lóbulo frontal | Circunvolución frontal medial | 9 |
| 5,31 | −44,56 | 16,07 | 9,46 | (L) Lóbulo frontal | Circunvolución precentral | 44 |
| 4,75 | −19,99 | 2,82 | 5,13 | (L) Sublobar | Núcleo lenticular | Putamen |
| 4,7 | −19,97 | 4,95 | 1,65 | (L) Sublobar | Núcleo lenticular | Putamen |
| 4,67 | −42,73 | 5,88 | 19,67 | (L) Lóbulo frontal | Circunvolución frontal inferior | 9 |
| 4,52 | −55,94 | 8,59 | 8,9 | (L) Lóbulo frontal | Circunvolución precentral | 44 |
| Ciclo de sueño regular | ||||||
| 8,06 | −46,45 | 15,97 | 11,25 | (L) Lóbulo frontal | Circunvolución frontal inferior | 44 |
| 7,99 | −52,14 | 21,13 | 20,6 | (L) Lóbulo frontal | Circunvolución frontal inferior | 9 |
| 7,72 | −52,16 | 18,89 | 25,88 | (L) Lóbulo frontal | Circunvolución frontal inferior | 9 |
| 7,3 | −50,28 | 15,19 | 23,85 | (L) Lóbulo frontal | Circunvolución frontal inferior | 9 |
| 7,25 | −46,34 | 39,53 | 0,12 | (L) Lóbulo frontal | Circunvolución frontal inferior | 46 |
| 7,09 | −42,56 | 37,61 | 0,02 | (L) Lóbulo frontal | Circunvolución frontal medial | 47 |
| 6,02 | 31,03 | −58,96 | −47,43 | (R) Lóbulo posterior | Amígdala cerebelosa | * |
| 5,42 | 19,68 | −55,18 | −45,45 | (R) Lóbulo posterior | Amígdala cerebelosa | * |
| 5,26 | 13,95 | −68,52 | −44,54 | (R) Lóbulo posterior | Lobulillo semilunar inferior | * |
| 4,54 | 25,3 | −72,29 | −46,53 | (R) Lóbulo posterior | Lobulillo semilunar inferior | * |
| 4,47 | 29,17 | −49,34 | −48,63 | ** | * | * |
| 4,45 | −1,18 | −50,59 | −25,37 | (L) Lóbulo anterior | Nódulo | * |
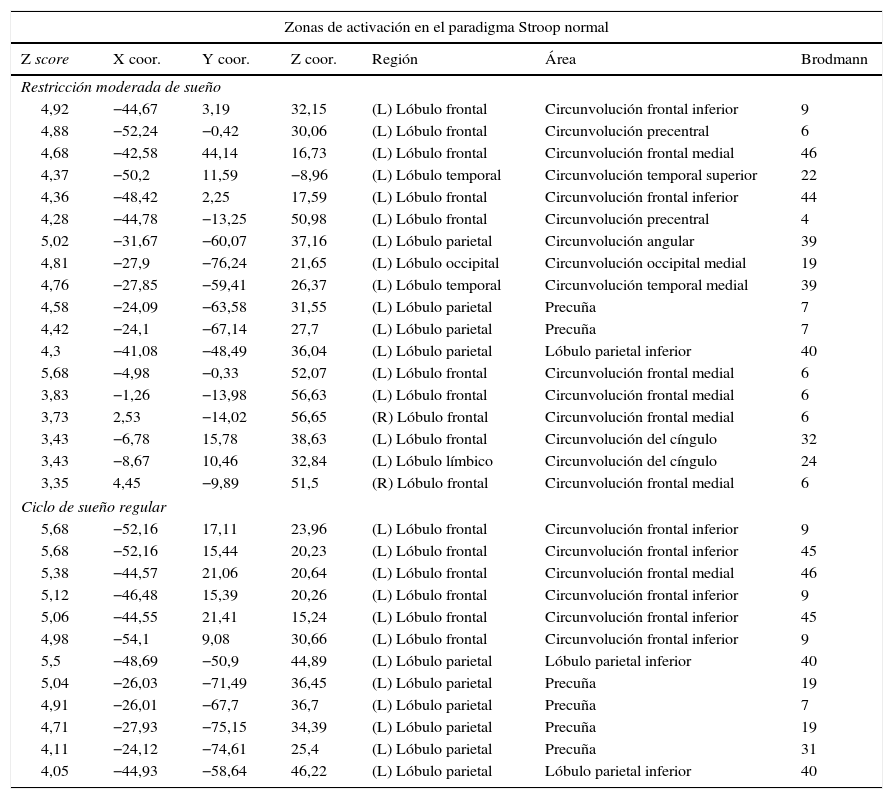
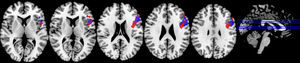
En el paradigma de inhibición de Stroop normal no se encontraron diferencias significativas entre las dos condiciones (fig. 5; tabla 4). Se observaron diversas activaciones primordialmente en las regiones anteriores izquierdas y zonas como la circunvolución frontal media, el cíngulo y la circunvolución frontal inferior.
Stroop listaEn este paradigma de inhibición se constató que en ambas condiciones se activaron las regiones de la circunvolución frontal inferior y media (fig. 6; tabla 5), sin haber diferencias significativas al compararlas.
Zonas de activación en el paradigma de Stroop
| Zonas de activación en el paradigma Stroop normal | ||||||
|---|---|---|---|---|---|---|
| Z score | X coor. | Y coor. | Z coor. | Región | Área | Brodmann |
| Restricción moderada de sueño | ||||||
| 4,92 | −44,67 | 3,19 | 32,15 | (L) Lóbulo frontal | Circunvolución frontal inferior | 9 |
| 4,88 | −52,24 | −0,42 | 30,06 | (L) Lóbulo frontal | Circunvolución precentral | 6 |
| 4,68 | −42,58 | 44,14 | 16,73 | (L) Lóbulo frontal | Circunvolución frontal medial | 46 |
| 4,37 | −50,2 | 11,59 | −8,96 | (L) Lóbulo temporal | Circunvolución temporal superior | 22 |
| 4,36 | −48,42 | 2,25 | 17,59 | (L) Lóbulo frontal | Circunvolución frontal inferior | 44 |
| 4,28 | −44,78 | −13,25 | 50,98 | (L) Lóbulo frontal | Circunvolución precentral | 4 |
| 5,02 | −31,67 | −60,07 | 37,16 | (L) Lóbulo parietal | Circunvolución angular | 39 |
| 4,81 | −27,9 | −76,24 | 21,65 | (L) Lóbulo occipital | Circunvolución occipital medial | 19 |
| 4,76 | −27,85 | −59,41 | 26,37 | (L) Lóbulo temporal | Circunvolución temporal medial | 39 |
| 4,58 | −24,09 | −63,58 | 31,55 | (L) Lóbulo parietal | Precuña | 7 |
| 4,42 | −24,1 | −67,14 | 27,7 | (L) Lóbulo parietal | Precuña | 7 |
| 4,3 | −41,08 | −48,49 | 36,04 | (L) Lóbulo parietal | Lóbulo parietal inferior | 40 |
| 5,68 | −4,98 | −0,33 | 52,07 | (L) Lóbulo frontal | Circunvolución frontal medial | 6 |
| 3,83 | −1,26 | −13,98 | 56,63 | (L) Lóbulo frontal | Circunvolución frontal medial | 6 |
| 3,73 | 2,53 | −14,02 | 56,65 | (R) Lóbulo frontal | Circunvolución frontal medial | 6 |
| 3,43 | −6,78 | 15,78 | 38,63 | (L) Lóbulo frontal | Circunvolución del cíngulo | 32 |
| 3,43 | −8,67 | 10,46 | 32,84 | (L) Lóbulo límbico | Circunvolución del cíngulo | 24 |
| 3,35 | 4,45 | −9,89 | 51,5 | (R) Lóbulo frontal | Circunvolución frontal medial | 6 |
| Ciclo de sueño regular | ||||||
| 5,68 | −52,16 | 17,11 | 23,96 | (L) Lóbulo frontal | Circunvolución frontal inferior | 9 |
| 5,68 | −52,16 | 15,44 | 20,23 | (L) Lóbulo frontal | Circunvolución frontal inferior | 45 |
| 5,38 | −44,57 | 21,06 | 20,64 | (L) Lóbulo frontal | Circunvolución frontal medial | 46 |
| 5,12 | −46,48 | 15,39 | 20,26 | (L) Lóbulo frontal | Circunvolución frontal inferior | 9 |
| 5,06 | −44,55 | 21,41 | 15,24 | (L) Lóbulo frontal | Circunvolución frontal inferior | 45 |
| 4,98 | −54,1 | 9,08 | 30,66 | (L) Lóbulo frontal | Circunvolución frontal inferior | 9 |
| 5,5 | −48,69 | −50,9 | 44,89 | (L) Lóbulo parietal | Lóbulo parietal inferior | 40 |
| 5,04 | −26,03 | −71,49 | 36,45 | (L) Lóbulo parietal | Precuña | 19 |
| 4,91 | −26,01 | −67,7 | 36,7 | (L) Lóbulo parietal | Precuña | 7 |
| 4,71 | −27,93 | −75,15 | 34,39 | (L) Lóbulo parietal | Precuña | 19 |
| 4,11 | −24,12 | −74,61 | 25,4 | (L) Lóbulo parietal | Precuña | 31 |
| 4,05 | −44,93 | −58,64 | 46,22 | (L) Lóbulo parietal | Lóbulo parietal inferior | 40 |
| Zonas de activación en el paradigma Stroop lista | ||||||
|---|---|---|---|---|---|---|
| Z score | X coor. | Y coor. | Z coor. | Región | Área | Brodmann |
| Restricción moderada de sueño | ||||||
| 4,59 | −50,32 | 7,15 | 30,56 | (L) Lóbulo frontal | Circunvolución frontal inferior | 9 |
| 4,06 | −44,59 | 13,48 | 20,15 | (L) Lóbulo frontal | Circunvolución frontal inferior | 9 |
| 3,94 | −52,18 | 14,98 | 27,44 | (L) Lóbulo frontal | Circunvolución frontal inferior | 9 |
| 3,93 | −52,15 | 20,9 | 24,2 | (L) Lóbulo frontal | Circunvolución frontal inferior | 9 |
| 3,86 | −50,34 | 5,02 | 34,04 | (L) Lóbulo frontal | Circunvolución frontal medial | 9 |
| 3,74 | −50,27 | 10,2 | 12,66 | (L) Lóbulo frontal | Circunvolución frontal inferior | 44 |
| Ciclo de sueño regular | ||||||
| 4,29 | −44,65 | 3,42 | 28,54 | (L) Lóbulo frontal | Circunvolución frontal inferior | 9 |
| 4,24 | −40,85 | 5,63 | 23,28 | (L) Lóbulo frontal | Circunvolución frontal inferior | 9 |
| 4,18 | −52,2 | 9,29 | 27,07 | (L) Lóbulo frontal | Circunvolución frontal inferior | 9 |
| 3,86 | −44,61 | 6,25 | 14,25 | (L) Sublobar | Ínsula | 13 |
| 3,79 | −42,71 | 9,79 | 18,11 | (L) Sublobar | Ínsula | 13 |
| 3,71 | −37 | −0,54 | 30,13 | (L) Lóbulo frontal | Circunvolución precentral | 6 |
En investigaciones con RMf se ha estudiado el efecto de la restricción del sueño en los procesos de atención, como el de la clasificación y reconocimiento visual de objetos, y se ha encontrado una reducción de la activación en áreas específicas como las regiones parahipocámpicas y la corteza frontoparietal en asociación con el enlentecimiento en el reconocimiento de los objetos y una menor capacidad para recordar escenas8. Otros estudios han mostrado cómo los efectos negativos de la restricción del sueño se relacionan con una menor activación de áreas visuales parietales y por fuera del estriado sin que haya incremento de la distractibilidad26. No obstante, Mander et al.27 han demostrado que en tareas de atención espacial y de tiempos de reacción, después de una privación de sueño de 24 horas, existe una mayor susceptibilidad a la distracción.
Las pruebas llevadas a cabo en nuestra población exploraron la atención vinculada con la red ejecutiva mediante el test psicológico d2 y la RMf, empleando el paradigma Stroop. El resultado de la prueba de atención d2, contrariamente a algunas publicaciones que han comunicado una disminución en los tiempos de reacción y un aumento de errores, no mostró diferencias significativas entre la condición de sueño regular y la de restricción moderada para ninguna de las variables. Esta discrepancia puede explicarse principalmente porque la restricción de sueño en nuestro grupo fue parcial y menor, en comparación con la de otros artículos publicados. Sin embargo, el resultado es válido, en tanto es la restricción real que tienen los estudiantes sometidos a la prueba28.
Al igual que en otros estudios, con el paradigma Stroop se activaron regiones anteriores, principalmente en el hemisferio cerebral izquierdo. Al cotejar los dos paradigmas, el Stroop lista presentó mayor dificultad, pero fue mucho más específico activando regiones frontales inferiores y mediales. En el Stroop normal, se observó una mayor cantidad de activaciones en las regiones ya mencionadas y en la anterior del cíngulo, la circunvolución temporal superior y media, y la precuña, lo cual es similar a lo descrito en otras publicaciones29,30.
Como en el resultado obtenido mediante el test d2, en los procesos de inhibición cognitiva en la prueba de RMf con paradigmas Stroop no hubo diferencias en las activaciones asociadas a la restricción moderada de sueño. Si bien no se realizó un Stroop conductual con mediciones de tiempos de reacción que nos permitiera inferir un cambio en el desempeño, hay investigaciones que informan ausencia de cambios después de una restricción moderada de sueño, pero sí presencia de alteraciones en los tiempos de respuesta31. Desde esta perspectiva, en nuestro estudio las funciones inhibitorias no se vieron afectadas por la restricción moderada de sueño en la muestra de estudiantes utilizada.
En cuanto a la restricción moderada de sueño, es posible que esta no haya sido suficiente para producir los efectos esperados en la atención e inhibición con las pruebas Stroop en la RMf. Además, puede considerarse que la dificultad en los paradigmas no fue la suficiente para producir diferencias en la ejecución de los participantes luego de la restricción moderada del sueño o que existen procesos de compensación en los sujetos expuestos frecuentemente a una restricción moderada de sueño (los cuales se han documentado en estudios de RMf)32.
Por otro lado, se observaron diferencias significativas en la RMf con el paradigma de movimiento de la mano derecha. Este mostró un contraste significativo de la restricción moderada de sueño sobre las zonas de representación motora, con una menor activación de áreas motoras y sensoriales primarias y secundarias, y activación de otras áreas, como el cíngulo anterior.
Ante una restricción moderada del sueño, una de las inferencias posibles es que existe un reclutamiento adicional de zonas frontales, como la circunvolución frontal media y el cíngulo anterior, mientras disminuye la actividad en regiones pre y poscentrales, correspondientes a las áreas motoras y sensoriales primarias. Este patrón es muy similar al observado en la reorganización cerebral después de lesiones motoras en recuperación33.
Una posibilidad que podría explicar la aparición de esta activación, tanto en nuestra muestra como en los pacientes en recuperación motora, es el factor esfuerzo. Así, es posible que el efecto de restricción moderada de sueño en el sistema muscular o de control motor genere de alguna manera un esfuerzo mayor de los sujetos, incrementando, por ejemplo, el nivel de alarma. En efecto, tanto el cíngulo anterior como las regiones prefrontales forman parte del sistema de alerta y se activan cuando el sujeto necesita aumentar sus niveles de atención. Este cambio en la actividad de alerta podría correlacionarse con otros estudios en los que se hace referencia a un aumento en los tiempos de reacción31. La mayor latencia sería el resultado de un incremento de las regiones de reclutamiento.
Olasky et al. evaluaron cómo afecta la restricción del sueño en las habilidades motoras, mostrando cómo varía su desempeño en el manejo de aparatos médicos, como simuladores quirúrgicos o de laparoscopia34. Sin embargo, la función motora no había sido objeto de estudio en otras publicaciones que han valorado la restricción del sueño con RMf como sí lo es en nuestro trabajo, donde se corroboraron los resultados de dichos exámenes, al mostrar la disminución de la activación de las áreas motoras como consecuencia de la falta del sueño.
Los resultados obtenidos solo pueden ser extrapolados a poblaciones con similares condiciones, es decir, estudiantes de Medicina de pre o posgrado que en su entrenamiento padecen restricción parcial de sueño por los turnos, con una frecuencia usual de una vez por semana. Al respecto, se deduce que este tipo de privación afectaría negativamente a las actividades que requieren habilidad motora y que, por tanto, sería más grave en especialidades quirúrgicas o que requieren mayormente técnicas manuales. Sin embargo, Lehmann et al. no han detectado cambios en el desempeño de los cirujanos luego de una restricción relativa de sueño en un turno de 24 horas28.
En los paradigmas de fluidez fonológica tampoco se evidenciaron cambios significativos por la restricción moderada de sueño. Al igual que en otros estudios, se observaron las activaciones en las regiones frontal inferior o de Broca (Brodmann 45 y 9) y medial (Brodmann 46). Estas se activan generalmente durante la generación y fluencia verbal.
El presente estudio tomó en cuenta a un grupo de estudiantes de Medicina que se rigen por exigencias laborales y académicas propias del proceso de entrenamiento. La restricción del sueño en ellos solo puede calificarse como parcial, a diferencia de otras publicaciones. Si bien se pretendía obtener una privación del 75%, en esta muestra fue del 63%, reflejando dos situaciones reales de este grupo. Por un lado, el promedio de horas de sueño en condiciones regulares es inferior al considerado normal para la población general; y por el otro, la restricción de sueño durante el turno no es completa, ya que lo habitual es que se duerman algunas horas. Por tanto, el porcentaje de restricción de sueño resulta menor en comparación con otros estudios similares publicados.
En estas condiciones no se demostraron diferencias significativas en la prueba psicológica de atención d2 ni en las activaciones cerebrales comparativas entre ambos ciclos de sueño en los estudios de RMf con los paradigmas de atención selectiva visual (medida con el paradigma Stroop) y de lenguaje. Esto puede reflejar cómo la restricción crónica del sueño en el grupo estudiado permitió desarrollar habilidades para lograr un desempeño adecuado en el lenguaje y la atención, o mecanismos de adaptación a la restricción leve y moderada de sueño. Esto ha sido estudiado por otros autores, como Belenky et al.35 que han señalado que la recuperación de las habilidades en estas personas al cesar la restricción del sueño es más lenta que la de aquellas que han tenido una limitación aguda.
Dado que se trató de estudiantes de Medicina, estos han estado expuestos a condiciones similares de restricción moderada y continua de sueño, por lo que podrían haber desarrollado mecanismos compensatorios más eficientes o al menos suficientes para que no haya cambios significativos en las pruebas de atención y de fluencia fonológica presentadas. Por ello, los resultados solo pueden extrapolarse a poblaciones similares. No obstante, en algunas series estudiadas sin privación crónica del sueño, la restricción necesaria para mostrar diferencias en funciones asociadas al sueño no fue mayor del 55%36.
Se debe tener en cuenta que la única función neurocognitiva explorada fue la atención del tipo ejecutiva medida con Stroop, mientras que no se atendió a otras condiciones de este tipo que también pueden alterarse con la restricción de sueño (p. ej. la memoria laboral, los tiempos de respuesta a los estímulos y otras funciones mayores, como el aprendizaje o la detección de errores)37–40.
ConclusiónLa resonancia magnética funcional mostró una interacción de la restricción moderada del sueño sobre las zonas de representación motora: disminución en las activaciones de las áreas sensoriomotoras y activación de otras zonas, como la circunvolución del cíngulo y la frontal media, por lo que se infiere que, ante esta condición, se produce un reclutamiento adicional para compensar la disminución de la activación de las regiones sensoriomotoras pre y poscentrales. Este patrón se asemeja al observado en la reorganización cerebral después de lesiones motoras en recuperación, y posiblemente está relacionado con el factor esfuerzo o con la adaptación del cerebro a la restricción moderada de sueño.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia
FinanciaciónLos autores declaran que este estudio fue financiado por la II Convocatoria del Centro de Investigación en Salud (Hospital Universitario Fundación Santa Fe de Bogotá- Universidad de los Andes), sin representar ningún conflicto de interés.
Conflictos de interésLos autores declaran no tener conflictos de interés.