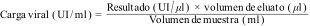El citomegalovirus (CMV) es una de las principales complicaciones vinculadas con el trasplante, ya sea de órgano sólido o de células progenitoras hematopoyéticas, y se asocia a un incremento de la morbimortalidad postrasplante. A causa del alto impacto que tiene, se prefiere que su prevención sea mediante el uso de profilaxis o terapia preventiva. Esta última requiere el monitoreo viral del paciente, dado que la viremia es predictiva de la enfermedad, de modo que el monitoreo permite la detección temprana y el tratamiento preventivo oportuno. En la actualidad, la técnica de monitoreo viral por excelencia es la determinación cuantitativa de ácidos nucleicos. En este sentido, los laboratorios suelen enfrentarse a desafíos prácticos relacionados con el tipo de muestra por tomar, sus condiciones de transporte y almacenamiento, los métodos adecuados de extracción y cuantificación de ácidos nucleicos, la frecuencia del monitoreo y los puntos de corte a utilizar. Todos estos aspectos son importantes para garantizar precisión y reproducibilidad de los resultados de las pruebas de carga viral de CMV. Es por ello que la Sociedad Argentina de Virología ha conformado un grupo de trabajo dedicado específicamente a abordar estas temáticas. En este documento se brinda una serie de recomendaciones referidas a los puntos mencionados, consensuadas sobre la base de la evidencia científica disponible y la experiencia del grupo de trabajo a cargo.
CMV is one of the main complications associated with transplantation, whether of solid organs or hematopoietic stem cells, and is related to an increase in post-transplant morbidity and mortality. Due to its significant impact, prevention is recommended, either through prophylaxis or other preventive therapies. The latter require viral monitoring of the patient, as viremia serves as a predictor of of the disease, allowing for an early detection and timely preventive treatment. The gold standard for viral monitoring is the quantitative determination of nucleic acids. Laboratories often face practical challenges regarding the type of sample to be used, its transport and storage conditions, the appropriate methods of nucleic acid extraction and quantification, the frequency of monitoring and establishment of cut-off points to ensure the accuracy and reproducibility of CMV viral load test results. The Argentine Society of Virology has formed a working group specifically dedicated to addressing these difficulties.
This document aims to provide recommendations on the aforementioned points based on the available scientific evidence and the expertise of the working group.
El citomegalovirus (CMV), también conocido como citomegalovirus humano B5 (CMVH-B5), pertenece a la familia Ortoherpesviridae y se clasifica en la subfamilia Betaherpesvirinae, género Citomegalovirus. Es un virus envuelto, de simetría icosaédrica y genoma ADN de doble cadena71.
Las infecciones por CMV son comunes y tienen una distribución global; pueden ocurrir en cualquier etapa de la vida, aunque son más frecuentes en la infancia. Se estima que la proporción de individuos seropositivos para CMV oscila entre el 40% y más del 90%, según la región geográfica5,12,102.
El CMV se transmite a través de líquidos corporales, como la saliva, la orina, la sangre, las lágrimas, el semen y la leche materna. Las vías de transmisión son por contacto directo con la saliva o la orina, especialmente en bebés y niños pequeños, a través de la leche materna en los lactantes, por contacto sexual y por medio de trasplantes de órganos y transfusiones de sangre6,39,91,95.
En individuos inmunocompetentes, el CMV generalmente no presenta complicaciones significativas. Después de la primoinfección, el virus entra en un estado de latencia de por vida y puede dar lugar a reactivaciones en situaciones particulares. Sin embargo, en pacientes inmunodeprimidos, receptores de trasplantes, personas con infección por el virus de la inmunodeficiencia humana (HIV) o en casos de infección congénita, se comporta como un patógeno oportunista. En estos individuos puede ocasionar enfermedades graves, dejar secuelas e incluso llevar a consecuencias fatales, lo que destaca la importancia crítica de su diagnóstico, monitoreo y manejo en diferentes contextos clínicos específicos66. En el caso particular de los pacientes trasplantados, al recibir tratamientos inmunosupresores para prevenir el rechazo del órgano, su sistema inmunitario se debilita, lo que los hace más propensos a infecciones y reactivaciones virales, entre ellas la de CMV. En este tipo de población, la infección primaria o la reactivación del CMV pueden producir un amplio espectro de enfermedades, como síndrome febril, hepatitis, neumonía, enfermedad gastrointestinal, encefalitis y retinitis. El CMV es una de las principales complicaciones asociadas al trasplante, ya sea de órgano sólido (TOS) o de células progenitoras hematopoyéticas (TCPH), y se asocia a un incremento de la morbimortalidad postrasplante66.
Teniendo en cuenta este escenario, la Sociedad Argentina de Virología ha conformado un grupo de trabajo que tuvo a su cargo la elaboración de una guía de recomendaciones que abordan de manera integral los aspectos claves del diagnóstico y el seguimiento de las cargas virales del CMV en pacientes trasplantados. Esta iniciativa se concretó a partir de la fundamentación proporcionada por la evidencia científica, así como de la experiencia y los conocimientos especializados de nuestro equipo de trabajo. Nuestro propósito es ofrecer una herramienta práctica y confiable que sirva como referencia fundamental para los profesionales de la salud, garantizando un enfoque integral de la atención del paciente trasplantado.
Infección y enfermedad: definiciones de interésEn 1993, en la Cuarta Conferencia Internacional de CMV realizada en París, se establecieron por primera vez definiciones de infección y enfermedad debido a las dificultades para diferenciar estos dos estadios en diferentes tipos de pacientes y enfermedades53,55. Luego de dos actualizaciones de estos conceptos en los años 199558 y 200257, y teniendo en cuenta los grandes avances logrados en el manejo, el tratamiento y los métodos de diagnóstico, en 2016, el CMV Drug Development Forum, un grupo de especialistas estadounidenses, europeos y canadienses, junto con representantes de la Food and Drug Administration (FDA), la European Medicines Agency (EMA) y la industria farmacéutica y de diagnóstico, ampliaron estas definiciones. Se incorporaron a la categoría de enfermedad probada las categorías de enfermedad probable y posible, al mismo tiempo que se incorporó la PCR cuantitativa como método diagnóstico de algunas categorías de enfermedad en órgano por CMV. En 2024, el Transplant Associated Virus Infections Forum (creado en 2014) publicó una actualización de las definiciones referidas al CMV para ser empleadas en estudios clínicos tanto en TOS como en TCPH53,55.
Algunas definiciones que vamos a considerar por su importancia en el diagnóstico son las siguientes:
- -
Infección por CMV o replicación de CMV. Se define por el aislamiento del virus o por la detección de proteínas (antígenos) o de ácido nucleico viral en cualquier fluido o tejido corporal: plasma, suero, sangre entera, leucocitos de sangre periférica, líquido cefalorraquídeo (LCR), lavado broncoalveolar (BAL), orina y diversos tejidos. Según la metodología empleada, la replicación del CMV puede valorarse y denominarse como CMV ADNemia, si se emplean técnicas de amplificación de ácidos nucleicos (NAAT); CMV antigenemia, si se detecta la presencia de antígenos, y CMV viremia, si se basa en el cultivo viral. No siempre la detección de ADNemia representa que el CMV se está replicando activamente. Los llamados «blips de ADN» se caracterizan por una detección única de ADN, usualmente con baja carga viral, y podrían representar una replicación viral incompleta o el control del CMV por parte de la respuesta inmune.
- -
Infección primaria por CMV. Primera detección de infección por CMV en el paciente sin evidencia de exposición al virus antes del trasplante.
- -
Enfermedad por CMV. Se establece cuando la infección está acompañada de signos y síntomas, y puede presentarse como «síndrome por CMV» o «enfermedad en órgano».
- •
Síndrome por CMV: detección dentro de la primera semana de inicio de síntomas de CMV en sangre mediante NAAT, antigenemia o cultivo viral, sumado al menos a dos de las siguientes condiciones55:
- 1.
Fiebre ≥ 38°C por al menos 2 días.
- 2.
Nuevo malestar o fatiga, o incremento de esta.
- 3.
5% de linfocitosis atípica.
- 4.
Leucopenia o neutropenia en dos mediciones distintas.
- 5.
Trombocitopenia.
- 6.
Transaminasas hepáticas elevadas.
- 1.
- •
Esta denominación debe ser empleada solo en pacientes con trasplante de órgano sólido; no es aplicable en individuos con TCPH. Además, el síndrome por CMV se clasifica solo bajo la categoría de probable dada la imposibilidad de excluir todas las causas posibles de la sintomatología descrita.
- •
Enfermedad en órgano. Algunos pacientes trasplantados desarrollan enfermedad por CMV en órganos (neumonía, enfermedad gastrointestinal, hepatitis, retinitis, encefalitis, nefritis, cistitis, miocarditis, pancreatitis), y, en ocasiones, con cargas virales en plasma no detectables. Los cuadros más frecuentes son neumonía y gastroenteritis. En cuanto al diagnóstico de estas enfermedades, se han consensuado definiciones internacionales específicas que señalan con qué métodos diagnósticos documentarlas. La mayor dificultad que se presenta con el CMV es no solo su capacidad de estar en estado latente y poder ser detectado con técnicas muy sensibles, sino también que, aun si se está replicando activamente, puede no ser el agente etiológico de la enfermedad. Estas definiciones establecen diferentes categorías de acuerdo a la certeza o posibilidad de que el CMV sea el agente etiológico: enfermedad probada, enfermedad probable o enfermedad posible.
A continuación se presentan las definiciones de las principales enfermedades asociadas a CMV53,55.
Neumonía por CMVSe distinguen tres categorías:
- a)
Neumonía por CMV probada. Síntomas y/o signos de neumonía (infiltrados en imágenes, hipoxia, taquipnea y/o disnea) más la detección de CMV en biopsia de tejido de pulmón por aislamiento viral, cultivo rápido, histopatología, inmunohistoquímica o técnicas de hibridación de ADN.
- b)
Neumonía por CMV probable. En pacientes con TCPH, se define como la detección de CMV por cultivo tradicional o rápido en muestra de BAL o una carga viral elevada en BAL, más signos y síntomas de neumonía, en ausencia de otro patógeno. El valor de corte de carga viral no se ha definido aún por falta de estandarización en el procedimiento de toma de muestra y en los ensayos utilizados en la cuantificación de ácidos nucleicos. Se han sugerido niveles de al menos 3log10 para este tipo de pacientes. La especificidad aumenta con niveles más altos de carga viral y la ausencia de ADN viral en BAL tiene un alto valor predictivo negativo.
En pacientes con trasplante de órgano sólido, este síndrome es un evento más raro y no hay consenso respecto de la definición de un punto de corte para la carga viral en BAL. Sin embargo, se acordó que cargas virales altas junto con los síntomas señalan una neumonía probable.
- c)
Neumonía por CMV posible. Detección de altos niveles de carga viral en BAL junto con otro patógeno.
Se ha reconocido la existencia de infecciones asintomáticas por CMV en el tracto respiratorio inferior, ya sea mediante aislamiento o por detección molecular; la detección de bajas cargas virales se asocia a presencia asintomática: cuanto más alta es la carga viral, mayor es la asociación con neumonía. En relación con esto, un hecho controversial tanto en TCPH como en TOS es cuando se detectan otros patógenos junto con CMV. En esos casos, cuando la carga viral de CMV es baja, la probabilidad de que la neumonía se deba a CMV es baja. Por el contrario, cuando las cargas virales son altas, la probabilidad es mayor.
El gran desafío de utilizar la carga viral en BAL para predecir neumonía es definir qué valores se consideran «bajos» y «altos». Recientemente se realizó un estudio para determinar la utilidad de la PCR cuantitativa para el diagnóstico de neumonía por CMV y establecer un valor umbral para diferenciar la enfermedad de la presencia asintomática en BAL. Se determinaron las cargas virales en BAL de pacientes con TCPH y neumonía por CMV probada, usando como controles pacientes con neumonía de origen idiopático, pacientes asintomáticos y pacientes con neumonía por otras causas distintas del CMV. Se encontró para la neumonía por CMV una carga viral media de aproximadamente 4log10UI/ml (rango: 2,6-6log10UI/ml); en neumonía no por CMV y en la idiopática, este valor fue de 0log10UI/ml (rango: 0-1,6log10UI/ml) y en la asintomática fue de 1,63log10UI/ml (rango: 0-2,5log10UI/ml). Se determinó un valor de 500UI/ml en BAL para diagnóstico de neumonía. Estas cargas se ajustaron al número de células contenidas en el BAL mediante la detección del gen de la beta-globina8.
En otro estudio se compararon las cargas virales en plasma y en BAL de pacientes con TCPH y cuadro clínico de neumonía; se observó una amplia variabilidad en los valores de las cargas en BAL, y, comparadas con las cargas en plasma, estas últimas fueron siempre más bajas o negativas. En este caso no se determinó un valor umbral; al contrario, se asumió que cualquier valor de carga viral en BAL que fuera mayor que el del plasma sería sugestivo de neumonía por CMV42.
Estos estudios son el comienzo de la aplicación de PCR cuantitativa en muestras con células y van a requerir no solo armonizar la carga viral de CMV con el estándar internacional (detallado más adelante), sino también considerar la variabilidad de utilizar la PCR en muestras no homogéneas, como BAL o biopsias.
Otra enfermedad de órgano que se presenta con frecuencia en los pacientes trasplantados es la enfermedad gastrointestinal.
Enfermedad gastrointestinal por CMVSe distinguen también tres categorías:
- a)
Enfermedad gastrointestinal probada. Requiere la presencia de síntomas relacionados con el tracto gastrointestinal superior o inferior, más lesiones macroscópicas en la mucosa, más CMV documentado en tejido por histopatología, aislamiento viral, cultivo rápido, inmunohistoquímica o técnicas de hibridación de ADN. Además, es importante descartar la presencia de enfermedad injerto contra huésped como diagnóstico alternativo en receptores de TCPH.
- b)
Enfermedad gastrointestinal probable. Requiere la presencia de síntomas relacionados con el tracto gastrointestinal superior o inferior más CMV documentado en tejido, pero sin lesiones macroscópicas en mucosas. Además, es importante descartar la presencia de enfermedad injerto contra huésped como diagnóstico alternativo en receptores de TCPH.
- c)
Enfermedad gastrointestinal posible. En muchos centros, la práctica clínica habitual ha evolucionado hacia no realizar endoscopias y biopsias en pacientes con TOS que no sea de intestino delgado. En su lugar, se los trata como casos de enfermedad gastrointestinal por CMV, especialmente cuando presentan una carga viral de CMV en sangre elevada o en aumento, acompañada de diarrea clínicamente significativa u otros síntomas gastrointestinales, y en ausencia de otras causas probables. En estos casos, la ADNemia por CMV junto con la presencia de síntomas gastrointestinales con una calificación de intensidad de grado ≥2 según los criterios de terminología común para eventos adversos del Instituto Nacional del Cáncer (versión 4.0) se puede utilizar para establecer un posible diagnóstico de enfermedad gastrointestinal por CMV.
En TCPH, la detección de CMV en biopsias intestinales por PCR sin lesiones macroscópicas en mucosa puede usarse para definir enfermedad gastrointestinal posible.
El hallazgo de CMV en plasma mediante PCR no es suficiente para diagnosticar enfermedad gastrointestinal por CMV. Es posible que se desarrolle dicha enfermedad en el tracto gastrointestinal aun cuando la carga viral en plasma no sea detectable53. Se ha sugerido investigar la materia fecal como una muestra no invasiva para diagnosticar este cuadro. La presencia de CMV en heces se correlaciona con altas cargas virales en biopsias intestinales; su detección en heces puede tener una sensibilidad y especificidad del 67% y del 96%, respectivamente, para el diagnóstico de enfermedad intestinal22. Además, se ha intentado estandarizar la detección cuantitativa de CMV en biopsias gastrointestinales expresando los resultados en UI/μg de ADN o de órganos93. Se requieren más estudios para poder validar las cargas virales en biopsias de diversos orígenes y determinar valores umbrales que permitan reemplazar la histopatología.
Se han consensuado las definiciones de otras enfermedades menos frecuentes, como hepatitis, retinitis y encefalitis por CMV. A continuación se detallan sus definiciones.
Hepatitis por CMVSe considera que hay hepatitis por CMV probada frente a la presencia de pruebas hepáticas alteradas más CMV documentado en tejido hepático por histopatología, aislamiento viral, cultivo rápido, inmunohistoquímica o técnicas de hibridación de ADN, en ausencia de otra causa de hepatitis documentada. No se llegó a un consenso para la definición de hepatitis probable.
Retinitis por CMVSe considera que hay retinitis por CMV probada frente a la presencia de signos oftalmológicos típicos más la presencia de ADN en humor vítreo u otra parte del ojo. Cuando se cuenta solo con la presencia de signos oftalmológicos típicos, se debe considerar bajo la categoría de «probable».
Encefalitis por CMVSe distinguen dos categorías:
- a)
Encefalitis por CMV probada. Si hay presencia de síntomas en el sistema nervioso central (SNC) más CMV documentado en tejido del SNC por aislamiento viral, cultivo rápido, inmunohistoquímica o técnicas de hibridación in situ o PCR cuantitativa.
- b)
Encefalitis por CMV probable. Si hay presencia de síntomas en el SNC más detección de CMV en LCR, sin signos visibles de contaminación con sangre, más anormalidades en el estudio de imágenes.
El CMV también puede causar enfermedad en otros órganos, aunque con menor frecuencia. Para su interpretación se pueden utilizar las definiciones generales o referirse a las definiciones específicas de nefritis, cistitis, miocarditis y pancreatitis en el documento de consenso mencionado anteriormente53.
Enfermedad tardía por CMVSe denomina así a la enfermedad por CMV que aparece una vez que se discontinúa la profilaxis antiviral. Generalmente se presenta entre los 3 y 12meses luego de finalizada la profilaxis en los TOS y luego de los 100días postrasplante en los TCPH, en especial en donantes seropositivos. Sin embargo, también puede presentarse años después de realizado el trasplante, dependiendo de los factores de riesgo. Esta enfermedad puede considerarse en subgrupos de riesgo, dentro de los cuales es posible encontrar pacientes de alto riesgo. En ellos se recomienda utilizar profilaxis prolongada o estrategias híbridas (iniciar con profilaxis y continuar con monitoreo viral). El seguimiento de la infección tardía por CMV, la frecuencia de las pruebas de CMV y la duración del seguimiento difieren entre distintas publicaciones.
En la bibliografía se han definido los conceptos de infección refractaria y enfermedad refractaria81:
Infección refractaria por CMVCon la nueva actualización, las categorías de infección probada y probable se unieron en una sola definición, la de infección refractaria por CMV, a saber: aumento de ADNemia o antigenemia de CMV (>1log10 en el mismo compartimento sanguíneo respecto de la máxima carga viral medida en el mismo laboratorio y con el mismo ensayo comercial) o persistencia (aumento o descenso de ≤1log10) después de al menos 2semanas de tratamiento antiviral con la dosis apropiada43,56.
Enfermedad refractaria por CMVLo mismo ocurrió con la definición de enfermedad refractaria, dentro de la cual se fusionaron las dos categorías, probada y probable. El criterio para considerar enfermedad refractaria por CMV es el siguiente: empeoramiento de los signos y síntomas o progresión a enfermedad localizada en órgano (para pacientes no diagnosticados previamente con enfermedad de órgano), o falta de mejoría en los signos y síntomas luego de al menos 2semanas de tratamiento antiviral con la dosis apropiada.
Hay algunas enfermedades de órgano en las que no se realizan cargas virales en sangre, en cuyo caso es posible que no pueda recuperarse el virus para hacer estudios de resistencia.
Las posibles razones de refractariedad por CMV son las siguientes: a)estado de inmunosupresión excesiva, incluida la ausencia o deficiencia de la inmunidad de célulasT específicas de CMV: b)concentraciones subterapéuticas de fármacos antivirales, y c)resistencia al ganciclovir u otros fármacos antivirales.
Resistencia antiviral del CMVOtro concepto importante para definir es la resistencia a los antivirales del CMV. Esta se define como la infección refractaria por CMV (antes definida) sumada a la presencia de alteración genética viral que confiere una reducida sensibilidad frente a una o más drogas antivirales.
Las principales mutaciones que confieren resistencia son las que se encuentran en los genes UL97 y UL54. El gen UL97 codifica una quinasa viral que cataliza la fosforilación inicial y la activación del ganciclovir. El gen UL54 codifica la ADN polimerasa del CMV responsable de la elongación de la cadena del ADN viral. El grado de resistencia asociado a las mutaciones en cada gen depende del sitio en el que se encuentra la mutación, y estas pueden conferir bajo o alto nivel de resistencia. Las mutaciones más comunes son las del gen UL97, que confieren resistencia a ganciclovir. Las mutaciones en UL54 son menos frecuentes y pueden conferir resistencia cruzada a ganciclovir, foscarnet y cidofovir.
Se han descrito mutantes resistentes a drogas antivirales que se están utilizando más recientemente, como el maribavir y el letermovir. El maribavir actúa inhibiendo la quinasa viral que fosforila el ganciclovir; el letermovir interfiere en la replicación del ADN viral y la formación de los nuevos viriones.
Las mutaciones más conocidas en el gen UL97 son: M460V/I, H520Q, C592G, A594V, L595S y C603W14,46. También se han descrito otras mutaciones menos frecuentes, concentradas entre los codones 590 y 607. Se ha observado que mutaciones en el gen UL97 pueden producir resistencia cruzada al ganciclovir y maribavir, ya que los dos antivirales actúan sobre el mismo blanco. En el caso particular del maribavir, las mutaciones de resistencia descritas en UL97 son las sustituciones T409M, H411Y y C480F14. En el gen UL54, que codifica la polimerasa, las mutaciones ocurren en múltiples sitios, la mayoría concentradas en las regiones 395-545 y 809-987. Así también, se han descrito mutaciones en el gen UL56, que codifica el complejo de la terminasa viral, blanco del letermovir.
Epidemiología e impacto clínicoSin una estrategia de prevención, la infección o la enfermedad por CMV se produce durante los primeros 3meses luego de un TOS. A pesar de que actualmente se utilizan estrategias de prevención después del trasplante que disminuyen el riesgo de enfermedad por CMV, esta afección puede ocurrir en hasta el 50% de los pacientes con TOS de alto riesgo, receptor seronegativo y donante seropositivo (R−/D+), y en hasta el 17% de los receptores seropositivos (R+)52,73. Generalmente la infección por CMV es asintomática cuando se diagnostica en el contexto del monitoreo viral postrasplante.
Con respecto a los receptores de TCPH, el CMV produce enfermedad en el 10% al 40% de estos pacientes, manifestándose principalmente como neumonitis, en la mayoría de los casos, y con una tasa de mortalidad elevada, de alrededor del 70%. En la actualidad, con la implementación de estrategias de prevención, la incidencia de la enfermedad por CMV es del 5% al 10%27,29. A pesar de ello, la infección por CMV se asocia con mayor mortalidad no relacionada con recaída luego del trasplante, probablemente debido a los efectos indirectos de la infección o de su tratamiento29,97.
Estrategias de prevenciónDebido a la elevada morbimortalidad asociada, a lo largo de los años se implementaron diversas estrategias de prevención con el objetivo de evitar la infección o la reactivación del CMV previa al desarrollo de la enfermedad. Entre estas estrategias se destacan la profilaxis y la terapia preventiva32.
La profilaxis previene la infección primaria o la reactivación viral utilizando un antiviral, como el ganciclovir, por un plazo de 3 a 12meses según el tipo de trasplante y los factores de riesgo asociados. En el caso de la terapia preventiva, el uso del antiviral está guiado por el monitoreo de la carga viral, ya que una vez detectada la replicación, se trata de prevenir la enfermedad. En este caso, el antiviral se incorpora cuando mediante el monitoreo se detectan niveles que superan ciertos puntos de corte preestablecidos17,32.
Tanto la profilaxis como la terapia preventiva tienen buena eficacia para prevenir la enfermedad por CMV. La selección entre una u otra estrategia depende del tipo de trasplante y de los factores de riesgo asociados en cada situación. Algunos centros optan por una estrategia híbrida para pacientes de riesgo alto, la cual implica iniciar con profilaxis y luego continuar con terapia preventiva10,17,27,29,32,49,52,56,73,81,97.
La profilaxis evita la infección o reactivación viral temprana y es más común la enfermedad por CMV tardía. El desarrollo de cepas resistentes es poco frecuente en ambos casos. En cuanto a la implementación, la profilaxis es más sencilla de llevar a cabo. La terapia preventiva requiere de cierta infraestructura del centro y coordinación para incorporar el monitoreo semanal de los pacientes, estar pendientes de los resultados y generar sistemas de comunicación de alertas, lo que demanda un trabajo en conjunto del equipo médico y del laboratorio. Además, es muy importante brindar una respuesta rápida (dentro de las 24-48h) que permita la implementación oportuna del tratamiento, impactando positivamente en la evolución del paciente.
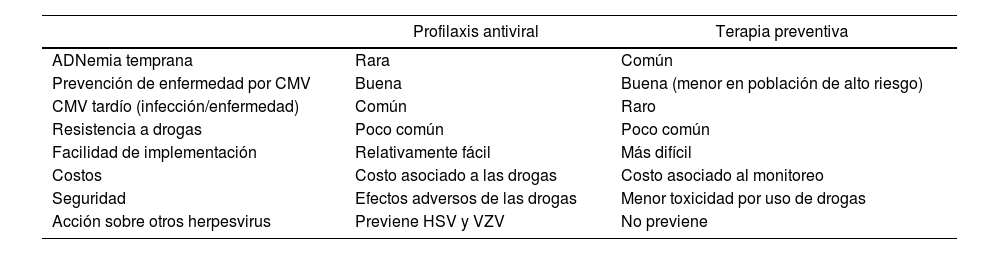
Los pacientes que se manejan con terapia preventiva requieren, además, considerar la prevención de otros herpesvirus, como varicela zóster (VZV) y herpes simplex (HSV), que sí estarían cubiertos con el uso de profilaxis. Por otra parte, en la terapia preventiva, se hace un uso selectivo de las drogas antivirales, con lo cual se reducen tanto los costos asociados como sus efectos adversos. Sin embargo, esta estrategia requiere considerar los costos adicionales derivados del monitoreo de las cargas virales. Con ambas estrategias se mejora la sobrevida del injerto. En la tabla 1 se presenta un resumen de las principales ventajas y desventajas de cada estrategia. En la mayoría de los consensos internacionales se recomienda el uso de profilaxis en pacientes de riesgo muy alto. También es importante considerar que el uso de terapia preventiva no ha sido suficientemente estudiado en el caso de trasplantes de pulmón e intestino. A continuación se ejemplifican diferentes estrategias documentadas en la bibliografía.
Comparación de las ventajas y desventajas del uso de profilaxis y de terapia preventiva
| Profilaxis antiviral | Terapia preventiva | |
|---|---|---|
| ADNemia temprana | Rara | Común |
| Prevención de enfermedad por CMV | Buena | Buena (menor en población de alto riesgo) |
| CMV tardío (infección/enfermedad) | Común | Raro |
| Resistencia a drogas | Poco común | Poco común |
| Facilidad de implementación | Relativamente fácil | Más difícil |
| Costos | Costo asociado a las drogas | Costo asociado al monitoreo |
| Seguridad | Efectos adversos de las drogas | Menor toxicidad por uso de drogas |
| Acción sobre otros herpesvirus | Previene HSV y VZV | No previene |
HSV: virus herpes simplex virus; VZV: virus varicela zóster.
En pacientes con TCPH, inicialmente se comenzó a utilizar profilaxis con ganciclovir hasta los 100días postrasplante, con buenos resultados, pero debido a los efectos adversos, en especial la mielosupresión y el consecuente aumento de las infecciones por CMV tardías, se evaluó la terapia preventiva con ganciclovir al principio y luego con valganciclovir, dirigido solo a receptores seropositivos para CMV que presenten infección. Este esquema demostró la misma eficacia para la prevención de la enfermedad que la profilaxis con ganciclovir, pero con menos efectos adversos y menores costos31. Es por esto que se ha recomendado seguir con esta última estrategia de prevención en TCPH32.
En este sentido, en 2017 se realizó un estudio aleatorizado de profilaxis usando otro antiviral contra CMV, el letermovir, en pacientes con TCPH seropositivos para CMV durante los primeros 100días luego del trasplante. Este régimen demostró una alta eficacia y un muy buen perfil de seguridad, sin mielotoxicidad, lo que motivó su aprobación como profilaxis primaria, inicialmente en Estados Unidos y luego en Europa63. Este antiviral se encuentra disponible en la Argentina desde fines de 2019; los estudios realizados señalan su efectividad en la prevención de la enfermedad por CMV y la hospitalización de adultos con TCPH37,38.
Actualmente, dada la mayor eficacia y el bajo riesgo de efectos secundarios graves del letermovir en comparación con otras opciones de profilaxis antiviral en adultos, no se recomienda el uso de otro fármaco, excepto que no sea posible usar letermovir. Se recomienda la profilaxis con letermovir en receptores de TCPH alogénico seropositivos para CMV. Se debe comenzar con este régimen dentro de los 28días posteriores al trasplante y continuarlo durante los primeros 100días, iniciándolo lo antes posible54.
La profilaxis secundaria con letermovir luego de una reactivación del CMV tratada no ha sido estudiada. La resistencia al letermovir es poco común durante la profilaxis primaria en receptores de TCPH, con una incidencia por debajo del 2% según ensayos de fase315.
La interrupción temporal del tratamiento o cualquier situación que provoque bajas concentraciones del fármaco constituyen un factor de riesgo para la rápida aparición de resistencia al letermovir durante la profilaxis.
En pediatría, su uso como profilaxis primaria y secundaria es seguro y eficaz en la prevención de la infección por CMV luego de un TCPH de alto riesgo. La incidencia de infección por CMV en pacientes seropositivos que reciben profilaxis con letermovir no supera el 9% en los 6meses posteriores al TCPH. Aún no ha sido claramente establecido el impacto del letermovir sobre la sobrevida global en pacientes considerados de riesgo estándar, es decir, aquellos sin factores de riesgo elevado para reactivación o con enfermedad por CMV tras un TCPH105.
Aunque no hay estudios aleatorizados, un estudio en fase2b sobre profilaxis con letermovir en niños informó una incidencia de infección (24%) hasta la semana 24 después del TCPH en adolescentes (12 a 18años) similar a la del estudio de fase3 en adultos (37,5%)30,101.
Hay pocos estudios clínicos que comparen ambas estrategias de prevención en pacientes con TOS. Algunos de estos estudios, realizados a baja escala, demostraron que ambas estrategias poseen similar efectividad en la prevención de la enfermedad por CMV, incluso en los pacientes R−/D+44,47,85,103. Los antivirales de elección para la profilaxis de CMV son el valganciclovir y ganciclovir intravenoso. El letermovir fue aprobado recientemente en trasplantes de riñón de pacientes de riesgo alto, reduciendo la toxicidad mielosupresora.
En un ensayo clínico aleatorizado donde se evaluó la eficacia del uso de profilaxis prolongada en pacientes trasplantados de riñón R−/D+ se demostró una reducción de la incidencia de enfermedad por CMV del 16,1% con 200días de profilaxis respecto al 36,8% con 100días de valganciclovir41. No existen ensayos clínicos aleatorizados que evalúen la duración óptima de la profilaxis antiviral en pacientes receptores de trasplante de intestino y pulmón. Estos trasplantes son de muy alto riesgo y se utilizan profilaxis prolongadas que han demostrado una reducción en las tasas de infección y de enfermedad asociada40,106.
Otra opción de antiviral de primera línea para utilizar en algunos pacientes es el maribavir. Este fue comparado con valganciclovir en un ensayo aleatorizado y controlado; se observaron resultados similares de disminución de la carga viral en sangre (valganciclovir 77,4% vs. maribavir 69,3%), con una toxicidad medular inferior con el maribavir. Por ello, se recomienda considerar el uso de maribavir en pacientes con neutropenia que no pueden ser tratados con valganciclovir o en pacientes con deterioro de la función renal, para quienes el uso de foscarnet no es apropiado54.
En conclusión y de acuerdo con la evidencia documentada en la bibliografía, expertos en el tema recomiendan que cada centro defina las estrategias a utilizar en los diferentes tipos de trasplante y de acuerdo con los factores de riesgo asociados al paciente.
Factores de riesgo para la infección por CMVLos factores de riesgo de infección o reactivación de CMV son el estado serológico del donante y el receptor, el tipo de trasplante de órgano sólido o de células progenitoras hematopoyéticas y el tratamiento inmunosupresor.
El principal factor de riesgo que predispone al desarrollo de la enfermedad por CMV después del TOS es una deficiencia cualitativa (funcional) o cuantitativa en la inmunidad global (inespecífica) o específica frente al CMV61,67.
En la práctica clínica, la serología para CMV (anticuerpos IgG) previa al trasplante permite determinar la categoría de riesgo. Los pacientes con mayor riesgo son los R–/D+16,61,62,67. Por otro lado, los R+ tienen un riesgo moderado de infección y enfermedad por CMV20. En este grupo, el riesgo de infección por CMV es mayor cuando el donante también es seropositivo (D+) en comparación con el donante seronegativo (D–), probablemente debido a una sobreinfección con CMV transmitida por el donante. Un receptor seronegativo que recibe un órgano de un donante seronegativo (R–/D–) tiene el riesgo más bajo de enfermedad por CMV, siempre y cuando reciba hemoderivados filtrados.
La inmunosupresión inducida por fármacos, que reduce la cantidad (es decir, linfopenia grave) y paraliza la función de las célulasT (es decir, anergia de los linfocitos), aumenta el riesgo de CMV después del TOS23,65. En particular, el uso de agentes que agotan los linfocitos (globulinas antitimocito y alemtuzumab)21,79, o dosis altas de fármacos inmunosupresores de mantenimiento, incrementan el riesgo de CMV20,59. El uso de inhibidores de mTOR (como sirolimus y everolimus), por el contrario, se ha asociado con un menor riesgo de CMV9,60,76. El rechazo del aloinjerto es un factor de riesgo importante para el CMV, especialmente cuando se trata con anticuerpos antilinfocitos.
El riesgo de enfermedad por CMV también varía según el tipo de órgano trasplantado, en orden decreciente: pulmón, intestino delgado, hígado, corazón y riñón.
En el caso del TCPH, el estado serológico del donante y el receptor es también el primer factor de riesgo a considerar. Otros factores por considerar son la fuente del trasplante, el tratamiento previo y el tratamiento inmunosupresor de mantenimiento25. Los receptores seropositivos que reciben células de un donante seronegativo constituyen el principal factor de riesgo.
La interpretación de los resultados de la serología en pacientes menores de 12meses puede resultar dificultosa por la posibilidad de que se detecten anticuerpos de origen materno. La PCR de CMV en orina o saliva puede ser de gran utilidad para definir el estado serológico del paciente, ya que la detección del virus en estos compartimentos confirma la infección74.
Otros factores de riesgo son los siguientes: enfermedad injerto versus huésped, el uso de altas dosis de corticosteroides (≥1mg/kg/día), depleción de célulasT, donante haploidéntico, sangre de cordón, trasplante no relacionado o HLA no idéntico, linfopenia, uso de ciclofosfamida, entre otros28.
Las nuevas modalidades de trasplante inciden en el riesgo de infección y enfermedad por CMV. Los trasplantes de tipo haploidéntico y aquellos que se realizan a través de sangre de cordón umbilical tienen frecuencias similares de reactivación del CMV80. Los receptores de TCPH de tipo haploidéntico, con manipulación del injerto ex vivo, son frecuentes en pediatría y representan un grupo de riesgo elevado, con una mortalidad asociada del 50%4.
La infección por CMV es frecuente después de un TCPH de sangre del cordón umbilical, probablemente debido a un retraso en la reconstitución inmune11,87. Se ha documentado una mayor mortalidad, no relacionada con recaída de su enfermedad de base, en los receptores de TCPH a partir de sangre de cordón con serología pretrasplante positiva que reactivan CMV en comparación con otras fuentes celulares69.
La incidencia de enfermedad luego de un TCPH dentro de los primeros 100días postrasplante ha disminuido en las últimas décadas7,27. La enfermedad por CMV pre-engraftment, aunque es rara, se asocia con una elevada mortalidad. La enfermedad gastrointestinal por CMV es el cuadro diagnosticado con mayor frecuencia (70-80% de los casos), aunque las pruebas de PCR generalmente son negativas al momento del diagnóstico. Esto probablemente se deba a que la enfermedad gastrointestinal, al menos en sus etapas iniciales, es un fenómeno local fuertemente asociado a la enfermedad injerto versus huésped28,64. El uso de las estrategias de prevención, profilaxis o terapia preventiva ha incrementado el riesgo de desarrollo de la llamada enfermedad por CMV tardía (>100días post-TCPH)7. La enfermedad más frecuentemente asociada, en este caso, es la neumonía18.
Métodos de diagnóstico y monitoreo viralLos métodos de diagnóstico de CMV han evolucionado a lo largo de los años. Inicialmente se comenzó con la serología, que en la actualidad se utiliza para determinar el estado inmune pretrasplante. Posteriormente se implementó el cultivo tradicional del virus, el cual fue reemplazado por el cultivo rápido (shell vial). Como primera técnica de monitoreo en pacientes trasplantados, se utilizó la detección del antígeno pp65 por inmunofluorescencia en polimorfonucleares de sangre periférica. Esta metodología requiere el procesamiento de la muestra en el día y es menos sensible que los métodos moleculares. Además, en pacientes neutropénicos la sensibilidad es aún menor debido a la disminución de leucocitos circulantes. En la actualidad se utilizan técnicas altamente sensibles, como la amplificación de ácidos nucleicos por PCR y, de forma aún más avanzada, la cuantificación de ácidos nucleicos mediante PCR en tiempo real, que es el método de elección para realizar el monitoreo54.
El fundamento que respalda el uso de la terapia preventiva guiada por el monitoreo viral es que la enfermedad, luego de una infección o reactivación viral, es precedida por una etapa de replicación viral clínicamente silenciosa. Detectar esta replicación de manera oportuna es crucial para iniciar la terapia preventiva y así prevenir el desarrollo de la enfermedad y sus graves consecuencias. Las técnicas moleculares cuantitativas han demostrado una correlación directa entre los valores hallados y el riesgo de desarrollar enfermedad; es por ello que la terapia preventiva se inicia al superar un determinado punto de corte.
Asimismo, el monitoreo postratamiento es la mejor herramienta para medir la respuesta a la terapia antiviral y permite identificar pacientes con riesgo de una recaída de la enfermedad y aquellos con riesgo de resistencia a antivirales.
La detección de CMV se puede realizar en diferentes tipos de muestras, pero su sola presencia no siempre es predictiva de enfermedad. Sin embargo, no ocurre lo mismo con la detección de ciertos niveles de ADNemia en sangre entera o plasma, que tiene un alto valor predictivo de enfermedad; por esta razón, es la sangre (o el plasma) la muestra de elección para el estudio cuantitativo de CMV.
Los laboratorios suelen enfrentarse a desafíos prácticos relacionados con el tipo de muestra a utilizar, sus condiciones de transporte y almacenamiento, los métodos adecuados de extracción de ácidos nucleicos, su cuantificación, la frecuencia de monitoreo y los puntos de corte a utilizar para garantizar precisión y reproducibilidad de los resultados de las pruebas de carga viral del CMV. El propósito del apartado siguiente es brindar recomendaciones acerca de estos aspectos sobre la base de la evidencia científica disponible y la expertise del grupo de trabajo.
Lineamientos para la evaluación de la carga viral de CMV en pacientes trasplantadosTipos de muestra y condiciones de transporte y conservaciónEn el monitoreo viral se puede utilizar tanto sangre entera como plasma. No obstante, es de suma importancia el uso de un solo tipo de muestra en la vigilancia seriada para el correcto manejo clínico de los pacientes a fin de garantizar la comparabilidad de los resultados, ya que, si bien hay correlación entre ambos compartimentos, pueden encontrarse diferencias de hasta 2 o 3log1050,51,54,78,86.
La recolección de las muestras (sangre entera o plasma) debe realizarse en tubos que contengan EDTA como anticoagulante. Las muestras recolectadas en tubos heparinizados son inadecuadas para el análisis por amplificación de ácidos nucleicos, dado que la heparina puede inhibir dicha reacción99.
Para asegurar una proporción óptima de sangre/anticoagulante, es esencial utilizar el volumen de muestra adecuado, siguiendo las recomendaciones y especificaciones del fabricante de los tubos. El volumen mínimo requerido para la detección de CMV varía según el método de extracción de ácidos nucleicos seleccionado, por lo que se recomienda consultar con el laboratorio donde se procesarán las muestras cuando estas son derivadas. También es importante verificar la calidad de las muestras de sangre destinadas a obtener plasma, incluyendo la presencia de hemólisis, lipidemia, ictericia, entre otros. En el caso de detectar alguna de estas alteraciones, la muestra debe ser rechazada y se debe solicitar una nueva.
Se ha observado que las cargas virales son más altas en sangre entera que en plasma. Esto podría estar relacionado con la detección del virus latente presente en los monocitos, lo cual hace que la sangre sea una muestra más sensible pero menos específica. La detección de CMV en la fracción plasmática refleja replicación viral activa con liberación de partículas virales hacia el plasma desde diversos compartimentos, siendo una muestra de mayor utilidad para predecir enfermedad, mientras que la cuantificación en sangre entera no permite distinguir la infección latente de la infección activa por CMV24,86.
Las muestras deben enviarse al laboratorio de forma inmediata, idealmente dentro de la hora de su recolección. En muestras de sangre entera se recomienda realizar la extracción del ADN viral lo más pronto posible, preferentemente dentro de las 4horas posteriores a su recolección. En caso de ser necesario, podrá conservarse como máximo 24horas refrigerada (2 a 8°C) hasta el momento de su procesamiento, evitando la congelación75,88,94. Del mismo modo, las muestras de plasma, si no pueden procesarse inmediatamente, es importante almacenarlas refrigeradas (2 a 8°C) como máximo hasta 48horas.
Para obtener el plasma es necesario centrifugar la muestra de sangre lo más pronto posible (idealmente de inmediato o dentro de las 4horas de extraída la muestra) a 2.500rpm durante 10minutos2,74,88,104.
En los centros o laboratorios que realizan derivaciones de muestras es esencial tener en cuenta las condiciones para su transporte. Las muestras deben transportarse en recipientes que cumplan con los estándares de bioseguridad de acuerdo con las instrucciones locales y nacionales para el transporte de material patogénico. Las muestras de sangre entera deben enviarse refrigeradas (2 a 8°C) dentro de las 24horas de ser recogidas; si se trabajara con muestras de plasma, se recomienda su separación inmediata y posterior envío refrigeradas (2 a 8°C) dentro de las 48horas.
Si la muestra no cumple con los requisitos de aceptación, será necesario comunicarse con el servicio de salud de donde proviene para pedir el envío de una nueva muestra junto con una nueva solicitud diagnóstica99. Debido a la variabilidad en el tiempo máximo de conservación de las muestras de sangre entera y plasma reportada en la literatura, las condiciones de conservación indicadas son las ideales. Sin embargo, si no es posible cumplir con dichos requisitos debido a dificultades en el envío, a la situación crítica del paciente o a otros motivos y se procesa la muestra de todos modos, es importante tener en cuenta y registrar esta circunstancia, ya que el valor obtenido podría no reflejar el valor real.
Extracción y conservación de ácidos nucleicosExiste una gran variedad de métodos de extracción de ácidos nucleicos disponibles en el mercado; nos enfocaremos en aquellos que ofrecen resultados sensibles, cuantificables, rápidos y reproducibles, con rendimientos similares70,100. Estos métodos incluyen aquellos basados en el uso de partículas magnéticas y columnas de sílica tanto en versiones manuales como automatizadas. En este contexto, se detallarán las características más importantes que se deben tener en cuenta en cada método.
- •
Métodos de extracción mediante columnas de sílica. El principio de extracción en este tipo de método se basa en la capacidad de adsorción de los ácidos nucleicos en una columna de sílice en presencia de altas concentraciones de sales caotrópicas. Los contaminantes presentes en la muestra se eliminan mediante lavados de la columna y, finalmente, el ADN se eluye utilizando agua o un tampón de resuspensión con baja fuerza iónica y pH neutro o ligeramente alcalino. Dado que los diversos ensayos disponibles no funcionan de la misma manera, se aconseja seguir las instrucciones específicas de cada uno según el tipo de muestra a procesar.
El rendimiento y la pureza de las columnas de extracción de ADN dependen de varios factores, como el tipo de muestra y su calidad, así como del protocolo de extracción utilizado. En general, con las columnas de sílice es posible obtener entre 1 y 100ng de ADN cada 100μl de muestra, con una pureza del ADN extraído generalmente adecuada, indicada por una relación de valores de absorbancia A260/A280 de entre 1,8 y 2,0. La pureza del ADN extraído se puede evaluar mediante espectrofotometría UV98.
Si se va a utilizar un control interno (CI) como control del proceso de extracción del ADN e inhibición de la PCR, aquel se debe añadir al comienzo del procedimiento de extracción. Este paso no es requerido cuando se emplea un control interno endógeno para evaluar el proceso, debido a que ya está presente en la muestra.
- •
Métodos de extracción basados en el uso de partículas magnéticas. Los sistemas basados en partículas magnéticas emplean esferas magnéticas recubiertas con polímeros que presentan una alta afinidad por los ácidos nucleicos. Estas esferas se agregan al lisado de la muestra, lo que permite que se unan a las moléculas de ADN. Al colocar un imán en la pared del tubo, se agrupan las esferas con el ADN unido, mientras que los contaminantes de la muestra en solución se eliminan por pipeteo o decantación. Después de varios ciclos de resuspensión y lavado, en los que las esferas quedan retenidas por el imán, el ADN se eluye en un tampón adecuado84.
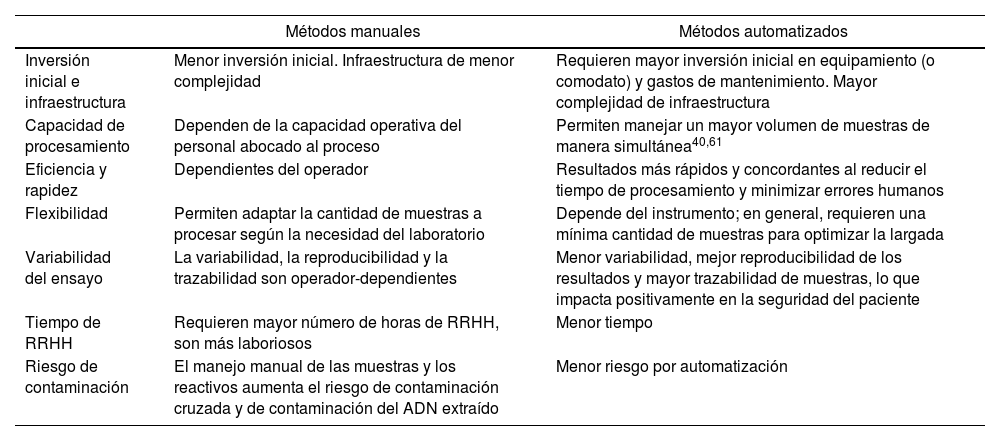
Los métodos de extracción de ácidos nucleicos basados en columnas de sílice o partículas magnéticas están disponibles en el mercado en formatos tanto manuales como automatizados. Existe una gran variedad de plataformas o robots que automatizan todo o gran parte del proceso de extracción de ácidos nucleicos. Los métodos manuales suelen ser más económicos y accesibles, pero pueden ser laboriosos y dar mayor lugar a errores humanos. Requieren la capacitación y el entrenamiento adecuado del personal para evitar contaminaciones, degradación del ADN o inhibiciones, que determinan variabilidad de los resultados. Los métodos automatizados ofrecen resultados más rápidos, precisos y reproducibles y tienen un menor riesgo de contaminación, aunque suelen ser más costosos en términos de equipamiento y reactivos. Adicionalmente, estos sistemas aportan trazabilidad y mayor calidad de resultados. Son menos laboriosos que los métodos manuales, cuyos resultados dependen muchas veces de la experiencia del personal y de factores extrínsecos difíciles de controlar19,68,96. Esto contribuye a una mayor seguridad en el proceso de atención del paciente, ya que con los métodos automatizados se reducen los errores producidos por el operador. El rendimiento y la pureza de estos métodos son comparables con los de la extracción manual y dependen de la marca comercial que se utilice. La cantidad de muestras a procesar, la frecuencia de uso y los recursos disponibles en el laboratorio son los factores que suelen definir la elección entre un método u otro45,89. En la tabla 2 se muestran las principales características generales de los métodos de extracción manuales y automatizados.
Características generales de los métodos manuales y automatizados
| Métodos manuales | Métodos automatizados | |
|---|---|---|
| Inversión inicial e infraestructura | Menor inversión inicial. Infraestructura de menor complejidad | Requieren mayor inversión inicial en equipamiento (o comodato) y gastos de mantenimiento. Mayor complejidad de infraestructura |
| Capacidad de procesamiento | Dependen de la capacidad operativa del personal abocado al proceso | Permiten manejar un mayor volumen de muestras de manera simultánea40,61 |
| Eficiencia y rapidez | Dependientes del operador | Resultados más rápidos y concordantes al reducir el tiempo de procesamiento y minimizar errores humanos |
| Flexibilidad | Permiten adaptar la cantidad de muestras a procesar según la necesidad del laboratorio | Depende del instrumento; en general, requieren una mínima cantidad de muestras para optimizar la largada |
| Variabilidad del ensayo | La variabilidad, la reproducibilidad y la trazabilidad son operador-dependientes | Menor variabilidad, mejor reproducibilidad de los resultados y mayor trazabilidad de muestras, lo que impacta positivamente en la seguridad del paciente |
| Tiempo de RRHH | Requieren mayor número de horas de RRHH, son más laboriosos | Menor tiempo |
| Riesgo de contaminación | El manejo manual de las muestras y los reactivos aumenta el riesgo de contaminación cruzada y de contaminación del ADN extraído | Menor riesgo por automatización |
Independientemente de que se utilicen metodologías manuales o automatizadas, es fundamental seguir las buenas prácticas establecidas por el sistema de gestión de calidad implementado en el laboratorio. En este sentido, los mantenimientos preventivos y correctivos del equipamiento, así como la calibración de micropipetas, resultan esenciales para garantizar la reproducibilidad de las técnicas moleculares. En el caso de los equipos automatizados también se recomienda realizar respaldos periódicos de los datos generados. Para ambas metodologías es importante mantener un volumen de elución constante, ya que esta variable puede influir en la adecuada monitorización del paciente y es necesaria para calcular el factor de conversión. Además, se sugiere realizar una inspección visual de los eluatos para verificar tanto su volumen como su color.
Es esencial utilizar marcas de ensayos de extracción que estén aprobadas por la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT) para su uso en diagnóstico in vitro (IVD), asegurando así la calidad y la fiabilidad de los resultados.
Conservación del ADN extraídoUna vez extraído el ADN, es importante la adecuada conservación de los eluatos para garantizar su estabilidad e integridad. Pautas generales:
- -
Para conservación a corto plazo (hasta 5días), se recomienda almacenar el ADN refrigerado a una temperatura de entre 2°C y 8°C77.
- -
Para períodos más prolongados se aconseja almacenar a −20°C72.
- -
Es importante evitar ciclos repetidos de congelación y descongelación, ya que estos pueden afectar la calidad del ADN.
- -
Para conservación a un plazo largo se recomienda almacenar a –20°C o –70°C en condiciones ligeramente básicas (p.ej., Tris·HCl, pH8,0, o tampón TE) porque las condiciones ácidas pueden provocar la hidrólisis de ADN.
La medición de la carga viral (CV) mediante PCR en tiempo real es el método de elección para el monitoreo viral en el paciente trasplantado. Esta técnica utiliza una curva estándar para calcular la concentración de ADN del CMV en la muestra.
En el mercado hay disponible una gran variedad de ensayos. El rendimiento, la sensibilidad y el rango lineal de los ensayos varían debido a los diferentes métodos de extracción de ácidos nucleicos, secuencias de amplificación blanco, cebadores, sondas de detección (región y tipo de sondas), condiciones de ciclado, métodos de detección y estándares de cuantificación (tabla 3). Como resultado, es posible que no haya una estrecha coincidencia en los valores de carga viral entre los diferentes laboratorios.
Factores que influyen en la variabilidad de la carga viral
| Fuente de variabilidad | Descripción |
|---|---|
| Tipo de muestra | Sangre entera o plasma |
| Cinética viral | Varía según tipo de muestra, tipo de trasplante y tratamiento inmunosupresor |
| Método de extracción | • Fundamento del ensayo: columnas de sílica o perlas magnéticas• Manual o automatizado• Eficiencia de la extracción según tamaño del ADN |
| Blancos de reacción | Gen simple, múltiples genes, polimorfismo |
| Tamaño del amplicón | Mayores CV en ensayos con pequeños amplicones (<100pb) vs. grandes amplicones (>250pb) |
| Sondas de detección | • Secuencia elegida• Tipo de sonda: hidrólisis, hibridación, etc. |
En el año 2010, para estandarizar y eliminar la variabilidad entre los laboratorios, el Comité de Expertos de la Organización Mundial de la Salud (OMS) desarrolló el primer estándar internacional de CMV (EI), que consiste en un lote de virus cepa Merlín (genotipo1) preparado en células MRC5 y con un valor consensuado en 5×106UI/ml. Este estándar se utilizó como referencia primaria para calibrar estándares secundarios en ensayos comerciales, lo que ha demostrado reducir la variabilidad entre laboratorios en comparación con métodos no calibrados. Se esperaba que esto facilitara la correlación entre los niveles de carga viral y el desarrollo de enfermedad en estudios clínicos. Sin embargo, aunque el uso del EI ha disminuido la variabilidad en los resultados de muestras individuales, se han observado diferencias clínicamente relevantes, de entre 1,5log10 y 2,82log1054.
Para estos materiales, el concepto de conmutabilidad hace referencia a una característica clave que ha ayudado a describir y explicar las diferencias en el rendimiento del ensayo y las disparidades en los resultados. La conmutabilidad describe el grado en el que el material de referencia se comporta de manera similar a las muestras de los pacientes. Esto es de vital importancia, porque si no existe conmutabilidad, entonces los materiales de referencia con la misma concentración objetivo pueden producir diferentes medidas finales de concentración de ADN cuando se usan para calibrar los resultados de las muestras de pacientes. Es importante resaltar que la conmutabilidad del ensayo debe ser asegurada no solo con la utilización del EI sino en todas las fases del proceso de cuantificación34,35. La conmutabilidad mejora con amplicones pequeños82.
Los blancos de amplificación utilizados en los ensayos de cuantificación pueden ser varios: la polimerasa viral, la glicoproteínaB, los genes inmediatamente tempranos y UL83, entre otros, pero en la gran mayoría de los casos estos no son informados por los fabricantes36.
Se recomienda verificar o validar cada ensayo específico antes de su uso, según corresponda, con preferencia por los ensayos comerciales IVD o las plataformas automatizadas integradas sobre los métodos in house. Esto se debe a la menor variabilidad intra e interensayo, así como también a que son ensayos cuyos estándares están calibrados en UI/ml, y esto ayuda a reducir la variabilidad entre ensayos en el laboratorio. Además, es importante que los ensayos cuenten con un control interno de amplificación o de extracción (o ambos) que permita controlar todo el proceso.
Las plataformas automatizadas ofrecen ventajas significativas en términos de trazabilidad y son especialmente útiles en centros con un elevado volumen de muestras.
Los valores de concentración de ADN se calculan considerando el volumen de muestra utilizada, el volumen de eluato de la extracción, el volumen utilizado para la PCR en tiempo real y siguiendo las instrucciones del fabricante. Una fórmula general para el cálculo de la concentración de ADN de CMV en una muestra en UI/ml, utilizando el EI para la curva de calibración, es:
Es importante destacar que la expresión de los valores específicos de carga viral (CV) y unidades puede variar según el ensayo y el equipo utilizado, por lo que es esencial seguir las instrucciones proporcionadas por el fabricante para realizar el cálculo de manera precisa y adecuada. Asimismo, cabe señalar que la variabilidad intra e interlaboratorio en la cuantificación del genoma del CMV tiene un impacto significativo en la calidad del cuidado del paciente trasplantado, sobre todo cuando se utilizan estrategias de terapia preventiva para la prevención de la enfermedad. Por ello, es importante que el laboratorio siga protocolos estandarizados para la cuantificación del genoma del CMV, donde se mantienen absolutamente todas las condiciones definidas en el ensayo1.
Expresión de resultadosLos resultados de CV de CMV se informan de forma cuantitativa en UI/ml, preferentemente, o en copias/ml y también en log10 para facilitar su interpretación clínica. La escala logarítmica permite determinar rápidamente si los cambios en la carga viral son significativos o no.
Frecuencia de monitoreoLa frecuencia con la que se realiza el monitoreo es usualmente cada 5 a 7días, pero en algunos casos de pacientes con factores de riesgo se puede requerir aumentar la frecuencia. Esto está relacionado con el grado de inmunosupresión del paciente, que regula la cinética viral —representada por el tiempo de duplicación del CMV (doubling time)— y que, en promedio, es de 1 a 2días, y con el tiempo de vida media del virus, que es de 3 a 8días en plasma. Cuanto mayor es la inmunosupresión, más corto es el doubling time y más rápidos son los incrementos de la carga viral en el tiempo.
En pacientes de riesgo alto que reciben profilaxis antiviral de inicio se utiliza el monitoreo mediante cargas virales una vez finalizada la profilaxis con el objetivo de evitar el desarrollo de la enfermedad por CMV tardía. En TOS, dependiendo del riesgo, el monitoreo luego de la profilaxis puede realizarse una vez al mes durante un año93. En TCPH, luego del día100 desde el trasplante (fin de la profilaxis), el monitoreo se continúa, inicialmente, una vez por semana hasta 1año postrasplante en pacientes con riesgo elevado.
En el caso particular del seguimiento de pacientes en tratamiento es importante considerar que puede haber aumentos de la carga viral los días posteriores al inicio de aquel. Se recomienda enviar una nueva muestra antes de comenzar el tratamiento antiviral, de manera de contar con un valor de partida con el cual comparar los siguientes resultados y evitar así interpretaciones erróneas. La primera muestra de seguimiento se tomará a los 7-10días desde el inicio del tratamiento y luego se continuará con el monitoreo de manera semanal50.
Puntos de corte e interpretación de resultadosLa variabilidad en los resultados de CV observada entre los laboratorios y entre los métodos de cuantificación ha impedido definir un valor de corte o de referencia para la CV que determine una decisión médica, como diagnóstico de enfermedad o inicio de terapia preventiva. Las diferentes situaciones que se presentan, como tipo de muestra, tipo de trasplante (TOS o TCPH), estado serológico del receptor y del donante y tipo de inmunosupresión, también dificultan el establecimiento de un punto de corte para diagnosticar una infección por CMV clínicamente significativa54. A la hora de validar los resultados es importante considerar si se trata de un trasplante de órgano sólido o de un receptor de células progenitoras hematopoyéticas y los factores de riesgo asociados. Según el método que se utilice, se debe considerar que en los ensayos moleculares cuantitativos el límite de detección no siempre coincide con el de cuantificación. El límite de detección de un ensayo es la mínima concentración de ADN que puede detectarse en el 95% de los replicados, mientras que el límite de cuantificación inferior es la mínima cantidad que se detecta con una «precisión aceptable». Este último valor no está establecido para los ensayos moleculares cuantitativos, aunque, en general, se acepta un valor de entre el 20 y el 30%.
Se presentan a continuación los diferentes escenarios de resultados que pueden obtenerse y una sugerencia para su informe:
- a)
Una posibilidad es obtener un resultado menor que el valor del límite de detección del método utilizado, en cuyo caso se informará como «No detectable».
- b)
Otra posibilidad es obtener un resultado de carga viral mayor que el límite de detección, pero menor que el límite de cuantificación del método utilizado; eso significa que se detectó ADN, pero que el resultado obtenido no tiene una precisión aceptable como para informar un valor absoluto. Frente a esta situación, hay dos opciones de informe: «Detectable no cuantificable» o «Menor de…», indicando en este último caso el límite de cuantificación (p.ej., «Menor de 250UI/ml»).
- c)
Por último, si el valor de CV obtenido se encuentra entre el menor y el mayor límite de cuantificación, se informarán directamente los valores numéricos de ambos en UI/ml y log10.
Debido a la rápida dinámica de replicación, se recomienda que los resultados de las cargas virales de CMV se encuentren disponibles dentro de las 24 a 48horas, para poder tomar decisiones clínicas de manera oportuna50. El valor inicial de la carga viral es predictivo del riesgo de enfermedad y es el mejor indicador de la dinámica de replicación del virus. Cuanto más alta es la carga viral, mayor es el riesgo de enfermedad y de mortalidad7. Todavía no se ha establecido un valor de corte de carga viral ni un algoritmo para el inicio de la terapia preventiva. Se han utilizado diversas estrategias en los diferentes centros médicos; algunas de ellas son las enumeradas seguidamente:
- 1)
Monitoreo semanal e implementación de terapia preventiva ante la positivización de la carga viral, cualquiera que sea su valor67.
- 2)
Monitoreo semanal e inicio del tratamiento definido por determinados valores de carga viral: se han utilizado valores de corte mayores de 102 a 3×103 copias/ml3,7.
- 3)
Monitoreo basado en la cinética viral mediante la aplicación del «tiempo de duplicación» del virus. El inicio del tratamiento se basa en el aumento de la carga viral entre dos muestras consecutivas33,90.
Si se utiliza la diferencia entre dos cargas virales consecutivas como parámetro de inicio o seguimiento de la terapia, se debe considerar la variabilidad intralaboratorio de los ensayos de carga viral para asegurar que un aumento o disminución sea verdadero, es decir, que la variabilidad del ensayo debe ser menor que la diferencia considerada clínicamente significativa. El coeficiente de variación de los métodos moleculares cerca de la zona del límite de detección es de un 50%, con lo cual un cambio significativo estaría representado por 0,7log, y en la zona media de la curva en adelante es del 30%, motivo por el cual se deberían considerar como cambios significativos aquellos de 0,5log36.
En los estudios que se realizaron con el primer estándar se observó que, dependiendo del ensayo que se utilizaba, había poca o nula conmutabilidad en el 50% de estos; más aún, en los estándares secundarios posteriores se determinó que faltaba uniformidad y conmutabilidad34.
Además de estas variables, para establecer los valores de corte se deben considerar las diversas situaciones diagnósticas, el estado de inmunosupresión de las distintas poblaciones de pacientes y el uso de letermovir como profilaxis54.
Para determinar la finalización del tratamiento existen diferentes criterios, y cada centro debe definir los suyos. Varias guías sugieren suspender el tratamiento tras completar un mínimo de 2semanas (duración mínima de la terapia), siempre que se haya alcanzado la resolución clínica y se haya logrado la clarificación de la ADNemia. En pacientes con TCPH, esto se debe confirmar con muestras consecutivas tomadas con un intervalo de 3-4días, mientras que en los casos de TOS se recomienda un intervalo de 7días10,81.
Las primeras guías recomendaban tratar hasta detectar ADNemias negativas; dada la incorporación de técnicas ultrasensibles, se puede considerar la suspensión luego de 1 o 2muestras negativas o con cargas virales inferiores al límite de detección de la metodología en uso48.
Como alternativa, si la carga viral está en descenso luego de 1 a 2semanas de terapia de inducción, puede considerarse un cambio a la dosis de mantenimiento y continuar el seguimiento hasta que desaparezca la ADNemia32.
En pacientes sometidos a profilaxis con letermovir se puede detectar ADN de CMV fragmentado o aún no encapsidado en sangre, sin evidencia de infección por CMV13. Este fenómeno, denominado «blips de letermovir», se ha atribuido, en parte, al mecanismo de acción del letermovir, que interfiere en la escisión del genoma viral luego de la replicación intranuclear del virus105.
Las cargas de CMV en pacientes bajo profilaxis primaria con letermovir que desarrollan episodios de ADNemia que se resuelven solos generalmente no superan las 1.500UI/ml en plasma o las 10.000UI/ml en sangre entera. Estos blips no son signo de infección o de resistencia a letermovir y se puede suspender la terapia preventiva13,26,54,92.
Cuando se sospecha una infección por CMV con resistencia a antivirales, se deben realizar estudios de resistencia genotípica para detectar mutaciones específicas asociadas a la resistencia. Se debe considerar que durante los primeros 5 a 7días de inicio del tratamiento pueden observarse aumentos transitorios de la carga viral, sin que ello signifique resistencia. Para una mejor interpretación, es fundamental analizar los valores de carga viral junto con la fecha de inicio de tratamiento.
En ausencia de inmunidad mediada por células después de un TCPH, la carga viral puede tardar varias semanas en disminuir, a pesar de un tratamiento eficaz. Sin embargo, en ese contexto es razonable evaluar la posibilidad de realizar estudios de resistencia antiviral.
La incidencia de resistencia luego de la terapia con ganciclovir en TOS es generalmente baja (<5%); sin embargo, existen publicaciones que documentan un nivel de resistencia del 5 al 12%, con un valor aún más alto, del 18%, en receptores de pulmón, y del 31% en receptores de intestino y en trasplantados de múltiples órganos48. En TCPH, esta frecuencia varía entre el 0 y el 10%, según la población de pacientes (tipo de trasplante, edad, regímenes inmunosupresores utilizados y factores de riesgo), con valores más altos entre pacientes con trasplante alogénico con depleción de célulasT ex vivo.
Además de las mutaciones detectadas en los genes UL97 y UL54, también se han identificado alteraciones en otros genes relacionados con la resistencia a letermovir y maribavir. Se han reportado mutaciones en los genes UL56 y menos comúnmente en UL51 y UL89, que codifican el complejo de terminasa viral. Las pruebas genotípicas de resistencia al ganciclovir y valganciclovir incluyen los genes UL97 (codones 335-665) y UL54 (codones 290-1000). En relación con el letermovir, la región importante para la genotipificación es UL56 (codones 229-369), aunque también se pueden incluir UL51 y UL89. En algunos casos refractarios al maribavir también podría incluirse, aparte del gen UL97, el análisis de UL27. Sin embargo, en la actualidad estos estudios no se encuentran ampliamente disponibles en la práctica diaria83.
Resumen de las principales conclusiones y recomendaciones internacionalesSe resumen seguidamente las principales conclusiones de este documento (para mayores detalles en cuanto a profilaxis y tratamiento de las diferentes situaciones que se presentan en el TOS y en el TCPH, sugerimos consultar los dos últimos consensos internacionales50,54).
- •
La disponibilidad del estándar internacional de CMV aprobado por la OMS ha llevado a una mejor concordancia de los valores de carga viral entre varios ensayos. Aún existen diferencias debido a una variedad de factores, incluyendo la matriz, el método de extracción, los blancos de amplificación, el tamaño del amplicón, las sondas de hibridación/detección, la cuantificación no estandarizada de estándares secundarios y el uso de estándares no conmutables.
- •
La armonización global y el desarrollo de umbrales universales se facilitarán mediante el uso de ensayos en los que todos los pasos se encuentren completamente estandarizados.
- •
Recomendamos utilizar técnicas de amplificación de ácidos nucleicos cuantitativas (QNAAT) calibradas según el estándar de la OMS tanto para el diagnóstico y la vigilancia como para orientar el tratamiento antiviral preventivo y realizar el seguimiento terapéutico, debido a la posibilidad de armonizar y estandarizar estas pruebas.
- •
Los resultados deben informarse en UI/ml y su log y denominarse ADNemia, en lugar de viremia.
- •
Se recomienda que los resultados de las cargas virales de CMV se encuentren disponibles dentro de las 24 a 48horas para poder tomar decisiones clínicas de manera óptima.
- •
Se recomienda el uso de muestras de plasma o de sangre total para QNAAT, con un reconocimiento de las diferencias en los valores de carga viral, cinética viral y características de rendimiento del ensayo.
- •
Debido a la variabilidad, no debe cambiarse el tipo de muestra ni el ensayo al monitorear a los pacientes.
- •
A pesar de informar en UI/ml, se recomienda que los valores de carga viral no se comparen entre centros o laboratorios, a menos que se puedan utilizar reactivos y procedimientos de prueba idénticos asegurados o se haya documentado la equivalencia.
- •
Aunque la armonización de QNAAT ha mejorado, los umbrales universales para la terapia o los criterios de valoración del tratamiento no han sido establecidos aún y siguen siendo específicos del ensayo. En consecuencia, se recomienda que los centros establezcan sus propios umbrales y auditen los resultados clínicos para verificarlos. Una alternativa para la toma de decisiones tanto en la terapia preventiva como en el monitoreo antiviral es estudiar el dinamismo de las cargas virales en el tiempo, más que un valor único de carga viral.
- •
Se recomienda considerar los cambios en la carga viral que excedan 0,5log10UI/ml (tres veces) como diferencias clínicamente significativas en la ADNemia. En cargas virales bajas, menores de 3log10, considerar cambios que excedan 0,7log10UI/ml (cinco veces) como significativos.
- •
No se recomienda la vigilancia de rutina de la ADNemia por CMV durante la profilaxis.
- •
Se recomienda que, al monitorear la respuesta a la terapia antiviral, se realice QNAAT semanalmente.
- •
En el caso de que se emplee QNAAT altamente sensible, con un límite inferior de cuantificación (lower limit of quantification [LLOQ]) <200UI/ml, se sugiere suspender la terapia después de 1resultado menor que el LLOQ. Si se utiliza este enfoque, las pruebas confirmatorias deben realizarse 1semana después de suspender el tratamiento. Si el ensayo utilizado no es altamente sensible, entonces se necesitan 2resultados «No detectable» consecutivos para suspender el tratamiento.
- •
No se debe emplear QNAAT en muestras de orina ni para el diagnóstico ni para el seguimiento de pacientes R+.
- •
El diagnóstico de la mayoría de las enfermedades en órganos por CMV debe confirmarse por histopatología, con o sin inmunohistoquímica, como método estándar. La importancia del empleo de QNAAT en la enfermedad en órgano es su alto valor predictivo negativo debido a su sensibilidad.
- •
En BAL, el uso de QNAAT se puede emplear para el diagnóstico de neumonía probable, pero el valor umbral para discriminar entre enfermedad y eliminación asintomática aún debe ser definido.
Declaramos no haber recibido ningún tipo de financiación para la realización de este artículo.
Conflicto de interesesDeclaramos que no existe ningún conflicto de intereses en la realización de este trabajo.
Agradecemos a la Dras. Andrea Mangano y Pamela Valva por su valiosa revisión y sugerencias, que han sido fundamentales para mejorar este trabajo.