Contar con dosis estandarizadas, como las dosis diarias definidas veterinaria (DDDvet) y dosis de curso definidas veterinaria (DCDvet), es indispensable para cuantificar el uso de los antimicrobianos (AM) en medicina veterinaria y poder definir estrategias tendientes a su uso responsable. Por ello, los objetivos de este estudio fueron relevar las formulaciones de pomos intramamarios disponibles en Argentina y estimar sus DDDvet y DCDvet. Se fijaron las DDDvet y DCDvet de 29 formulaciones contra mastitis y las DCDvet de 27 formulaciones para secado. Se identificaron formulaciones con AM de importancia crítica de máxima prioridad para la salud humana (ceftiofur o cefquinoma) en ambos grupos; además, se detectó que se comercializan pomos combinados con hasta cuatro AM, incluyendo AM de importancia crítica. Los resultados de este trabajo evidencian una gran diversidad de formulaciones y concentraciones en pomos intramamarios, una escasa disponibilidad de productos monodroga y una alta proporción de combinaciones que incluyen AM de importancia crítica para la salud humana. Estos hallazgos destacan la necesidad urgente de estandarizar las dosis en el país, priorizar el uso de AM de menor importancia médica y promover un uso más prudente y racional de estos fármacos, en línea con un enfoque de Una Salud.
Standardized doses such as defined daily doses (DDDvet) and defined course doses (DCDvet) are essential to quantify the antimicrobials (AMs) used in veterinary medicine as a prior step for determining strategies for their responsible use. Therefore, the aim of this study was to create a list of the available intramammary formulations for mastitis and drying off in Argentina, and to estimate their DDDvet and DCDvet. DDDvet and DCDvet were determined for 29 mastitis cases and 27 drying formulations. Critically important AM formulations of the highest priority for human health (ceftiofur or cefquinome) were identified. In addition, there were combined formulations with up to four different AMs, including critically important AMs. The results of this study show a high diversity of formulations and concentrations, low availability of mono-drug products, and a high proportion of combinations that include AMs considered essential for human health. These findings highlight the urgent need to standardize dosages in Argentina, prioritize the use of AMs of low medical importance, and promote the prudent and rational use of these drugs, in line with a One Health approach.
El uso indebido y excesivo de antimicrobianos (AM) en animales contribuye a la aparición de bacterias resistentes, lo cual incrementa el riesgo de transmisión de estos microorganismos a los humanos a través de la cadena alimentaria, el ambiente o por contacto directo29. Esto puede reducir la eficacia de los AM para el tratamiento de enfermedades humanas y animales25,27,31. Dado que la resistencia antimicrobiana (RAM) es considerada un problema multisectorial (humanos, animales, ambiente y vegetales), minimizar el riesgo de aparición y transmisión de la RAM requiere del enfoque de Una Salud1,25. En 2019, se estimó que 5 millones de muertes humanas estuvieron vinculadas con la RAM, de las cuales 1,3 millones fueron causadas directamente por bacterias resistentes. Se considera que, si no se actúa rápidamente para controlar su avance, la RAM será la principal causa de muerte en 205028.
Con el fin de mantener la vigilancia sobre la aparición de bacterias con RAM, desde hace varios años, muchos países de la Unión Europea realizan reportes del uso de AM (UAM) en animales11, y también la Organización Mundial de Sanidad Animal lleva adelante reportes anuales27. Numerosos trabajos científicos publicados en revistas internacionales han informado resultados del UAM en diversos países, como Canadá18,34, Brasil37, Argentina13 y EE. UU.31. De ellos se desprende que los AM más empleados en bovinos de leche son los pomos intramamarios (IMM) para el tratamiento de la mastitis y para el período de secado13,19,39. Las clases de AM más frecuentemente utilizadas en el mundo son β-lactámicos, aminoglucósidos, lincosamidas y macrólidos20. A nivel nacional, un estudio realizado en 2015 en la provincia de Buenos Aires identificó a los β-lactámicos y los aminoglucósidos como los AM más utilizados por vía IMM para el tratamiento de mastitis clínica y a los β-lactámicos para la terapia de vaca seca13. En Argentina no existen datos actualizados sobre el UAM en rodeos lecheros.
La forma más frecuente de cuantificar el UAM es estimando las dosis diarias definidas (DDD) y las dosis de curso definidas (DCD), que cuantifican de manera estandarizada las dosis de un AM empleado en un establecimiento por día y por curso de tratamiento, respectivamente31. En medicina veterinaria se utiliza el sistema DDD veterinaria (DDDvet) y DCD veterinaria (DCDvet), cuyo objetivo principal es proporcionar unidades de medida estandarizadas para la presentación de datos sobre el consumo de AM por especie animal. Estas unidades tienen en cuenta diferencias en la dosificación entre especies y sustancias9,10. Para abordar el problema del incremento de la RAM se necesitan datos válidos y comparables sobre el UAM en el ganado, lo que remarca la importancia de estandarizar las unidades de medida17.
En Argentina existe el Programa Nacional de Vigilancia de la RAM, cuyo objetivo es vigilar y prevenir la generación y difusión de bacterias resistentes a los AM32. Asimismo, en 2015, el Ministerio de Salud junto con el ex Ministerio de Agricultura, Ganadería y Pesca crearon la Comisión Nacional de Control de la Resistencia Antimicrobiana (CoNaCRA)4, que tiene la responsabilidad de verificar el cumplimiento de la estrategia nacional para el control de la RAM. Además, en el año 2022 se sancionó la Ley de Prevención y Control de la resistencia a los AM (Ley 27680), y uno de sus objetivos es fortalecer la vigilancia de la RAM en el país. A pesar de esto, los valores de DDDvet (DDDvetArg) y DCDvet en Argentina (DCDvetArg) no están estandarizados13. Esto impide obtener datos sobre el UAM que permitan evaluar la situación actual y adoptar medidas para asegurar su uso adecuado.
En este contexto, y con el objetivo de promover un uso responsable de los AM, la Organización Mundial de la Salud (OMS) publicó recientemente una lista que categoriza a los AM según su prioridad en medicina humana25. Dicha lista sirve como herramienta de gestión para la toma de decisiones, minimizando el impacto del UAM en sectores no humanos sobre la RAM en los seres humanos25.
A partir de estos antecedentes, los objetivos de este trabajo fueron relevar las formulaciones en pomos IMM disponibles en Argentina para el tratamiento de mastitis y para el uso durante el secado en bovinos, categorizar los AM presentes en dichos pomos según la clasificación de la OMS y estimar sus DDDvetArg y DCDvetArg.
Materiales y métodosRelevamiento y clasificación de los productosSe realizó un estudio observacional (mayo de 2023 a agosto de 2024) que consistió en la búsqueda en Internet de los laboratorios veterinarios que producen o distribuyen AM IMM para uso en bovinos en Argentina. La información de los laboratorios aprobados se recabó, principalmente, del vademécum de productos veterinarios registrados en la página oficial de SENASA36, de páginas oficiales de laboratorios y de otros sitios web dedicados a la venta de productos veterinarios38. Se creó una base de datos con los nombres comerciales de los pomos IMM utilizados tanto para el tratamiento de mastitis como para el momento del secado. Posteriormente, se agruparon según sus principios activos y concentración de las sustancias antibióticas.
Método para estimar las DDDvetArg y DCDvetArgSe analizó la combinación de AM en un producto como si cada uno se encontrara individualmente. Para productos con terapia de dosis única (p. ej., los pomos IMM de secado), la DCDvetArg fue igual a la DDDvetArg17. Por lo tanto, para los pomos IMM utilizados en el momento del secado, solo se calculó la DCDvetArg (mg/ubre/total), ya que el tratamiento final recomendado es un pomo IMM para cada pezón, multiplicando la dosis (mg) de AM contenida en el pomo por cuatro.
Para estandarizar las unidades de medida en mg, se aplicó un factor de conversión en aquellos casos en que las unidades estaban expresadas en unidades internacionales. El factor de conversión utilizado fue 0,0006 para la penicilina, 0,0012 para la estreptomicina y 0,0013 para la kanamicina26.
La DDDvetArg (mg/pezón/día) para los pomos de mastitis se definió como la cantidad total de sustancia activa por pomo multiplicada por el número de administraciones diarias37. Este número se calculó según la frecuencia recomendada en el marbete (cada 12 o 24h) de cada producto. En aquellos casos en los que se recomendaba la aplicación de un pomo cada 12 o 24h, según el criterio del profesional, se calcularon dos DDDvetArg: una para la administración de un pomo cada 12h y otra para la administración de un pomo cada 24h. Para calcular la DCDvetArg, se multiplicaron las DDDvetArg calculadas por el número total de días de tratamiento (mg/pezón/total)17, que se fijó en 3 días7,16.
Clasificación de las formulaciones según la OMSSiguiendo la división de la OMS para los AM de uso en humanos y animales, según la importancia médica en humanos y considerando el riesgo potencial de desarrollo y propagación de RAM25, los AM presentes en las formulaciones relevadas se clasificaron en las cuatro categorías definidas, representadas por colores diferentes, a saber: color rojo intenso para aquellos AM de importancia crítica de máxima prioridad (AMICMP), como las cefalosporinas de tercera y cuarta generación, las polimixinas, las quinolonas y los derivados del ácido fosfónico; color rojo claro para los AM de importancia crítica (AMIC): aminoglucósidos, macrólidos y ansamicinas; color naranja para los AM de gran importancia (AMGI): cefalosporinas de primera y segunda generación, anfenicoles, lincosamidas, tetraciclinas, nitroimidazoles, penicilinas, estreptograminas, sufidanes, sulfonamidas, inhibidores y combinaciones de dihidrofolato reductasa; y color amarillo para los AM importantes (AMI), como aminociclitoles, polipéptidos cíclicos, compuestos heterocíclicos, hidroxiquinolina, pleuromutilinas y derivados de nitrofurano.
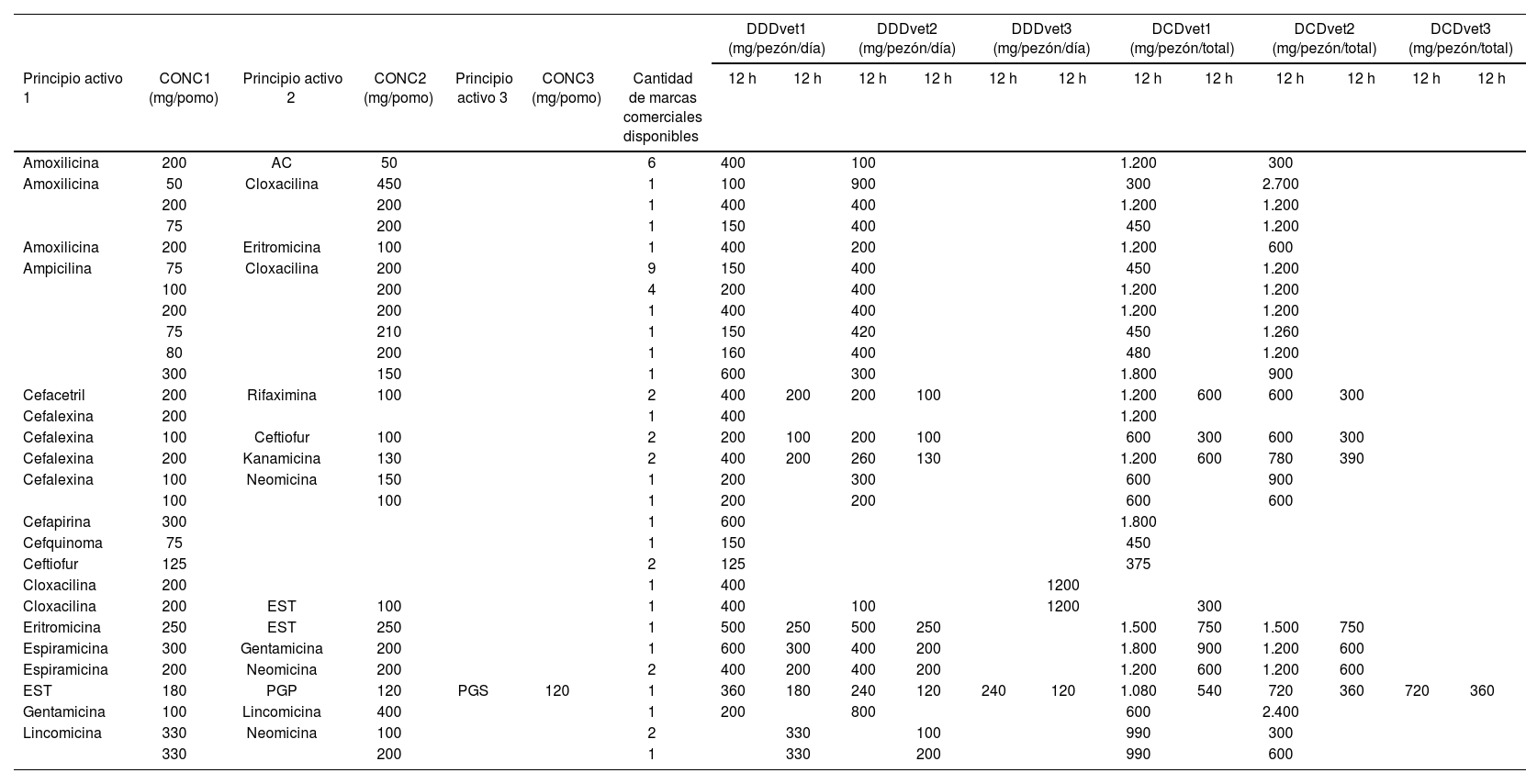
ResultadosInventario de pomos IMM disponibles en el mercado argentinoSe registraron 30 laboratorios que expendían pomos IMM para el tratamiento de mastitis clínica, con un total de 51 marcas comerciales. Las marcas comerciales se clasificaron, a su vez, según los principios activos contenidos en su formulación, dando un total de 29 formulaciones diferentes. Las DDDvetArg y DCDvetArg calculadas para cada formulación pueden verse en la tabla 1.
Algunas formulaciones contenían un solo fármaco AM (simples) y otras contenían más de un AM (combinadas). Se identificaron formulaciones con combinaciones de AM similares, pero en donde la concentración de los principios activos difería según el nombre comercial. Se encontraron 5 formulaciones simples, 23 formulaciones con dos fármacos combinados y una sola formulación que combinaba tres fármacos AM diferentes en el mismo pomo (17,24, 79,31 y 3,44%, respectivamente; tabla 1). De las 51 marcas comerciales analizadas, 6 contenían un solo fármaco antibiótico, 44 combinaban dos fármacos y una marca incluía tres antibióticos en su formulación.
Formulaciones de pomos intramamarios para tratamiento de mastitis clínica disponibles comercialmente en Argentina (año 2024)
| DDDvet1 (mg/pezón/día) | DDDvet2 (mg/pezón/día) | DDDvet3 (mg/pezón/día) | DCDvet1 (mg/pezón/total) | DCDvet2 (mg/pezón/total) | DCDvet3 (mg/pezón/total) | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Principio activo 1 | CONC1 (mg/pomo) | Principio activo 2 | CONC2 (mg/pomo) | Principio activo 3 | CONC3 (mg/pomo) | Cantidad de marcas comerciales disponibles | 12 h | 12 h | 12 h | 12 h | 12 h | 12 h | 12 h | 12 h | 12 h | 12 h | 12 h | 12 h |
| Amoxilicina | 200 | AC | 50 | 6 | 400 | 100 | 1.200 | 300 | ||||||||||
| Amoxilicina | 50 | Cloxacilina | 450 | 1 | 100 | 900 | 300 | 2.700 | ||||||||||
| 200 | 200 | 1 | 400 | 400 | 1.200 | 1.200 | ||||||||||||
| 75 | 200 | 1 | 150 | 400 | 450 | 1.200 | ||||||||||||
| Amoxilicina | 200 | Eritromicina | 100 | 1 | 400 | 200 | 1.200 | 600 | ||||||||||
| Ampicilina | 75 | Cloxacilina | 200 | 9 | 150 | 400 | 450 | 1.200 | ||||||||||
| 100 | 200 | 4 | 200 | 400 | 1.200 | 1.200 | ||||||||||||
| 200 | 200 | 1 | 400 | 400 | 1.200 | 1.200 | ||||||||||||
| 75 | 210 | 1 | 150 | 420 | 450 | 1.260 | ||||||||||||
| 80 | 200 | 1 | 160 | 400 | 480 | 1.200 | ||||||||||||
| 300 | 150 | 1 | 600 | 300 | 1.800 | 900 | ||||||||||||
| Cefacetril | 200 | Rifaximina | 100 | 2 | 400 | 200 | 200 | 100 | 1.200 | 600 | 600 | 300 | ||||||
| Cefalexina | 200 | 1 | 400 | 1.200 | ||||||||||||||
| Cefalexina | 100 | Ceftiofur | 100 | 2 | 200 | 100 | 200 | 100 | 600 | 300 | 600 | 300 | ||||||
| Cefalexina | 200 | Kanamicina | 130 | 2 | 400 | 200 | 260 | 130 | 1.200 | 600 | 780 | 390 | ||||||
| Cefalexina | 100 | Neomicina | 150 | 1 | 200 | 300 | 600 | 900 | ||||||||||
| 100 | 100 | 1 | 200 | 200 | 600 | 600 | ||||||||||||
| Cefapirina | 300 | 1 | 600 | 1.800 | ||||||||||||||
| Cefquinoma | 75 | 1 | 150 | 450 | ||||||||||||||
| Ceftiofur | 125 | 2 | 125 | 375 | ||||||||||||||
| Cloxacilina | 200 | 1 | 400 | 1200 | ||||||||||||||
| Cloxacilina | 200 | EST | 100 | 1 | 400 | 100 | 1200 | 300 | ||||||||||
| Eritromicina | 250 | EST | 250 | 1 | 500 | 250 | 500 | 250 | 1.500 | 750 | 1.500 | 750 | ||||||
| Espiramicina | 300 | Gentamicina | 200 | 1 | 600 | 300 | 400 | 200 | 1.800 | 900 | 1.200 | 600 | ||||||
| Espiramicina | 200 | Neomicina | 200 | 2 | 400 | 200 | 400 | 200 | 1.200 | 600 | 1.200 | 600 | ||||||
| EST | 180 | PGP | 120 | PGS | 120 | 1 | 360 | 180 | 240 | 120 | 240 | 120 | 1.080 | 540 | 720 | 360 | 720 | 360 |
| Gentamicina | 100 | Lincomicina | 400 | 1 | 200 | 800 | 600 | 2.400 | ||||||||||
| Lincomicina | 330 | Neomicina | 100 | 2 | 330 | 100 | 990 | 300 | ||||||||||
| 330 | 200 | 1 | 330 | 200 | 990 | 600 | ||||||||||||
Las diferentes formulaciones se encuentran agrupadas según principios activos (PA) y sus concentraciones (en mg/pomo), a las que se les asignaron los valores de DDDvet (mg/pezón/día) y DCDvet (mg/pezón/total).
AC: ácido clavulánico; CONC1, CONC2 y CONC3: concentración de principio activo correspondiente; DCDvet: dosis de curso definida veterinaria; DDDvet: dosis diaria definida veterinaria; EST: estreptomicina; PGP: penicilina G procaínica; PGS: penicilina G sódica.
La combinación de ampicilina y cloxacilina fue la más frecuente, con diversidad de concentraciones de ambos fármacos, dando un total de 6 formulaciones diferentes y representando un 20,69% de las formulaciones disponibles para tratar la mastitis clínica. La formulación más común de esta combinación contenía 75mg/pomo de ampicilina y 200mg/pomo de cloxacilina, disponible en 9 marcas comerciales diferentes (17,64% del total de marcas).
La combinación de amoxicilina (200mg/pomo) con ácido clavulánico (50mg/pomo) se encontró presente en 6 marcas comerciales, ocupando el segundo lugar de importancia en cuanto a disponibilidad de marcas comerciales en el mercado (11,7% del total de marcas; tabla 1).
De las 51 marcas comerciales de pomos para tratar la mastitis clínica, 17 (33,33%) incluían antiinflamatorios en su composición (una contenía flumetasona, dos contenían dexametasona y 14 prednisolona).
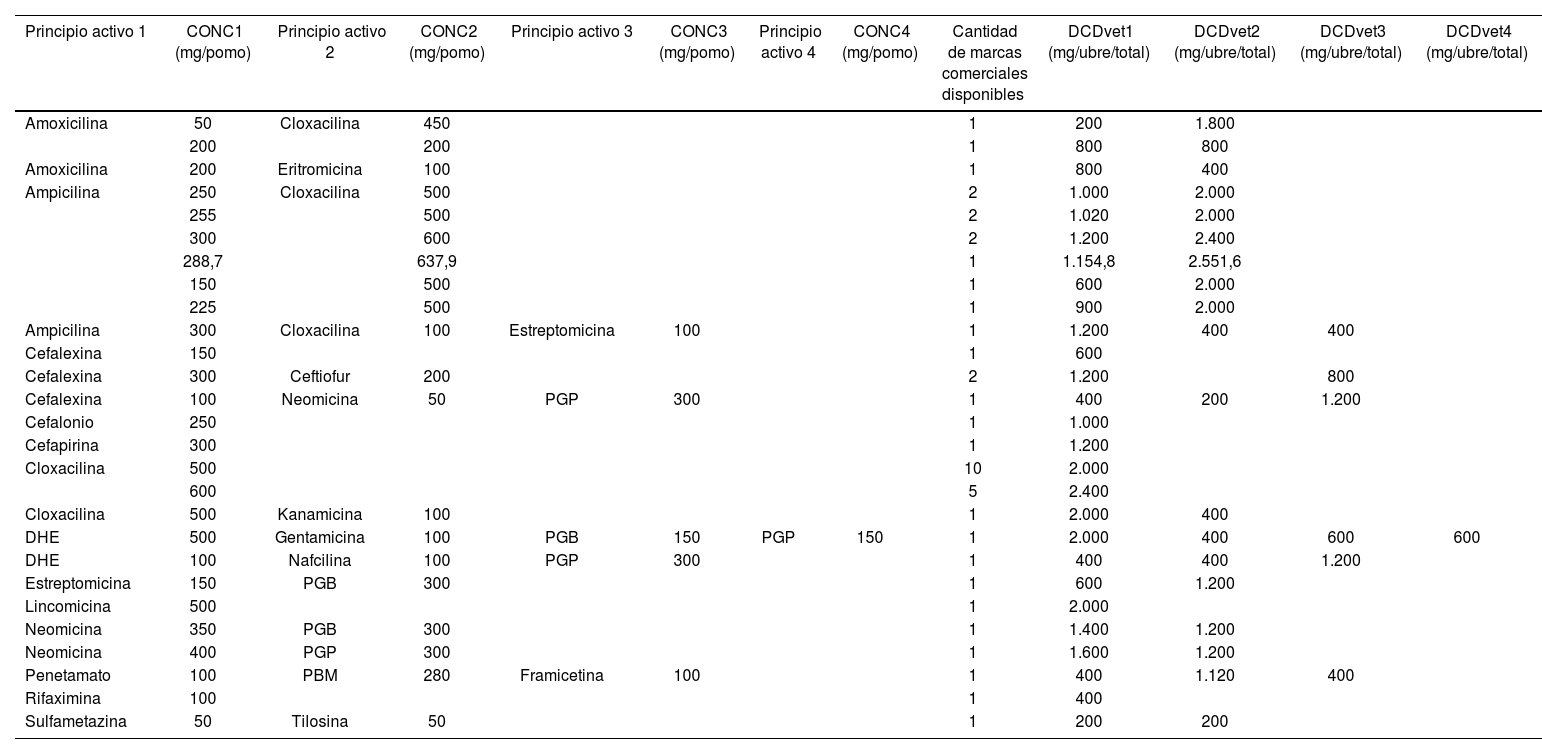
En cuanto a los pomos IMM para el momento del secado, se encontró que 31 laboratorios los producían, con 44 marcas comerciales y 27 formulaciones diferentes (simples o combinadas), variando la concentración de los principios activos según el nombre comercial. Las DCDvetArg calculadas para estas formulaciones se exponen en la tabla 2. De las 44 marcas comerciales analizadas, 20 contenían un solo fármaco antibiótico, 19 incluían dos, 4 combinaban 3 fármacos y una marca incorporaba cuatro antibióticos en su formulación.
Formulaciones de pomos intramamarios para el momento del secado disponibles comercialmente en Argentina (año 2024)
| Principio activo 1 | CONC1 (mg/pomo) | Principio activo 2 | CONC2 (mg/pomo) | Principio activo 3 | CONC3 (mg/pomo) | Principio activo 4 | CONC4 (mg/pomo) | Cantidad de marcas comerciales disponibles | DCDvet1 (mg/ubre/total) | DCDvet2 (mg/ubre/total) | DCDvet3 (mg/ubre/total) | DCDvet4 (mg/ubre/total) |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Amoxicilina | 50 | Cloxacilina | 450 | 1 | 200 | 1.800 | ||||||
| 200 | 200 | 1 | 800 | 800 | ||||||||
| Amoxicilina | 200 | Eritromicina | 100 | 1 | 800 | 400 | ||||||
| Ampicilina | 250 | Cloxacilina | 500 | 2 | 1.000 | 2.000 | ||||||
| 255 | 500 | 2 | 1.020 | 2.000 | ||||||||
| 300 | 600 | 2 | 1.200 | 2.400 | ||||||||
| 288,7 | 637,9 | 1 | 1.154,8 | 2.551,6 | ||||||||
| 150 | 500 | 1 | 600 | 2.000 | ||||||||
| 225 | 500 | 1 | 900 | 2.000 | ||||||||
| Ampicilina | 300 | Cloxacilina | 100 | Estreptomicina | 100 | 1 | 1.200 | 400 | 400 | |||
| Cefalexina | 150 | 1 | 600 | |||||||||
| Cefalexina | 300 | Ceftiofur | 200 | 2 | 1.200 | 800 | ||||||
| Cefalexina | 100 | Neomicina | 50 | PGP | 300 | 1 | 400 | 200 | 1.200 | |||
| Cefalonio | 250 | 1 | 1.000 | |||||||||
| Cefapirina | 300 | 1 | 1.200 | |||||||||
| Cloxacilina | 500 | 10 | 2.000 | |||||||||
| 600 | 5 | 2.400 | ||||||||||
| Cloxacilina | 500 | Kanamicina | 100 | 1 | 2.000 | 400 | ||||||
| DHE | 500 | Gentamicina | 100 | PGB | 150 | PGP | 150 | 1 | 2.000 | 400 | 600 | 600 |
| DHE | 100 | Nafcilina | 100 | PGP | 300 | 1 | 400 | 400 | 1.200 | |||
| Estreptomicina | 150 | PGB | 300 | 1 | 600 | 1.200 | ||||||
| Lincomicina | 500 | 1 | 2.000 | |||||||||
| Neomicina | 350 | PGB | 300 | 1 | 1.400 | 1.200 | ||||||
| Neomicina | 400 | PGP | 300 | 1 | 1.600 | 1.200 | ||||||
| Penetamato | 100 | PBM | 280 | Framicetina | 100 | 1 | 400 | 1.120 | 400 | |||
| Rifaximina | 100 | 1 | 400 | |||||||||
| Sulfametazina | 50 | Tilosina | 50 | 1 | 200 | 200 |
Las diferentes formulaciones se encuentran agrupadas según los principios activos y sus concentraciones (en mg/pomo), a las que se les asignaron los valores de DCDvet (mg/ubre/totales).
CONC1, CONC2 y CONC3: concentración de principio activo correspondiente; DCDvet: dosis de curso definida veterinaria; DDDvet: dosis diaria definida veterinaria; DHE: dihidroestreptomicina; PBM: benetamina penicilina; PGB: penicilina G benzatínica; PGP: penicilina G procaínica.
Se encontraron 7 formulaciones simples (25,92%), 15 formulaciones con dos principios activos combinados (55,55%), cuatro formulaciones con tres principios activos combinados (14,81%) y una combinación de cuatro principios activos diferentes (3,70%; tabla 2). Las formulaciones simples se encontraron en 20 marcas comerciales (45,45% del total de marcas).
La formulación más común fue la doxacilina en el caso de los pomos de secado, disponible en dos concentraciones simples: 500mg/pomo (presente en 10 marcas comerciales, 22,72%) y 600mg/pomo (en 5 marcas, 11,36%).
Datos de DDDvetArg y DCDvetArgLos datos obtenidos de DDDvetArg para los pomos IMM contra mastitis se mantienen dentro de un rango que va desde los 100mg/pezón/día hasta los 900mg/pezón/día, teniendo en cuenta la dosis de cada antibiótico. Las DCDvetArg oscilaron entre 300mg/pezón/total y 2.700mg/pezón/total (tabla 1). Los datos calculados de DCDvetArg para el período de secado estuvieron entre 200mg/ubre/total y 2.551,6mg/ubre/total (tabla 2).
Clasificación de las formulaciones según la OMSDentro de las formulaciones para el tratamiento de mastitis que contenían un antibiótico se registraron dos que contenían AMICMP (ceftiofur y cefquinoma). Además, se identificaron formulaciones con cloxacilina, cefalexina y cefapirina, todas clasificadas como AMGI. Entre las formulaciones que incluían dos antibióticos, tres contenían dos antibióticos clasificados como AMGI, siete combinaban un AMGI con otro AMIC, tres incluían dos AMIC y una combinaba un AMGI con un AMICMP, mientras que la formulación con tres antibióticos combinaba dos AMGI y un AMIC.
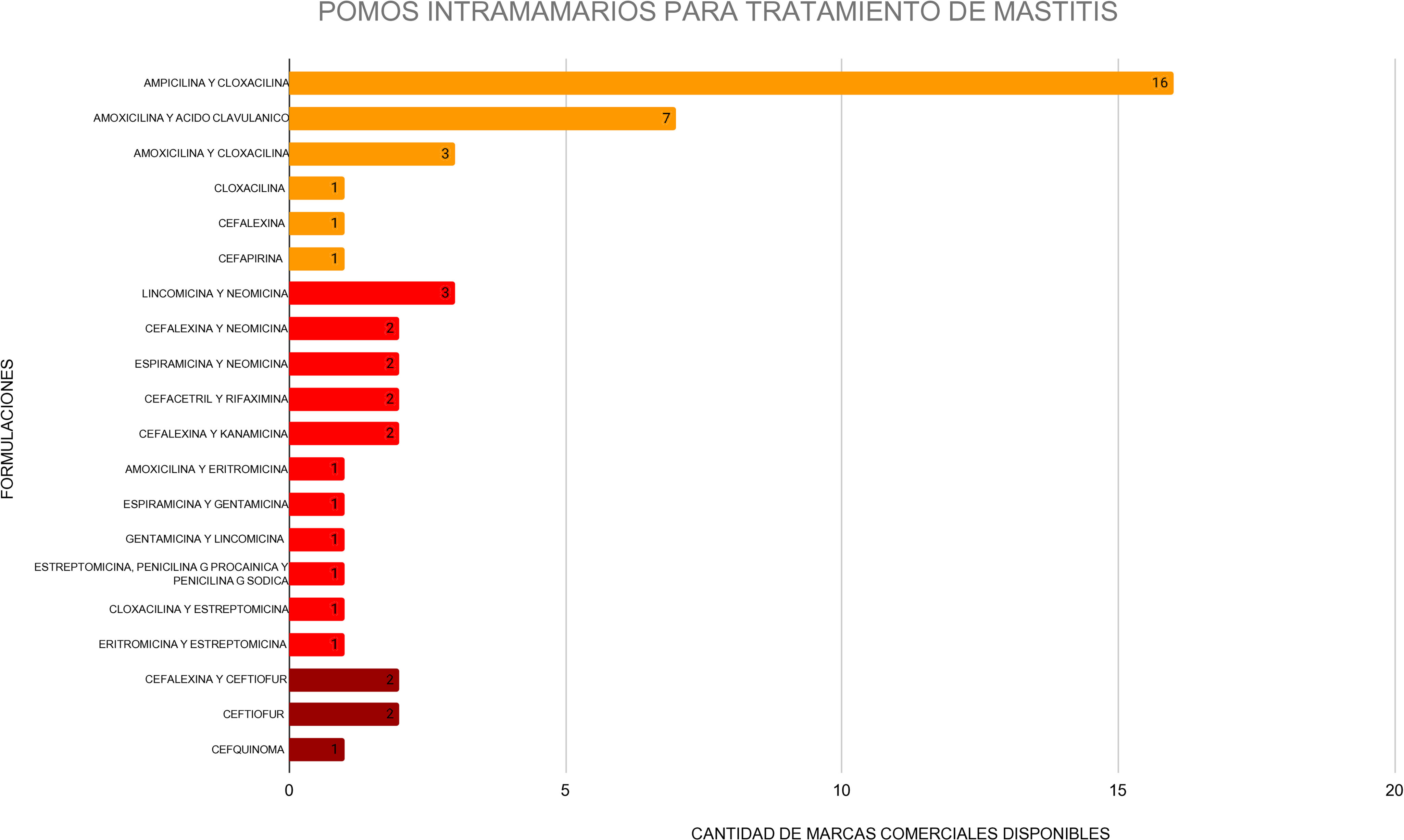
Los AMIC que se encontraron en las formulaciones combinadas fueron aminoglucósidos (gentamicina, estreptomicina, kanamicina o neomicina), macrólidos (espiramicina o eritromicina) o ansamicinas (rifaximina), y dentro de los AMGI, fueron cefapirina, cefalexina, amoxicilina, ampicilina y cloxacilina. No se encontró ningún pomo IMM que contuviera un AMI (fig. 1).
Inventario de formulaciones de pomos intramamarios para el tratamiento de mastitis disponibles en Argentina. Los colores de las barras indican la categoría de los AM según la clasificación de la Organización Mundial de la Salud: rojo intenso, antimicrobianos de importancia crítica de máxima prioridad (AMICMP); rojo claro: antimicrobianos de importancia crítica (AMIC); naranja: antimicrobianos de gran importancia (AMGI). Se muestra, además, la cantidad de productos comerciales presentes en el mercado argentino que contienen los AM listados.
Entre las formulaciones disponibles en el mercado para el período de secado que contenían un AM, se identificaron las siguientes sustancias activas clasificadas como AMGI: cloxacilina, lincomicina, cefalexina, cefapirina y cefalonio. Además, se encontró una formulación que contenía un AMIC, como la rifaximina. Entre las formulaciones que incluían dos antibióticos, dos contenían dos AMGI, seis combinaban un AMGI con otro AMIC y una combinaba un AMGI con un AMICMP. Asimismo, las cuatro formulaciones con tres antibióticos combinaban dos AMGI con un AMIC, mientras que la formulación con cuatro antibióticos combinaba dos AMGI con dos AMIC.
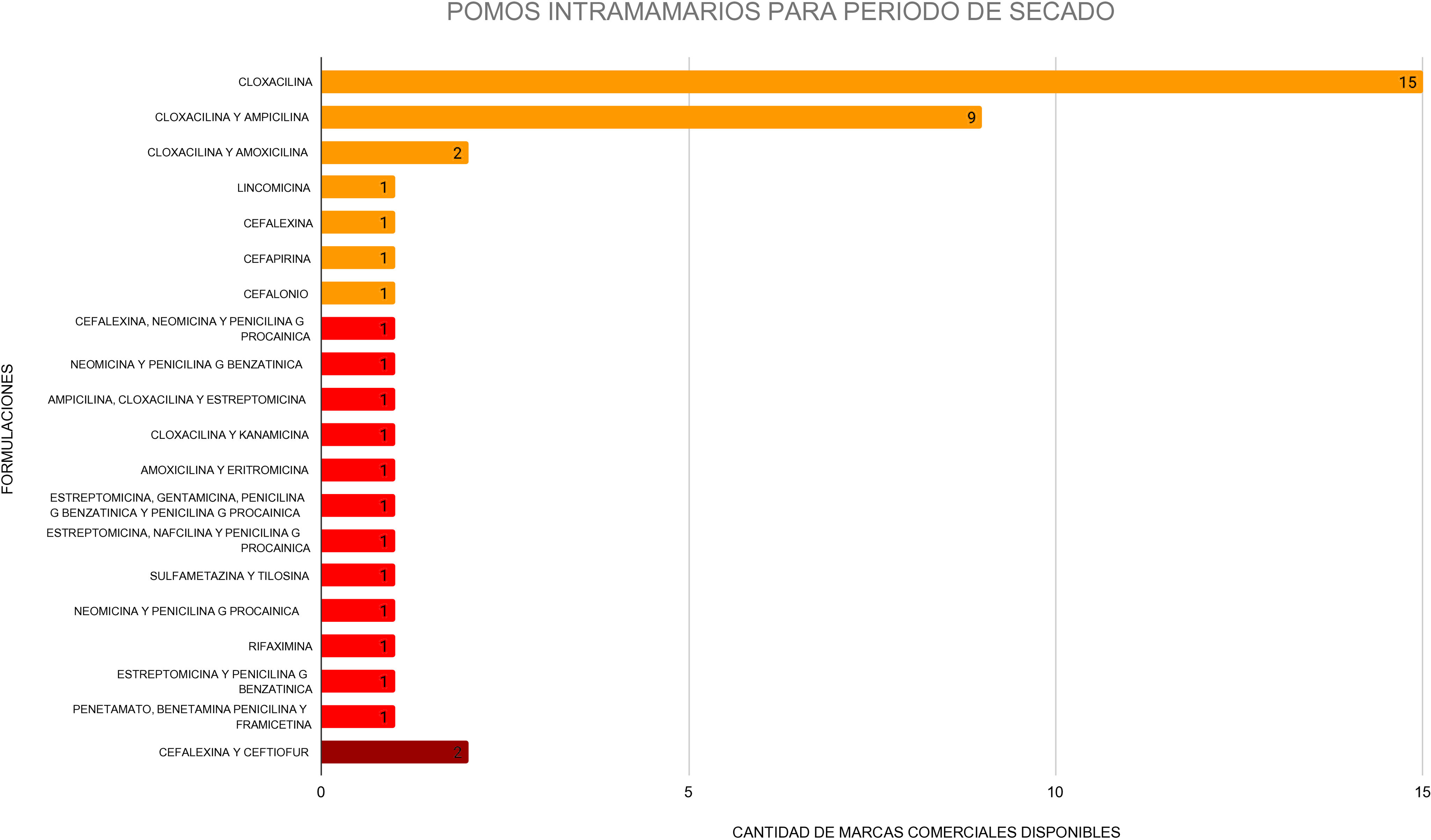
Los AMIC que se registraron en formulaciones combinadas fueron aminoglucósidos (framicetina, estreptomicina, kanamicina o neomicina) y macrólidos (tilosina o eritromicina). Los AMGI abarcaron cloxacilina, ampicilina, amoxicilina, cefalexina, nafcilina, penetamato o algún AM del grupo de las penicilinas. Ninguna formulación se clasificó como AMI (fig. 2).
Inventario de formulaciones de pomos intramamarios para el periodo de secado. disponibles en Argentina. Los colores de las barras indican la categoría de los AM según la clasificación de la Organización Mundial de Salud: rojo intenso, antimicrobianos de importancia crítica de máxima prioridad (AMICMP); rojo claro: antimicrobianos de importancia crítica (AMIC); naranja: antimicrobianos de gran importancia (AMGI). Se muestra, además, la cantidad de productos comerciales presentes en el mercado argentino que contienen los AM listados.
En nuestro país, existe una falta de estandarización en las dosis de antibióticos empleadas en bovinos, lo que dificulta la cuantificación del UAM. En este trabajo nos centramos en calcular las dosis para los pomos de aplicación IMM destinados al tratamiento de mastitis clínica y al período de secado. Sin embargo, es fundamental contar en el futuro con las dosis estandarizadas de AM correspondientes a todas las vías de administración, con el fin de lograr una correcta cuantificación del UAM, que permita la comparación entre establecimientos de nuestro país y entre países15. La escasez de datos a nivel local y regional sobre este tema limita la posibilidad de comparar nuestros resultados con los de otros estudios.
Al relevar las formulaciones de pomos IMM, resulta destacable la amplia oferta de productos AM disponibles, así como la variedad de combinaciones de principios activos en distintas concentraciones. Esta situación complica el seguimiento ordenado de dichos agentes y dificulta la estandarización de las dosis recomendadas. En un trabajo sobre cuantificación del UAM realizado en nuestro país, se utilizaron las indicaciones de los marbetes para definir las DDD13. Sin embargo, existen casos en que los prospectos de los pomos IMM presentan recomendaciones abiertas al criterio profesional en cuanto a la frecuencia diaria (cada 12 o 24h) y días de administración del producto, por lo que en el presente trabajo definimos las DDD para ambas frecuencias de administración. En otras ocasiones, el número de días de tratamiento recomendado no permite cumplir con los 3 días mínimos para AM tiempo-dependientes, como lo establece la bibliografía7, encontrándose solo tres marcas comerciales del total de 51 que lo especificaban. Debido a esto, se calcularon dos DDDvetArg, una para la administración de un pomo cada 12h y otra para los casos en que se usan cada 24h, y dos DCDvetArg, estableciendo en 3 el número total de días de tratamiento16,17,35.
Por un lado, esta estandarización de los tratamientos en 3 días pretende abarcar la mayor parte de los tratamientos IMM, pero existen casos de mastitis en los cuales se recomienda realizar una terapia extendida por 5 días con AM, como es el caso de aquellas causadas por Staphylococcus aureus, Streptococcus uberis o Klebsiella spp.6,7,9. Por otro lado, la mastitis clínica puede resultar dolorosa y comprometer el bienestar animal30, por lo que se recomienda el tratamiento con pomos IMM que incluyan antiinflamatorios en su formulación o antiinflamatorios parenterales en todos los casos de mastitis clínica, independientemente de la realización o no de un tratamiento AM6,14.
En Argentina y otros países, Streptococcus agalactiae, Streptococcus dysgalactiae, Streptococcus uberis y Staphylococcus aureus son las principales causas de mastitis5,33. En la cuenca lechera central santafesina, estudios previos en leche de tanque identificaron como patógeno predominante a S. aureus (42,6%), seguido de S. uberis (27,1%), S. dysgalactiae (10,9%) y S. agalactiae (4,7%)22. Considerando que los patógenos más prevalentes en el país son bacterias grampositivas, es de esperar que la mayor parte de los productos disponibles para el tratamiento de las mastitis incluyan antibióticos dirigidos a este tipo de bacterias, lo que coincide con lo relevado en nuestro trabajo. Respecto de la RAM de los patógenos de mastitis, existe escasa información en Argentina que permita analizar las variaciones en sus patrones de sensibilidad frente a los AM más utilizados en mastitis bovina3. Solamente se dispone de datos de estudios realizados sobre S. aureus, que no muestran una variación significativa de la RAM a los agentes de uso frecuente20. Esto no significa que no debamos trabajar fomentando un uso responsable de los AM para prevenir futuros problemas de RAM.
En otros países, la disponibilidad de pomos IMM es mucho menor que la documentada en el presente trabajo17,31,37, lo que facilita la cuantificación del uso de AM y un uso más prudente de estos. En otro orden, cabe mencionar que los fármacos más comúnmente empleados para tratamientos IMM tanto en Argentina como a nivel mundial son los β-lactámicos8,13,18,21, lo que explica la gran disponibilidad de AM de este grupo encontrada en este estudio. Los trabajos de cuantificación del UAM publicados emplean, por lo general, dosis obtenidas de los marbetes de los productos o dosis estándares, tomadas de vademécums veterinarios, y no se detalla la composición de los productos disponibles o cuantificados23,34. Esto dificulta la comparación de lo encontrado en nuestro trabajo con los hallazgos de otras investigaciones, de modo que solo podemos dar unos pocos ejemplos. En un trabajo publicado recientemente sobre generación de DDDvet y DCDvet, realizado en Canadá, las formulaciones disponibles para el tratamiento de la mastitis que coinciden con las utilizadas en Argentina son las que contienen ceftiofur y cefapirina, aunque las dosis son menores, ya que utilizan dos días como tratamiento final17. En Canadá, se establece para la cefapirina la misma DDDvet y DCDvet, mientras que en Argentina son diferentes. Probablemente esto se deba a que en ese país usan un pomo monodosis. Respecto a los productos para secado, las DCDvet de cefapirina y cloxacilina coinciden con las encontradas en nuestro trabajo. En otro trabajo realizado en Brasil37, se informan formulaciones semejantes a las aquí descritas, con equivalencia también en las DDDvet y en el intervalo entre aplicaciones. También se utiliza cefquinoma en ambos países, aunque con diferente concentración. Los intervalos entre dosis coinciden en Brasil y Argentina: dos aplicaciones diarias para las formulaciones combinadas y cada 24h para ceftiofur. En Argentina, falta un criterio unificado para la realización de los tratamientos y, por esta razón, se decidió unificar el criterio de duración del tratamiento y establecer las DCDvet para 3 días de tratamiento.
Actualmente, se considera necesario comenzar a aplicar estrategias de reducción del UAM mediante el diagnóstico preciso del agente causal y la selección del AM de manera adecuada, basándose en los resultados del cultivo microbiológico y la sensibilidad a los AM, así como en el riesgo de generación de RAM que posee cada AM31. Con el propósito de sumar en este sentido, en el presente trabajo se generó una clasificación de los pomos disponibles en Argentina siguiendo la recomendación de la OMS25. Según dicha recomendación, al seleccionar un AM es conveniente priorizar los AMI, luego los AMGI, y solo recurrir a los AMIC y AMICMP como último recurso25. Entre los pomos disponibles relevados en este estudio no se encontró ninguno perteneciente al grupo AMI. La gran mayoría fue clasificada como AMGI (el 58,8% de los pomos de mastitis y el 68,2% de los de secado). En las formulaciones para el período de secado con monodrogas, la rifaximina (perteneciente a la familia de las rifamicinas) es la única clasificada como AMIC, mientras que el resto se ubica dentro de la clasificación AMGI. Esto incluye a la cloxacilina (un antibiótico β-lactámico del grupo de las penicilinas), la cefalexina, la cefapirina y el cefalonio (antibióticos β-lactámicos del grupo de las cefalosporinas de primera generación), así como a la lincomicina (perteneciente al grupo de las lincosamidas).
El uso de monodrogas simplifica el tratamiento y puede ayudar a reducir el riesgo de RAM. Al usar un solo fármaco, se puede controlar mejor la evolución de la resistencia y, si es necesario, cambiar de tratamiento de manera más específica. Los productos compuestos, salvo que se hayan llevado a cabo estudios específicos, presentan perfiles farmacocinéticos inciertos y se desconoce su estabilidad, potencia y seguridad40. En el presente trabajo se identificó una disponibilidad muy limitada de pomos IMM que cumplan con las características de monodroga para el tratamiento de mastitis (seis marcas comerciales, que representaron el 11,7%), de las cuales tres correspondieron a AM clasificados como AMICMP (con ceftiofur y cefquinoma). Esto evidencia una oferta reducida de productos que cumplen con los requisitos establecidos. En cuanto al período de secado, se registraron 20 marcas comerciales (45,45%) de productos monodroga, ninguna clasificada como AMICMP, por lo que estas cumplen con los requisitos para ser elegidas como primera opción. Según datos de la European Surveillance of Veterinary Antimicrobial Consumption (ESVAC)12, en países de la Unión Europea como Alemania y los Países Bajos, así como en Canadá17, también predominan los productos IMM monodroga para estas formulaciones.
La combinación de dos principios activos, uno clasificado como AMGI y otro como AMIC, fue la formulación más frecuente tanto entre los productos para el tratamiento de mastitis como entre los indicados para el período de secado. Los aminoglucósidos se encuentran clasificados como AMIC por la OMS25 y, en nuestro trabajo, se encontraron siempre en combinación con otros AM como β-lactámicos¸ macrólidos o lincosamidas. Dado que los aminoglucósidos son considerados AM de amplio espectro, sería importante evaluar si resulta estrictamente necesario realizar combinaciones, sobre todo en los casos donde el microorganismo actuante fue identificado mediante algún tipo de diagnóstico microbiológico, lo que permitiría seleccionar un AM de espectro más reducido. Las combinaciones de AM pueden poseer desventajas, como un mayor costo, mayor toxicidad, posible antagonismo y aumento de la RAM2. Estas formulaciones deben demostrar su efecto sinérgico mediante evidencia científica29. Para el caso de los tratamientos en humanos, de acuerdo con las recomendaciones de la OMS presentadas en la guía AWaRe24, la primera opción siempre consiste en el uso de una monodroga. Para el caso de medicina veterinaria, en algunos países del mundo, la disponibilidad de combinaciones de fármacos AM en pomos IMM ya se encuentra reducida12,17.
Es crítico preservar la eficacia de los AM de los grupos AMICMP y AMIC, ya que su pérdida debido a la aparición de resistencia tendría un impacto significativo en la salud humana, en particular para las personas con infecciones potencialmente mortales25,29. En conjunto, estos grupos de AM representaron un 43 y un 31,8% de los pomos disponibles para mastitis y secado, respectivamente, relevados en este estudio. Sería importante reservar su uso para casos especiales de RAM frente al resto de los pomos disponibles. Este enfoque de selección de AM basado en la clasificación de los productos no ha sido reportado en otros trabajos científicos, pero se fundamenta en las recomendaciones de entidades internacionales, como la OMS y la OMSA25,27.
Los resultados de este trabajo evidencian una gran diversidad de formulaciones y concentraciones, una escasa disponibilidad de productos monodroga en formulaciones para el tratamiento de mastitis y una alta proporción de combinaciones que incluyen AM de importancia crítica para la salud humana. Estos hallazgos destacan la necesidad urgente de estandarizar las dosis en el país, priorizar el UAM de menor importancia médica y promover un uso más prudente y racional de estos fármacos, en línea con un enfoque de Una Salud. El cálculo de las DDDvetArg y DCDvetArg de las formulaciones relevadas brindará datos valiosos para futuros estudios sobre cuantificación de UAM.
Financiación- –
PIP 11220200101110CO (convocatoria 2021-2023). «Identificación de factores de riesgo asociados a la emergencia y difusión de microorganismos resistentes a los AM en producción primaria de leche».
- –
Proyecto INTA 2023-PD-L06-I115. «Resistencia antimicrobiana y desarrollo de alternativas que minimicen el uso de antibióticos y antiparasitarios para una producción animal más sustentable».
- –
Proyecto INTA 2023-PD-L01-I118. «Innovaciones en los procesos de crianza, recría y vaca en transición de rodeos lecheros».
No existe conflicto de intereses, incluyendo entre estos últimos las relaciones financieras, personales o de otro tipo con otras personas u organizaciones, que pudieran influir de manera inapropiada en el trabajo.