En la actualidad, el enfoque terapéutico y el seguimiento de los pacientes con carcinoma diferenciado de tiroides (CDT) es individualizado de acuerdo con el riesgo de recurrencia de la enfermedad, con una menor tendencia a ablacionar a pacientes de bajo riesgo de recurrencia. Por otro lado, la evaluación de las respuestas al tratamiento se validó en pacientes tratados con tiroidectomía total (TT) y ablación con radioyodo (RAI), pero son escasos los estudios en pacientes no ablacionados. Los objetivos de este estudio fueron describir las características de una población de pacientes con CDT no ablacionados y validar las respuestas al tratamiento durante el seguimiento. Se incluyó a 88 pacientes con un seguimiento mínimo de 12 meses. El 87,6% eran mujeres y la edad promedio en el momento del diagnóstico fue de 47,5 años. Basados en el Consenso Intersocietario Argentino, el 97,7% de la cohorte fue clasificada como de bajo riesgo y el 2,3% como de riesgo intermedio de recurrencia. Los pacientes presentaron una respuesta inicial excelente en el 73% de los casos, con un estado sin evidencia de enfermedad al final del seguimiento en el 85,5%. Una minoría de los pacientes (1%) presentó una respuesta inicial estructural incompleta, la cual fue similar al final del seguimiento (1%). Por otro lado, el 26% de los pacientes presentó una respuesta inicial indeterminada, aunque solo el 13,5% permaneció con esta respuesta al final del seguimiento. Nuestros datos validan las respuestas al tratamiento en pacientes con CDT que recibieron TT no ablacionados como una herramienta efectiva para la estratificación del riesgo dinámico. Los pacientes apropiadamente seleccionados tratados sin RAI tienen un excelente pronóstico, con una baja frecuencia de respuesta estructural incompleta en el seguimiento, inclusive menor que la de los pacientes de bajo riesgo ablacionados.
The therapeutic approach and the follow-up of patients with differentiated thyroid cancer (DTC) is currently individualised according to the risk of recurrence, with a lower tendency to perform remnant ablation (RA) in patients with low risk of recurrence. While response to therapy assessment has been validated for DTC patients treated by total thyroidectomy (TT) and RA, it has not been widely confirmed in patients treated with TT without RA. The aims of this study were to describe the characteristics of the population of patients treated with TT without RA, and to validate the response to therapy. The study included 88 patients followed-up for at least 12 months after surgery. In the entire cohort, 87.9% were female and the mean age was 47.5 years old. Based on the Argentine Intersociety Consensus, 97.7% and 2.3% were classified as low risk and intermediate risk of recurrence, respectively. Patients had an initial excellent response to treatment in 73% of cases, with a disease-free status at the end of follow-up of 85.5%. A minority of patients (1%) presented with an initial structural incomplete response, which was similar at the end of follow-up (1%). On the other hand, 26% of the patients had an initial indeterminate response, although only 13.5% remained with this response at the end of follow-up. These results validate the responses to treatment in DTC patients treated with TT without RA as an effective tool for the dynamic risk stratification. Patients appropriately selected who did not receive RA have an excellent outcome, with a low frequency of structural incomplete response, even lower than that observed in low risk ablated patients.
El enfoque de los pacientes con carcinoma diferenciado de tiroides (CDT) presentó un cambio radical en los últimos años, con una tendencia mundial hacia el tratamiento individualizado de acuerdo al riesgo de recurrencia (RR) de la enfermedad1,2. La estratificación por RR fue propuesta casi concomitantemente por la American Thyroid Association (ATA) y por la Sociedad Latinoamericana de Tiroides (SLAT), entre otras sociedades en el mundo1-5. Estos sistemas de clasificación, originalmente diseñados para establecer la probabilidad de respuesta estructural incompleta, fueron adicionalmente validados para ser predictivos de múltiples otros resultados clínicos importantes en el seguimiento del paciente con CDT: la frecuencia de una respuesta inicial excelente, de recurrencia luego de haber alcanzado esta respuesta, y la de ser considerado sin evidencia de enfermedad a largo plazo2,5-9. El Sistema de Estratificación Modificado del año 2009 de la ATA (SEM ATA 2009) redefinió la clasificación de los pacientes con riesgo bajo e intermedio de recurrencia2 y nuestro grupo fue el primero en el mundo en validar esta nueva clasificación10. Por otra parte, varios investigadores demostraron que la clasificación estática del RR inicial podría mejorarse aplicando el denominado riesgo dinámico, que resulta de adicionar al RR estático inicial, los hallazgos que aparecen en el seguimiento del paciente, lo que se denomina como riesgo dinámico6,7,10. Este riesgo dinámico adiciona: 1) los niveles de tiroglobulina (Tg) hallados luego de la cirugía11 en el momento de la ablación con radioyodo (RAI); 2) los medidos en la respuesta inicial al tratamiento bajo terapia hormonal (TH) de reemplazo, y 3) los hallazgos ecográficos, entre otras variables, las que podrían modificar la probabilidad inicial de presentar una respuesta estructural incompleta en el seguimiento2.
La evaluación de la respuesta inicial al tratamiento, usualmente entre los 6-18 meses, es una herramienta utilizada para redefinir conductas terapéuticas y de seguimiento a largo plazo, las cuales fueron ampliamente descriptas y validadas para pacientes tratados con tiroidectomía total (TT) y ablación con RAI6-9,10,12. En el año 2014, Momesso y Tuttle13 propusieron por primera vez las definiciones de respuestas al tratamiento para pacientes tratados con lobectomía y/o TT sin RAI. Sin embargo, son escasos los estudios que validan dichas respuestas en pacientes no ablacionados14.
Históricamente, en Latinoamérica, la administración de RAI fue rutinaria en todos los pacientes independientemente del RR, y recién en el año 2009, con la publicación de las guías regionales, comenzó a existir un menor uso de RAI en pacientes con microcarcinomas unifocales3. De hecho, todos los pacientes incluidos en nuestra base de datos hasta el año 2011 habían recibido RAI. Actualmente, el 15% de los pacientes de nuestra base de datos no recibió RAI luego de la TT, lo que muestra el cambio ocurrido luego de la implementación de estas guías internacionales y nacionales1,5.
Debido a la escasa bibliografía existente en relación con la validación de las respuestas al tratamiento en pacientes que recibieron TT y no fueron ablacionados14, y a la ausencia de publicaciones nacionales que muestren la evolución de pacientes de bajo riesgo/riesgo intermedio sin RAI, los objetivos de esta investigación fueron: 1) describir las características y la evolución de esta población de pacientes, y 2) validar las respuestas al tratamiento en pacientes tratados con TT sin ablación con RAI.
Pacientes y métodosSe revisaron 610 historias clínicas de pacientes de nuestra base de datos de la División Endocrinología del Hospital de Clínicas de la Universidad de Buenos Aires, desde enero del 2001 hasta octubre del 2016.
Se incluyó a pacientes mayores de 18 años, con carcinoma papilar de tiroides, que recibieron TT en centros especializados, de riesgo bajo e intermedio de recurrencia, y con un período de seguimiento mínimo de 12 meses. Para ser incluidos, adicionalmente, cada paciente debía contar con al menos dos determinaciones de Tg y anticuerpos anti-Tg (aTg). Aquellos pacientes que presentaron niveles de Tg > 5ng/ml bajo reemplazo hormonal fueron excluidos de este estudio y, posteriormente, fueron sometidos a ablación con RAI.
Evaluación y seguimientoLa evaluación luego del tratamiento inicial se realizó con la medición de Tg y aTg aproximadamente a los 30, 90 y 180 días posquirúrgicos, y posteriormente, de manera semestral. A partir del sexto mes de seguimiento, se adicionó ecografía de partes blandas de cuello con un transductor lineal de 11MHz, la cual se repitió semestralmente (fig. 1).
Medición de tiroglobulina y anticuerpos antitiroglobulinaLos valores de Tg se midieron con método quimioluminiscente (ICMA Immulite 2000, Siemens) con una sensibilidad analítica (SA) de 0,2ng/ml y una sensibilidad funcional (SF) de 0,3ng/ml, y por método electroquimioluminiscente (ICMA) Elecsys 1010 (Roche) con una SA de 0,04ng/ml y SF de 0,1ng/ml. Los ensayos para medición de aTg fueron el método electroquimioluminiscente Elecsys Anti-Tg (RSR Ltd., Pentwyn, Cardiff, UK) y el método quimioluminiscente Immulite 2000 Anti-TG Ab (Siemens). Para ambos ensayos, los valores > 20 UI/ml se consideraron positivos.
Estadificación inicialPara la clasificación de RR se utilizó el Consenso Intersocietario Argentino (CIA)5. El riesgo de mortalidad fue establecido con el Sistema de Estadificación de la American Joint Committee on Cancer/International Union against Cancer (AJCC/UICC) 7.a ed.15 (estadios TNM I, II, III, IV).
Respuesta inicial al tratamiento y al final del seguimientoPara la evaluación de la respuesta inicial al tratamiento se usaron las definiciones previamente publicadas y validadas13,14. Se definieron las respuestas como: excelente: Tg bajo TH < 0,2ng/ml o estimulada < 2ng/ml con anticuerpos aTg negativos; indeterminada: Tg bajo TH entre 0,2ng/ml y 5ng/ml, Tg estimulada entre 2 y 10ng/ml, o pacientes con niveles de aTg estables o en descenso, con hallazgos inespecíficos por imágenes; bioquímica incompleta: Tg bajo TH > 5ng/ml o estimulada > 10ng/ml, o niveles de Tg o aTg en ascenso con niveles similares de TSH, e imágenes negativas; estructural incompleta: evidencia de enfermedad locorregional o metástasis a distancia.
ResultadosSe incluyó a 113 pacientes no ablacionados que constituían el 18,5% del total de nuestra base de datos de pacientes con CDT.
El 22% de la cohorte presentó valores de Tg > 5ng/ml, por lo que se decidió RAI al evaluar el riesgo dinámico. Adicionalmente, un paciente fue excluido por recibir lobectomía como tratamiento quirúrgico inicial.
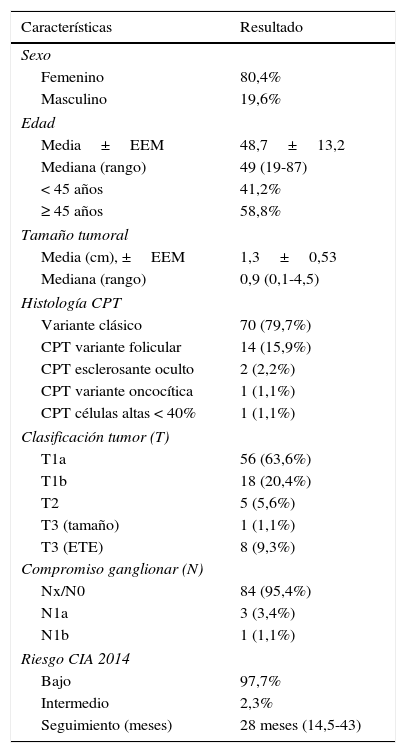
Finalmente, se incluyó a 88 pacientes en el estudio. Las características basales de estos pacientes pueden observarse en la tabla 1.
Características basales de los pacientes incluidos en el estudio
| Características | Resultado |
|---|---|
| Sexo | |
| Femenino | 80,4% |
| Masculino | 19,6% |
| Edad | |
| Media±EEM | 48,7±13,2 |
| Mediana (rango) | 49 (19-87) |
| < 45 años | 41,2% |
| ≥ 45 años | 58,8% |
| Tamaño tumoral | |
| Media (cm), ±EEM | 1,3±0,53 |
| Mediana (rango) | 0,9 (0,1-4,5) |
| Histología CPT | |
| Variante clásico | 70 (79,7%) |
| CPT variante folicular | 14 (15,9%) |
| CPT esclerosante oculto | 2 (2,2%) |
| CPT variante oncocítica | 1 (1,1%) |
| CPT células altas < 40% | 1 (1,1%) |
| Clasificación tumor (T) | |
| T1a | 56 (63,6%) |
| T1b | 18 (20,4%) |
| T2 | 5 (5,6%) |
| T3 (tamaño) | 1 (1,1%) |
| T3 (ETE) | 8 (9,3%) |
| Compromiso ganglionar (N) | |
| Nx/N0 | 84 (95,4%) |
| N1a | 3 (3,4%) |
| N1b | 1 (1,1%) |
| Riesgo CIA 2014 | |
| Bajo | 97,7% |
| Intermedio | 2,3% |
| Seguimiento (meses) | 28 meses (14,5-43) |
CIA: Consenso Intersocietario Argentino; CPT: carcinoma papilar de tiroides; EEM: error estándar de la media; ETE: extensión extratiroidea.
Además de la TT, un 16% de la cohorte recibió de manera adicional un vaciamiento ganglionar (93% central y 7% latero-cervical). El 80,4% fueron mujeres, con una edad media de 48,7±13,2 años. La media de tamaño tumoral fue de 1,3±0,53cm (mediana 0,9, rango 0,1-4,5cm).
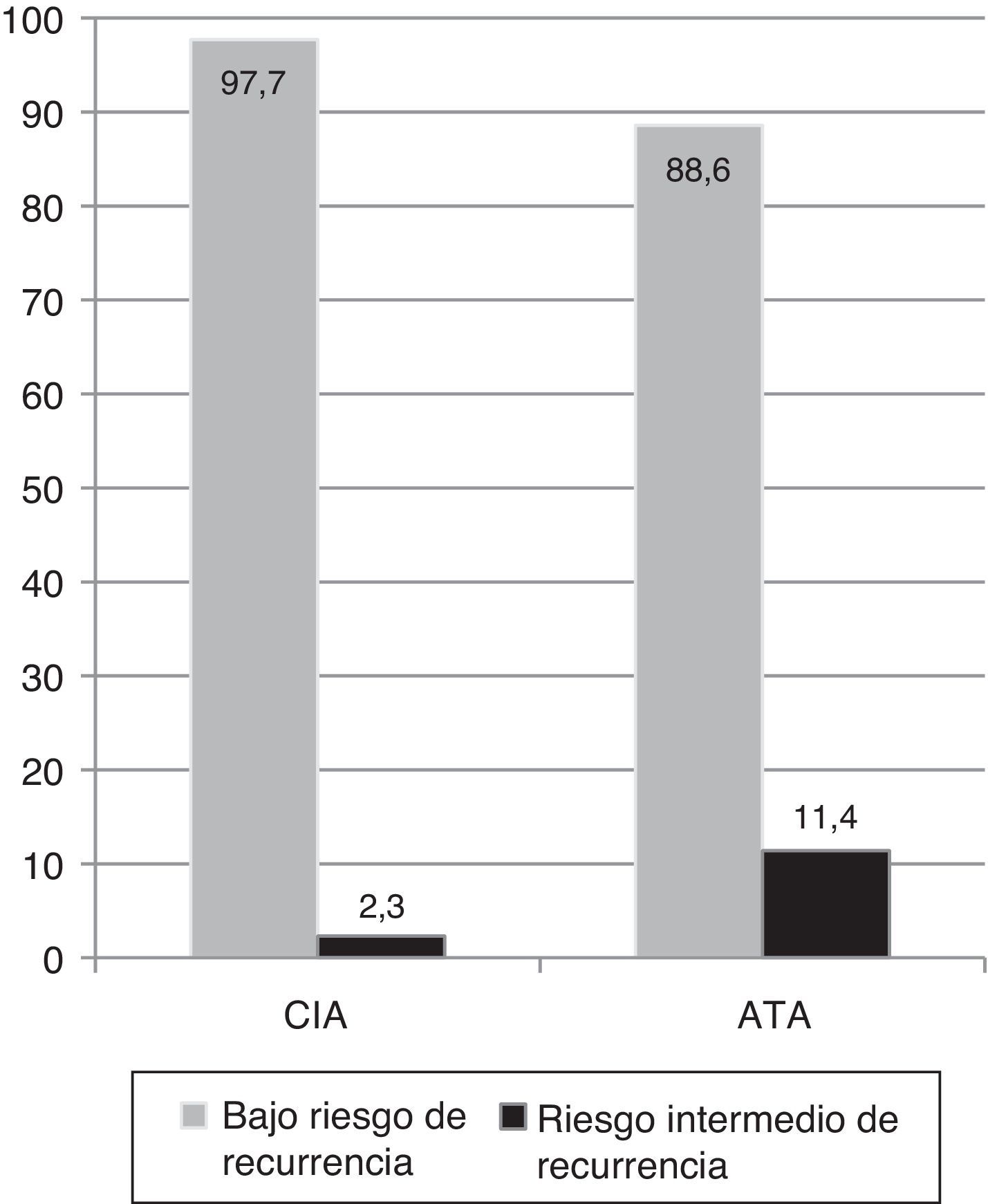
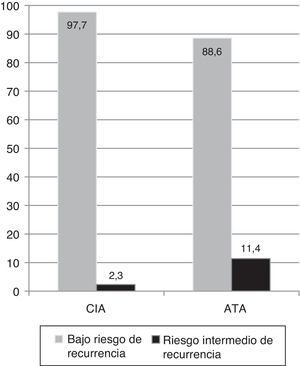
El 80% fueron carcinomas papilares variedad clásica. El 91% de los pacientes presentaron tumores intratiroideos y en el 4,5% se objetivó compromiso ganglionar. En la cohorte analizada, el 97,7% fue clasificado como de bajo riesgo y el 2,3% como de riesgo intermedio de recurrencia5.
Cuando se reclasificó a estos pacientes de acuerdo con el Sistema de Estratificación Modificado del año 2009 de la guía de la ATA, que incluye a T3 por extensión extratiroidea (ETE) mínima como riesgo intermedio, el porcentaje de este grupo ascendió al 11,4% (fig. 2).
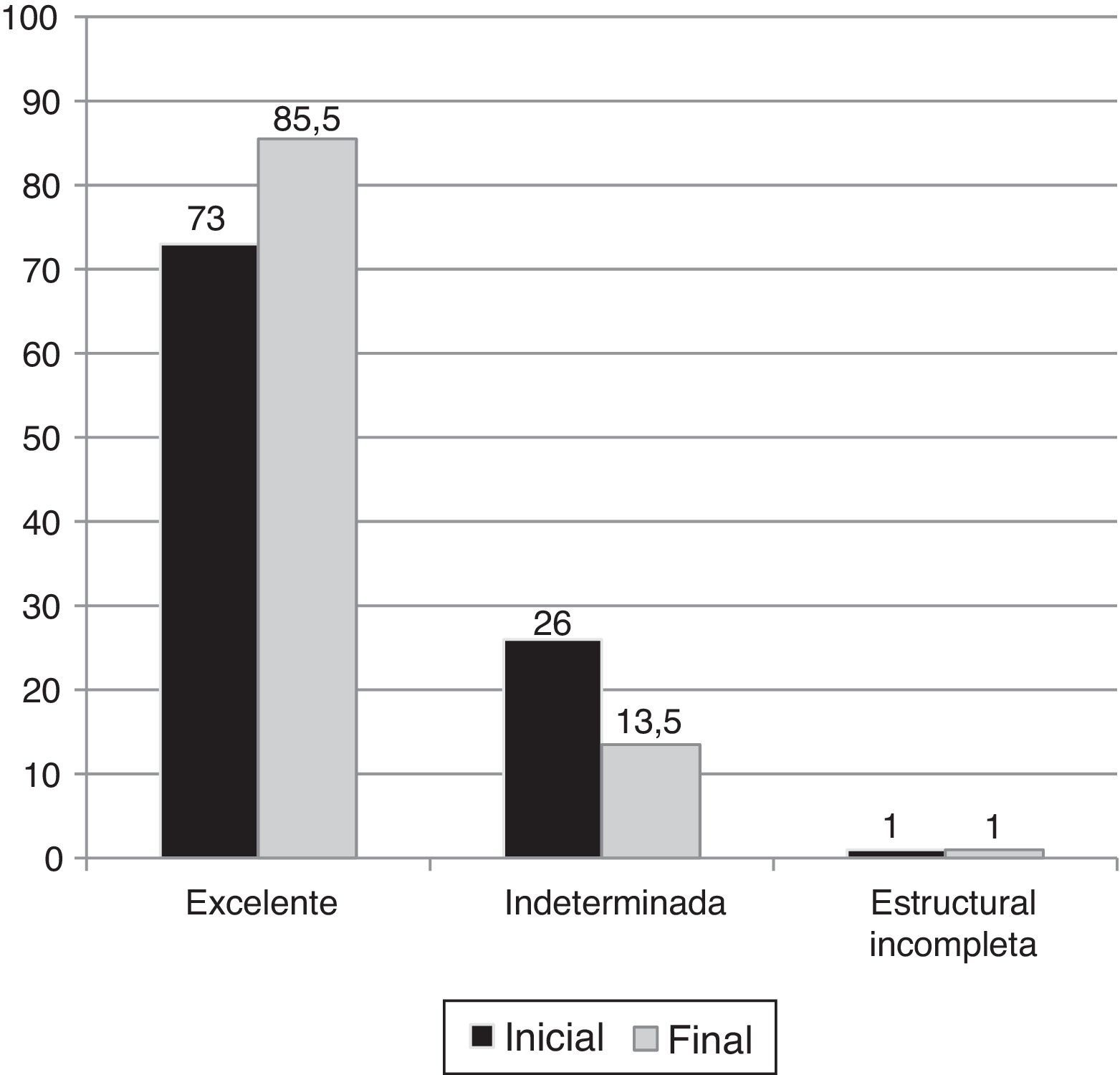
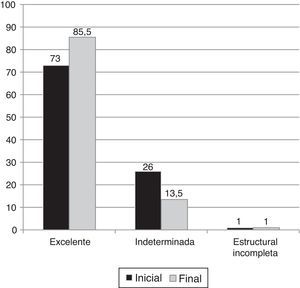
Los pacientes presentaron una respuesta inicial excelente en el 73% de los casos, con un estado sin evidencia de enfermedad del 85,5% al final del seguimiento.
Un 1% de los pacientes (n=1) presentó una respuesta inicial estructural incompleta ganglionar. Un paciente adicional (1%) presentó una respuesta estructural incompleta al final del seguimiento. Por otro lado, el 26% de los pacientes presentó una respuesta inicial indeterminada, aunque solo el 13,5% permaneció con esta respuesta al final del seguimiento (fig. 3).
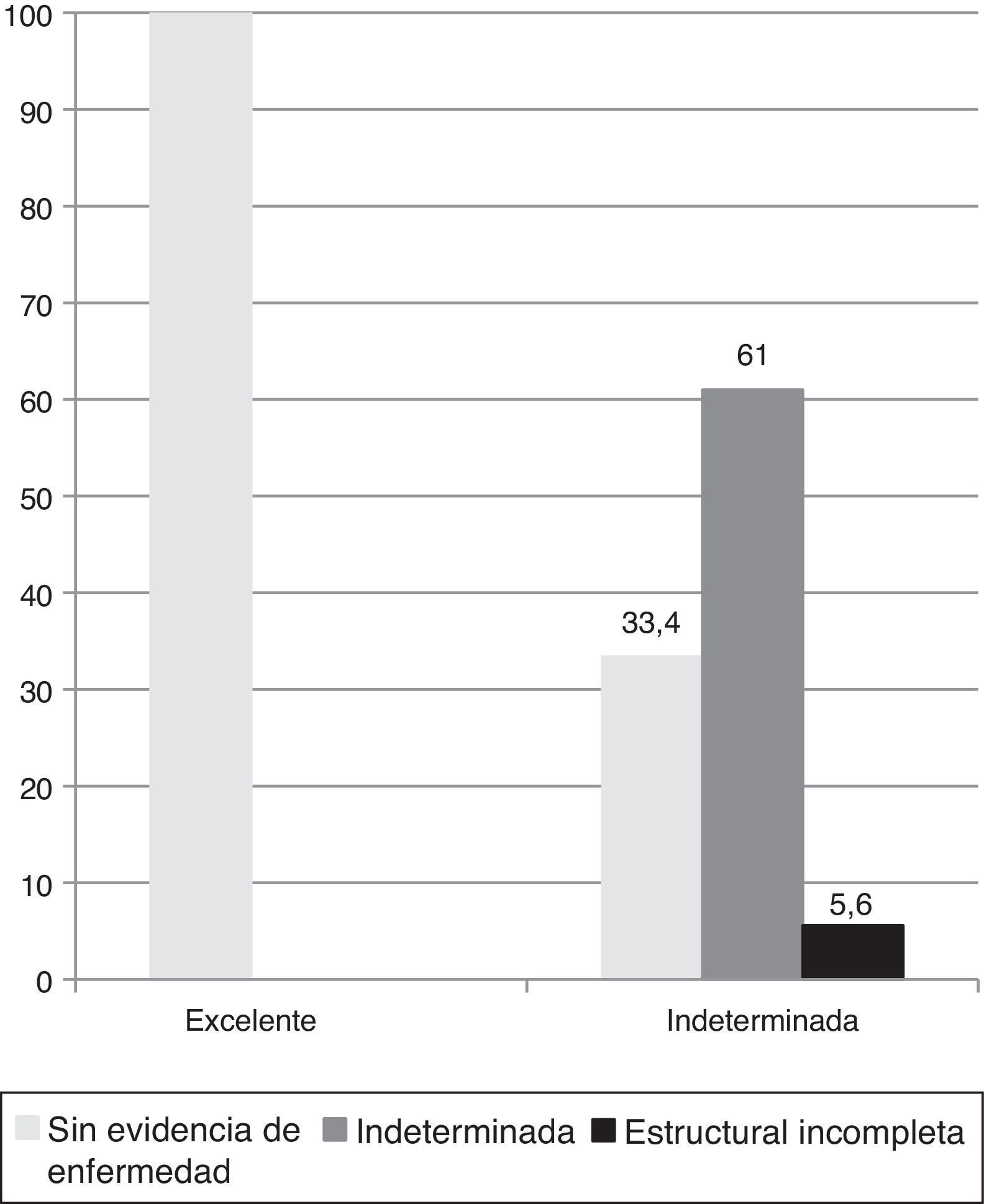
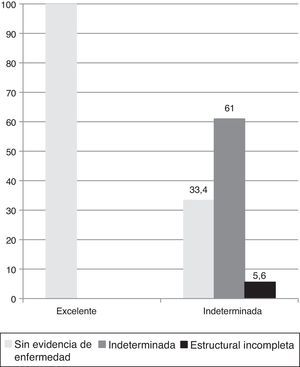
Evaluación comparativa de riesgo dinámico inicial y al final del seguimientoDurante el seguimiento, los pacientes con respuesta inicial excelente evolucionaron sin evidencia de enfermedad en el 100% de los casos (fig. 4).
Aquellos con respuesta inicial indeterminada permanecieron con esta respuesta al final del seguimiento en el 61% de los casos debido a: 1) hallazgos inespecíficos en imágenes (18%, n=2/11); 2) aTg en descenso (73%, n=8/11), y 3) niveles de Tg entre 0,2 y 5ng/ml bajo TH (9%, n=1/11). El 33,4% de los pacientes con respuesta inicial indeterminada evolucionó a un estado sin evidencia de enfermedad al final del seguimiento, debido a: 1) desaparición de hallazgos inespecíficos en imágenes (17%, n=1/6), y 2) negativización de aTg (83%, n=5/6). Un paciente con respuesta inicial indeterminada (5,6%) evolucionó con respuesta estructural incompleta ganglionar a los 12 meses (fig. 4).
Un paciente con respuesta inicial estructural incompleta recibió un vaciamiento ganglionar del compartimento central con respuesta indeterminada a los 24 meses de seguimiento.
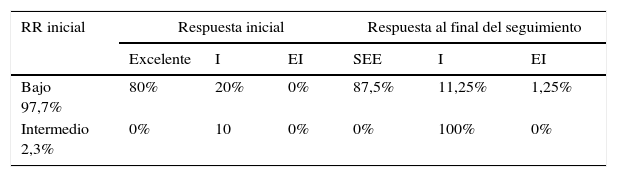
Evaluación comparativa de riesgo de recurrencia inicial y riesgo dinámicoAl evaluar el riesgo dinámico y correlacionarlo con el RR inicial, evidenciamos que en el grupo de bajo riesgo (97,5% de toda la cohorte) el 87,5% de los pacientes evolucionaron a un estado sin evidencia de enfermedad al final del seguimiento, el 11,25% con respuesta indeterminada y el 1,25% con respuesta estructural incompleta. Dos pacientes clasificados como de riesgo intermedio de recurrencia evolucionaron con una respuesta indeterminada al final del seguimiento (tabla 2).
Respuesta inicial y al final del seguimiento de acuerdo con el riesgo de recurrencia inicial en 88 pacientes no ablacionados con radioyodo incluidos en el estudio
| RR inicial | Respuesta inicial | Respuesta al final del seguimiento | ||||
|---|---|---|---|---|---|---|
| Excelente | I | EI | SEE | I | EI | |
| Bajo 97,7% | 80% | 20% | 0% | 87,5% | 11,25% | 1,25% |
| Intermedio 2,3% | 0% | 10 | 0% | 0% | 100% | 0% |
EI: estructural incompleta; I: indeterminada; RR: riesgo de recurrencia; SEE: sin evidencia de enfermedad.
Al analizar de manera separada a este grupo de pacientes, el 71,6% evolucionó a un estado sin evidencia de enfermedad al final del seguimiento y el 28,4% a una respuesta indeterminada (promedio de 24 meses de seguimiento). Los pacientes con respuesta indeterminada inicial permanecieron con esta respuesta al final del seguimiento por niveles de Tg entre 0,2 y 5ng/ml bajo TH y por hallazgos inespecíficos en imágenes. Ningún paciente de este grupo evidenció respuesta estructural incompleta al inicio ni al final del seguimiento (tabla 3).
DiscusiónLos sistemas de clasificaciones de RR (ATA, SEM ATA 2009 y CIA) estratifican de manera similar a los pacientes que recibieron TT y fueron ablacionados, en relación con las respuestas al tratamiento inicial y a largo plazo5,9,10. Aunque el SEM ATA 2009 y el CIA expanden la clasificación de bajo riesgo, incluyendo a pacientes con N1 y ubica a un mayor número de pacientes en este subgrupo, con una probabilidad de respuesta estructural incompleta estimada entre el 5-8%2. Estas cifras serían similares a las que se observan en pacientes con bajo RR de la clasificación del año 20091,10.
Las validaciones de las respuestas al tratamiento en pacientes tratados con TT y RAI demostraron que un paciente de bajo riesgo puede presentar una frecuencia de respuesta excelente al final del seguimiento entre 78-91% y estructural incompleta entre el 3-9%; y un paciente de riesgo intermedio entre 52-63% y 21-34%, respectivamente6,10.
Al analizar nuestra cohorte de pacientes de bajo RR ablacionados, el 2,9% de ellos presentó una respuesta estructural incompleta según la clasificación ATA 200912,y el 9,8% según el SEM ATA 200910 vs. el 1,2% en el grupo de pacientes no ablacionados seleccionados de acuerdo con el riesgo dinámico de recurrencia incluidos en este estudio.
Si bien la frecuencia de respuesta excelente es comparable con la de otras series de pacientes de bajo riesgo ablacionados; una reevaluación de la cohorte actual en el seguimiento a largo plazo permitirá validar estas conclusiones.
Al analizar el subgrupo de pacientes con tumores T3 por ETE, el 28,4% evolucionó con respuesta indeterminada al final del seguimiento. En pacientes ablacionados que presentan esta respuesta, es conocido que la mayoría logrará el estado «sin evidencia de enfermedad» al final del seguimiento, sin otra conducta más que la mera observación8,16. Si esta evolución es similar en pacientes no ablacionados, es una cuestión que todavía está por definirse.
Nuestra hipótesis respecto a la baja frecuencia de respuesta estructural incompleta observada en este estudio en pacientes no ablacionados, comparados con aquellos de bajo riesgo tratados con RAI, se relacionaría con la adecuada selección de los que no se beneficiarían con la radioablación en el riesgo dinámico; situación completamente diferente de nuestra cohorte histórica, que recibió ablación con RAI inmediatamente luego del tratamiento quirúrgico, independientemente del riesgo dinámico10,12.
La aplicación del riesgo dinámico de recurrencia en nuestro estudio fue una herramienta útil para predecir con mayor certeza la probabilidad de respuesta excelente al final del seguimiento, comparado con los sistemas estáticos de clasificación de RR iniciales. En la mayoría de los pacientes no ablacionados incluidos en este estudio, los niveles de Tg evolucionaron espontáneamente a valores indetectables, lo que demuestra el beneficio de la evaluación dinámica para decidir la RAI.
ConclusionesEstos datos validan la evaluación de las respuestas iniciales al tratamiento como una herramienta efectiva para definir el riesgo dinámico en pacientes con CDT tratados con TT sin ablación con RAI. Cuando estos pacientes son apropiadamente seleccionados tienen un excelente pronóstico, con una baja frecuencia de respuesta estructural incompleta en el seguimiento, inclusive menor que la de los pacientes de bajo riesgo ablacionados históricamente, cuando se consideraba solamente el RR estático inicial.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesNo existen conflictos de interés.