El embarazo es una situación fisiológica que presenta cambios endócrinos e inmunológicos. La tiroides modifica su economía para proveer suficientes hormonas a la madre y al feto. La autoinmunidad y las disfunciones tiroideas tienen alta prevalencia en mujeres en edad fértil y pueden afectar el curso de la gestación, con repercusiones clínicas adversas maternas y fetales. El objetivo de este estudio fue relacionar la proporción de gestantes eutiroideas con tirotrofina (TSH) en 2 niveles del rango de referencia (< 1,2 y entre 1,2 y 2,5 mUI/l) y anticuerpos antitiroperoxidasa (a-TPO) positivos y negativos, con la frecuencia de complicaciones en la gestación y evolución a disfunción tiroidea.
MétodosSe analizaron retrospectivamente los niveles de TSH, tiroxina libre (T4L), tiroxina total (T4) y a-TPO de mujeres eutiroideas que cursaban el primer trimestre de embarazo, 580 con a-TPO positivos (EP) y 533 a-TPO negativos (EN). Se subdividieron según sus niveles de TSH en: TSH<1,2 mUI/l EP1-EN1 y TSH entre 1,2 y 2,5 mUI/l EP2-EN2. Se registraron complicaciones obstétrico-fetales: aborto espontáneo, muerte intraútero, parto pretérmino y disfunciones tiroideas durante la gestación y el posparto.
ResultadosLa TSH fue mayor en EP con respecto a EN (X¯±DS; 1,57±0,82 vs. 1,16±0,54 mUI/l, p=0,001). Los niveles séricos de T4L y T4 fueron similares en ambos grupos. De la subpoblación EP, el 63% fue incluida en EP1 y el 37% en EP2, y en EN el 80% en EN1 y el 20% en EN2. Se observó un incremento significativo (p=0,001) en las complicaciones en EP (22%) vs. EN (10%). En mujeres EP con y sin aborto espontáneo, la TSH (X¯±DS) fue 1,65±0,67 vs. 0,99± 0,77 mUI/l (p=0, 014). Las mujeres EP con y sin parto prematuro presentaron niveles de TSH (X¯±DS) 1,63±0,70 vs. 1,15±0,53 mUI/l (p = 0,012). En el grupo EN, el nivel de TSH (X¯±DS) para las mujeres con y sin aborto fue 1,45±0,61 vs. 0,85± 0,66 mUI/l (p=0,001), mientras que en mujeres con y sin parto prematuro la TSH (X¯±DS) fue 1,59±0,71 vs. 0,83±0,64 mUI/l (p=0,001), respectivamente. Sin embargo, no hubo diferencias entre los niveles promedio de TSH encontrados en aborto vs. parto pretérmino en ambos grupos. En EP, 32 mujeres y 19 en EN desarrollaron hipotiroidismo en el curso del embarazo (ns) y 29 en EP y 10 en EN tiroiditis posparto (p=0,005).
ConclusiónLa autoinmunidad tiroidea y los mayores niveles de TSH dentro del rango de referencia en mujeres en primer trimestre de embarazo estarían asociados a complicaciones en el transcurso de la gestación y desarrollo de disfunción tiroidea posparto.
Pregnancy is a physiological state presenting with endocrine and immunological changes. The thyroid gland modifies its output in order to provide enough hormones to the mother and foetus. Thyroid autoimmunity and thyroid dysfunction are prevalent in women of childbearing age and may affect the course of gestation and having maternal and foetal clinical consequences. The purpose of the present study was to establish the relationship between euthyroid pregnant women with thyrotropin (TSH) at two levels of the reference range (< 1.2 and between 1.2 and 2.5 mIU/L), and positive or negative anti-thyroid peroxidase autoantibodies (TPO Ab) with the frequency of pregnancy complications and the development of thyroid dysfunction.
MethodsA retrospective study of euthyroid women in their first trimester of pregnancy was performed. TSH, free thyroxine (FT4), total thyroxine (T4), and TPOAb values were analysed. A total of 580 women had positive TPOAb (EP group), and 533 women had negative TPOAb (EN group). The EP and EN groups were subdivided according to TSH levels into EP1: positive TPOAb and TSH<1.2, and EP2: positive TPOAb and TSH between 1.2 and 2.5 mIU/L. Maternal and foetal complications, such as miscarriage, intrauterine death, preterm delivery, and thyroid dysfunction during pregnancy and postpartum were taken into account.
ResultsTSH values were higher in EP group vs EN group (X¯±SD; 1.57±0.82 vs 1.16±0.54 mIU/L, P=.01). FT4 and T4 values were similar in both groups. Out of the pregnant women in the EP group, 63% were included in EP1, and 37% in EP2. In the EN group, 80% of women were included in EN1 and 20% in EN2. A significant (P=.001) increase in pregnancy complications in EP group (22%) vs EN (10%) was observed. In the EP group, TSH levels were: 1.65±0.67 vs 0.99± 0.77 (X¯±SD) mIU/L (P=.014) respectively, in women with and without miscarriage. TSH levels were 1.63±0.70 vs 1.15±0.53 (X¯±SD) mIU/L (P=.012), respectively, in women with and without preterm delivery. In the EN group TSH levels were: 1.45±0.61 vs 0.85± 0.66 (X¯±SD) mIU/L (P=.001), respectively, in women with and without miscarriage. TSH levels were 1.59±0.71 vs 0.83±0.64 (X¯±SD) mIU/L (P=.001), respectively, in women with and without preterm delivery. However, TSH levels in miscarriage and preterm delivery were similar. Thirty-two EP, and 19 EN women developed hypothyroidism in pregnancy (ns), and 29 EP and 10 EN women developed post-partum thyroiditis (P=.005).
ConclusionThyroid autoimmunity and higher TSH levels within the reference range during the first trimester of pregnancy were associated with pregnancy complications and with the development of thyroid postpartum dysfunction.
Durante el embarazo, la tiroides modifica su economía para proveer suficientes hormonas a la madre y al feto. La iododeficiencia y la presencia de autoinmunidad tiroidea son los principales condicionantes para lograr un adecuado incremento en la producción de tiroxina (T4) que satisfaga el aumento de la demanda1,2. Los anticuerpos antitiroideos no reflejan el status funcional tiroideo, aunque están relacionados con baja reserva tiroidea, mayor probabilidad de desarrollar hipotiroidismo durante el embarazo y disfunción tiroidea en el posparto. Mujeres eutiroideas con autoinmunidad tiroidea positiva tienen mayor riesgo de presentar abortos y partos prematuros3-7.
Por tal motivo, nos propusimos establecer la frecuencia de complicaciones durante la gestación, de progresión a hipotiroidismo durante el embarazo y de disfunción tiroidea posparto en gestantes eutiroideas con tirotrofina (TSH) en 2 niveles del rango de referencia y presencia o ausencia de autoinmunidad tiroidea.
Materiales y métodosSe realizó un estudio transversal y retrospectivo en la Cátedra de Endocrinología de la Facultad de Ciencias Exactas de la UNLP que involucró a Centros de Salud de atención pública y privada de la ciudad de La Plata. Entre 2004 y 2014, se recolectaron los datos de embarazadas que consultaron en Servicios de Ginecología y Obstetricia de la ciudad de La Plata en forma temprana en primer trimestre sin diagnóstico de patología aguda o crónica previa documentada y con factores de riesgo que hizo sospechar de posible disfunción tiroidea y que habitan en un área iodo suficiente. Los criterios de inclusión fueron la edad de las mujeres (entre 18 y 32 años), con embarazo único, logrado en forma espontánea y eutiroideas en el primer control bioquímico realizado. El tiempo de seguimiento de las mujeres en estudio fue de 18 meses desde el inicio del embarazo con la finalidad de registrar complicaciones en la gestante y disfunción tiroidea en el embarazo y el posparto. Se tomó al menos una muestra por trimestre durante la gestación.
Se seleccionó a 580 gestantes del primer trimestre, con autoanticuerpos antitiroperoxidasa (a-TPO) positivos (EP) y 533 con anticuerpos negativos (EN) sin patología tiroidea clínica o subclínica en el momento del estudio, sin antecedentes de hipotiroidismo o hipertiroidismo tratado, ni de autoinmunidad tiroidea evidenciada en controles previos. La edad gestacional (EG) fue la documentada en las historias clínicas. La estimación de la EG fue hecha teniendo en cuenta la fecha de la última menstruación (FUM) en aquellas mujeres con ciclos de 28 días y por estimación ecográfica en aquellas sin ciclos de 28 días o FUM incierta.
Se subdividieron en 2 grupos de acuerdo con los niveles de TSH (mUI/l) ≤ a 1,2 EP1 y EN1 y>a 1,2 y < 2,5 EP2 y EN2. Las muestras de sangre venosa fueron tomadas en ayunas, entre las 7 y las 9 de la mañana.
La TSH (CV intra e interensayo: 5,9 y 6,1%), la tiroxina libre (T4L) (CV intra e interensayo: 6,5 y 7,3%) y la T4 (CV intra e interensayo: 6,2 y 7,1%) fueron medidas en equipos automatizados con detección de señal por quimioluminiscencia (Access, Beckman). La medida de a-TPO se realizó con diferentes metodologías de inmunoensayos a lo largo de estos 10 años: RSR-TR (CV intra e interensayo: 11,2 y 13,1%), competitivo en fase sólida manual con señal radiactiva; Immulite DPC (CV intra e interensayo: 10,5 y 13,0%), inmunométrico en fase sólida, automatizado con señal quimioluminiscente y vidas de Biomérieux (CV intra e interensayo: 7,5 y 8,1%), competitivo automatizado con señal fluorescente.
El rango normal usado para TSH en cada trimestre de gestación fue el recomendado por las guías internacionales7 para el primer trimestre: 0,10 a 2,50 mUI/l, segundo: 0,20 a 3,00 mUI/l, y tercero: 0,30 a 3,00 mUI/L. Los rangos de referencia utilizados en el primer, el segundo y el tercer trimestres para T4L fueron 0,80 a 1,80ng/dl. Para T4: 4,50 a 9,50 en el primer y 6,80 a 14,30μg/dl en el segundo y el tercer trimestre de gestación. El cutt-off para los a-TPO fue el sugerido por el fabricante del equipo utilizado: 8,0 U/l (RSR-TR), 35 UI/ml (IMMULITE) y 8,0 UI/ml (Vidas de BIOMÉRIEUX).
Se registraron las siguientes complicaciones: aborto espontáneo (pérdida del embarazo antes de las 22 semanas de EG), muerte intraútero (fallecimiento producido en útero partir de la semana 20 hasta el parto) y parto pretérmino (alumbramiento entre la semana 24 y la 37 de gestación).
Para la clasificación de las disfunciones tiroideas durante el embarazo y el posparto se utilizó la guía de la Asociación Americana de Tiroides (ATA)7. Las patologías tiroideas consideradas fueron hipotiroidismo subclínico y clínico, hipertiroidismo autoinmune (enfermedad de Graves) y tiroiditis posparto (TPP). Hipotiroidismo subclínico se definió con TSH entre 2,5 y 10,0 mUI/l y niveles de T4L normales. Hipotiroidismo clínico se consideró con TSH elevadas (> 2,5 mUI/l) en conjunto con una disminución de los niveles de T4L o con TSH de 10,0 mUI/l o más, independiente del nivel de T4L.
El hipertiroidismo autoinmune se confirmó con la presencia de concentraciones séricas de TSH suprimidas o indetectables y concentraciones elevadas de T4L o T4 en presencia de anticuerpos antirreceptor de TSH (TRAB). Se consideró TPP a la manifestación de disfunción tiroidea en el primer año posparto en mujeres eutiroideas durante el embarazo. Las diferentes formas de presentación de TPP son forma clásica, tirotoxicosis aislada o hipotiroidismo aislado. Para hacer diagnóstico diferencial de la tirotoxicosis con la enfermedad de Graves se midieron los TRAB.
El tratamiento estadístico de los datos fue realizado con el programa Graph Pad Prism versión 5.0 para Windows (GraphPad software, San Diego, CA, EE. UU.). Los resultados para las variables cuantitativas se expresaron como valores promedios±desviación estándar (X¯±DS) y mediana para TSH y rango intercuartílico. Para comparar el grupo de gestantes con anticuerpos positivos vs. negativos y los subgrupos de acuerdo con el nivel de TSH se utilizó el test T no paramétrico y Mann-Whitney para variables sin distribución gaussiana o paramétrico según fuera apropiado. Las comparaciones de variables cualitativas fueron analizadas con el test exacto de Fisher. La correlación entre las variables fue evaluada por un test no paramétrico (Spearman). Se consideró diferencia significativa p<0,05.
Este estudio fue evaluado y aprobado para su realización por el Comité de Ética del Instituto Médico Mater Dei de la ciudad de La Plata.
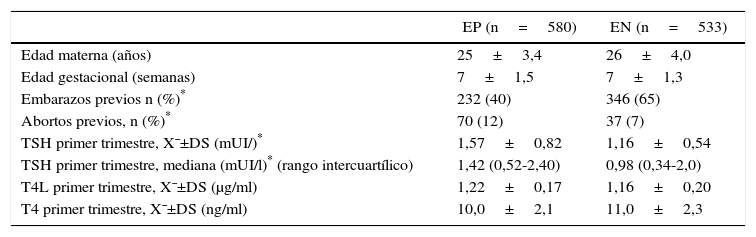
ResultadosLas mujeres en el primer trimestre de gestación fueron 580 con autoanticuerpos a-TPO EP y 533 con a-TPO EN con similar distribución etaria y tiempo de gestación al momento de la consulta ginecológica y toma de la primera muestra. En la tabla 1 se resumen las características de la población. En las mujeres seleccionadas, el nivel medio de TSH fue significativamente mayor en EP respecto de EN (X¯±DS; 1,57±0,82 vs. 1,16±0,54 mUI/l, p=0,01). En cambio, no hubo diferencias entre las medias de T4L y T4 en ambos grupos. La diferencia entre el número de gestantes con embarazos y abortos espontáneos previos en ambos grupos fue significativa.
Características clínicas de las gestantes con a-TPO positivos y negativos. Perfil hormonal y edad gestacional expresado como valor medio ± desviación estándar, mediana y rango intercuartílico para TSH, al momento de comenzar el estudio
| EP (n=580) | EN (n=533) | |
|---|---|---|
| Edad materna (años) | 25±3,4 | 26±4,0 |
| Edad gestacional (semanas) | 7±1,5 | 7±1,3 |
| Embarazos previos n (%)* | 232 (40) | 346 (65) |
| Abortos previos, n (%)* | 70 (12) | 37 (7) |
| TSH primer trimestre, X¯±DS (mUI/)* | 1,57±0,82 | 1,16±0,54 |
| TSH primer trimestre, mediana (mUI/l)* (rango intercuartílico) | 1,42 (0,52-2,40) | 0,98 (0,34-2,0) |
| T4L primer trimestre, X¯±DS (μg/ml) | 1,22±0,17 | 1,16±0,20 |
| T4 primer trimestre, X¯±DS (ng/ml) | 10,0±2,1 | 11,0±2,3 |
EN: gestantes a-TPO negativos; EP: gestantes a-TPO positivos; X ± DS: valor medio ± desviación estándar.
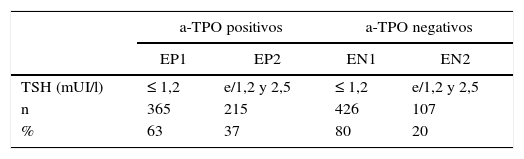
Se observó diferencia (p=0,01) en la distribución de las gestantes con el valor de corte para TSH en 1,2 mUI/l. En EP el 63% (365/580) de las mujeres se ubicaron en EP1 y el 37% (215/580) en EP2, y en EN el 80% (426/533) pertenecía a EN1 y el 20% (107/533) a EN2 (tabla 2).
Distribución del número y porcentaje de gestantes en primer trimestre con a-TPO positivos y a-TPO negativo según los niveles de TSH
| a-TPO positivos | a-TPO negativos | |||
|---|---|---|---|---|
| EP1 | EP2 | EN1 | EN2 | |
| TSH (mUI/l) | ≤ 1,2 | e/1,2 y 2,5 | ≤ 1,2 | e/1,2 y 2,5 |
| n | 365 | 215 | 426 | 107 |
| % | 63 | 37 | 80 | 20 |
EN: gestantes a-TPO negativos; EP: gestantes a-TPO positivos.
EP1 y EN1 con TSH <1,2; EP2 y EN2 con TSH entre 1,2 y 2,5 (mUI/l).
p=0,01.
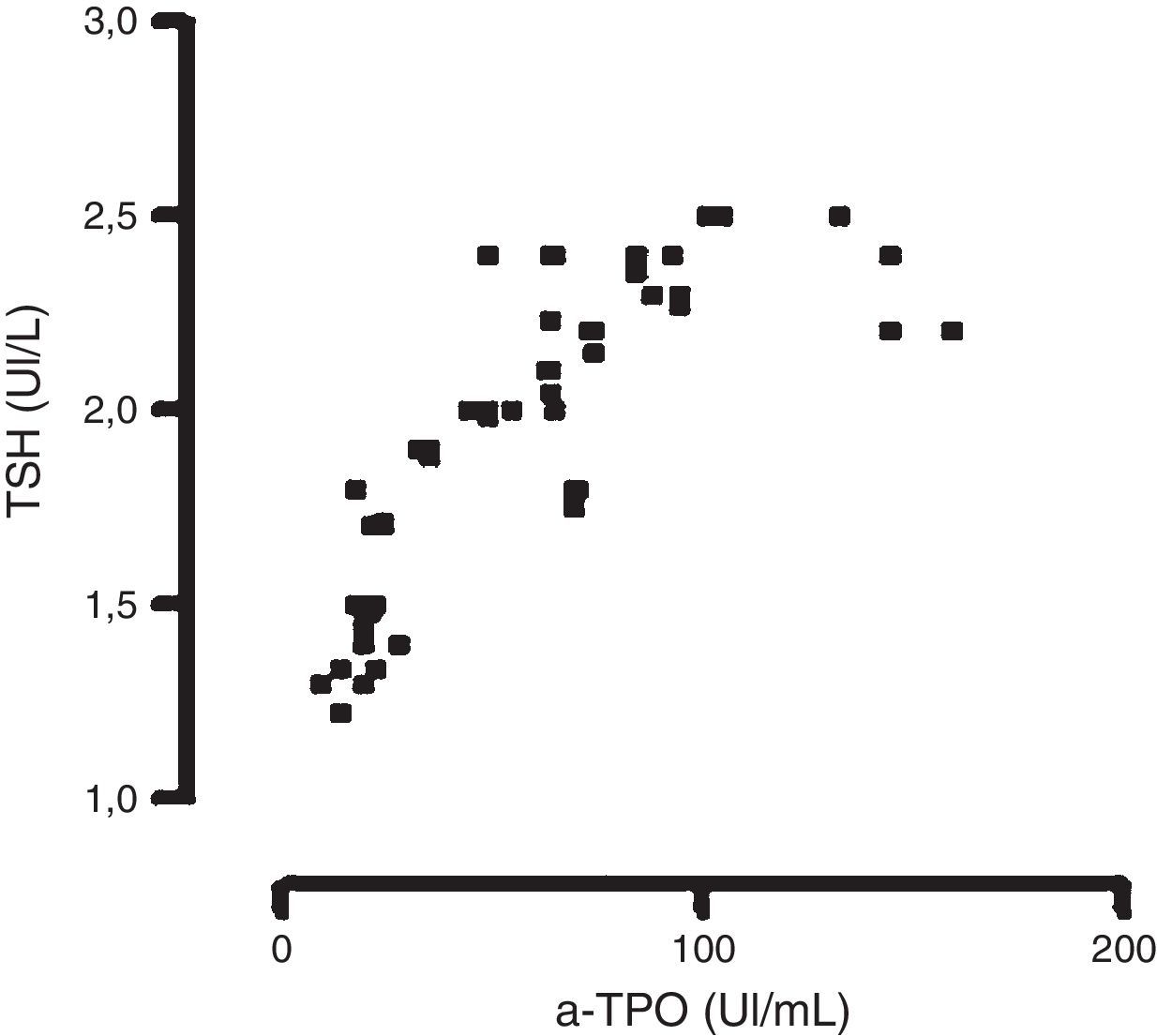
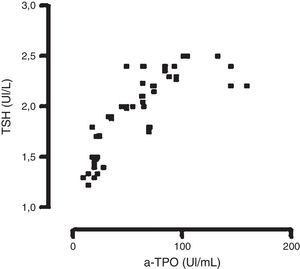
Únicamente pudo observarse una correlación significativa entre los niveles de TSH y los de a-TPO en las mujeres incluidas en el grupo EP2, para la metodología en fase sólida manual con señal radiactiva (n=65) r = 0,707; con señal quimioluminiscente (n=60) r = 0,779 y por fluorescencia (n=90) r=0,810 (fig. 1); test de Spearman (p<0,05).
Las complicaciones obstétricas y fetales registradas durante el curso de la gestación fueron aborto espontáneo, muerte intraútero y parto pretérmino (tabla 3). En el grupo EP se constataron complicaciones en el 22% (126/580) y en EN en el 10% (54/533) de las mujeres, p=0,001. En el primer grupo, 87 mujeres de 580 y en el segundo 39 de 533 presentaron aborto espontáneo (p=0,001). La ocurrencia de parto pretérmino, se observó en 35 mujeres en EP y en 13 del grupo EN (p=0,031). En cambio, no hubo diferencias en el número de mujeres con muerte intraútero.
Complicaciones obstétrico-fetales registradas en gestantes primer trimestre con a-TPO positivos y negativos, en número y porcentaje
| EP (n=580) | EN (n=533) | p | |
|---|---|---|---|
| Aborto espontáneo, n (%) | 87 (15) | 39 (7,3) | 0,001 |
| Muerte intraútero, n (%) | 4 (0,7) | 2 (0,4) | 0,688 |
| Parto pretérmino, n (%) | 35 (6,0) | 13 (2,4) | 0,031 |
EN: gestantes a-TPO negativos; EP: gestantes a-TPO positivos.
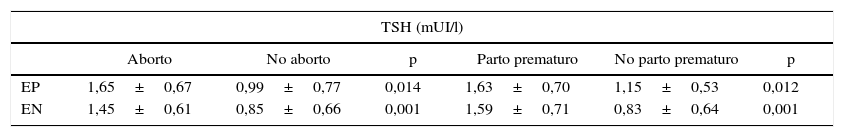
Con respecto a TSH (tabla 4), el valor medio en mujeres EP y EN con complicaciones en la gestación fue mayor que en ausencia de complicaciones. En EP, el nivel medio de TSH (mUI/l) para las mujeres con y sin aborto espontáneo fue 1,65±0,67 vs. 0,99±0,77 (p=0,014). El promedio de TSH (mUI/l) en EP con y sin parto pretérmino fue 1,63±0,70 vs. 1,15±0,53 (p=0,012). En el grupo EN, el nivel de TSH (mUI/l) para las mujeres con y sin aborto fue 1,45±0,61 vs. 0,85±0,66 (p=0,001), mientras que el promedio de TSH con y sin parto prematuro fue 1,59±0,71 vs. 0,83±0,64 (p=0,001). Sin embargo, no hubo diferencias entre los niveles promedio de TSH encontrados en aborto vs. parto pretérmino. No incluimos los niveles de TSH en muerte intraútero por ser muy escaso el número de mujeres que presentaron esta complicación. Además, no mostraron diferencias los niveles promedio de TSH en mujeres abortadoras y las con parto pretérmino EN vs. EP.
Niveles promedio ± desviación estándar de TSH en gestantes de primer trimestre con a-TPO positivos y negativos con/sin aborto y con/sin parto prematuro durante el embarazo en estudio
| TSH (mUI/l) | ||||||
|---|---|---|---|---|---|---|
| Aborto | No aborto | p | Parto prematuro | No parto prematuro | p | |
| EP | 1,65±0,67 | 0,99±0,77 | 0,014 | 1,63±0,70 | 1,15±0,53 | 0,012 |
| EN | 1,45±0,61 | 0,85±0,66 | 0,001 | 1,59±0,71 | 0,83±0,64 | 0,001 |
EN: gestantes a-TPO negativos; EP: gestantes a-TPO positivos.
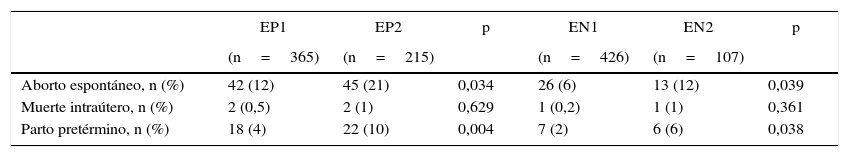
Cuando se analizaron los registros por subgrupo, comparando las mujeres por nivel de TSH, se observó un 16% de complicaciones en EP1 vs. 32% en EP2 (p = 0,001) y un 8% en EN1 vs. 19% en EN2 (p=0,001). EP1 y EN1 corresponden a niveles de TSH menores a 1,2 y EP2 y EN2 a TSH entre 1,2 y 2,5 mUI/l. En la tabla 5 se describe el número de pacientes (%) para cada complicación en los diferentes subgrupos.
Complicaciones obstétrico-fetales registradas en mujeres a-TPO positivos y negativos según niveles de TSH, en número y porcentaje
| EP1 | EP2 | p | EN1 | EN2 | p | |
|---|---|---|---|---|---|---|
| (n=365) | (n=215) | (n=426) | (n=107) | |||
| Aborto espontáneo, n (%) | 42 (12) | 45 (21) | 0,034 | 26 (6) | 13 (12) | 0,039 |
| Muerte intraútero, n (%) | 2 (0,5) | 2 (1) | 0,629 | 1 (0,2) | 1 (1) | 0,361 |
| Parto pretérmino, n (%) | 18 (4) | 22 (10) | 0,004 | 7 (2) | 6 (6) | 0,038 |
EN: gestantes a-TPO negativos; EP: gestantes a-TPO positivos.
EP1 y EN1, TSH < 1,2 y EP2 y EN2, TSH entre 1,2 y 2,5 mUI/l.
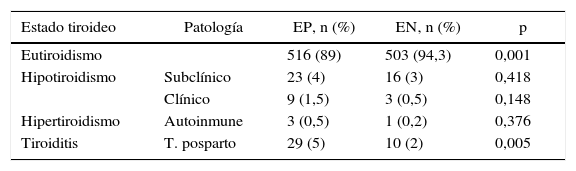
Se registró la disfunción tiroidea en las mujeres durante el embarazo y el posparto. El 89% de EP y el 94,3% de EN se mantuvieron eutiroideas durante ambos períodos. Únicamente se observaron diferencias significativas en el desarrollo de TPP, 29 mujeres en EP vs. 10 en EN (tabla 6). En las mujeres con dicha disfunción, el nivel de TSH inicial (al comienzo del estudio) fue mayor a 1,2 mUI/l en el 80% de EP y en el 85% de EN.
Distribución del número y porcentaje de embarazadas que desarrollaron enfermedad tiroidea durante la gestación y posparto con a-TPO positivos (n=580) y negativos (n=533)
| Estado tiroideo | Patología | EP, n (%) | EN, n (%) | p |
|---|---|---|---|---|
| Eutiroidismo | 516 (89) | 503 (94,3) | 0,001 | |
| Hipotiroidismo | Subclínico | 23 (4) | 16 (3) | 0,418 |
| Clínico | 9 (1,5) | 3 (0,5) | 0,148 | |
| Hipertiroidismo | Autoinmune | 3 (0,5) | 1 (0,2) | 0,376 |
| Tiroiditis | T. posparto | 29 (5) | 10 (2) | 0,005 |
EN: gestantes a-TPO negativos; EP: gestantes a-TPO positivos.
En concordancia con la literatura, el presente estudio en mujeres eutiroideas en primer trimestre de embarazo demuestra, en primer lugar, que la autoinmunidad tiroidea se manifiesta con un incremento en los niveles de TSH y en las complicaciones obstétrico-fetales. En segundo lugar, que la frecuencia de estas complicaciones está asociada a los niveles de TSH. Y en tercer lugar, que en presencia de autoanticuerpos antitiroideos (a-TPO) se observa una mayor prevalencia de disfunción tiroidea en el embarazo y posparto.
Abalovich et al. (2010) hacen referencia a la relevancia de alcanzar una concentración ideal de TSH preconcepción en mujeres hipotiroideas en tratamiento con levotiroxina a fin de no requerir incrementos en la dosis de reemplazo intraembarazo8. Partimos de ese valor ideal de TSH como nivel de corte (1,2 mUI/l) para analizar la distribución de gestantes eutiroideas con y sin a-TPO positivo (EP y EN).
Al respecto, pudimos comprobar que las mujeres a-TPO positivo mostraban valores de TSH más elevados en relación a las mujeres con a-TPO negativos. A su vez, una mayor proporción de mujeres con a-TPO positivo tenían valores de TSH entre 1,2 y 2,5 mUI/l. Esta observación podría indicar una baja reserva tiroidea cuando aumenta la demanda de hormonas tiroideas en el embarazo. No obstante, las concentraciones de T4L y T4 fueron similares en ambos grupos, a diferencia de lo observado por Negro et al.9. En concordancia con nuestros resultados, la mediana de TSH en el primer trimestre de gestación en 1.211 mujeres a-TPO fue significativamente mayor que en 8.351 mujeres a-TPO negativos, 1,64 mIU/l vs. 1,00 mIU/l10. En coincidencia, Haddow et al.11 muestran que la exclusión de mujeres con autoanticuerpos positivos en el primer y el segundo trimestre de embarazo reduce el límite superior del rango de TSH.
Por otra parte, varios metaanálisis que evalúan el riesgo de aborto en mujeres eutiroideas con autoinmunidad tiroidea refieren que la diferencia en la media de TSH (mUI/l) entre mujeres con anticuerpos positivos y negativos fue 0,81±0,5812, 0,6113 y 0,51 (IC del 95%, 0,14-0,88)14. En nuestro caso, fue 0,41 mUI/l. Esta menor diferencia que observamos podría atribuirse a que solo evaluamos a-TPO y algunos de los casos negativos podrían ser positivos si además de a-TPO hubiéramos medido anticuerpos antitiroglobulina.
En relación con las complicaciones obstétrico-fetales comprobamos un incremento de aborto espontáneo en mujeres eutiroideas con a-TPO positivos, Negro et al. reportaron una alta incidencia de abortos en mujeres con anticuerpos positivos15. Dos metaanálisis recientes evaluaron el riesgo de presentar aborto espontáneo en mujeres con autoinmunidad tiroidea positiva. Thangaratinam et al.14 observaron una OR de 3,9 cuando se analizaron 19 estudios de cohorte y una OR de 1,8 en los 12 estudios caso-control. Una clara asociación entre autoinmunidad tiroidea y aborto también fue observada en el metaanálisis realizado por Chen y Hu, en el que se estimó una OR de 2,55 en 8 estudios caso-control y un riesgo relativo de 2,31 en 14 estudios de cohorte13. De Vivo et al. confirmaron la alta incidencia de autoinmunidad en mujeres que abortan a una EG muy temprana16.
Por otra parte, también observamos un aumento significativo de partos prematuros en mujeres eutiroideas con a-TPO positivos. En concordancia, Negro et al. reportaron un 4,5% de partos muy pretérmino (< 34 semanas) en mujeres eutiroideas con a-TPO positivos vs. 1,8% en mujeres a-TPO negativas, diferencia estadísticamente significativa17.
Un metaanálisis de estudios prospectivos que incluyó a 35.467 embarazadas mostró que la presencia de a-TPO resultaba en un aumento significativo de partos prematuros18. En contraposición, un estudio reciente en mujeres eutiroideas de la India refiere un aumento no significativo de la frecuencia de parto muy pretérmino en mujeres con a-TPO positivos19. La presencia de autoanticuerpos en mujeres con función tiroidea normal podría estar asociada a una deficiencia sutil en la disponibilidad de hormonas tiroideas o a una baja capacidad de la glándula tiroides para responder a la demanda requerida en la gestación. Además, se ha indicado que los autoanticuerpos podrían ser indicadores de un estado autoinmune global con efectos adversos sobre la placenta y el desarrollo fetal12. Si bien es clara la asociación entre anticuerpos tiroideos y complicaciones obstétrico-fetales, no necesariamente indican evidencia de causalidad19.
En el presente estudio, los niveles de TSH iniciales, aunque dentro del rango normal, fueron significativamente más elevados en mujeres con complicaciones obstétrico-fetales. Además, se constató una relación directa entre los niveles de TSH (en 2 rangos,>1,2 y entre 1,2 y 2,5 mUI/l) con la frecuencia de aborto y parto pretérmino tanto en gestantes con a-TPO positivos como negativos. De igual modo, en mujeres holandesas sin patología tiroidea, el riesgo incrementado de aborto y muerte fetal y neonatal también se correspondió con TSH más elevada6. Sin embargo, otros autores proponen que las complicaciones no serían causadas directamente por las concentraciones más elevadas de TSH, sino que reflejarían una menor capacidad de la glándula para responder a la demanda hormonal durante el embarazo20. Es claro, no obstante, que las hormonas tiroideas maternas desempeñan un papel importante en mantener el embarazo viable en los estadios tempranos de la gestación.
Ashoor et al. compararon a mujeres que presentaron pérdida fetal con aquellas que tuvieron embarazos normales y concluyen que la inapropiada función tiroidea podría predisponer a aborto o muerte fetal, aunque no encuentran relación con la positividad de anticuerpos antitiroideos entre ambos grupos21. Como referimos previamente, nuestro estudio indica que el riesgo de abortos se relaciona tanto con los niveles de TSH como con la presencia de autoanticuerpos a-TPO. En concordancia con nuestros resultados, un estudio en mujeres gestantes revela mayor riesgo de aborto en embarazadas a-TPO positivos y en aquellas con mayores niveles de TSH22.
En este trabajo observamos que un grupo de mujeres embarazadas eutiroideas con a-TPO positivos evolucionaron a disfunción tiroidea durante el embarazo y en el posparto. Se ha reportado que la incidencia relativa de hipotiroidismo clínico y subclínico en el embarazo es de aproximadamente el 0,4 y el 3,0%, respectivamente, mientras que la enfermedad tiroidea autoinmune oscila entre el 5 y el 20%23. En nuestro estudio en gestantes eutiroideas con a-TPO positivos encontramos un 4% de hipotiroidismo subclínico y un 1,5% de hipotiroidismo clínico. En cambio, en las que tenían a-TPO negativos dicha frecuencia fue del 3 y el 0,5%, respectivamente.
Según Lazarus et al., el hipertiroidismo se manifiesta en el 0,2% de las embarazadas y la causa más común es el hipertiroidismo de Graves24. En el presente estudio, se registraron 3 casos de hipertiroidismo en mujeres con anticuerpos positivos y un caso con autoanticuerpos negativos. Como puede observarse, no hay diferencias significativas. En realidad, el 88% de mujeres en EP y el 94% en EN se mantuvieron eutiroideas. En cambio, sí se manifiesta la diferencia en la TPP en las pacientes con autoinmunidad tiroidea. La TPP es la disfunción tiroidea más común en esa etapa y puede presentarse como hiper o hipotiroidismo. La fase hipertiroidea es causada por destrucción autoinmune de la glándula. Según Lazarus et al., la presencia de a-TPO en el embarazo temprano conlleva un 50% de riesgo de desarrollar disfunción tiroidea posparto24. Soldin propone la determinación de anticuerpos antitiroideos en el embarazo temprano debido a que más de un tercio de las mujeres eutiroideas con autoanticuerpos positivos evolucionará a TPP25.
El hipotirodismo subclínico y clínico ha sido asociado con efectos adversos en el embarazo y el desarrollo fetal. Estas condiciones materno-fetales adversas provocan un riesgo aumentado de parto pretérmino, bajo peso al nacer y aumentos en morbimortalidad perinatal26. Un estudio en mujeres embarazadas con hipotiroidismo subclínico y clínico pone de manifiesto que la dosis adecuada de reemplazo hormonal con levotiroxina durante la gestación minimiza los riesgos de aborto, parto prematuro y muerte fetal independientemente de la severidad del hipotiroidismo27. El hipertiroidismo, aunque menos común que el hipotiroidismo, tiene potenciales efectos adversos en la madre y el feto.
Nuestro estudio presenta algunas limitaciones; en primer lugar, no fueron medidos los anticuerpos antitiroglobulina como marcador de autoinmunidad tiroidea y el número de pacientes con embarazos y abortos espontáneos previos en los grupos de gestantes no fue tenido en cuenta en los criterios de selección. Una diferencia que encontramos respecto de varios autores en relación con nuestro trabajo es el valor de corte utilizado para la positividad de los autoanticuerpos a-TPO, nuestro cutt-off fue el sugerido por el fabricante y más bajo que en los demás trabajos referidos.
La fortaleza de este trabajo es que el número de gestantes con autoanticuerpos positivos es comparable con el de embarazadas con anticuerpos negativos y la distribución de edades fue muy similar entre ambos grupos.
En resumen, concluimos que en mujeres gestantes en primer trimestre, la presencia de autoanticuerpos se asocia a incrementos en los efectos adversos en el embarazo y posparto. Además, que estas complicaciones estarían relacionadas con los niveles de TSH en las primeras semanas de la gestación.
Son necesarios más estudios para revelar los mecanismos por los cuales la autoinmunidad tiroidea afecta la evolución del embarazo y la posible relación de los niveles de TSH con las complicaciones obstétrico-fetales en el estado eutiroideo.
Responsabilidades éticasProtección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos. Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no poseer conflictos de interés.