La presencia de metástasis a distancia en el cáncer diferenciado de tiroides es un hecho infrecuente que ocurre en menos del 10% de los pacientes. Cuando sucede, la supervivencia a 10 años disminuye significativamente. La curación es el objetivo primario, pero dado que 2 tercios de los tumores metastásicos se volverán radiorrefractarios en su evolución, la finalidad terapéutica es estabilizar la enfermedad y tratar sus síntomas. En la última década, el manejo de estos pacientes cambió radicalmente con el advenimiento de las terapias con blancos moleculares. El objetivo de esta revisión es describir las características de los pacientes con cáncer diferenciado de tiroides que presenten metástasis a distancia, la supervivencia global, los métodos diagnósticos utilizados, y los tratamientos locales y sistémicos disponibles.
Distant metastases occur in less than 10% of patients with differentiated thyroid carcinoma. In these patients, overall survival at 10 years is considerably reduced. Whereas cure is the initial goal of treatment, stabilisation of the disease and management of symptoms have become the primary objective in many patients with persistent radio-iodine refractory progressive disease. In the last decade, several targeted therapies have shown encouraging results in patients with advanced disease. The objective of this review is to describe the characteristics, diagnosis, overall survival, and the local and systemic available treatments for patients with distant metastases from differentiated thyroid cancer.
El cáncer diferenciado de tiroides (CDT) es la neoplasia endocrina maligna más común y constituye un 1-2% de todos los cánceres. La mayoría de los pacientes se presenta con enfermedad localizada cervical, con un pronóstico excelente y una sobrevida mayor al 97% a 10 años1. Sin embargo, un subgrupo de pacientes (menos del 10%) presentará metástasis a distancia; 2 tercios de ellos se volverán refractarios al tratamiento con iodo radiactivo2, con disminución considerable de la supervivencia. En promedio, luego del diagnóstico de radiorrefractariedad, la supervivencia es del 25-40% a los 5 años y de menos del 10% tras 10 años de seguimiento2,3.
Cuando aparecen metástasis a distancia radiorrefractarias, las posibilidades de remisión completa son escasas con el tratamiento estándar (0-30%)3,4. Entonces, el objetivo terapéutico es evitar o enlentecer la progresión de la enfermedad y tratar los síntomas que se generen. En los últimos años, el tratamiento de estos pacientes presentó un cambio radical con el advenimiento de las terapias con blancos moleculares denominados inhibidores multicinasas (IMK). Justamente, uno de los principales dilemas actuales es dilucidar cuándo iniciarlo, ya que implica modificar la calidad de vida del paciente en pos de enlentecer la progresión de la enfermedad, sin saber a ciencia cierta si esto tendrá impacto en la supervivencia global5.
Presentación y manifestaciones clínicasEn la mitad de los casos, las metástasis a distancia de los tumores diferenciados de tiroides se encuentran presentes en el momento del diagnóstico (metástasis sincrónicas) y en el resto se diagnosticarán en el seguimiento, luego de los 6 meses del diagnóstico del tumor tiroideo (metástasis metacrónicas). Solamente un 15% aparecerá luego de 10 años del diagnóstico3,6,7. Las metástasis sistémicas son más frecuentes en pacientes con tumores de gran tamaño y extensión local, y se presentan de manera muy infrecuente (menos del 1%) en pacientes con microcarcinomas.
El mecanismo molecular exacto que predispone a la diseminación de la enfermedad a distancia se desconoce8,9. Las localizaciones más frecuentes son: pulmones (50%), huesos (25%), ambos (20%) y, con mucha menor frecuencia, otros sitios como cerebro, hígado y piel (3-5%)3,6,10,11. También se reportaron metástasis raras en otros sitios12.
Las metástasis pulmonares son generalmente asintomáticas. Cuando aparecen síntomas como dolor torácico, disnea, tos y hemoptisis, en general, se tratará de metástasis voluminosas o en pacientes con compromiso bronquial o pleural, de desarrollo tardío6.
Las metástasis óseas son generalmente lesiones múltiples y osteolíticas, localizadas en esqueleto axial, costillas, pelvis, huesos largos, esternón y base de cráneo13,14. Hasta el 85% de los pacientes con metástasis óseas presentará dolor, inflamación o complicaciones ortopédicas3,6. En un estudio retrospectivo, Farooki et al.15 encontraron que 2 tercios de los pacientes presentó eventos esqueléticos dentro del año del diagnóstico de las metástasis óseas. La incidencia de fracturas patológicas fue del 13%, siendo la más frecuente el aplastamiento vertebral. La presencia de compresión medular, entre aquellos con metástasis en columna vertebral, ocurrió en el 28% de los pacientes. En un estudio retrospectivo y multicéntrico del Departamento de Tiroides de la Sociedad Argentina de Endocrinología y Metabolismo, que incluyó a 47 pacientes con metástasis óseas, se demostró que la principal manifestación fue el dolor en el sitio metastásico (70%). En su mayoría fueron lesiones múltiples (68%) y la localización más frecuente fue vertebral (36%). Los marcadores de remodelado óseo estuvieron elevados en el 29% de los pacientes, sin hipercalcemia en los pacientes evaluados16. Por otro lado, la presencia de hipercalcemia maligna generada por metástasis óseas de tumores tiroideos ocurre en menos del 3% de los estudios publicados6,15,16.
Los pacientes con metástasis cerebrales pueden evidenciar síntomas neurológicos, aunque la mayoría son asintomáticos11. Las metástasis cutáneas pueden observarse en pacientes con enfermedad avanzada y extensamente diseminada, en forma de lesiones únicas o múltiples, asintomáticas17.
Evaluación diagnósticaAntes de describir los métodos diagnósticos que se emplean para la detección de metástasis a distancia, es importante enfatizar que el hallazgo de estas lesiones se realiza, habitualmente, en el contexto de un cáncer de tiroides conocido. Cuando el escenario se invierte, es decir, cuando se encuentran lesiones óseas o pulmonares en un paciente con un nódulo tiroideo, el médico debe sospechar el diagnóstico de cáncer de tiroides, descartando antes otras posibilidades. Debe tenerse en cuenta que las metástasis a distancia en el cáncer de tiroides son infrecuentes y en muy pocas ocasiones generarán el síntoma inicial que llevará a su diagnóstico. Por otra parte, los nódulos tiroideos son muy frecuentes (prevalencia 30-50%) y solo el 5-10% de ellos serán malignos. Por ello, se requerirá realizar una biopsia de las lesiones metastásicas para demostrar su origen tiroideo, antes de proceder a tratamientos agresivos9. Del mismo modo, el descubrimiento de lesiones secundarias en pacientes en seguimiento por un cáncer de tiroides, cuando los niveles de tiroglobulina (Tg) y anticuerpos antitiroglobulina (aTg) son bajos o indetectables y el rastreo corporal total con 131I (RCT) no muestra captación, debe poner en duda el origen tiroideo y se debe considerar la realización de una biopsia para confirmar o descartar la procedencia tiroidea9.
Medición de niveles de Tg séricaLa producción de Tg se mantiene en casi todos los pacientes con CDT y es un marcador sensible y específico para detectar una recurrencia de enfermedad9,18. Los pacientes con metástasis a distancia que no presenten interferencias en el dosaje de Tg tendrán, casi siempre, niveles detectables o elevados de Tg durante el tratamiento supresivo con levotiroxina. El hallazgo de Tg indetectable bajo terapia hormonal es muy infrecuente y puede asociarse con el hallazgo de micronódulos pulmonares o con variantes histológicas pobremente diferenciadas, incapaces de sintetizarla, a pesar de gran extensión de la enfermedad3,6,19,20. La determinación de Tg luego del estímulo de tirotrofina (TSH), tanto posterior a la suspensión de la terapia con levotiroxina o al uso de TSH recombinante humana (TSHrh), aumenta la sensibilidad para la detección de tejido neoplásico, hallándose valores habitualmente mayores a 10ng/ml en el contexto de metástasis a distancia. Los valores de Tg tras suspensión de levotiroxina son generalmente mayores a los encontrados después de TSHrh21.
Los niveles de Tg son, generalmente, más elevados en pacientes con carcinoma de estirpe histológica folicular, comparados con los carcinomas papilares. También serán más elevados en el caso de metástasis óseas comparadas con las pulmonares aisladas y en pacientes con lesiones pulmonares macronodulares vs. las micronodulillares19,20.
Durante et al. analizó a 444 pacientes con metástasis a distancia3. A 174 pacientes se les realizó medición de Tg en el momento del diagnóstico de enfermedad diseminada; el 97% presentó Tg detectables bajo tratamiento con levotiroxina y solo el 3% (n=5) tuvo Tg indetectable. De los 211 pacientes en quienes se obtuvo determinación de Tg con suspensión del tratamiento con levotiroxina, todos tuvieron Tg elevada, el 97% > 10ng/ml y el 3% entre 5-9ng/ml3. Recientemente, Miyauchi et al. han demostrado que el tiempo de duplicación de Tg menor a un año es predictor de metástasis a distancia y se relaciona con un mayor riesgo de morir a causa de la enfermedad22. En los pacientes que presenten niveles elevados de Tg, sin evidencia de enfermedad localizada en cuello, deberán solicitarse estudios adicionales con el fin de detectar lesiones a distancia, especialmente cuando se observa una tendencia a incrementarse en el tiempo9.
Métodos por imágenesRastreo corporal total con radioyodoLuego de una dosis ablativa o terapéutica de 131I, está indicado realizar siempre un rastreo a los 5-7 días, debido a que entre el 10 y el 26% de los pacientes pueden presentar focos adicionales de enfermedad, que modifican la estadificación inicial23. El rastreo diagnóstico tiene una baja sensibilidad, por lo que solo está indicado en situaciones puntuales9.
Tomografía computarizada, resonancia nuclear magnética y centellograma óseoLa TAC de tórax es el método más sensible para el diagnóstico de lesiones pulmonares, ya que es capaz de detectar micronódulos de hasta 2mm18. Las metástasis óseas son en general osteolíticas puras, por lo que en el centellograma óseo puede verse disminución o solo moderado aumento de la captación, y han sido reportados un gran porcentaje de falsos positivos24. El compromiso óseo, así como su extensión hacia los tejidos circundantes, se visualiza mejor con tomografía por emisión de positrones con 18 flúor-desoxi-glucosa (18FDG PET/CT), RNM o TAC25. La RM es el método de elección para metástasis cerebrales, óseas o hepáticas. La TAC o RM de cerebro o abdomen deben considerarse en pacientes con Tg elevada e imágenes de cuello y tórax normales, o en aquellos que presenten síntomas referidos a esos órganos9.
18FDG PET-CTLa Asociación Americana de Tiroides (ATA, por sus siglas en inglés) recomienda la realización de 18FDG-PET CT en pacientes con CDT de alto riesgo o en aquellos con Tg elevada que presenten RCT 131I negativo. En estos pacientes, ha demostrado una sensibilidad del 83% (50-100%) y una especificidad del 84% (42-100%). Debe considerarse también en la estadificación inicial de cánceres pobremente diferenciados y carcinomas de células de Hürthle invasivos, o en aquellos con metástasis a distancia ya conocidas, para determinar el pronóstico y para evaluar la respuesta al tratamiento, en caso de utilizar terapias sistémicas. En aquellos pacientes que presenten Tg estimuladas menores de 10ng/ml, la sensibilidad de la PET-CT es baja (menos del 30%), por lo que se aconseja su utilización principalmente en pacientes con niveles de Tg estimulada ≥ 10ng/ml, aunque no existe un punto de corte de Tg que determine en quiénes debe realizarse este estudio26,27. Es importante tener en cuenta que los tumores poco diferenciados podrían no secretar Tg, por lo que, al igual que los pacientes con aTg positivos, tendrían Tg bajas o indetectables.
La sensibilidad de la PET-CT aumenta poco al realizarse luego del estímulo con TSH y su relevancia clínica no es clara. Tampoco hay estudios que demuestren mejoría del valor pronóstico del método al realizarse tras el estímulo9. Una mención aparte merecen aquellos pacientes con aTg positivos, en quienes después de 3-5 años de la tiroidectomía total persisten con niveles positivos o ascendentes. Existen varios trabajos que indican la utilidad del 18FDG PET-CT, aunque por el momento no existe una indicación clara para su uso en este contexto9,28. La captación tumoral de 18FDG es un factor predictivo negativo para la respuesta al tratamiento con 131I y también es un indicador pronóstico de agresividad tumoral y de supervivencia29,30.
BiopsiaEs importante asegurarse del origen tiroideo de lesiones a distancia, en particular en aquellos pacientes con lesiones metastásicas a distancia asociadas a niveles de Tg bajos o indetectables por la presencia de ATG, o cuando la localización o características de las metástasis no sean las habituales para un cáncer de tiroides9.
Pronóstico y supervivenciaLa tasa de supervivencia global desde el momento de detección de las metástasis a distancia es de 40-47% a 10 años6,7,9,20. Sin embrago, la supervivencia será variable según las características del paciente:
1. Captación de yodo: en pacientes con captación de 131I es del 56-69% a 10 años, mientras que en aquellos con ausencia de captación es de solo 10-38%3,31.
2. Localización de metástasis a distancia: pacientes con metástasis de localización únicamente pulmonar tienen un mejor pronóstico comparados con los que tienen metástasis en otros sitios32,33. La supervivencia a 10 años en estos varía del 42 al 85%, mientras que cuando existen metástasis óseas es de solo el 13-21%13,20,32,34. Cuando aparecen metástasis cerebrales, la supervivencia, en general, es de un año35.
3. Edad y características de las metástasis: la supervivencia a 10 años fue del 95% en pacientes<40 años en el momento del diagnóstico, con metástasis pulmonares micronodulillares; fue del 14% en > 40 años con metástasis macronodulares o metástasis óseas múltiples, y del 64% en > 40 años con metástasis micronodulillares o < 40 años con metástasis macronodulares3. Los factores pronósticos se muestran en la tabla 1.
Factores pronósticos del CDT con metástasis a distancia
| Factor | Favorable | Desfavorable |
|---|---|---|
| Edad6,7,10,31,32,34 | < 45 | > 45 |
| Captación 131I3,31 | Captación pulmonar difusa bilateral | Pulmonar focal o ausente |
| 18FDG PET-CT26,27,30 | Negativo o bajo SUV | Alta captación |
| Localización3,20 | Única pulmonar u ósea | Múltiples |
| Tamaño de las lesiones3,7,10,20,32 | No visible o micronódulos (<1cm) en pulmón, u óseas sin correlato en imágenes | Macronódulos pulmonares (>1cm) visibles por imágenes en hueso |
| Tg estimulada al diagnóstico de M161 | < 400ng/ml | > 400ng/ml |
| Histología7,10,33 | Papilar | Folicular o pobremente diferenciado |
Tg: tiroglobulina.
La TSH desempeña un papel fundamental en la regulación del crecimiento y proliferación de la célula tiroidea36. Es por esto que la terapia supresiva con levotiroxina podría enlentecer el crecimiento de tumores TSH-dependientes36. El nivel óptimo de TSH es controvertido, pero en los pacientes con alto riesgo de recurrencia se recomienda mantenerla por debajo de 0,1 mUI/l9. Se discute si una supresión menor podría dar beneficios superiores, aunque este valor de TSH se asoció a mejores resultados clínicos en un estudio aislado37. La terapia supresiva no está exenta de efectos adversos (EA) y se vincula con exacerbación de cardiopatía isquémica, aumento del riesgo de fibrilación auricular en pacientes añosos y una mayor frecuencia de osteoporosis en mujeres posmenopáusicas38. Por estos motivos, debe evaluarse el beneficio vs. el riesgo que conlleva el hipertiroidismo subclínico según la situación clínica de cada paciente en particular9.
RadioyodoLos objetivos del tratamiento con yodo radiactivo en los pacientes con metástasis a distancia son: curación, disminución de la tasa de recurrencia o paliativo. Desafortunadamente, la literatura existente sobre la efectividad del 131I en lograr estos objetivos es controvertida. En primer lugar, no existen estudios prospectivos que demuestren que el tratamiento con yodo radiactivo mejore la supervivencia, disminuya las recurrencias o tenga efectos paliativos importantes. En segundo lugar, a pesar de que hay varios estudios retrospectivos disponibles, son muy heterogéneos y los resultados son contradictorios4. De todas formas, el 131I es el tratamiento más utilizado para el tratamiento del cáncer de tiroides avanzado metastásico9. La preparación correcta antes del tratamiento con radioyodo consiste en la suspensión del tratamiento con levotiroxina durante 3 a 4 semanas para lograr un nivel arbitrario de TSH > 30 mUI/l, asociado a una dieta con bajo contenido en yodo por 1-2 semanas. Los pacientes que presenten metástasis cerebrales o en la columna vertebral, con riesgo de compresión medular, deben recibir tratamiento con corticoides previo a la dosis de 131I9. La utilización de TSHrh no está aprobada para la utilización en pacientes con metástasis a distancia. De todas formas, puede considerarse en pacientes seleccionados que presenten enfermedades clínicas o psiquiátricas graves que podrían exacerbarse al inducir el hipotiroidismo o en pacientes con hipopituitarismo, incapaces de elevar la TSH9.
El tratamiento con 131I se repetirá cada 6-12 meses, según el caso, hasta la negativización del RCT posdosis o hasta que el paciente se considere refractario9.
La eficacia al tratamiento radiactivo se evalúa con parámetros funcionales (Tg sérica y porcentaje de captación de 131I en el RCT posdosis) y anatómicos (evaluación del volumen tumoral) a través de imágenes, utilizando los criterios RECIST 1.139. Las respuestas favorables se caracterizan por disminución paralela en el tamaño tumoral, la captación de 131I y los niveles de Tg. En cambio, una disminución o ausencia en la captación de 131I, sin una disminución análoga en el volumen tumoral, implica la ausencia de células tumorales bien diferenciadas, que conservaban la capacidad de captar 131I y la persistencia de células poco diferenciadas que, probablemente, van a progresar. Estos pacientes se consideran radiorrefractarios, por lo que continuar con el tratamiento con 131I será inefectivo2. De los 444 pacientes con metástasis por CDT en el estudio de Durante et al.3, el 70% presentó inicialmente lesiones que captaron 131I, y de estos, el 42% logró una respuesta completa al tratamiento con radioyodo con la desaparición total de las lesiones en las imágenes. En este trabajo, finalmente, el 29% del total de pacientes logró curación con el tratamiento con yodo radiactivo 3. La probabilidad de responder al tratamiento con 131I dependerá de varios factores: será mayor en pacientes jóvenes (< 40-45 años), con metástasis pulmonares micronodulares o miliariformes, histología de estirpe papilar, y ausencia de captación de 18FDG en la PET-CT3,6,20,29,32,34,40. Por otro lado, las metástasis óseas que presentan correlato estructural en las imágenes, excepcionalmente responden al tratamiento con radioyodo, pero muchos pacientes se beneficiarán presentando mejoría sintomática, estabilización de las lesiones o respuestas parciales13. Algunos pacientes con lesiones óseas pequeñas pueden responder al tratamiento con radioyodo41. La tabla 2 muestra la probabilidad de respuesta al tratamiento con 131I, según la localización de las metástasis4.
Probabilidad de respuesta al tratamiento con 131I
| Localización | Alta probabilidad | Baja probabilidad |
|---|---|---|
| Pulmonar | Captación 131I difusa micronodular o sin correlato tomográfico PET-FDG18 negativo. Edad < 40 años | Captación focal 131I o ausente macronodular PET-FDG18 positivo. Edad > 40 años |
| Ósea | Captación 131I pequeñas, escaso número | Ausencia de captación. Extensas, múltiples |
| Cerebral | Adyuvante y paliativo, escasa respuesta | En general |
| Otras | No hay datos | No hay datos |
Dos tercios de los pacientes con metástasis a distancia dejarán de responder al tratamiento con radioyodo en algún momento de su evolución2. Luego del diagnóstico de radiorrefractariedad, la expectativa de vida es de 3 a 5 años2,3. Se considerarán refractarios aquellos pacientes que presenten2,9,21:
Enfermedad metastásica que no capta131I desde el momento de la dosis ablativa.
Pérdida de la habilidad de captar yodo radiactivo en lesiones que antes eran ávidas.
Algunas lesiones captan yodo pero otras no42.
Metástasis que progresan a pesar de presentar gran avidez por131I luego de 12 a 16 meses de una dosis terapéutica adecuada de yodo.
Ausencia de curación luego de dosis acumuladas ≥ 600 mCi de131I: solo se evidencia curación en alrededor del 4% con dosis superiores3,6,32,34. Como consecuencia, la probabilidad de obtener algún beneficio con el suministro de dosis terapéuticas mayores es muy baja y la frecuencia de eventos adversos aumenta en forma considerable3,9,34,43.
Intensa captación de18FDG en PET/CT: la posibilidad de obtener curación es muy baja en estos pacientes26,29,30.
Enfermedad avanzada no pasible de tratamiento quirúrgico: cuando el tumor tiroideo no puede ser resecado, el paciente se considera radiorrefractario. Esto es debido a que, al encontrarse in situ la glándula tiroides, las metástasis a distancia no responderán al tratamiento con radioyodo21.
Tratamientos localesCirugíaLa cirugía paliativa será necesaria cuando las metástasis óseas produzcan o tengan alto riesgo de complicaciones ortopédicas o neurológicas. Debe considerarse con fines curativos cuando la lesión es única o en pocos sitios. Desafortunadamente, lo habitual es que las metástasis óseas sean múltiples y la resección completa de las mismas sea imposible13. En el caso de metástasis cerebrales únicas o pocas y accesibles, la cirugía es la primera opción35,44,45. En general, las metástasis pulmonares son múltiples, por lo que su resección no obtendrá curación, pero a veces retrasará el inicio de los síntomas3,6.
Ablación térmicaLa ablación térmica (por radiofrecuencia o crioablación) es una alternativa válida a la cirugía en algunos pacientes con metástasis óseas, pulmonares o hepáticas. Es un procedimiento menos agresivo y su eficacia evaluada con 18FDG PET/CT resultó ser similar al tratamiento quirúrgico46-48.
Radioterapia externaSe recomienda para el tratamiento de lesiones que no sean abordables quirúrgicamente ni por ablación térmica, incluyendo enfermedad residual grosera en cuello o tumores que invadan el tracto aéreo-digestivo, metástasis óseas o cerebrales. Además, puede combinarse con otras modalidades, en caso de ser necesario9. En lo referido a metástasis óseas, se utiliza este tratamiento para paliar el dolor y para estabilizar estructuras óseas críticas, como la columna vertebral o la base del cráneo, con el objetivo de prevenir compresiones nerviosas. En estudios retrospectivos, hasta el 80% de los pacientes alcanzó alivio sintomático total o parcial13,25.
En cuanto a metástasis cerebrales, la cirugía continúa siendo el tratamiento de elección. Sin embargo, la radioterapia estereotáxica es adecuada en lesiones irresecables o como terapia adyuvante luego de la resección quirúrgica11,44,45.
Tratamientos sistémicosFármacos antirresortivosBifosfonatos: existen pocos estudios que evalúen específicamente el uso de estos fármacos en pacientes con metástasis óseas por CDT. Pamidronato (PMD) 90mg en infusión lenta (durante 2 h) de manera mensual durante un año demostró disminución del dolor, mejoría en el performance status y calidad de vida de los pacientes y, además, 2 pacientes tuvieron respuestas parciales > 50%49. Por otro lado, el ácido zoledrónico 4mg en infusión lenta (durante 15 min) mensual, durante un tiempo promedio de 14 a 16 meses disminuyó significativamente la frecuencia de eventos esqueléticos (compresión medular, hipercalcemia o fracturas patológicas) que fue del 50% en los que no recibieron AZ al 14% en los que sí lo hicieron (p=0,007). Además, retrasó el tiempo de inicio de estas complicaciones: a los 3 años el 86% de los pacientes tratados continuaba libre de complicaciones, mientras que la mitad de los pacientes no tratados ya habían presentado alguna complicación (p=0,002). En ninguno de estos estudios se evidenció disminución de la masa tumoral50,51.
Denosumab: aunque todavía no existen estudios específicos en CDT, este potente anticuerpo monoclonal inhibidor de RANK-ligando ha demostrado retrasar la aparición de complicaciones esqueléticas y mejorar los síntomas con igual o incluso mayor eficacia que los bifosfonatos, en pacientes con metástasis óseas secundarias a otros tumores sólidos9. La dosis empleada es de 120mg, vía subcutánea, cada 4 semanas.
La guía de la Sociedad Americana de Tiroides recomienda iniciar tratamiento con fármacos antirresortivos en pacientes con metástasis óseas múltiples progresivas y/o sintomáticas, preferentemente con ácido zoledrónico administrado cada 3 meses9. No existe consenso sobre cuánto tiempo se debe continuar con este tratamiento.
Quimioterapia citotóxicaEn la actualidad, esta modalidad terapéutica no se recomienda en ninguna guía de manejo de pacientes con CDT9,23,52.
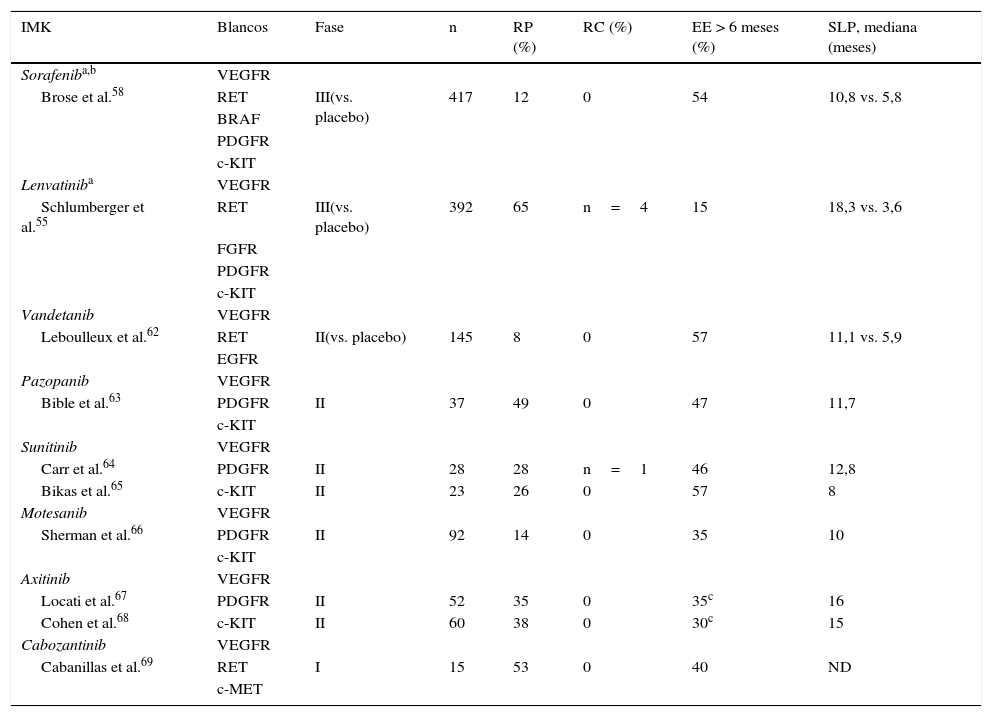
Inhibidores multicinasasTodos los IMK se unen a distintos receptores con diferente afinidad, pero comparten el mismo mecanismo de acción: inhibición competitiva del sitio de unión del ATP en el dominio catalítico del receptor, bloqueando de esta manera las cascadas de señalización intracelular. Casi todos los IMK utilizados en CDT tienen múltiples blancos, pero la mayoría actúa sobre VEGFR, bloqueando principalmente la angiogénesis tumoral. En una publicación realizada recientemente por nuestro equipo se aborda extensamente sobre el manejo de estos fármacos en la práctica clínica53.
Los principales IMK utilizados en CDT se muestran en la tabla 3.
IMK utilizados en CDT radiorrefractarios
| IMK | Blancos | Fase | n | RP (%) | RC (%) | EE > 6 meses (%) | SLP, mediana (meses) |
|---|---|---|---|---|---|---|---|
| Sorafeniba,b | VEGFR | ||||||
| Brose et al.58 | RET | III(vs. placebo) | 417 | 12 | 0 | 54 | 10,8 vs. 5,8 |
| BRAF | |||||||
| PDGFR | |||||||
| c-KIT | |||||||
| Lenvatiniba | VEGFR | ||||||
| Schlumberger et al.55 | RET | III(vs. placebo) | 392 | 65 | n=4 | 15 | 18,3 vs. 3,6 |
| FGFR | |||||||
| PDGFR | |||||||
| c-KIT | |||||||
| Vandetanib | VEGFR | ||||||
| Leboulleux et al.62 | RET | II(vs. placebo) | 145 | 8 | 0 | 57 | 11,1 vs. 5,9 |
| EGFR | |||||||
| Pazopanib | VEGFR | ||||||
| Bible et al.63 | PDGFR | II | 37 | 49 | 0 | 47 | 11,7 |
| c-KIT | |||||||
| Sunitinib | VEGFR | ||||||
| Carr et al.64 | PDGFR | II | 28 | 28 | n=1 | 46 | 12,8 |
| Bikas et al.65 | c-KIT | II | 23 | 26 | 0 | 57 | 8 |
| Motesanib | VEGFR | ||||||
| Sherman et al.66 | PDGFR | II | 92 | 14 | 0 | 35 | 10 |
| c-KIT | |||||||
| Axitinib | VEGFR | ||||||
| Locati et al.67 | PDGFR | II | 52 | 35 | 0 | 35c | 16 |
| Cohen et al.68 | c-KIT | II | 60 | 38 | 0 | 30c | 15 |
| Cabozantinib | VEGFR | ||||||
| Cabanillas et al.69 | RET | I | 15 | 53 | 0 | 40 | ND |
| c-MET |
EE: enfermedad estable; ND: no disponible; RC: respuestas completas; RP: respuestas parciales; SLP: supervivencia libre de progresión.
Luego de un tiempo variable de tratamiento con IMK, las células malignas comienzan a proliferar nuevamente. Esto se atribuye al desarrollo de resistencia por parte de las células tumorales y sucede siempre, independientemente de qué IMK se utilice o del tipo de cáncer54.
Acción citostáticaNingún IMK tiene efecto citotóxico, lo que significa que las células malignas no son destruidas, sino que simplemente se las mantiene en un estado quiescente, impidiendo su proliferación. Esta es la razón principal por la cual no se observan respuestas completas, salvo excepciones55. Las respuestas parciales y la disminución del tamaño tumoral, en general, se deben al efecto antiangiogénico que presentan esto fármacos, con la consecuente isquemia tumoral. A su vez, esto representa una limitación, ya que una vez iniciado el tratamiento deberá continuarse de manera indefinida hasta que se evidencie progresión o hasta que los EA sean intolerables. Además, hay evidencias que demuestran una progresión más veloz del tamaño tumoral tras la suspensión del fármaco54.
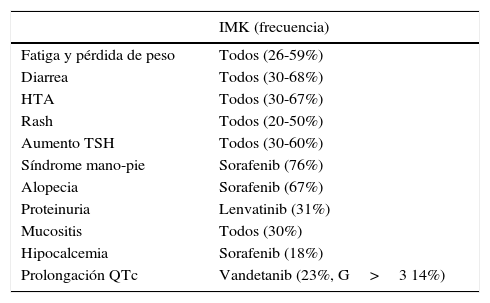
Efectos adversosLa mayoría de los EA son comunes a todos los IMK y serán grado 1 o 2. En general, la toxicidad puede manejarse sin necesidad de suspender ni disminuir la dosis del fármaco. Los más frecuentes se muestran en la tabla 456,57. EA grado 3 y 4 suceden con menor frecuencia (5%-10%) y los principales reportados son: trombosis arterial y venosa, hemorragias, fístulas y perforación gastrointestinal, infarto agudo de miocardio, insuficiencia cardíaca, neoplasias secundarias (carcinoma de células escamosas), citopenias, hepatotoxicidad, insuficiencia renal y síndrome de leuco-encefalopatía posterior reversible55,58.
Efectos adversos más frecuentes relacionados a IMK55,58,62
| IMK (frecuencia) | |
|---|---|
| Fatiga y pérdida de peso | Todos (26-59%) |
| Diarrea | Todos (30-68%) |
| HTA | Todos (30-67%) |
| Rash | Todos (20-50%) |
| Aumento TSH | Todos (30-60%) |
| Síndrome mano-pie | Sorafenib (76%) |
| Alopecia | Sorafenib (67%) |
| Proteinuria | Lenvatinib (31%) |
| Mucositis | Todos (30%) |
| Hipocalcemia | Sorafenib (18%) |
| Prolongación QTc | Vandetanib (23%, G>3 14%) |
Según observaciones recientes, la toxicidad producida por estos fármacos puede ser utilizada como un marcador de eficacia al tratamiento. En el cáncer de tiroides, este fenómeno se evidenció en pacientes con hipertensión arterial secundaria a lenvatinib54.
IMK: ¿cuándo iniciar el tratamiento?Uno de los principales desafíos en los pacientes con CDT avanzado es la selección adecuada de aquellos que se beneficiarán de un tratamiento sistémico. Siempre debe tenerse en cuenta que cualquiera de estos fármacos disminuye de manera significativa la calidad de vida y que además conllevan el riesgo de causar EA graves. Los pacientes con metástasis a distancia pueden permanecer estables durante muchos años, sin mediar ningún tratamiento. Actualmente, se encuentra en fase de reclutamiento el estudio RIFTOS, del cual participa como Steering Committee uno de los autores de esta revisión (Pitoia, F.), y cuyo objetivo primario es determinar el tiempo de progresión sintomática desde la observación de progresión de enfermedad radiorrefractaria superior al centímetro de diámetro5.
En general, se reserva el tratamiento con IMK a los pacientes con criterios de refractariedad al 131I que presenten progresión de la enfermedad según los criterios RECIST 1.139 o que se encuentren sintomáticos9,59,60.
¿Cuándo suspender el tratamiento con IMK?El tratamiento debe continuarse mientras el beneficio supere los riesgos9. No existe, por el momento, consenso, y la decisión de abandonar el IMK deberá evaluarse en cada caso en particular.
ConclusionesLas metástasis a distancia en el CDT son infrecuentes. Cuando ocurren, 2 tercios serán refractarias al tratamiento con radioyodo. Muchas de estas metástasis, principalmente las pulmonares, pueden permanecer estables por años antes de que el paciente sea candidato a una terapia sistémica. Actualmente, los únicos fármacos aprobados en este contexto son sorafenib y lenvatinib. Estos fármacos mantienen estable la enfermedad, pero, por el momento, no demostraron prolongar la supervivencia y solo excepcionalmente logran respuestas completas. Los IMK se reservan para aquellos pacientes en los que se evidencie progresión, en los que se sospeche que la progresión determinará rápidamente la aparición de síntomas y/o en aquellos pacientes con enfermedad avanzada que presenten síntomas no pasibles de tratamiento local. Queda por determinar todavía cuál es el momento apropiado de inicio de los IMK en pacientes asintomáticos con enfermedad progresiva indolente, el estudio RIFTOS, multicéntrico, probablemente nos brindará alguna respuesta5. Los aspectos fundamentales que todavía se desconocen son los factores que están involucrados tanto en la génesis como en la progresión de las metástasis. Estos datos son indispensables para el desarrollo de blancos moleculares más específicos y para el empleo de tratamientos secuenciales o combinados que, sin lugar a dudas, cambiarán la historia natural de estos pacientes.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesFabián Pitoia es consultor de los laboratorios Bayer y Genzyme-Sanofi. El resto de los autores no presenta conflictos de interés.