La tasa de mortalidad por cardiopatía isquémica en pacientes mayores de 35 años, a pesar de la mejora en el diagnóstico precoz y de los avances en el tratamiento, está en el 33%. Se presenta un caso de cirugía urgente en paciente con cardiopatía severa.
Material y métodosDescripción de un caso clínico y revisión de la literatura.
ResultadosPaciente de 70 años con múltiples factores de riesgo cardiovascular y enfermedad coronaria de 3 vasos con afectación de tronco que ingresa por hematuria franca, anemización y angina. Tras valorarse cirugía de urgencia sin posibilidad de traslado a centro de referencia, se realiza una monitorización hemodinámica invasiva y una terapia guiada por objetivos. Intraoperatoriamente, se reseca por vía transuretral una neoformación indicativa de malignidad en la vejiga. En el postoperatorio, evoluciona favorablemente y se decide traslado al centro de referencia para revascularización cardiaca.
DiscusiónLa cardiopatía isquémica es una enfermedad muy frecuente, pero encontrarnos ante un paciente con indicación de revascularización cardiaca bajo un cuadro de inestabilidad por sangrado que requiere cirugía urgente en un hospital no terciario es infrecuente. El manejo hemodinámico del paciente, así como el equilibrio entre los factores que favorecen el sangrado y los factores que favorecen la trombosis coronaria, es la clave para el correcto abordaje del caso y la disminución de las complicaciones perioperatorias.
ConclusionesSiempre puede existir la posibilidad de enfrentarnos a pacientes que por diversas circunstancias deben someterse a una intervención quirúrgica urgente y no están en un estado preoperatorio óptimo. El caso más temido es el paciente con cardiopatía que se somete a cirugía urgente no cardiaca. La monitorización invasiva y la terapia por objetivos demuestra que disminuye la morbimortalidad perioperatoria de estos pacientes.
Despite the improvement in early diagnosis and advances in treatment, the death rate from ischaemic heart disease in patients over 35 years old is 33%. The case is presented of emergency surgery performed on a patient with severe heart disease.
Material and methodsDescription of a case report and review of literature.
ResultsA 70 year-old patient with multiple cardiovascular risk factors and coronary three-vessel disease with coronary trunk involvement that led to frank haematuria was admitted due to anaemia and angina. After assessment for emergency surgery, and with no possibility of transfer to a referral centre, invasive haemodynamic monitoring and objective-guided therapy was started. The surgery consisted of a transurethral resection of a neoformation suggestive of a malignancy in the bladder. He progressed favourably after the surgery, and it was decided to transfer to a reference centre for cardiac revascularisation.
DiscussionThe haemodynamic management of the patient, as well as the balance between factors that promote bleeding and factors that favour coronary thrombosis, is the key to the correct approach to the case, and with decreased perioperative complications.
ConclusionsInvasive monitoring and therapy targets are shown to decrease perioperative morbidity and mortality of these patients.
La tasa de mortalidad por cardiopatía isquémica en pacientes mayores de 35 años, a pesar de la mejora en el diagnóstico precoz y de los avances en el tratamiento, está en el 33%1. La prevalencia real de la enfermedad coronaria es compleja, pero continúa siendo de predominio masculino, con un incremento marcado a partir de los 60 años2. El tratamiento de la cardiopatía isquémica ha avanzado en paralelo con el conocimiento de las bases fisiopatologías de la enfermedad; actualmente existe consenso de que la base del tratamiento en la isquemia miocárdica son los betabloqueantes, vasodilatadores como la nitroglicerina (NTG) y los antiagregantes. En caso de obstrucción total del vaso, se debe realizar una fibrinólisis intravenosa o una intervención coronaria percutánea urgente.
Aun así, existe la posibilidad de enfrentarnos a pacientes en quirófano que por diversas circunstancias deben someterse a una intervención quirúrgica urgente y no están en un estado preoperatorio óptimo, incrementándose de manera exponencial la morbimortalidad perioperatoria. Reportamos un caso de un paciente con cardiopatía isquémica severa y cirugía urgente no cardiaca.
Caso clínicoPaciente masculino de 70 años, sin antecedentes alérgicos conocidos, extabaquista desde hace 10 años, hipertenso de larga evolución con tratamiento errático, diabetes mellitus de tipo 2 desde hace más de 20 años, en tratamiento con insulina, con control metabólico errático (HbA1c 8,9) y repercusión sistémica, incluyendo retinopatía diabética, insuficiencia renal crónica (IRC) estadio 3, antecedente de accidente cerebrovascular isquémico en arteria cerebral media izquierda con recuperación completa e historial de angina inestable. Como antecedente quirúrgico se detalla una cirugía de cataratas.
Siete meses antes del ingreso que nos ocupa, es ingresado por infarto agudo de miocardio (IAM) no Q Killip I con un cateterismo cardiaco que informa de enfermedad coronaria de 3 vasos con disfunción sistólica ventricular izquierda e hipocinesia leve antero-lateral y moderada-severa apical y diafragmática. Se le plantea revascularización quirúrgica, la cual fue rechazada por el paciente.
Su tratamiento habitual era bisoprolol, amlodipino, atorvastatina, NTG parches, omeprazol, insulina, clopidogrel y aspirina (AAS).
Tras este episodio coronario agudo, ingresó meses después presentando hematuria macroscópica de 5 días de evolución, presentando al ingreso hemoglobina (Hb) de 8,2mg/dl, hematocrito de 25,5% y troponinas elevadas. Se retiró el tratamiento antiagregante y se pautó enoxaparina sódica (Clexane©) 60 mg/24h por vía subcutánea (sc). A las 48 h del ingreso presentó dolor torácico típico, con troponinas en ascenso. El electrocardiograma (ECG) evidenció un descenso del segmento ST en la cara inferior y lateral, que se corrigió con NTG sublingual y la transfusión de 2 concentrados de hematíes. El ecocardiograma transtorácico demostró una aurícula izquierda no dilatada, una discinesia de toda la cara septal que se continúa hacia la apical y una discinesia de toda la cara inferior, que condiciona una disfunción sistólica severa sin valvulopatías. El ventrículo derecho no presentó signos de dilatación ni hipertrofia.
La UCI informó la imposibilidad de realizar tratamiento convencional por la presencia de hematuria franca. Fue estudiado por el servicio de urología, recibiendo tratamiento en dicho momento con atorvastatina, betabloqueantes y NTG en perfusión. Decidido el traslado a un hospital de referencia para efectuarse una coronariografía, este no puede llevarse a cabo debido a la presencia de fiebre.
El servicio de urología realizó un estudio ecográfico de las vías urinarias evidenciando una vejiga con gas en su interior y la presencia de una masa de 6,6×5,4cm que sugiere la presencia de un coagulo, así como un engrosamiento irregular de la pared posterior y lateral derecha de la vejiga que le impide contraerse, persistiendo así la hematuria y la anemia. Se procedió a realizar un abordaje multidisciplinar, para evacuar el coágulo, tratar la posible neoplasia vesical y controlar la hematuria (lleva 8 días sin antiagregación).
Previo a la intervención, se le administró bisoprolol 5mg por vía oral (vo) y atorvastatina 20mg vo. Se monitorizó al paciente con el dispositivo Picco© (se utilizó la arteria femoral derecha y un catéter venoso tipo Drumm en el miembro superior derecho); además, se canalizó la vía periférica en el miembro superior izquierdo de calibre 16 G. El paciente ingresó a la sala de operaciones consciente, hemodinámicamente estable, con Hb de 10mg/dl, hematocrito del 30% y con monitor Picco© funcionando. A su vez, fue monitorizado con ECG, pulsioximetría y tensión arterial no invasiva.
La inducción de anestesia general se realizó con fentanilo 3μg/kg, propofol 1mg/kg+etomidato 0,1mg/kg y Esmeron® 1mg/kg. El paciente fue intubado sin incidencias.
Tras la inducción, se inició ventilación mecánica y el mantenimiento con una mezcla de O2 y aire (FiO2 0,6%) y sevoflurano al 2%, con una infusión continua de remifentanilo a 0,15μg/kg/min. Se colocó al paciente en posición de litotomía y se realizó el procedimiento quirúrgico por vía transuretral (uso de un asa diatérmica, la cual produce la vaporización de la lesión). Debido a una pérdida hemática intraoperatoria de 500ml, se transfundieron 2 unidades de hematíes y 1000ml de cristaloides.
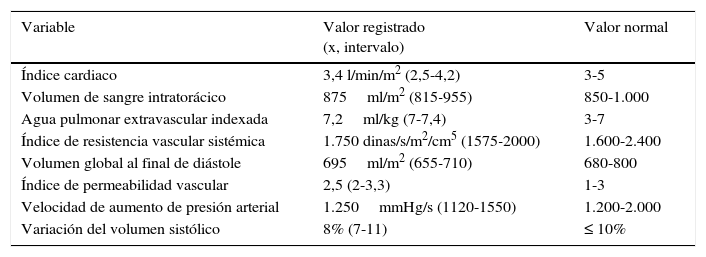
Se mantuvo la estabilidad hemodinámica en todo momento, con perfusiones de NTG a 0,3μcg/kg/min, dobutamina a 3μg/kg/min y noradrenalina a 0,1μg/kg/min, ajustando sus velocidades en base a objetivos para mantener la presión arterial media en el orden de los 80mmHg. Además se mantuvo un índice cardiaco de 3,2 l/min/m2, un agua extravascular pulmonar indexada de 10ml/kg/m2, un volumen total al final de la diástole de 750ml/m2, una presión venosa central de 15mmHg, una variación del volumen sistólico del 3-5%, un índice de permeabilidad vascular de 1 y unas resistencias vasculares sistémicas en torno a 1.800-2.200 dinas/s/cm5/m2. La velocidad de aumento de la presión intraarterial (Dp/max) preinducción era de 750mmHg/s y tras la misma cayó a valores de 400-500mmHg/s, que se mantenían con la perfusión de dobutamina, sin presentarse en el ECG extrasístoles, arritmias o variaciones dinámicas del segmento ST (tabla 1).
Valores hemodinámicos registrados durante la intervención
| Variable | Valor registrado (x, intervalo) | Valor normal |
|---|---|---|
| Índice cardiaco | 3,4 l/min/m2 (2,5-4,2) | 3-5 |
| Volumen de sangre intratorácico | 875ml/m2 (815-955) | 850-1.000 |
| Agua pulmonar extravascular indexada | 7,2ml/kg (7-7,4) | 3-7 |
| Índice de resistencia vascular sistémica | 1.750 dinas/s/m2/cm5 (1575-2000) | 1.600-2.400 |
| Volumen global al final de diástole | 695ml/m2 (655-710) | 680-800 |
| Índice de permeabilidad vascular | 2,5 (2-3,3) | 1-3 |
| Velocidad de aumento de presión arterial | 1.250mmHg/s (1120-1550) | 1.200-2.000 |
| Variación del volumen sistólico | 8% (7-11) | ≤ 10% |
El motivo que hace este caso poco usual fue que el paciente presentaba una coronariopatía severa sintomática (angina inestable) de 12 años de evolución, con coronariografía y criterios de revascularización quirúrgica, con antecedentes de IAM de 7 meses de evolución y la presencia de sangrado activo por vías urológicas que anemizaban al paciente y agravaban su cardiopatía isquémica, ya de por sí inestable. Otro punto de interés del caso fue la suspensión de fármacos antiagregantes habituales en su tratamiento (AAS y clopidogrel suspendidos durante más de 8 días y su sustitución por HBPM sc). En este caso se superponen las claras indicaciones de tratamiento antiagregante plaquetario e incluso fibrinólisis en el contexto del IAM con claras contraindicaciones, como es el sangrado activo por vías urológicas. A ello debemos añadir la indicación de cirugía urgente, de la que se toma conocimiento por el servicio de urología.
Nos encontramos con un paciente con alto riesgo de sangrado y alto riesgo de trombosis arterial (antiagregantes suspendidos) y venosa (posición de litotomía por tiempo prolongado y anestesia general). El índice de riesgo preoperatorio de Lee3 catalogaría al paciente con un riesgo muy elevado (más del 11% de presentar complicaciones intra y postoperatorias cardiacas y/o pulmonares fatales). Otros estudios demuestran en esta situación una incidencia perioperatoria de infarto o complicación cardiaca de hasta el 28%4.
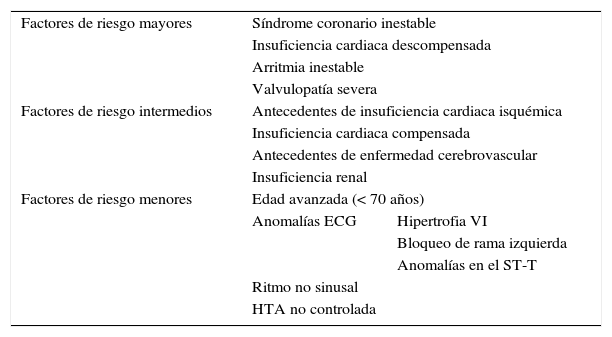
Tomando en cuenta las comorbilidades del paciente en el momento del acto operatorio, podemos considerar al paciente de muy alto riesgo por presentar factores clínicos predictores de riesgo cardiaco mayores, como es la isquemia coronaria reciente y la angina inestable, factores clínicos predictores intermedios como es la IRC y la diabetes mellitus, con afectación de órganos (ojos, riñón) y factores predictores menores, como son la hipertensión arterial mal controlada y la historia de accidente cerebrovascular previo (tabla 2).
Factores de riesgo clínico
| Factores de riesgo mayores | Síndrome coronario inestable | |
| Insuficiencia cardiaca descompensada | ||
| Arritmia inestable | ||
| Valvulopatía severa | ||
| Factores de riesgo intermedios | Antecedentes de insuficiencia cardiaca isquémica | |
| Insuficiencia cardiaca compensada | ||
| Antecedentes de enfermedad cerebrovascular | ||
| Insuficiencia renal | ||
| Factores de riesgo menores | Edad avanzada (< 70 años) | |
| Anomalías ECG | Hipertrofia VI | |
| Bloqueo de rama izquierda | ||
| Anomalías en el ST-T | ||
| Ritmo no sinusal | ||
| HTA no controlada | ||
En lo que se refiere a los factores asociados al riesgo operatorio, la sola indicación de cirugía urgente lo hace de alto riesgo, a pesar de ser una cirugía en principio endoscópica. La duración del procedimiento es otro factor importante a considerar en el preoperatorio, al igual que la posible laparotomía, si no se conseguía resolver el cuadro de hematuria por vía endoscópica.
A la hora de tomar la decisión de proceder con la intervención solicitada como urgente, no dudamos en administrar preoperatoriamente betabloqueantes con la finalidad de disminuir el consumo miocárdico de oxígeno, prevenir elevaciones en la frecuencia cardiaca y aumentar el tiempo de llenado diastólico. Administramos atorvastatina vo con la finalidad de buscar la estabilidad de la placa de ateroma y disminuir la cantidad de ácidos grasos libres circulantes con potenciales efectos lesivos a nivel de la membrana, favoreciendo la arritmogenicidad en el marco de una isquemia coronaria reciente2,5,6.
Al revisar la literatura, encontramos que existe controversia en la elección de la técnica anestésica (técnica neuroaxial frente a la anestesia general), no contraindicando ninguna de las 2 siempre que se mantenga la estabilidad hemodinámica7.
En nuestro caso optamos por la anestesia general con monitorización mínimamente invasiva con el sistema Picco y una monitorización convencional realizando un tratamiento guiado por objetivos. En el intraoperatorio, la clave de nuestro manejo clínico estaba basada en la estrecha monitorización del paciente y el logro de objetivos. Para ello, es imprescindible el uso de sistemas de medición continua basados en el análisis del contorno de la onda del pulso y la termodilución transpulmonar. La monitorización del segmento ST con ECG transtorácico, utilizando simultáneamente las derivaciones DII y V5, nos permitiría detectar variaciones del mismo, así como la presencia de arritmias cardiacas6. En previsión de arritmias, tuvimos en cuenta la lidocaína iv 1mg/kg en bolo para casos de extrasístoles ventriculares Lown I o II y amiodarona 300mg iv en 20min y perfusión de 900mg para 24 h en casos de taquicardia ventricular con pulso, así como la preparación del desfibrilador para los casos de arritmias con inestabilidad hemodinámica.
El valor del agua extravascular pulmonar indexada mayor de 15ml/kg se asocia a una mortalidad del 65%, disminuyendo al 33% si el agua extravascular pulmonar es inferior a 10ml/kg8. El objetivo primordial es el mantenimiento de la presión de perfusión sistémica, evitando los episodios de hipotensión y haciendo hincapié en el mantenimiento de la presión arterial diastólica, que es la fundamental en la perfusión miocárdica, el manejo de la anemia y el control del dolor9,10.
En cuanto al uso de la ecocardiografía transesofágica, existe poca evidencia de su uso para la monitorización cardiaca en cirugía no cardiaca y se necesita experiencia en su uso y en la interpretación de sus datos. El uso del que fue el sistema más utilizado, el catéter de Swan-Ganz, no ha mostrado beneficio en la detección de isquemia perioperatoria, aunque se puede valorar su uso en el IAM perioperatorio1.
En nuestro caso, uno de los factores que más contribuía a aumentar el riesgo anestésico quirúrgico del paciente fue el manejo de la isquemia miocárdica reciente sin el uso de antiagregantes plaquetarios. Se debe recordar que el uso de anticoagulantes, como heparina no fraccionada, HBPM, fondoparinux o acenocumarol, no sustituye el tratamiento antiagregante plaquetario.
El uso por parte del equipo quirúrgico del asa diatérmica que produce vaporización del tejido tumoral fue muy importante, ya que este dispositivo deja un menor número de vasos sanguíneos expuestos, disminuyendo así el sangrado y la cantidad de líquido de irrigación que se absorbe.
La enzima cardiaca que se continuó monitorizando durante su estancia en la UCI fue la troponina y no se tomaron muestras para CPK-MB, que son más útiles para el diagnóstico analítico del reinfarto.
Debido a la complejidad sistémica del paciente, comprendimos en todo momento que debido a la gravedad de la situación, el lugar más idóneo para haber realizado esta intervención era una unidad donde se pudiese contar con otros sistemas de apoyo como hubiese sido un balón de contrapulsación intraaórtico, que era el sistema de elección a utilizar en el caso de presentar el paciente complicaciones intraoperatorias graves (isquemia coronaria aguda refractaria al tratamiento iv).
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.