Determinar el tiempo de reversión del bloqueo neuromuscular con sugammadex posterior a dosis analgésicas de sulfato de magnesio.
MétodoEstudio con diseño prospectivo, comparativo, aleatorizado y doble ciego, donde se determinó el tiempo de reversión con sugammadex de 60 pacientes sometidos a anestesia general. Los pacientes fueron divididos aleatoriamente en 2 grupos de 30 individuos cada uno: grupo 1, recibió 100ml de solución 0,9% NaCl IV, y grupo 2 recibió sulfato de magnesio 50mg/kg diluido en 100ml de solución 0,9% NaCl IV. Ambos recibieron anestesia inhalatoria balanceada con isoflurano y remifentanilo, y fueron revertidos con sugammadex a 2mg/kg, midiéndose el tiempo transcurrido desde ese momento hasta la aparición del train of four (TOF) de 90%.
ResultadosNo hubo diferencia estadísticamente significativa entre los tiempos de reversión de ambos grupos (p=0,7387). Hubo un menor consumo de bromuro de rocuronio en el grupo 2 (p=0,0007).
ConclusiónLa administración de sulfato de magnesio a 50mg/kg IV no afecta al tiempo de reversión del bloqueo neuromuscular inducido por bromuro de rocuronio al utilizar sugammadex, pero potencia la relajación neuromuscular disminuyendo el consumo de bloqueante neuromuscular.
To determine the time of reversal of neuromuscular blockade with sugammadex and analgesic doses of magnesium sulfate.
MethodsIt is a prospective, comparative, randomized and double blind clinical trial where time reversal with sugammadex of 60 patients undergoing general anesthesia was determined. Patients were randomly into 2 groups of 30 subjects each: group 1, received 100ml of solution 0.9% NaCl IV; and group 2, received magnesium sulfate 50mg/kg diluted in 100ml solution 0.9% NaCl IV. Both received balanced inhalational anesthesia with remifentanil and isoflurane and were measured the time of reversal with sugammadex 2mg/kg from that moment until the appearance of TOF 90%.
ResultsThere wasn’t statistically significant difference between the times of reversal of both groups (P=.7387). There was less use of rocuronium bromide in group 2 (P=.0007).
ConclusionAdministration of magnesium sulfate 50mg/kg IV does not affect the time reversal of neuromuscular blockade induced by rocuronium bromide when using sugammadex, but increased potency of neuromuscular relaxation decreasing consumption of neuromuscular blocking agent.
El sulfato de magnesio (SMg) ha sido empleado desde principios del siglo xx e incluso hoy en día sigue teniendo una amplia variedad de usos en la práctica anestésica, debido a sus múltiples efectos a nivel del sistema nervioso central y periférico, cardiovascular, respiratorio y en la práctica obstétrica. Sus propiedades antinociceptivas lo han incluido en el reciente concepto de analgesia multimodal1, pero por sus efectos a nivel presináptico en los canales de calcio y postsináptico a nivel de las fibras musculares es conocido que el magnesio desempeña un importante papel en la transmisión neuromuscular. Además, está demostrado que el SMg potencia el bloqueo neuromuscular inducido por los bloqueantes neuromusculares (BNM) no despolarizantes2.
En el año 2007, se introdujo una nueva molécula perteneciente al grupo de las gamma-ciclodextrinas, el sugammadex, un compuesto altamente hidrosoluble con una cavidad hidrofóbica que encapsula al BNM no despolarizante esteroideo (como el rocuronio) a nivel plasmático, formando así un complejo estable y creando un gradiente de concentración que favorece la salida del rocuronio de la unión neuromuscular hacia el plasma. El sugammadex surge como una alternativa probablemente más segura y eficaz a los anticolinesterásicos para la reversión del bloqueo neuromuscular que, además, obvia el inconveniente del grado de profundidad del bloqueo en el momento de la reversión3,4.
Se ha comprobado que el sugammadex mantiene su perfil de efectividad bajo diversas condiciones perioperatorias con mínimas variaciones en su tiempo de acción (edades extremas, enfermedad renal y/o hepática, trastornos ácido-base, patología cardiovascular). Existen pocos datos en la literatura que estudien si el uso de dosis analgésicas de SMg modifica el tiempo de reversión de sugammadex; esto ha sido más estudiado con anticolinesterásicos, en que se ha demostrado que la recuperación inducida por neostigmina puede ser atenuada con el uso de SMg5,6.
Los resultados reportados son similares en la mayoría de estudios aleatorizados y casos clínicos: el SMg no interfiere con el tiempo de reversión del bloqueo moderado o profundo, ni con el mecanismo de acción del sugammadex7-9. Sin embargo, cambios en la respuesta al recuento postetánico, train of four (TOF) (aceleromiografía) y TOF ratio han sido reportados luego del uso de SMg y después de la reversión del bloqueo neuromuscular con sugammadex (TOF>0,9)10,11.
La hipótesis experimental fue que el uso de SMg a dosis analgésicas podría incrementar el tiempo de reversión del bloqueo neuromuscular inducido por bromuro de rocuronio cuando se administra sugammadex.
El objetivo primario de este estudio fue determinar el tiempo de reversión del bloqueo neuromuscular con sugammadex posterior a dosis analgésicas de SMg. Como objetivos secundarios se estudiaron: los niveles de magnesio séricos basales y posteriores a la administración de SMg, el grado de bloqueo neuromuscular y el tiempo de recuperación del mismo antes y después de la administración de sugammadex y, el consumo total de BNM.
MétodosSe diseñó un estudio controlado, aleatorizado, doble ciego, comparado con placebo, el cual se llevó a cabo en un hospital terciario. El cálculo del tamaño de la muestra se basó en un estudio piloto estimando una desviación estándar de 40 s utilizada para el cálculo, y se utilizó la prueba de ANOVA con una potencia estadística del 80% y un alfa de 0,05 para un total de 29 pacientes por grupo en cuanto a la variable principal utilizada en el estudio.
Después de la aprobación por parte del comité de ética de la institución y de obtener el consentimiento informado por escrito, 60 pacientes con edades comprendidas entre los 18 y los 65 años, y estado físico ASA I y II programados para cirugía abdominal electiva con duración prevista entre 60 y 180 min fueron incluidos en el estudio. Fueron excluidos aquellos pacientes con diabetes mellitus, enfermedad renal o hepática, miopatías, neuropatías, alergia a los medicamentos empleados y tratamiento crónico con magnesio o con algún fármaco que pueda interferir con la función neuromuscular (antibióticos aminoglucósidos, clindamicina, dantroleno, anestésicos locales).
De forma aleatoria, los pacientes se asignaron a uno de los grupos utilizando el método de aleatorización oculta en sobres opacos, sellados y numerados secuencialmente; para ello se utilizó una lista generada por ordenador de números aleatorios por bloques, la cual fue revisada por la persona encargada de preparar el medicamento y que no participó en el acto anestésico, se colocó en un sobre sellado y fue anexado a la historia del paciente hasta que finalizó la recolección de datos.
La mezcla administrada al grupo 1 consistió en 100ml de solución fisiológica 0,9%, mientras que en el grupo 2 fue infundido SMg 50mg/kg en 100ml con solución fisiológica 0,9%.
Diez minutos antes de ingresar a quirófano, los pacientes fueron premedicados con ranitidina 50mg, metoclopramida 10mg, dexametasona 8mg y midazolam 0,3mg/kg IV.
Al ingreso a quirófano, los pacientes fueron monitorizados con electrocardiografía, oximetría de pulso, presión arterial no invasiva (PANI), temperatura, capnografía y analizador de gases inspirados y espirados. Así mismo, se monitorizó la función neuromuscular, por aceleromiografía con monitor (TOF Watch®-SX monitor, Organon Ireland Ltd., Dublín, Irlanda), del músculo aductor del pulgar colocado sobre el nervio cubital en el lado ventral de la muñeca izquierda del paciente. Se utilizó como tipo de estímulo el tren de 4 estímulos (TOF) con calibración previa tras 5 s y estimulación tetánica a 50Hz usando el modo calibración, y un patrón de estímulo de onda cuadrática supramáxima de 200 ms y 4 estímulos de 2Hz con un intervalo de 15 s.
La inducción anestésica se realizó IV utilizando fentanilo 2μg/kg, lidocaína 1mg/kg y propofol 2mg/kg; una vez obtenida pérdida de consciencia, se calibró el monitor TOF y, al obtenerse los valores basales, se administró bromuro de rocuronio a 0,6mg/kg hasta evidenciar TOF 0, momento en el que se realizó laringoscopia directa e intubación orotraqueal con tubo endotraqueal adecuado para el paciente. Quince minutos posteriores a la inducción, se procedió a administrar el fármaco de estudio mediante bomba de infusión en un lapso de 20 min. La temperatura periférica se mantuvo por encima de los 34°C.
El mantenimiento de la anestesia se realizó con isoflurano a 0,5 CAM y remifentanilo a dosis que varió entre 0,05 y 0,5μg/kg/min. Se administró dosis de refuerzo de bromuro de rocuronio a 0,3mg/kg cuando se obtuvo un TOF ≥ 1 y/ recuento postetánico ≥ 10.
Al término de la cirugía, y manteniendo el grado de bloqueo neuromuscular, se administró sugammadex 2mg/kg IV y se midió el tiempo transcurrido desde la administración de este hasta la obtención de TOF ≥ 90% y se registró el resultado. Las concentraciones plasmáticas de magnesio sérico fueron medidas en dos momentos: inmediatamente después de la intubación del paciente previo a la infusión de la mezcla, y previo a la inyección de sugammadex al final de la cirugía, utilizando el método de azul de xilidilo con una imprecisión CV de 4,5%.
Se procedió a extubar al paciente y se trasladó a la unidad de cuidados postanestésicos (UCPA), donde se monitorizaron la frecuencia cardíaca, la PANI y la saturación de oxígeno hasta su egreso. En caso de que el paciente presentara algún evento o reacción adversa a los medicamentos utilizados, se realizaron las intervenciones necesarias para el tratamiento de las mismas y se registraron.
Se calcularon la media y la desviación estándar de las variables continuas y en el caso de las variables nominales, frecuencias y porcentajes. Los contrastes de las variables continuas se basaron en la prueba de la t de Student y para las variables nominales la prueba de la chi cuadrado de Pearson. Se consideró un valor significativo si p<0,05. Los datos se analizaron por SPSS versión 17 para Windows.
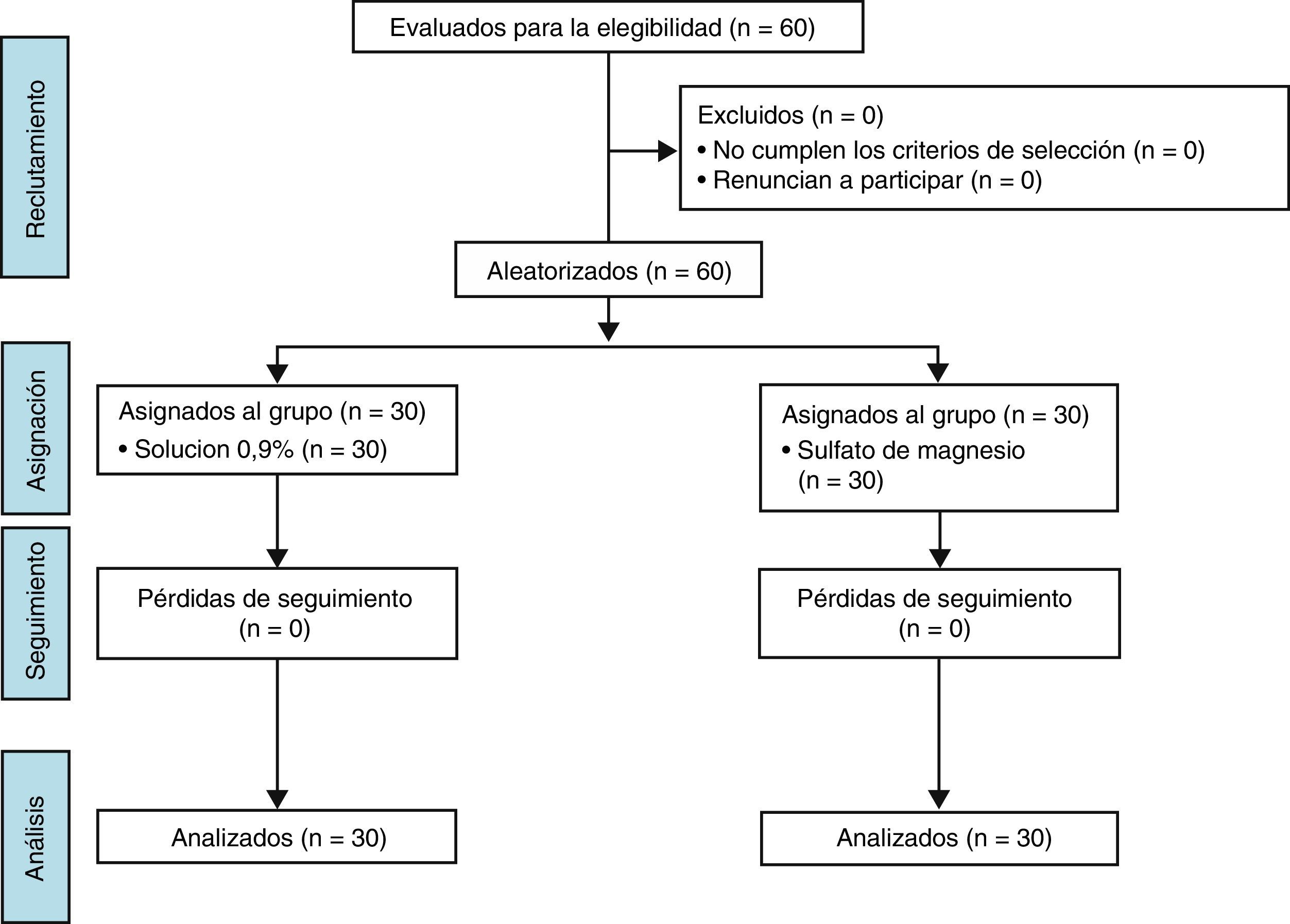
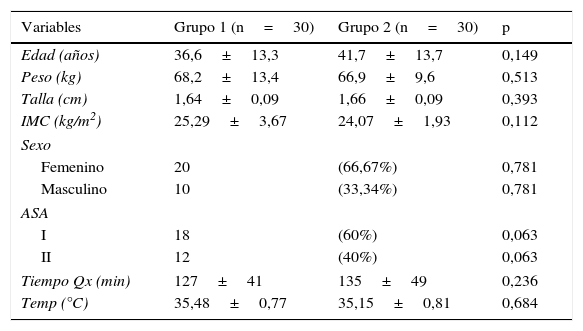
ResultadosSe incluyó a un total de 60 pacientes en el estudio, que se dividieron en 2 grupos de 30 individuos cada uno (fig. 1). Ambos grupos fueron comparables en relación con la edad, el peso, la talla, el sexo y ASA, observándose una predominancia del sexo femenino en ambos grupos (66,67% en el grupo 1 y 70% en el grupo 2). Tampoco hubo diferencias estadísticamente significativas en cuanto al tiempo quirúrgico y la temperatura en los grupos de estudio (tabla 1).
Características de la muestra
| Variables | Grupo 1 (n=30) | Grupo 2 (n=30) | p |
|---|---|---|---|
| Edad (años) | 36,6±13,3 | 41,7±13,7 | 0,149 |
| Peso (kg) | 68,2±13,4 | 66,9±9,6 | 0,513 |
| Talla (cm) | 1,64±0,09 | 1,66±0,09 | 0,393 |
| IMC (kg/m2) | 25,29±3,67 | 24,07±1,93 | 0,112 |
| Sexo | |||
| Femenino | 20 | (66,67%) | 0,781 |
| Masculino | 10 | (33,34%) | 0,781 |
| ASA | |||
| I | 18 | (60%) | 0,063 |
| II | 12 | (40%) | 0,063 |
| Tiempo Qx (min) | 127±41 | 135±49 | 0,236 |
| Temp (°C) | 35,48±0,77 | 35,15±0,81 | 0,684 |
Edad, peso, talla, IMC, tiempo Qx y Temp expresados como media±desviación estándar. Sexo y estado físico ASA expresados como frecuencia y (porcentaje).
IMC:, índice de masa corporal; Temp: temperatura; Tiempo Qx: tiempo quirúrgico.
En promedio, el grupo 1 presentó un TOF del 90% (0,9) a los 266±38 s a partir del momento de la reversión, mientras que el grupo 2 presentó en promedio un TOF del 90% a los 252±49 s luego de la reversión (tabla 2).
Comparación del tiempo transcurrido desde la administración de sugammadex hasta obtener un TOF 90% según grupos
| Grupos | Tiempo TOF 90% (s) | p |
|---|---|---|
| 1 | 266±38 | 0,7387 |
| 2 | 252±49 |
Tiempo transcurrido desde la administración de sugammadex hasta obtener tiempo TOF 90%. Expresado como media±desviación estándar.
Tiempo TOF 90%: train of four del 90%.
No hubo diferencia estadísticamente significativa al comparar el tiempo de aparición del TOF del 90% posterior a la reversión entre ambos grupos (tabla 2). Tampoco hubo diferencia estadísticamente significativa al comparar el porcentaje de pacientes de cada grupo que llegaron a TOF del 90% en el tiempo (p=0,4542).
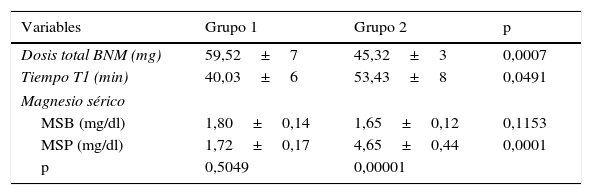
Con respecto a la dosis total de BNM requerida en cada grupo, hubo diferencia estadísticamente significativa: el grupo 1 requirió 59,52±7mg de bromuro de rocuronio, mientras que el grupo 2 solo ameritó 45,32±3mg, con un valor de p=0,007. El tiempo de aparición de T1 fue de 40,03±6 min en el grupo 1 y de 53,43±8 min en el grupo 2, siendo estadísticamente significativo, con un valor de p=0,0491. Por último, al comparar el valor de magnesio sérico basal con el de magnesio sérico prerreversión en el grupo 2, sí hubo diferencia estadísticamente significativa (1,72±0,17mg/dl frente a 4,65±0,44mg/dl). con un valor de p=0,00001; también hubo diferencia estadísticamente significativa entre los valores de magnesio sérico prerreversión del grupo 1 y el grupo 2 (1,65±0,12mg/dl vs. 4,65±0,44mg/dl), con un valor de p=0,00001 (tabla 3).
Comparación de la dosis total de bloqueante neuromuscular, tiempo de aparición de T1 y magnesio sérico según grupos
| Variables | Grupo 1 | Grupo 2 | p |
|---|---|---|---|
| Dosis total BNM (mg) | 59,52±7 | 45,32±3 | 0,0007 |
| Tiempo T1 (min) | 40,03±6 | 53,43±8 | 0,0491 |
| Magnesio sérico | |||
| MSB (mg/dl) | 1,80±0,14 | 1,65±0,12 | 0,1153 |
| MSP (mg/dl) | 1,72±0,17 | 4,65±0,44 | 0,0001 |
| p | 0,5049 | 0,00001 | |
Datos expresados como media±desviaciones estándar. Contraste para diferencia de medias basados en la distribución normal 95% de confianza.
Dosis total BNM: dosis total de bloqueante neuromuscular; Tiempo T1: tiempo de aparición de T1; MSB: magnesio sérico basal; MSP: magnesio sérico previo a la reversión.
No se observaron efectos adversos asociados al uso de sugammadex en la muestra estudiada.
DiscusiónActualmente, el SMg forma parte importante del arsenal de fármacos utilizados en la práctica anestésica, tanto por sus efectos positivos en los diferentes sistemas como para el manejo del dolor. A partir de muchos estudios se ha demostrado el efecto del SMg sobre la transmisión neuromuscular, ya que, al ser un antagonista natural del calcio, interfiere con su liberación y, por ende, con la de acetilcolina en la unión neuromuscular, así como en la sensibilidad de los receptores posjuncionales a la misma12.
Los anticolinesterásicos han sido los antagonistas de elección; sin embargo, el sugammadex como primer agente selectivo que revierte el bloqueo neuromuscular por BNM no despolarizantes supone nuevas opciones con esta indicación13,14.
Los resultados mostraron que el uso de SMg IV a dosis analgésicas no modificó significativamente el tiempo de reversión del bloqueo neuromuscular con sugammadex (266 s vs. 252 s); no obstante, se observó una disminución importante en el consumo de bromuro de rocuronio (59,52mg vs. 45,32mg) y en el tiempo de aparición de T1 (40,06min vs. 53,43min) en los pacientes que recibieron magnesio. Se confirmó el aumento de los niveles de magnesio sérico prerreversión del grupo que recibió SMg con un valor de 4,65±0,44mg/dl frente a 1,65±0,12mg/dl que tuvo el grupo control.
Czarnetzki et al.8 evaluaron la eficacia del sugammadex en pacientes pretratados con magnesio IV y concluyeron que este último no disminuye la eficacia de la dosis recomendada de sugammadex para la reversión del bloqueo neuromuscular moderado a profundo, resultados que concuerdan con nuestro trabajo, en el que se observa que todos los individuos tuvieron condiciones adecuadas de reversión del bloqueo neuromuscular a dosis de sugammadex de 2mg/kg hubieran o no recibido SMg.
El principal mecanismo de acción del SMg en la unión neuromuscular es la inhibición de la liberación de acetilcolina mediada por calcio en la terminal presináptica. Como mecanismo secundario, el magnesio reduce la sensibilidad a la acetilcolina a nivel postsináptico y, por ende, la sensibilidad del miocito15. Estos efectos son más pronunciados ante la presencia de BNM no despolarizantes6.
Germano et al.7 estudiaron el tiempo de reversión del bloqueo neuromuscular con sugammadex en pacientes pretratados con SMg a 40mg/kg y a los que se administró una sola dosis de rocuronio; determinaron que el pretratamiento con magnesio no afecta significativamente al tiempo de reversión del BNM moderado inducido por rocuronio. En nuestra investigación se utilizó dosis mayores de SMg (50mg/kg) y se mantuvo el bloqueo neuromuscular profundo con reinyecciones de bromuro de rocuronio durante el acto operatorio, pero igualmente no se observó una diferencia significativa en el tiempo de reversión entre los grupos estudiados. Por lo tanto, podemos inferir que, a pesar de que el magnesio potencia el bloqueo neuromuscular mediado por BNM no despolarizantes, al realizarse este por mecanismos diferentes no interfiere con la interacción que ejerce el sugammadex sobre el BNM, pudiendo recuperar la función de la acetilcolina en la unión neuromuscular sin afectar el tiempo de reversión del bloqueo neuromuscular ni las dosis necesarias de sugammadex.
La prolongación de la relajación neuromuscular y los menores requerimientos de BNM en pacientes que reciben SMg está demostrada por diversos trabajos16-18, de los cuales podemos citar el de Czarnetzki et al.19, quien afirma que la utilización de SMg a una dosis de 60mg/kg 15 min antes de la inducción con propofol disminuye la latencia del rocuronio en un 35% y prolonga su efecto retardando la recuperación hasta en un 25%, por lo que necesitó menos dosis de BNM, datos que concuerdan con los nuestros, en los que evidenciamos un menor consumo de bromuro de rocuronio en el grupo 2, el cual resultó estadísticamente significativo al compararlo con el grupo 1 (59,52mg frente a 45,32mg), lo cual equivale a una reducción aproximadamente del 24% del uso de BNM.
Si detallamos los resultados obtenidos, podemos ver una ligera discrepancia con una recuperación del bloqueo neuromuscular más rápida en el grupo que recibió SMg (252 vs. 266 s), situación que pudiera explicarse debido a que el magnesio, como se mencionó anteriormente, reduce el consumo de BNM y, por lo tanto, el requerimiento de sugammadex necesario para revertir el bloqueo neuromuscular no despolarizante sería menor al disminuir la cantidad total de rocuronio a ser retirado.
Con relación a la dosis administrada de SMg, se pudo observar que fue suficiente para mantener niveles séricos elevados para el momento de la reversión con sugammadex y evidenciamos que la tendencia en este mismo grupo de prolongarse el tiempo para alcanzar el T1 fue superior a pesar de no resultar estadísticamente significativo al compararlo con el grupo 1. Tomando en cuenta la conclusión de Czarnetzki et al.8, donde se recomienda utilizar las dosis recomendadas de sugammadex para obtener resultados satisfactorios, incluso en presencia de SMg y evitando aumentar las probabilidades de relajación neuromuscular residual como el caso reportado por Unterbuchner et al.11, no existen datos clínicos que indiquen la respuesta durante el TOF obtenida luego del uso de SMg sin exposición a relajantes musculares20.
No se han descrito aún efectos colaterales de importancia a la molécula de sugammadex y entre los pacientes de nuestro estudio tampoco se observaron. Los resultados de Suzuki et al.21 sugieren que el apropiado uso de sugammadex está asociado con la ausencia de bloqueo neuromuscular residual y eventos respiratorios severos en la UCPA; sin embargo, existen reportes de eventos de este tipo en situaciones clínicas específicas tales como hipotermia22.
Entre algunas limitaciones del estudio se considera la falta de acceso a dispositivos de monitorización de profundidad anestésica, los cuales nos hubiera permitido la utilización de técnicas de anestesia total IV que interfiere menos en el bloqueo neuromuscular que el uso de anestésicos inhalados. Delimitar la intervención quirúrgica que iba a conformar nuestra población y tomar en cuenta que los anestésicos locales afectan en el bloqueo neuromuscular que, aunque fue utilizado en ambos grupos de estudio, pudo haber influido en los tiempos establecidos para la reversión. Para investigaciones futuras, creemos que podría ser de utilidad evaluar el comportamiento del sugammadex en pacientes tratados con SMg bajo otras condiciones tales como obesidad y embarazo en las que se pudiera observar cambios significativos de la efectividad del medicamento, por lo que recomendamos continuar con estos estudios10,23.
En conclusión, se consiguió que la administración de SMg a 50mg/kg para la población en referencia no afecta la eficacia del sugammadex en la reversión del bloqueo neuromuscular inducido por bromuro de rocuronio. No obstante, disminuye el consumo de BNM y no altera el tiempo de reversión del bloqueo neuromuscular.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Queremos agradecer especialmente a todos los adjuntos y residentes del Servicio de Anestesiología, sin los cuales no hubiera sido posible realizar este estudio y los cuales siempre estuvieron con nosotros durante el transcurso de la investigación.
Agradecemos a todo el personal de enfermería y cirujanos, que colaboraron con nosotros para la obtención de los materiales y de la muestra que necesitábamos para la realización del estudio. Muchas gracias a todas las personas que se involucraron con nosotros y que hicieron esto posible.