Introducción
Las arañas del género Loxosceles son parte del reducido grupo de arañas capaces de producir la muerte al ser humano. Se les llama también araña parda, marrón, reclusa o violinista. Este último nombre se debe a una depresión dorsal característica del cefalotórax, más oscura, con forma de violín con el mango del mismo hacia el extremo posterior del artrópodo. El término Loxosceles proviene del griego loxos significa curvas y kelos es patas, característica que les da un aspecto circular o curvo.1,2
Las lesiones cutáneas causadas por veneno de araña, han sido reconocidas desde hace muchos años. Las arañas reclusas han sido las más frecuentemente implicadas en mordeduras.3 En 1947, Macchiavello confirmó a Loxosceles laeta, como causante de necrosis cutánea al inocular su veneno de araña en un cobayo.4 Pocas arañas pueden causar envenenamiento grave, la mayoría sólo producen lesiones menores; pero algunas son capaces de causar necrosis de piel en seres humanos.2 Loxocelismo es la intoxicación por la mordedura de la araña Loxosceles. Aunque los seres humanos siempre han coexistido con arañas, la noción de que las arañas pueden causar úlceras necróticas cutáneas es reciente, ya que ésto se sabe desde hace menos de un siglo en que se estableció por primera vez la conexión entre mordeduras de araña y lesiones en la piel humana (ulceración) en un caso publicado, en el que se documentó la mordedura de Loxosceles reclusa (señalada como L. rufescens).5
El loxoscelismo es considerado un problema de salud pública, con 3000 reportes de mordeduras por Loxosceles anuales.6 Estas arañas, se han adaptado a la vida en construcciones y viviendas realizadas por el hombre, por lo que se las puede hallar en el interior de las casas.7 Si existen las condiciones de hábitat adecuado, estas arañas son capaces de colonizar nuevos sitios, al ser transportadas pasivamente en bultos u objetos acarreados por humanos.8 A pesar de los numerosos estudios sobre su veneno, el cuadro fisiopatológico provocado por sus componentes no está del todo dilucidado ni existe consenso respecto a los mejores esquemas terapéuticos para tratar el cuadro de envenenamiento.7 Las glándulas donde se produce el veneno son de secreción apócrina.9 De acuerdo con las diferentes técnicas de extracción de veneno, se ha observado que con la estimulación eléctrica se obtienen de 0.15 a 0.45 microlitros por cada ejemplar y de las glándulas disecadas se pueden obtener 0.8 microgramos de la toxina.9 Un hallazgo importante es que el veneno de las especies sudamericanas de Loxosceles posee reactividad inmunoquímica cruzada10 y se han descrito un gran número de sus componentes.11-13 Debido a que en su mayoría los estudios de veneno en arañas Loxosceles, se han hecho con venenos de las especies intermedia y reclusa y en menor medida con gaucho, hay poca información sobre el veneno de la especie laeta.7 También es importante considerar los efectos biológicos de los componentes observados, y tener en cuenta la pureza del material de estudio, debido a que varían según su origen a partir de homogenizado de glándulas, de cefalotórax, veneno crudo, proteínas purificadas del veneno, etc.13-15 Otras características importantes de considerar en el veneno son que también puede presentar diferencias de actividad según la edad, el estado fisiológico y el sexo de la araña.16 Se ha observado que los componentes de venenos asociados con la actividad letal y necrótica, en las diferentes especies de Loxosceles estudiadas, tienen entre 30 y 35 kDa, con una composición proteica muy similar.7 En el veneno de L. intermedia se encontraron esfingomielinasas, metaloproteinasas13 y proteasas de serina.17 Sin embargo, la esfingomielinasa, proteína de 35 kDa, llamada F35, es la de mayor importancia.7 Esta posee tres isoformas, P1, P2 y P3, las isoenzimas P1 y P2 y tienen actividad de esfingomielinasa-D y se ha demostrado que in vivo causan hemólisis y dermonecrosis.18,19 Es importante considerar que la proteína F35 aparecería en las arañas durante el desarrollo ontogénico en la tercera muda, ya que no se ha encontrado en los ejemplares de las primeras dos mudas.20 Existen estudios en que se ha asociado a las enzimas descritas con los diferentes procesos fisiopatológicos que produce el veneno crudo; sin embargo, las más estudiadas hasta la fecha son las esfingomielinasas. Las esfingomielinasas D de los venenos de Loxosceles tienen alta homología hetero-específica. La esfingomielinasa D (P1 y P2) de Loxosceles intermedia, posee actividad dermonecrótica y hemolítica dependiente del complemento sérico, e inoculada en ratones produce un cuadro similar al choque endotóxico.18 Su inoculación eleva los niveles de factor de necrosis tumoral (TNF), interleucinas 6 y 10 (IL-6 e IL- 10), factor estimulante de colonias de macrófagos y granulocitos (GM-CSF) y de óxido nítrico.21,22 Se considera que la IL-6 está relacionada con la síntesis de factor de agregación plaquetaria por activación de fosfolipasas A2, y los radicales del óxido nítrico se relacionan con la relajación muscular.19 Ambos fenómenos se asocian con eventos que se producen en el choque endotóxico. La F35, además, induce la expresión de E-selectinas, fenómeno que se relaciona con los procesos inflamatorios vasculares.15 El mecanismo por el cual F35 produce todos los efectos que se le atribuyen no se conoce totalmente.15 En el veneno de L. intermedia también se ha descrito actividad de metaloproteinasas que hidrolizan gelatina, fibronectina y fibrinógeno, relacionadas según algunos autores, con las hemorragias y la CID, y una de estas tendría actividad dermonecrótica directa.12 También se ha mencionado que las proteasas de serina en este veneno tendrían participación en los procesos patológicos.23 Entre las lesiones como efectos producidos por el veneno de Loxosceles, puede provocar necrosis tisular, hemólisis intravascular, coagulación y vasculitis.14,19,21,24 Además se han descrito también mielopatías.25 Se ha observado CID con cuadros cutáneo-viscerales y hemolíticos fatales.26 Los desencadenantes de los mecanismos patológicos no están definidos, pero la acción necrotizante y la hemólisis estarían relacionadas con la activación del sistema del complemento.14,15,21,26
En cuanto a las lesiones locales, se ha observado que en la zona de la mordedura se presenta edema, adelgazamiento del endotelio vascular, acumulación de células inflamatorias, vasodilatación, coagulación intravascular, degeneración de las paredes vasculares y hemorragia.7 Estos fenómenos están relacionados con la vasculitis, que contribuye de manera significativa a la producción de la necrosis tisular.7 El veneno induce la expresión de E-selectinas y estimula la liberación de IL-8 y de GM-CSF, lo que induce la migración y adhesión de células que forman, aumentan y sostienen el fenómeno inflamatorio.27,7 Por otro lado, las ceramidas liberadas por acción de las esfingomielinasas, contribuyen a la adhesión plaquetaria y la formación de trombos, lo que provoca mayores trastornos en la microcirculación.7 Se observa siempre infiltración leucocitaria con predominio de neutrófilos perivasculares, células que tendrían un papel muy importante en la necrosis.28-30 De esta manera, el proceso inflamatorio y la vasculitis con formación de trombos, serían los principales responsables de las lesiones necróticas locales, favoreciendo el desarrollo de coagulación intravascular diseminada y de zonas de isquemia y hemorrágicas intercaladas, causantes a su vez de la lesión en placa marmórea o livedoide característica de la lesión local por mordedura de Loxosceles.2,11 Los mecanismos de necrosis tisular fueron confirmados in vitro por la liberación TNF-alpha a partir de queratinocitos.31 Otros efectos del veneno son la liberación de IL-8 y de GM-CS, F31 y ceramidas a partir de células endoteliales, y la inducción de la expresión de IL-8 y MCP-1. La producción de citocinas (IL-1β, IL-8 y TNF-a) se relacionaría con la hiperalgesia y el edema de las lesiones dérmicas.32-34 Las metaloproteinasas descritas por algunos autores en el veneno de Loxosceles podrían estar asociadas con estos eventos.12 En cuanto a las lesiones sistémicas, la hemólisis que se observa en los cuadros viscerales, se produciría por la modificación de componentes de la membrana eritrocitaria35 y la activación de la vía alterna del complemento.36 Se ha observado que la esfingomielinasa de L. intermedia (F35) actúa sobre la membrana de los glóbulos rojos y activa metaloproteinasas endógenas de su membrana favoreciendo la unión de factores del complemento desencadenantes de la hemólisis.37 Los cuadros hemolíticos y la liberación de mediadores inflamatorios se han asociado a la deficiencia de la enzima glucosa-6-fosfato deshidrogenasa.38 No existe relación entre la magnitud de la lesión local y la producción de hemólisis. No todas las mordeduras en humanos y animales provocan lesiones necróticas ni sistémicas, lo cual depende de la susceptibilidad individual al veneno.7 Se ha observado que el veneno de L. laeta produce experimentalmente más cuadros de hemólisis que los venenos de L. gaucho o intermedia, aunque la letalidad de L. laeta, es menor.10,38,39
La insuficiencia renal aguda (IRA) que se observa en los cuadros graves de loxoscelismo puede deberse a la disminución de la perfusión renal, a la precipitación de hemoglobina en los túbulos renales, a la coagulación intravascular diseminada (CID) y posiblemente al conjunto de estos fenómenos.7 La hemoglobina precipita en ciertas condiciones como pH ácido, y puede producir taponamiento renal, con oliguria o anuria, de manera similar a la observada en el envenenamiento por abejas, o en forma semejante a lo que sucede con la mioglobinuria en el envenenamiento por Crotalus durissus terrificus (víbora de cascabel sudamericana). De manera experimental, se ha observado necrosis tubular caracterizada por edema y lesiones vacuolares, daño en la membrana luminal y hemoglobina en la luz tubular.40 La hemólisis sería determinante para producir IRA y CID.7
Diagnóstico. En la mayoría de los casos éste se basa en el cuadro clínico. Los exámenes de laboratorio son inespecíficos, pero contribuyen al diagnóstico y al seguimiento. El examen clínico debe ir acompañado de una anamnesis detallada, con las características epidemiológicas del accidente y la cronología de los síntomas. La captura e identificación del animal agresor se registra en menos de 5% de los casos.41 De las pruebas de laboratorio inmunológicas el ELISA, por su sencillez y rapidez, permite detectar veneno circulante y en la lesión.41,42 En la práctica clínica aún no se cuenta con pruebas diagnósticas para uso rutinario. Los exámenes de laboratorio inespecíficos son complementarios a la clínica. La observación de leucocitosis con neutrofilia contribuye al diagnóstico de la forma cutánea, y en las formas cutáneo-visceral y sistémica existen varias alteraciones que se pueden detectar en el laboratorio clínico, como: anemia con reticulocitosis, trombocitopenia, elevación de bilirrubina indirecta, disminución de la haptoglobina, hiperpotasemia, aumento de la creatinina, uremia, alteración de pruebas de coagulación y hemoglobinuria.42 Los estudios histopatológicos muestran vasculitis con obliteración de pequeños vasos e infiltración de polimorfonucleares, edema, hemorragia y necrosis focal.43 Otro hallazgo es la trombocitopenia, lo cual complicaría los fenómenos de coagulación-anticoagulación por la degradación de la fibrina.44
Presentación del caso
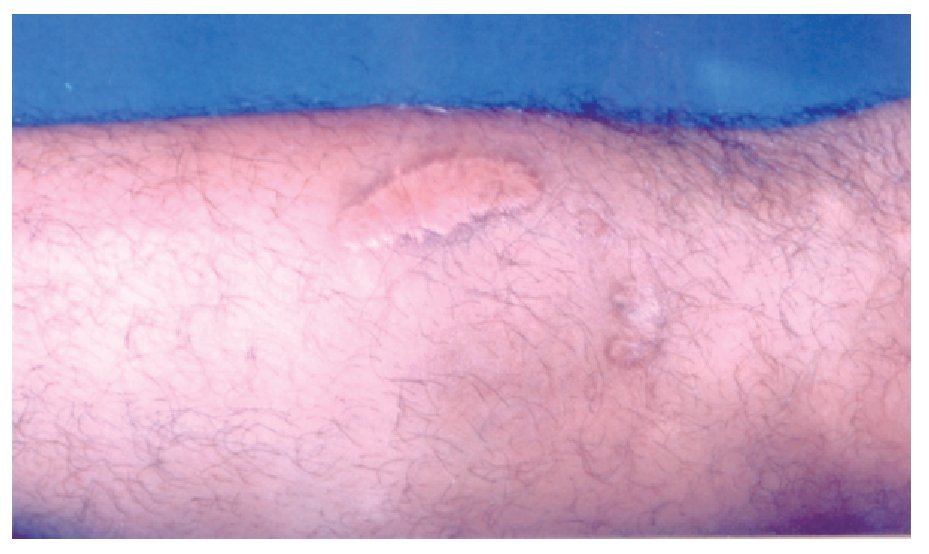
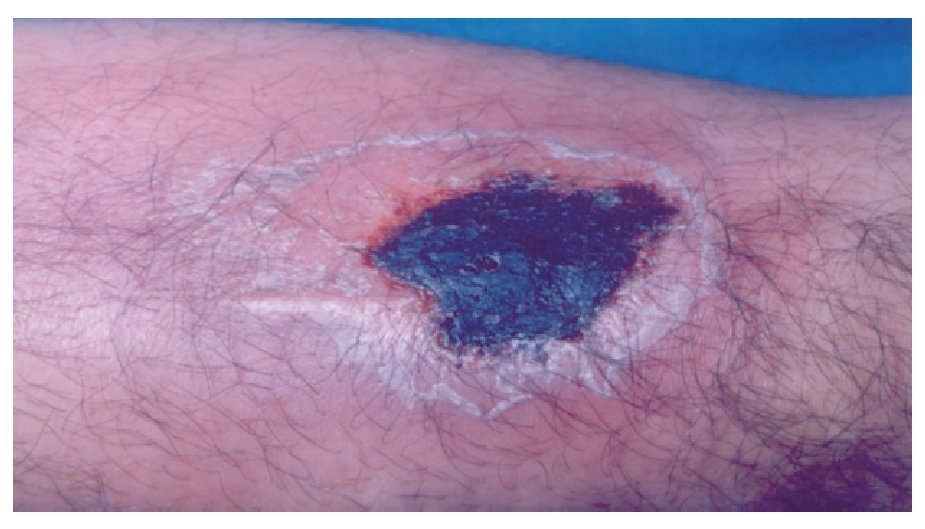
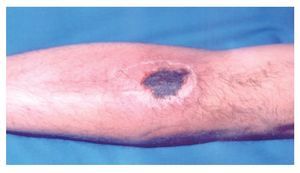
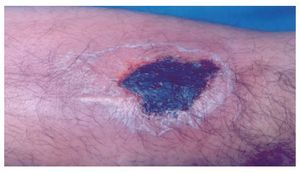
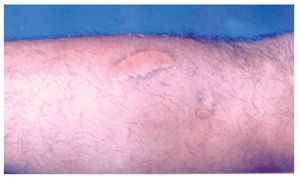
Hombre de 28 años de edad, que refierió la aparición de una lesión cutánea en el antebrazo izquierdo, con dolor local ardoroso, constante, no incapacitante, no acompañada de fiebre, pero sí de inflamación local, la cuál aumentó gradualmente. Al inicio tuvo color rojizo, que en el curso de pocas horas cambió a violáceo. Acudió a nuestro hospital el mismo día de presentar la lesión, cuyas dimensiones eran de 4 cm por 7 cm, de aspecto violáceo, con bordes eritematosos, bien delimitada y dolorosa al tacto. No encontramos adenomegalias regionales (Figuras 1 y 2). Dos días después tuvo descamación de la piel y la lesión presentó un trasudado melicérico, que en el curso de una semana evolucionó a una escara necrótica y posteriormente dejó una lesión queloide (Figura 3). Durante ese tiempo desaparecieron gradualmente el dolor y la inflamación. Una semana después presentó dos lesiones de las mismas características, localizadas en la cara posterior de la pierna izquierda. El paciente acudió a consulta a las 48 horas de haber aparecido las lesiones.
◊ Figura 1. Antebrazo del paciente con mordedura por araña Loxosceles, con una placa livedoide, de aspecto equimótico. La lesión se delimitó en las primeras 24 horas.
◊ Figura 2. Acercamiento de la lesión por mordedura de Loxosceles. Se aprecia una escara necrótica.
◊ Figura 3. Queloide derivado de la cicatrización de la lesión original por mordedura por araña Loxosceles.
Los estudios de laboratorio y gabinete mostraron: Biometría hemática con linfocitos de 41.5%. Intradermorreacción con varidasa: 4 mm por 4 mm. C3: 201 mg/dL, C4: 58 mg/dL, Complemento hemolítico a 50%: 361 UH/mL. IgG sérica total: 2062 mg/dL. La panendoscopia con datos de hernia hiatal y esofagitis. Subpoblaciones de linfocitos, examen general de orina, pruebas de función hepática y cultivo de exudado faríngeo con resultados normales. Ultrasonido del hígado y vías biliares: normal
Biopsia de la piel de la cara posterior de la pierna izquierda: Descripción macroscópica con huso de piel que mide 1.2 cm. Descripción microscópica: La superficie de espécimen está ulcerada y existe infiltrado inflamatorio denso predominantemente a base de neutrófilos, que se extienden a través de la dermis y hacia la grasa subcutánea. También están presentes linfocitos e histiocitos dentro del denso infiltrado inflamatorio; la mayoría de los vasos exhiben infiltración en sus paredes. Diagnóstico: piel de la mordedura de la parte posterior de la pierna izquierda con cambios compatibles con piodermia gangrenosa.
De acuerdo con la historia clínica, la exploración física, los resultados de laboratorio, los estudios inmunológicos y la biopsia, se integró el diagnóstico de: loxoscelismo cutáneo.
El tratamiento de las lesiones cutáneas consistió en la aplicación de frío local (debido a que la esfingomielinasa D es más activa a altas temperaturas), inmovilización y elevación de la zona afectada. Se le prescribió difenhidramina a 0.2 mg/kg/ dosis/día, durante siete días. No hubo necesidad de antibióticos ya que el cultivo de la lesión fue negativo, además de que no cursó con fiebre, ni cuadros infecciosos, ni adenomegalias. Para disminuir el proceso inflamatorio se utilizó dexametasona 4 mg cada seis horas, vía intramuscular en la fase aguda, después se disminuyó la dosis hasta suspenderla.
Discusión
De acuerdo con la revisión de la bibliografía y a la atención de los pacientes con loxoscelismo, es evidente que la fisiopatología de esta enfermedad está poco estudiada. Los mecanismos de necrosis relacionados con la liberación de mediadores tisulares recibieron confirmación indirecta en experiencias in vitro ya que el veneno induce la liberación TNF-a a partir de queratinocitos. Además, el veneno estimula la liberación de IL-8 y de GM-CSF, de ceramidas a partir de células endoteliales e induce la expresión de IL-8 y otras citocinas. La producción de IL-1β, IL-8 y TNF-a, estaría relacionada con la hiperalgesia y el edema observado en las lesiones dérmicas.40 Es necesario hacer más estudios para aclarar porque se autolimita la liberación de los mediadores inmunológicos de la inflamación y la necrosis dérmica.
Conclusión
Presentamos el caso de un paciente adulto joven con varias mordeduras por Loxosceles quien presentó lesiones necróticas cutáneas sincomplicaciones sistémicas. Es importante continuar con las investigaciones químicas y clínicas del loxoscelismo que ayuden a evitar el loxoscelismo cutáneovisceral grave y la muerte de quienes sufran mordeduras por este tipo de arañas.
Correspondencia: Dra. Martha Patricia Valencia Zavala.
Zacatecas 44, 2° piso, consultorio 203. Colonia Roma. 06700, México, D. F.
Teléfono: 5574 9124.
Correo electrónico: valenciazavala@hotmail.com.