Los avances en el conocimiento del genoma humano que se han producido en los últimos años están cambiando la forma de entender la Medicina. La investigación genética encaminada a mejorar los tratamientos de los pacientes puede enfocarse desde dos perspectivas diferentes. Por un lado, la farmacogenómica se ocupa de comprender las bases genéticas de las enfermedades para descubrir nuevas formas de tratar y prevenir enfermedades que lleven al desarrollo de nuevos y mejores fármacos. Ofrece la posibilidad de desarrollar una nueva generación de medicamentos, maximizando su eficacia y seguridad, que van a tener implicaciones importantes en la atención sanitaria. Por otro lado, la farmacogenética se ocupa de correlacionar la información genética del paciente con su respuesta a los fármacos, con la finalidad de administrar a cada paciente el tratamiento más adecuado. La farmacogenética es una disciplina científica orientada al estudio de los aspectos genéticos relacionados con la variabilidad de la respuesta a los medicamentos en individuos o poblaciones. Su objetivo es conseguir una medicina individualizada, es decir, administrar el fármaco más eficaz con el menor riesgo de efectos adversos y a la dosis adecuada desde el primer momento. De aquí se deduce que tiene una aplicación clínica directa.
La farmacogenética posiblemente no va a revolucionar la práctica médica en el futuro inmediato, pero sí a medio plazo: en unos 10 a 20 años el desarrollo y la comercialización de fármacos con una prueba diagnóstica asociada será una práctica habitual con la que conseguiremos individualizar los tratamientos.
Existe una gran variabilidad en la respuesta a los fármacos. Habitualmente, cuando a un paciente se le diagnostica una enfermedad se le prescribe el tratamiento de primera elección, y en la mayor parte de los casos se consigue el efecto terapéutico deseado. No obstante, existe un número importante de pacientes que no responde al tratamiento o que presenta reacciones adversas. Esta variabilidad en la respuesta depende de un gran número de factores, como el diagnóstico (un diagnóstico más correcto conseguirá una mejor respuesta porque se administrará un tratamiento más específico), la dosis (con una dosis más alta se puede conseguir mayor eficacia, pero también existe un mayor riesgo de efectos adversos), las interacciones medicamentosas, otros factores médicos o ambientales (como la dieta o el tabaco), y unos factores idiosincrásicos que dependen de la dotación genética de cada paciente. Esta última parte de la variabilidad que se mantiene estable durante toda la vida es la que estudia la farmacogenética.
El tratamiento farmacológico hoy en día se basa en el método de ensayo-error: a cada paciente se le prescribe un fármaco indicado para la patología que presenta (normalmente el fármaco de primera elección) y de acuerdo a la respuesta o la toxicidad se cambia por otro, hasta que se da con el medicamento más adecuado para ese paciente. Todo este proceso puede llevar bastante tiempo, a parte del sufrimiento por la falta de eficacia y la toxicidad que presente el paciente. Con la Medicina individualizada se pretende que el tratamiento farmacológico vaya dirigido a cada paciente concreto. Así, después de diagnosticar a un paciente, se le realizarán una serie de biomarcadores genéticos o de otro tipo que nos ayuden a predecir con qué tratamiento se va a conseguir una buena eficacia sin efectos adversos. Del mismo modo se administrará el fármaco más eficaz y seguro desde la primera vez, con lo que evitaremos mucho sufrimiento a los pacientes y reduciremos los gastos en medicamentos inútiles.
Variabilidad en la eficacia del tratamiento
Para que se autorice la comercialización de un fármaco se debe demostrar que es eficaz y seguro. No obstante, esto no significa que el fármaco sea eficaz en el 100% de los pacientes. De hecho, si analizamos los resultados de eficacia de fármacos comercializados para diferentes patologías podemos observar que entre el 20 y el 75% de los pacientes presentan fracaso terapéutico (tabla 1), lo que conduce al derroche de unos costes innecesarios (no es lógico tratar a pacientes que no van a responder a un fármaco) y una mala calidad asistencial. Por lo tanto, es necesario desarrollar marcadores u otro tipo de pruebas que nos ayuden a predecir qué pacientes van a presentar una buena respuesta, de tal modo que sólo administraremos el fármaco a la población optimizada para la eficacia.
El desarrollo de la farmacogenética para reducir esta variabilidad en la eficacia ya está dando sus primeros frutos, pero será uno de los principales cambios de la práctica de la Medicina en los próximos 10-20 años. Una de las primeras aplicaciones farmacogenómicas aprobadas para uso clínico es trastuzumab (Herceptin®). Se trata de un anticuerpo humanizado contra el receptor HER2 en el cáncer de mama. Va dirigido sólo a los pacientes que sobreexpresan HER2 (20-35% de los sujetos con cáncer de mama). Su desarrollo clínico ha sido muy rápido y requirió menos de 1.000 pacientes de estas características: sólo fueron necesarios dos ensayos clínicos de fase III, uno en monoterapia (222 pacientes) y otro en combinación con quimioterapia (469 pacientes), y así se autorizó la comercialización para el tratamiento de los pacientes con cáncer de mama avanzado que sobreexpresa HER2. Es decir, el fármaco sólo va dirigido a la población de pacientes que tiene una alta probabilidad de obtener un beneficio del tratamiento.
Otro ejemplo que se podría utilizar en la clínica es el de los inhibidores de la bomba de protones como omeprazol, uno de los grupos de fármacos más prescritos en el sistema sanitario. Se metabolizan en el hígado por la enzima CYP2C19,que presenta polimorfismo genético, de tal forma que los portadores de alelos CYP2C19*2 y *3 presentan muy baja actividad enzimática. Así, hay pacientes que son metabolizadores lentos (portadores de dos alelos mutados): 1-7% en raza caucásica, 14-25% en orientales y 60% en negros africanos. Estos fármacos se utilizan asociados a antibiótico para erradicar el Helicobacter pylori en pacientes con úlcera péptica. Los metabolizadores lentos consiguen una erradicación y curación de la úlcera del 100%, frente a sólo un 60-80% en metabolizadotes intermedios y un 30-60% en metabolizadores rápidos o normales. Para demostrar la utilidad de la Medicina individualizada en la práctica clínica habitual Furuta et al realizaron un ensayo clínico aleatorizado en el que se incluyeron 300 pacientes con infección por H. pylori que se asignaron a recibir el tratamiento estándar (lansoprazol, claritromicina y amoxicilina) o tratamiento con los mismos fármacos pero individualizando la dosis de acuerdo a dos biomarcadores (el polimofismo de CYP2C19 y la resistencia del microorganismo a claritromicina). Se demostró claramente que la Medicina individualizada consigue mejorar la eficacia, ya que la tasa de erradicación aumentó de 70 a 96%. Este estudio se ha realizado en población oriental, pero los resultados deberían ser similares en nuestro medio, y las dos pruebas están ya disponibles, aunque su precio todavía puede ser un poco elevado para realizarlas rutinariamente.
De todos modos, el buscar marcadores predictores de eficacia no es tan fácil como en los casos anteriores. Podemos ver como ejemplo la predicción de respuesta a clozapina, un antipsicótico que es eficaz en el 40-60% de los pacientes que no responden a otros antipsicóticos, pero presenta un alto riesgo de producir agranulocitosis, por lo que se debe hacer un control hematológico semanal. Sería necesario disponer de marcadores de respuesta para evitar exponer a un riesgo innecesario a los pacientes que no van a responder. Con este objetivo, Arranz et al realizaron un estudio en el que se analizaban 19 polimorfismos genéticos en 200 esquizofrénicos tratados con clozapina. La mejor capacidad de predicción se encontró con una combinación de 6 polimorfismos de receptores de serotonina e histamina y del transportador de serotonina. Aun así, el valor predictivo positivo era sólo de 76% y el valor predictivo negativo de 82%, lo que nos da una idea de la dificultad de predicción de respuesta, ya que en el mecanismo de acción de los fármacos están implicadas múltiples proteínas. Por este motivo resulta obligado analizar un gran número de polimorfismos de diferentes genes, lo que conlleva una enorme dificultad para interpretar los resultados.
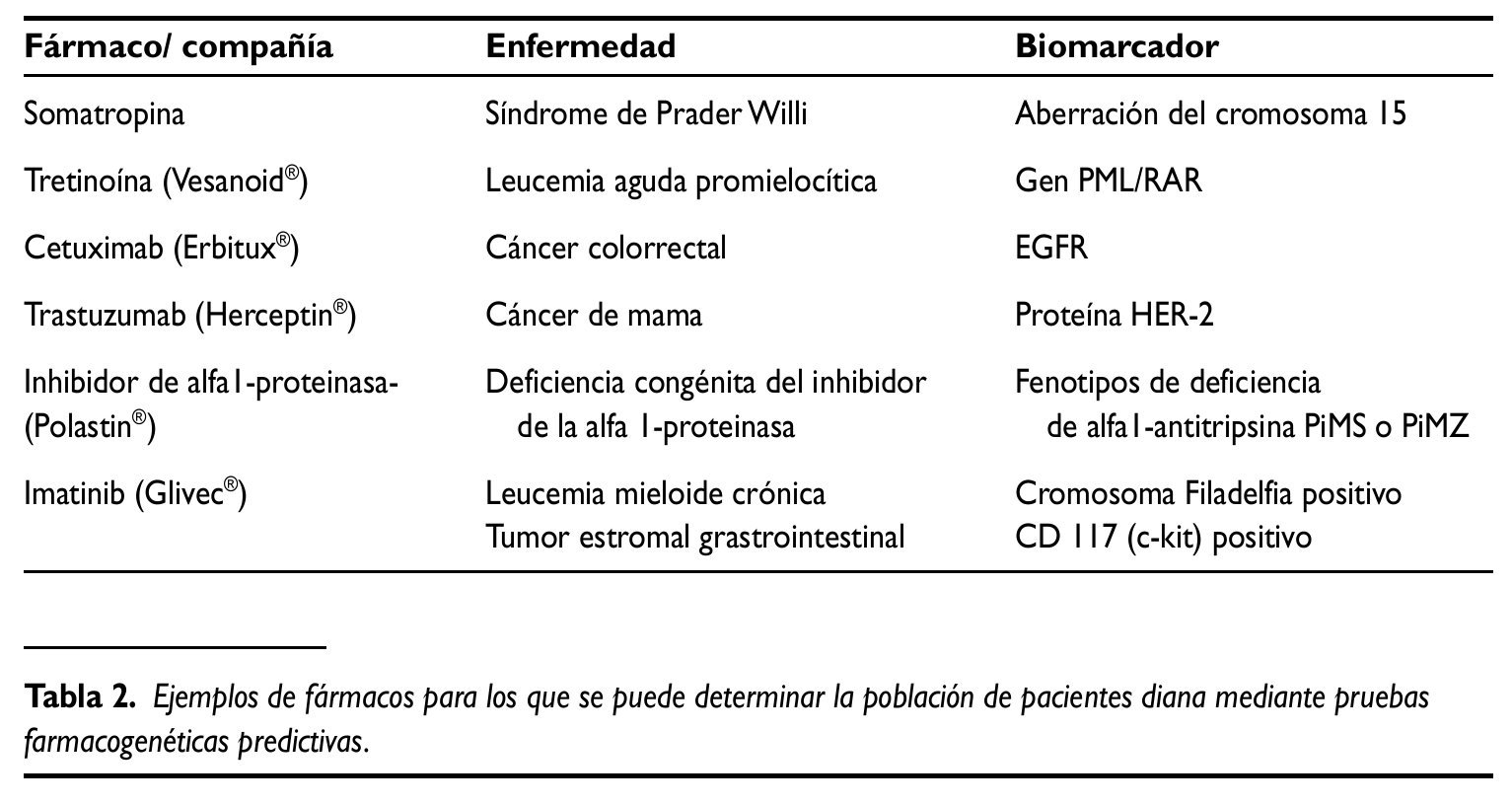
En la tabla 2 aparecen algunos ejemplos de fármacos para los que es posible determinar la población de pacientes con buena respuesta gracias a marcadores genéticos. La mayoría de estos ejemplos son de enfermedades oncológicas, campo en el que la farmacogenética está más desarrollada.
Impacto de los efectos adversos
En el ámbito de la seguridad de los medicamentos los datos son más preocupantes. En España se ha calculado que cerca del 4% de los ingresos se deben a efectos adversos. En el Reino Unido las cifras son similares: uno de cada 15 ingresos hospitalarios se debe a efectos adversos. En Estados Unidos cada año mueren 106.000 pacientes y 2,2 millones sufren algún tipo de lesión. De aquí podemos deducir la importante repercusión sanitaria y económica que tienen los efectos adversos. Además, los problemas de seguridad obligan a la retirada de un número importante de fármacos del mercado, que pueden ser eficaces en algunos pacientes; podemos recordar ejemplos como grepafloxacino, trovafloxacino, mibefradilo, ebrotidina, terfenadina, cisaprida, cerivastatina, etc.
Si somos capaces de encontrar marcadores de riesgo de toxicidad evitaríamos tratar a los pacientes de riesgo, de tal modo que sólo se administraría el fármaco a la población optimizada para la seguridad. Combinando marcadores de eficacia y seguridad seleccionaríamos sólo la población que va a responder bien, sin riesgo de efectos adversos. Ya hay algunos ejemplos de marcadores de seguridad que se están utilizando en la clínica.
Un ejemplo muy claro es del polimorfismo HLA-B*5701 como predictor de hipersensibilidad a abacavir, un fármaco utilizado para el tratamiento de la infección por el virus de la inmunodeficiencia humana, que en el 7% de los pacientes produce hipersensibilidad, y si el tratamiento no se interrumpe puede ser muy grave. Para demostrar la utilidad de este marcador en la práctica clínica se realizó un ensayo clínico controlado, aleatorizado y doble ciego, en 1.956 pacientes que iban a recibir abacavir (estudio PREDICT-1). Se asignaron aleatoriamente al grupo de prueba farmacogenética (genotipar para HLAB*5701 y si es positivo no tratar con abacavir) o al grupo control (tratar con abacavir de acuerdo a la práctica clínica habitual sin genotipar previamente). Se demostró claramente que la realización de una prueba farmacogenética prospectiva consigue reducir la incidencia de hipersensibilidad a abacavir tanto diagnosticada clínicamente (de 7,8% en el grupo control a 3,4%) como confirmada inmunológicamente con una prueba cutánea (de 2,7% a 0%). El valor predictivo negativo de esta prueba es muy alto (95,5% para el diagnóstico clínico y 100% para el diagnóstico inmunológico), lo que significa que si un paciente no es portador de HLAB*5701 su probabilidad de tener una reacción alérgica a abacavir es muy baja. Por este motivo, las autoridades sanitarias han actualizado la ficha técnica de este fármaco para recomendar la realización de esta prueba antes de empezar el tratamiento con abacavir, y así se está haciendo en la mayoría de los hospitales españoles y de otros países europeos.
Otro ejemplo que también se está aplicando en la práctica clínica diaria en muchos centros es el de tiopurina metiltransferasa (TPMT), una enzima que metaboliza azatioprina, 6-mercaptopurina y tioguanina, fármacos que se utilizan en el tratamiento de leucemias, o como inmunosupresores en enfermedades reumáticas, enfermedad inflamatoria intestinal, trasplantes u otras enfermedades autoinmunes. Esta enzima presenta polimorfismo genético, de tal forma que un 90% de los pacientes son homocigotos normales y deben recibir dosis plenas del fármaco, un 10% son heterocigotos (la actividad enzimática está disminuida a la mitad) en los que se debe reducir la dosis a un 50%,y un 0,3% son homocigotos para la mutación (no tiene actividad enzimática), que tienen un alto riesgo de toxicidad hematológica grave, por lo que estos fármacos estarían contraindicados o la dosis se debería reducir a un 10%. Es práctica habitual en muchos centros medir la actividad de TPMT antes de empezar el tratamiento con estos fármacos. Esta práctica tiene las ventajas de que permite empezar el tratamiento con las dosis adecuadas, con lo que se reduce el tiempo hasta la respuesta, minimiza el número de pacientes que desarrollan mielotoxicidad (se evita un caso por cada 20 pacientes tratados durante 6 meses) y, además, se ha demostrado que es coste-efectiva. No obstante, se deben seguir haciendo controles analíticos periódicos, porque la actividad de TPMT no es la única responsable de la toxicidad.
Otro ejemplo que se podría utilizar en la clínica es del citocromo P450, un grupo de enzimas hepáticas que se encarga de eliminar la mayoría de los fármacos. Las enzimas de este grupo con un polimorfismo genético más claro son CYP2D6 (metaboliza antidepresivos, neurolépticos, bloqueadores beta, antiarrítmicos, codeína, dextrometorfán y otros), CYP2C9 (metaboliza warfarina, glibenclamida, tolbutamida, AINE, fenitoína, losartán, celecoxib) y CYP2C19 (metaboliza omeprazol, citalopram, diazepam, imipramina, propranolol y fenitoína). Los pacientes que tienen mutados los dos alelos son metabolizadores lentos o pobres, y suelen tener una mayor eficacia y una mayor toxicidad, con la excepción de la codeína, para la que los metabolizadotes lentos presentan una falta de eficacia porque no se puede metabolizar a morfina.
El CYP2D6 metaboliza más de 100 fármacos utilizados principalmente para enfermedades psiquiátricas, neurológicas y cardiovasculares. Se han descrito más de 50 alelos diferentes, y de acuerdo al polimorfismo genético y la capacidad metabólica asociada los pacientes se pueden clasificar en: metabolizadotes lentos (tienen los dos alelos mutados y suponen el 6-8% en raza blanca,el 1% en japoneses y el 15% en nigerianos), intermedios (heterocigotos, sólo tienen un alelo mutado), rápidos (homocigotos, los dos alelos son normales) y ultrarrápidos (presentan una gran actividad enzimática porque poseen varias copias de los alelos activos y suponen el 1,5% en Escandinavia, el 7-8% en España y el 20% en Etiopía). Actualmente existen hospitales, principalmente en Escandinavia, donde se genotipa el CYP2D6 como ayuda para elegir la dosis individual en enfermedades psiquiátricas: a los pacientes metabolizadores lentos se les administra alrededor del 50% de la dosis habitual y a los ultra-rápidos una dosis dos o tres veces superior a la habitual. En la literatura se han publicado dos casos clínicos que nos demuestran la utilidad que puede tener la farmacogenética para evitar riesgos con medicamentos.
El primero es un caso de intoxicación por opiáceos en un paciente tratado con codeína publicado en New England Journal of Medicine en el año 2004.Se trataba de un paciente de 62 años con leucemia linfocítica crónica que presentaba un cuadro de astenia, fiebre, disnea y tos de tres días de evolución, que fue diagnosticado de neumonía bilateral y se trató con ceftriaxona, claritromicina y voriconazol. Además, recibió tratamiento con codeína 25 mg/8 horas para la tos. A los 4 días presentó un cuadro de depresión respiratoria diagnosticado de intoxicación por opiáceos y que revirtió con naloxona. El metabolismo de la codeína se produce en un 80% por la enzima CYP3A4,que da lugar a metabolitos inactivos, y en un 10% por CYP2D6,que produce morfina, que es la responsable de la acción terapéutica. En este caso se produjo una sobredosis por opiáceos porque toda la codeína se transformó en morfina, dado que el paciente era metabolizador ultra-rápido para CYP2D6, y el CYP3A4 estaba inhibido por claritromicina y voriconazol que estaba recibiendo el paciente.
El otro caso es parecido, pero con un desenlace fatal: la muerte de un bebé por prescripción de codeína a la madre, que se publicó en Lancet el año 2006. Después del parto la madre recibió tratamiento con paracetamol-codeína durante dos semanas para aliviar el dolor de la episiotomía. La dosis inicial fue la habitual (1.000 mg de paracetamol y 60 mg de codeína de liberación retardada cada 12 horas) pero, como presentó somnolencia y estreñimiento, a partir del tercer día se redujo a la mitad (500-30 mg cada 12 horas). El recién nacido sano estaba siendo amamantado, y el día 7 presentó dificultad para mamar y estaba aletargado, el día 12 tenía la piel gris y había dejado de mamar y el día 13 murió, detectándose en la autopsia niveles altos de morfina en sangre. La explicación es que la madre era metabolizadora ultrarrápida para CYP2D6 y el recién nacido era metabolizador normal, pero los neonatos no tienen capacidad para metabolizar la morfina. Si se hubiesen conocido estas características esta muerte se podría haber evitado.
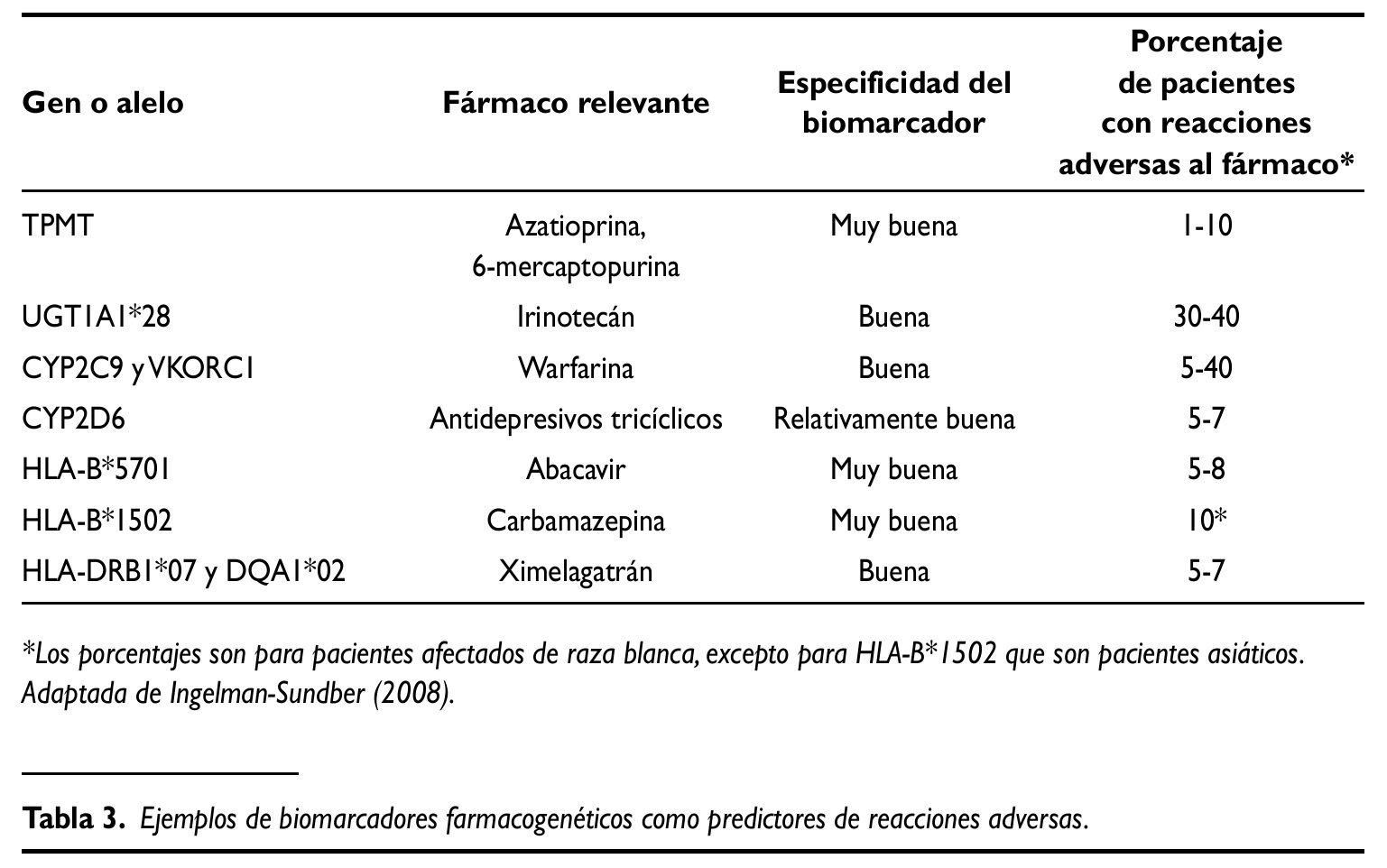
En la tabla 3 se pueden ver algunos ejemplos de biomarcadores farmaco-genéticos que nos puede ayudar a evitar reacciones adversas graves. Desgraciadamente no siempre es tan fácil la predicción de la respuesta. En la mayor parte de los casos se va a requerir el análisis de un gran número de genes para encontrar una capacidad predictiva útil en la clínica diaria.
Conclusiones
La individualización del tratamiento es necesaria para mejorar la eficacia y la seguridad de los fármacos, y será uno de los principales cambios en la práctica de la Medicina en los próximos 10-20 años.
La farmacogenética es el camino hacia la Medicina individualizada, y ya está llegando lentamente a la clínica para ayudar a seleccionar el fármaco más adecuado, a la dosis más adecuada para cada paciente concreto.
Como en la mayoría de los casos el efecto de los fármacos es poligénico se debe seguir investigando para buscar los biomarcadores adecuados y demostrar su utilidad en la práctica clínica diaria.
BIBLIOGRAFÍA RECOMENDADA
Alfirevic A, Pirmohamed M. Adverse drug reactions and pharmacogenomics: recent advances. Personalized Medicine. 2008;5:11-23.
Arranz MJ, Munro J, Birkett J, Bolonna A, Mancama D, Sodhi M, et al. Pharmacogenetic prediction of clozapine response. Lancet. 2000;355:1615-6.
Evans WE, McLeod HL. Pharmacogenomics - drug disposition, drug targets, and side effects. N Engl J Med. 2003; 348:538-49.
Evans WE, Relling MV. Pharmacogenomics: translating functional genomics into rational therapeutics. Science. 1999; 286:487-91.
Furuta T, Ohashi K, Kamata T, Takashima M, Kosuge K, Kawasaki T, et al. Effect of genetic differences in omeprazole metabolism on cure rates for Helicobacter pylori infection and peptic ulcer. Ann Intern Med. 1998;129: 1027-30.
Furuta T, Shirai N, Kodaira M, Sugimoto M, Nogaki A, Kuriyama S,et al. Pharmacogenomics-based tailored versus standard therapeutic regimen for eradication of H. pylori. Clin Pharmacol Ther. 2007;81:521-8.
Garijo B, de Abajo FJ, Castro MA, Lopo CR, Carcas A, Frías J. Hospitalización por fármacos: un estudio prospectivo. Rev Clin Esp. 1991;188:7-12.
Gasche Y, Daali Y, Fathi M, Chiappe A, Cottini S, Dayer P, et al. Codeine intoxication associated with ultrarapid CYP2D6 metabolism. N Engl J Med. 2004;351:2827-31.Erratum in: N Engl J Med. 2005;352:638.
Ingelman-Sundberg M. Pharmacogenomic biomarkers for prediction of severe adverse drug reactions. N Engl J Med. 2008;358:637-9.
Kirchheiner J, Brosen K, Dahl ML, Gram LF, Kasper S, Roots I, et al. CYP2D6 and CYP2C19 genotype-based dose recommendations for antidepressants: a first step towards subpopulation-specific dosages. Acta Psychiatr Scand. 2001;104:173-92.
Koren G, Cairns J, Chitayat D, Gaedigk A, Leeder SJ. Pharmacogenetics of morphine poisoning in a breastfed neonate of a codeine-prescribed mother. Lancet. 2006;368:704.
Lazarou J, Pomeranz BH, Corey PN. Incidence of adverse drug reactions in hospitalized patients: a meta-analysis of prospective studies. JAMA. 1998;279:1200-5.
Mallal S, Phillips E, Carosi G, Molina JM, Workman C,Tomazic J, et al. HLA-B*5701 screening for hypersensitivity to abacavir. N Engl J Med. 2008;358: 568-79.
Marra CA, Esdaile JM, Anis AH. Practical pharmacogenetics:the cost effectiveness of screening for thiopurine s-methyltransferase polymorphisms in patients with rheumatological conditions treated with azathioprine. J Rheumatol. 2002;29:2507-12.
Roses AD. Pharmacogenetics and drug development: the path to safer and more effective drugs. Nat Rev Genet. 2004;5:645-56.
Royal Society. Personalised medicines: hopes and realities. London: Royal Society; 2005. Consultado el 13 de junio de 2008. Disponible en: www.royalsoc.ac.uk/displaypagedoc.asp?id=15874
Zineh I, Gerhard T, Aquilante CL, Beitelshees AL, Beasley BN, Hartzema AG. Availability of pharmacogenomics-based prescribing information in drug package inserts for currently approved drugs. Pharmacogenomics J. 2004;4:354-8.