Introducción
En los últimos dos años ha cambiado notablemente el mapa de la política sanitaria española con varios acontecimientos de enorme trascendencia que plantean un nuevo escenario de futuro.
El primer hecho es la culminación de las transferencias del Insalud el 1 de enero de 2002 a las 10 comunidades autónomas gestionadas hasta entonces por la administración general del Estado, con lo que se cerró el mapa transferencial que comenzó 18 años antes.
Junto con las ventajas inherentes de las transferencias: fortalecimiento del Estado de las autonomías, acercamiento local de las decisiones, corresponsabilidad de todas las autonomías en la política y gestión sanitarias, etc., también se produjo algún efecto negativo. El principal, a corto plazo, es la pérdida del referente Insalud, que venía siendo el servicio de comparación y reflejo de la política sanitaria estatal, con lo que se produjo un cierto grado de "atomización" del Sistema Nacional de Salud.
El segundo hecho es el cambio de modelo de financiación autonómica. Coincidiendo con las transferencias se implantó un nuevo modelo que incluye como variables la población total, la población mayor de 65 años y la insularidad. Junto a ello se incorpora un fondo de cohesión y la corresponsabilidad fiscal con la posibilidad de implantar un nuevo impuesto minorista sobre hidrocarburos destinado a la financiación finalista de la sanidad. Hay que destacar que ya hay una comunidad (la de Madrid) que ha implantado este nuevo impuesto que se ha dado en llamar "el céntimo sanitario".
El tercer hecho es la aprobación de la Ley 16/2003 de Cohesión y Calidad del Sistema Nacional de Salud que, según señala en la exposición de motivos "establece acciones de coordinación y cooperación de las Administraciones públicas sanitarias como medio para asegurar a los ciudadanos el derecho a la protección de la salud, con el objetivo común de garantizar la equidad, la calidad y la participación social en el Sistema Nacional de Salud". Obviamente uno de los puntos de colaboración de esta ley se centra en la farmacia.
Por todo ello parece pertinente hacer una reflexión sobre la situación actual de la cohesión del Sistema Nacional de Salud desde el punto de vista de la industria farmacéutica.
Entre los elementos vertebradores del sistema hay dos tipos de estructuras que pueden contribuir a unificar criterios y actuaciones. Una estructura es interna y es el Consejo Interterritorial del Sistema Nacional de Salud, que en estos momentos está tomando protagonismo y recuperando su papel armonizador, sobre todo después de la promulgación de la citada Ley, como veremos posteriormente. Las estructuras externas que pueden contribuir a cohesionar la situación actual, según varios analistas y expertos consultados, serían las organizaciones profesionales, sindicales y empresariales entre las que se encuentra Farmaindustria. En estos casos se trata de entidades estatales con interés coincidente en la existencia de un "mercado uniforme", tanto en lo profesional o laboral de una parte, como en la prestación farmacéutica de otra.
Por ello, una conclusión inicial es reconocer la capacidad de cohesionar el sistema que tiene Farmaindustria y las acciones emprendidas, o que pueda emprender, en aras de cohesionar el Sistema Nacional de Salud.
Desde un punto de vista ideológico los componentes esenciales de esta vertebración serían laequidadde acceso para todos los ciudadanos y el mantenimiento de launidad de mercado en todo el Estado. Todos los riesgos de futuro, así como las oportunidades de mejora que se puedan plantear, deberían basarse en estas dos ideas de fuerza: equidad y unidad de mercado.
La industria española es el quinto mercado de la Unión Europea (UE) y el séptimo mundial; tiene una potencia creciente en I + D + I y es copartícipe del prestigio científico y profesional de la sanidad española, por lo que la ruptura de la equidad y unidad de mercado perjudicaría no sólo al tejido industrial, sino además a las inversiones en investigación que se realizan en nuestro país y que podrían ser canalizadas a otros entornos más favorables.
Ámbitos competenciales
En aras de la estabilidad del sistema y de un futuro asumible se deben mantener estrictamente los ámbitos competenciales actuales en relación con el mercado farmacéutico:
1. En la administraciónestatallaregulación de la oferta:aprobación, registro, fijación de precio y financiación.
En este caso la Ley actual incorpora la presencia de las comunidades autónomas en el Consejo Rector de la Agencia Española de Medicamentos y Productos Sanitarios (Art. 32) y traslada al Consejo Interterritorial del Sistema Nacional de la Salud la recomendación sobre "los criterios generales y comunes de los conciertos con oficinas de farmacia garantizando la igualdad efectiva de la dispensación en todo el territorio nacional, independientemente de su comunidad autónoma de residencia" (Art. 71).
2. En la administraciónautonómica laregulación de la demanda: visita médica, regulación de estudios post-autorización, proceso prescripción-dispensación-facturación, guías de prescripción, etc. En este segundo caso es imprescindible que la regulación sea homogénea y desarrolle los mismos principios básicos, pues de lo contrario se podría atomizar el sistema rompiendo los principios de equidad y unidad de mercado. También en alguno de estos puntos la Ley de Cohesión y Calidad tiene referencias específicas. En lo relacionado con la industria farmacéutica cuando hablamos de unidad de mercado lo hacemos en el amplio sentido del término, que incluye desde la unidad de investigación, pasando por la de formación y promoción, hasta la unidad de comercio.
Aspectos específicos a considerar
Gasto farmacéutico
Hay una preocupación global sobre el crecimiento del gasto farmacéutico por receta en todas las comunidades (tanto las recientemente transferidas como las anteriores).
Sobre este punto hay varios factores que debemos considerar. La industria farmacéutica es un sector innovador, y por lo tanto tiene efecto locomotora sobre el resto de la economía, por lo que su crecimiento suele estar y debe hacerlo al menos al nivel del PIB nominal. Este hecho es compartido por todos los sectores productivos innovadores.
La industria, pese a ser la innovadora en la cadena producción-distribución-dispensación del medicamento, sólo es responsable del 60 % del gasto por receta, ya que el 40 % restante se atribuye a las oficinas de farmacia y a la distribución. Por lo tanto cuando se analiza el crecimiento del gasto hay que considerar no sólo a la industria farmacéutica sino también al resto de la cadena hasta que el medicamento llega al paciente.
El crecimiento en los tres últimos años ha tendido a desplazarse desde el incremento en el precio medio por receta al incremento del número de recetas. En 2002 el número de recetas se incrementó un 6,4 % y el precio medio por receta sólo un 3,3 %. Curiosamente el gasto medio por receta ha crecido por debajo del incremento del IPC. Así en los tres últimos años el incremento acumulado del IPC ha sido del 10,7 % y el del gasto medio por receta del 9,4 %. Todo ello indica que el crecimiento del gasto tiene más que ver con los fenómenos que producen un incremento de recetas que con el encarecimiento aislado de los medicamentos, dado que el incremento que puedan suponer las innovaciones se ha tamponado con la aplicación de precios de referencia y mayor utilización de genéricos.
Las posibles causas de este aumento del número de recetas pueden estar en el envejecimiento de la población, el incremento de la misma, esencialmente debido a fenómenos migratorios, y en la generalización de programas preventivos (detección precoz de factores de riesgo y su tratamiento). Sin entrar en mayores detalles sólo apuntar dos datos: en los años 2000 y 2001 la población española creció en más de 1.300.000 habitantes (frente a los poco más de 100.000 anuales que crecía en años previos), y en los últimos tres años se incorporan a tratamientos con hipolipemiantes más de 200.000 personas al año y otras tantas a tratamientos antihipertensivos.
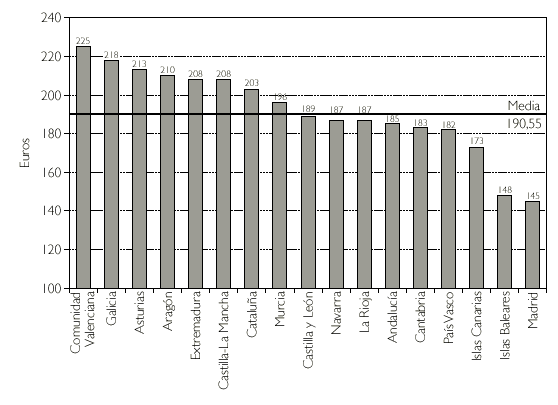
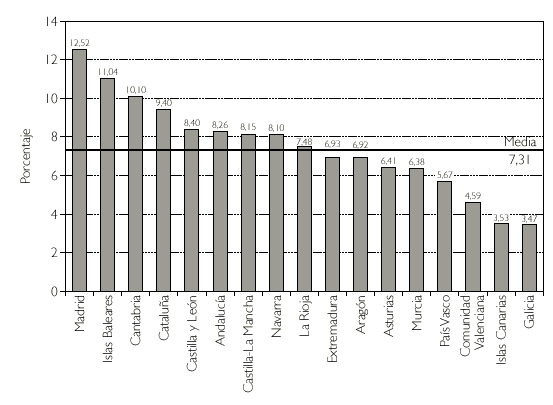
Otro hecho destacable es la notable diferencia entre comunidades en el gastoper capita, y en el porcentaje de envases de genéricos prescritos en 2002 (figs. 1 y 2). Las diferencias existentes en estos dos marcadores probablemente reflejen diferencias de estructura sociodemográfica y sus variaciones, así como la existencia de diferentes culturas sanitarias en la prescripción farmacéutica.
Figura 1.Gasto per capitapor CC.AA. en 2002.
Figura 2.Genéricos por CC.AA. (% recetas) en 2002.
Así pues, el análisis de los factores del incremento del gasto debe realizarse conjuntamente por el Ministerio, las Comunidades Autónomas, la industria, y el resto de actores de la cadena del medicamento para que la toma de decisiones se realice sobre argumentos sólidos.
Es llamativo que siendo la principal preocupación de las Comunidades Autónomas (CC.AA.) el incremento del gasto farmacéutico por receta, algunas han tomado medidas políticas que lo incrementan, modificando el techo de las prestaciones farmacéuticas. Todo ello con independencia de las aportaciones terapéuticas o sociales que conllevan dichas medidas. Así citaremos:
1. Andalucía: financia todos los medicamentos incluidos en el Real Decreto 1663/1998 sobre exclusión de la financiación con cargo a fondos de la Seguridad Social de determinados medicamentos ("medicamentazo 2").
2. Baleares: incluyó en los presupuestos de 2003 la financiación de fármacos para la disfunción eréctil en pacientes crónicos, así como la píldora postcoital.
3. Castilla y León: ha decidido disminuir la aportación de antifúngicos y antivirales en pacientes con cáncer de un 40 % a un 10 %, con un máximo de 2,64 euros por receta.
3. Extremadura: ha anunciado recientemente la intención de financiar el 100 % de los medicamentos prescritos a familias numerosas y a enfermos crónicos menores de 14 años.
Como vemos ya se ha producido de hecho una ruptura de la unidad de financiación en diferentes Comunidades, con un incremento adicional del gasto y con un techo de prestaciones que no son similares en todas las CC.AA., y que de alguna forma podría entrar en colisión con la redacción de la Ley "garantizando la igualdad efectiva de dispensación en todo el territorio nacional, independientemente de la comunidad autónoma de residencia".
Visados
La posibilidad de aplicar visados a varios productos en diversas CC.AA. rompería la homogeneidad estatal y abre la puerta a 17 regulaciones diferentes de visados dependiendo de los objetivos particulares de cada una de ellas.
Además, conlleva el riesgo para el paciente de que con una prescripción de una CC.AA. le nieguen la dispensación en una oficina de farmacia de otra, si ésta exige el visado para el producto prescrito, al no poder facturar la oficina de farmacia una receta sin visado a su Servicio Regional de Salud.
Así pues, un desarrollo no armónico de este punto alteraría la unidad de mercado y puede limitar la libe circulación de pacientes al alterar la homogeneidad estatal del proceso prescripción-dispensación.
Desde un punto de vista teórico los visados deberían responder a razones puramente sanitarias por las especiales características de un medicamento y ser de implantación nacional.
En el trámite parlamentario de la Ley de Cohesión respecto a las competencias del Estado en materia de farmacia se eliminó la frase "así como las condiciones especiales de prescripción y dispensación de medicamentos en el Sistema Nacional de Salud", no obstante, el Real Decreto 1087/2003 que establece la estructura orgánica del Ministerio de Sanidad y Consumo atribuye a la Dirección General de Farmacia y Productos Sanitarios "la fijación de las condiciones especiales de prescripción y dispensación de medicamentos en el Sistema Nacional de Salud, en particular el establecimiento de visados previos a la dispensación". Adicionalmente y para clarificar la situación la Ley de Medidas Fiscales, Administrativas y del Orden Social de 2004 incluye nuevamente en la Ley de Cohesión la frase anteriormente citada explicando en las justificaciones que su ausencia se debió a un "fallo informático".
En este momento en Andalucía desde el 1 de septiembre de 2003 el Servicio Andaluz de Salud (SAS) ha dispuesto la necesidad de visado para los antipsicóticos atípicos. Esta decisión ha sido recurrida en contencioso administrativo por el Ministerio de Sanidad y Consumo en defensa de sus competencias, pero mientras no haya resolución se sigue aplicando.
Un caso diferente es el de Galicia que estableció, en mayo de 2003, un Decreto de homologación sanitaria de recetas (DOG 9-5-03) en el que precisarán homologación todos los medicamentos que establezca el Ministerio que precisen visado y los que determine el Sergas "debido a sus características especiales de utilización". Tras un requerimiento del Ministerio de Sanidad y Consumo se acaba de publicar un nuevo Decreto (DOG 26-1-04) que rectifica el anterior limitando la homologación sólo para los medicamentos a los que el Ministerio imponga visado, excluyendo al Sergas de esta competencia. Así pues, se cumple escrupulosamente la legislación vigente.
De otra parte, en el momento de escribir estas líneas el País Vasco tiene en trámite de audiencia una Orden por la que impondría visado a todos los inhibidores de la bomba de protones, excepto el omeprazol. Aunque durante dicho trámite están reconsiderando su implantación y en su lugar utilizar otras herramientas de gestión de la prescripción. Habrá que esperar la decisión final en la confianza de que vaya en la misma línea que Galicia.
Así pues, en este momento no sólo hay alguna regulación que rompe la cohesión en el Sistema, sino que además plantea un conflicto de competencias entre la Administración General del Estado y las CC.AA., que para el beneficio de todos, debería resolverse a la mayor brevedad y siempre buscando la cohesión y no la atomización.
Por otra parte una reciente sentencia del Tribunal de la Competencia da la razón al antiguo Insalud de Madrid y a dicha CC.AA. reconociendo que "la recomendación del uso de especialidades farmacéuticas de menor coste es legítima, en base a los principios de eficiencia y economía que deben regir la utilización de los fondos públicos, en cuanto va dirigida a la reducción del gasto público, y por lo tanto, a una finalidad de interés general". Por cosiguiente si el uso de "herramientas de gestión" es legítimo y aún queda recorrido por delante, recurrir a medidas de dudosa legalidad, como la introducción de visados, induce a pensar tanto en una confrontación entre administraciones como en el auto-reconocimiento de un fracaso en la gestión de la política farmacéutica.
Receta por principio activo
Fue iniciada por Andalucía y posteriormente se ha ido ampliando a otras comunidades (Extremadura, Madrid, Aragón, Castilla La Mancha, etc.) tras los conciertos firmados entre consejerías y colegios de farmacéuticos. En estos casos la prescripción por principio activo no se limita a los conjuntos de especialidades farmacéuticas aprobados por el Ministerio de Sanidad y Consumo; es decir, aquellos en los que hay presentaciones con bioequivalencia demostrada. Además, la lista de principios incluidos no es idéntica en todas las comunidades y el tope de financiación fijado por cada una no es el mismo (en unos casos los dos más baratos, en otros tres, etc.).
La ruptura del marco de la bioequivalencia, al sobrepasar los conjuntos establecidos por el Ministerio de Sanidad y Consumo, además de los riesgos sanitarios que comporta la sustitución de productos no demostradamente bioequivalentes, abre la puerta a la posibilidad de que haya 17 listas de principios activos con diferentes topes de financiación, y por tanto 17 mercados. La Ley de Cohesión y Calidad en su disposición adicional tercera contempla un nuevo desarrollo de los precios de referencia y establece que cuando se prescriba por principio activo sometido a precio de referencia se debe dispensar el genérico de menor precio. La Orden ministerial que desarrolla la Ley ha entrado en vigor el 1 de enero de 2004 bajando los precios de referencia de más de 2.000 presentaciones farmacéuticas, en algunos casos en porcentajes espectaculares. Aunque la norma clarifica notablemente el tema y muchos de los conciertos vigentes entre consejerías y colegios de farmacéuticos deberán modificarse para adaptarse a la nueva legislación, permanece la laguna de la prescripción por principio activo en los no sometidos a precio de referencia, y si no se unifica la norma en todas las CC.AA. seguirá existiendo el riesgo antes citado de 17 posibles listas de principios activos.
De cara a los pacientes, y tal como señalábamos anteriormente, la existencia de estas diferencias puede impedir la dispensación en una CC.AA. de un producto recetado por principio activo en otra si las listas no son idénticas. Nuevamente se alteraría tanto la equidad como la movilidad de los pacientes al haber un proceso prescripción-dispensación no homogéneo.
Regulación de ensayos clínicos y estudios postautorización
Los ensayos clínicos están regulados en todo el Estado por un Real Decreto (561/1993) y en este momento el Ministerio de Sanidad está elaborando un nuevo Decreto para trasponer la Directiva europea 2001/20/CE. Esta secuencia de acontecimientos puede crear un entorno muy favorable para la investigación al tener una normativa homogénea no sólo dentro del Estado, sino en el espacio de la UE.
En el caso de los estudios postautorización ocurre lo contrario. La capacidad normativa es competencia de las CC.AA. y hay directrices muy diferentes, con desigual rango normativo y con aplicaciones prácticas dispares. Este hecho dificulta enormemente la investigación de ámbito nacional al tener que adecuarse a diferentes regulaciones un mismo estudio, ya que pone en riesgo el desarrollo de redes de investigación, puede atomizar la investigación y distanciar a los profesionales de Atención Primaria de la misma. Con ello, España puede perder posibilidades de investigación frente a países de nuestro entorno que tengan una regulación nacional unitaria y en los que las facilidades administrativas posibiliten la captación de fondos de investigación de las empresas transnacionales.
La ruptura del mercado único estatal, además de lo ya citado, puede poner en riesgo la farmacovigilancia, dado que una parte importante de los conocimientos en esta materia se obtienen de los estudios postautorización. Una cosa es diferenciar entre los estudios serios de farmacovigilancia y aquellos otros de menor calado científico y otra negar de forma sistemática por la vía de los hechos este tipo de estudios.
En el lado positivo la regulación de los estudios postautorización realizada por Cataluña no sólo es pionera y un ejemplo a seguir, sino que además ha realizado un ejercicio de transparencia, y en la página web de la Consejería se actualiza permanentemente el estado de autorización de los diferentes estudios solicitados. La utopía posible sería armonizar las regulaciones de las demás CC.AA. con este modelo.
Visita médica
Entre las comunidades transferidas en 2002 Madrid y Castilla La Mancha han regulado la visita médica en circulares recientes. Hasta ahora las regulaciones existentes son las siguientes:
1. CC.AA. transferidas 01-01-2002 (excepto Madrid): Circular Insalud 7/1988.
2. País Vasco: Circular 22/1988 de Osakidetza (aclaraciones en septiembre de 1992).
3. Andalucía: Circular 13/1991 del SAS.
4. Galicia: Circular 1/1992 del Sergas.
5. Canarias: Resolución 1997/113 del Servicio Canario de Salud.
6. Cataluña: Instrucción 07/1997 del Institut Català de la Salut.
7. Comunidad Valenciana: Circular 2/2001 de la Consellería de Sanitat.
8. Comunidad de Madrid: Circular 1/2002 de la Consejería de Sanidad (BOCM 2-12-02).
9. Comunidad de Castilla La Mancha: Circular 5/2003 del Sescam (DOCM 28-11-03).
En el momento de escribir este artículo existen borradores de circulares en diferente grado de desarrollo en Cataluña y la Comunidad Valenciana.
Si esta regulación no es homogénea en todo el Estado se alterarían las posibilidades de información similar de los profesionales sanitarios en las diferentes comunidades, además de modificar el marco de relaciones laborales entre la industria y los visitadores médicos (unos 12.500 en toda España) con el riesgo de llegar a múltiples regulaciones laborales de cada laboratorio con sus trabajadores en diferentes autonomías. También es de destacar la importante pérdida de puestos de trabajo que se produciría si las regulaciones son tan restrictivas como las dos más recientes, que suponen, sólo en Atención Primaria, disminuir las visitas un 25 % sobre la situación actual.
Receta electrónica
Varias comunidades están trabajando en el desarrollo de la receta electrónica y la conexión entre los prescriptores, los organismos gestores y las oficinas de farmacia de su territorio (Galicia, País Vasco, Madrid, Andalucía, Comunidad Valenciana). De hecho Andalucía acaba de anunciar que, tras concluir el estudio piloto, la extenderá a todos los centros de salud en 2004 y a urgencias y consultas de especialidades en el primer trimestre de 2005.
Sin duda la receta electrónica es un avance notable y su implantación aportará a las administraciones públicas una informaciónon-line sobre la facturación y el gasto, con la consiguiente mejora de la información sobre el proceso prescripción-dispensación. Sin embargo, si los sistemas que se utilizan en las diferentes comunidades no son compatibles se comprometería gravemente la dispensación fuera de la CC.AA. de origen.
Como aspecto positivo de enorme trascendencia hay que resaltar que la propia Ley de Cohesión (Art. 33) señala literalmente que "se tenderá [...] a la implantación de la receta electrónica, en cuyo desarrollo participarán las organizaciones colegiales médica y farmacéutica". Por lo tanto ya hay una meta y además una metodología. La meta es la implantación de la receta electrónica y la metodología es que en su desarrollo participen las organizaciones de los prescriptores y los dispensadores, lógicamente junto con todas las administraciones representadas en el Consejo Interterritorial del Sistema Nacional de Salud. En paralelo a estos hechos el Ministerio de Ciencia y Tecnología ha convocado un concurso para el diseño global de la receta electrónica en todo el Estado.
También por lógica el sistema debe ser de ámbito estatal para no colisionar con la movilidad geográfica de los ciudadanos, o que ésta sea incompatible con el sistema prescripción-dispensación.
Además, puede ser un instrumento de cohesión interterritorial al posibilitar el conocimiento inmediato de las facturaciones cruzadas, al analizar la comunidad de residencia del usuario y aquella en las que se ha realizado la dispensación; es decir, el gasto.
Tasas
Hasta el momento las únicas tasas existentes sobre la investigación o promoción de medicamentos eran de ámbito estatal, fijadas por la Agencia Española del Medicamento: el procedimiento de calificación de un producto de uso humano en fase de investigación clínica (2.080 euros) y el procedimiento de autorización o presentación de notificación de ensayos clínicos con medicamentos de uso humano (95 euros).
No obstante, este marco estatal y único se rompió con la aparición de tres nuevas tasas en la Ley 13/2002 de Medidas Fiscales y Administrativas de la Comunidad de Madrid que entró en vigor en enero de 2003. Éstas son:
1. Tasa por inspección de ensayos clínicos (que puede ser por solicitud del investigador o del promotor, o bien de oficio): 600 euros/jornada (es decir, por día de trabajo de la inspección).
2. Tasa por solicitud de estudios postautorización: 450 euros por solicitud.
3. Tasa por elaboración y planificación de la visita médica: 120 euros por cuatrimestre.
La aparición de estas tasas en Madrid tiene un doble efecto: de una parte aumenta la presión fiscal sobre la industria farmacéutica y de otra aumenta la fiscalidad de la investigación (ensayos clínicos y estudios postautorización) incluso con tarifas en estos estudios superiores a las estatales de ensayos clínicos.
Como era previsible el efecto "contagio" de nuevas tasas ya se ha producido y en Andalucía la Ley 18/2003 por la que se aprueban medidas fiscales y administrativas (Arts. 95-100), que entró en vigor en enero de 2004, ha introducido nuevas tasas: por solicitud de ensayos clínicos (494 euros), por solicitud de estudios postautorización (454 euros), por ampliación de centros (158 euros) y por modificaciones mayores de los protocolos (244 euros). Además, crea una nueva tasa por acreditación de actividades de formación continuada de las profesiones sanitarias.
Aparte del incremento de la fiscalidad sobre el sector los dos aspectos que más deberían preocupar en un entorno transferencial son la posible aparición de fiscalidades diferentes en las 17 comunidades, rompiendo así la unidad de mercado y el incremento de los costes de la investigación con su consiguiente efecto negativo sobre el I + D + i de la industria farmacéutica y los sistemas sanitarios, al detraer parte de los fondos al pago de tasas administrativas.
Demora en el pago de las facturas de hospitales
Ya antes de las últimas transferencias sanitarias había notables diferencias en el abono de las facturas por suministros hospitalarios entre las diferentes comunidades transferidas y el territorio Insalud. La demora media para el abono de dichas facturas oscilaba entre los máximos de 579 y 315 días en dos comunidades transferidas y los mínimos de 78 días en otra y los 91 días del Insalud.
Tras el último proceso transferencial el abanico de demora se ha abierto y a finales de 2002 hay 17 demoras diferentes en las 17 CC.AA., que oscilan entre máximos de 609 y 359 días y mínimos de 93 y 102 días. Pero incluso dentro de ellas hay variaciones muy importantes entre unos hospitales y otros, que en algunos casos superan los dos años de demora.
Lógicamente, este hecho constata que en el puro mercado de compra hospitalaria ya se había producido la ruptura del mercado único y últimamente se ha agudizado.
Además, con la entrada en vigor de la directiva europea en agosto pasado sobre morosidad (pendiente de transposición en España y ya en trámite parlamentario como "Proyecto de Ley por la que se establecen medidas contra la morosidad en operaciones comerciales", pero vigente desde el pasado agosto) los gastos financieros se incrementarán, dado que fija unos intereses de demora del euribor en más de 7 puntos, por lo que las reclamaciones de intereses que la industria de electromedicina, laboratorios farmacéuticos u otros proveedores realicen incrementarán notablemente la factura de los servicios de salud, con una distribución regional irregular que puede ser importante para las comunidades con mayor demora.
Farmacotecnia hospitalaria
En los últimos meses se han presentado a congresos nacionales y publicado resultados de algunos hospitales de Andalucía en los que elaboran determinados medicamentos en el servicio de farmacia (cápsulas, jeringas precargadas y mezclas intravenosas) partiendo de materias primas para conseguir un ahorro de costes. Esta actuación, además de los posibles problemas legales que plantea, puede acabar convirtiendo los servicios de farmacia hospitalaria en "mini-industrias" farmacéuticas que encapsulen o preparen medicamentos que ya existen en el mercado bajo los argumentos de ahorro de costes o de preparación de dosis ajustadas a cada paciente.
Adicionalmente al efecto de distorsión que produce en la industria, en algunos casos esta elaboración se realiza con productos altamente teratogénicos, con los consiguientes riesgos para el personal que los manipula. Parecería más razonable que en el entorno de desarrollo social, económico y sanitario que nos encontramos sea la industria la que fabrique medicamentos y que los hospitales realicen las prestaciones sanitarias que les son propias sin invadir campos ajenos.
Conclusión
Los puntos señalados anteriormente abren un amplio abanico de incertidumbres tanto para el Ministerio de Sanidad y las CC.AA. como para la industria farmacéutica y, especialmente, pueden alterar la equidad de los ciudadanos ante el sistema sanitario y llegar a un punto en el que el proceso prescripción-dispensación sea un obstáculo a la libre circulación de los mismos en el territorio nacional.
Junto a los riesgos de equidad hay que advertir de los riesgos de fragmentar el Estado en 17 mercados diferentes, máxime cuando estamos en un escenario de integración europea creciente. Adicionalmente se debe velar porque ninguna medida disgregadora ponga en riesgo la I + D + I en los campos cubiertos por la industria farmacéutica, o incluso el objeto esencial de la propia industria que es la investigación, producción y comercialización de medicamentos. Es más, en un marco internacional deberíamos hacer un esfuerzo para ser competitivos y atraer inversiones en I + D + I a nuestro país. Resulta evidente que en un mundo globalizado estas inversiones fluyen hacia los entornos más favorables y las trabas administrativas no son un buen reclamo para atraerlas.
Es importante resaltar la disposición de Farmaindustria para desempeñar un notable papel vertebrador del sistema, manteniendo posiciones homogéneas en todo el territorio nacional y su apuesta por el diálogo y la armonización con todas las Administraciones.
El momento actual será difícilmente repetible. La aprobación de la Ley de Cohesión y Calidad del Sistema Nacional de Salud proporciona un marco legal en el que armonizar y vertebrar el sistema. La enumeración de los puntos anteriores debe interpretarse más que como una mera descripción de problemas como un listado de oportunidades que nos brinda la Ley. Tanto la letra como el espíritu de la misma ya apuntan posibles soluciones, por ello cuanto antes se obtengan resultados mejor para todos. Sería deseable que en pocos meses se pudiera cambiar el título del presente artículo por el siguiente "La cohesión farmacéutica: una realidad".
La oportunidad histórica que se nos brinda es la de evitar todos los riesgos anteriormente señalados y trabajar conjuntamente (administraciones e industria) en la equidad de los ciudadanos al acceso a las prestaciones del sistema sanitario (en nuestro caso a la prestación farmacéutica) y en la potenciación de un mercado farmacéutico único en los aspectos de investigación, promoción, formación y comercialización.
*Una versión anterior de este artículo ha sido publicada en: Ars Medica. Revista de Humanidades 2003;2: 199-209. El autor agradece a la editorial y dirección de dicha revista la autorización para realizar esta publicación, que amplía y actualiza la anteriormente citada.