A cabergolina é um agonista dopaminérgico e apresenta efeito de supressão sobre a prolactina. É usada para o tratamento de hiperprolactinemias em pacientes inférteis e na prevenção da síndrome da hiperestimulação ovariana nos ciclos de fertilização in vitro.
ObjetivoFazer revisão sistemática dos estudos que avaliaram a segurança do uso da cabergolina na embriogênese e na gestação.
MétodoRevisão sistemática dos trabalhos publicados nos últimos 23 anos que relacionaram o uso de cabergolina no período gestacional com um possível efeito teratogênico. Esses estudos estavam disponíveis nas bases de dados científicas Medline, Lilacs e Scielo. Os descritores de busca usados foram cabergoline, pregnancy e teratogen.
ResultadosForam selecionados 12 artigos publicados de 1994 a 2013. Verificou‐se a existência de cerca de 800 casos de gestantes expostas à cabergolina. A maioria dos artigos revisados demonstrou que a cabergolina é uma opção segura para o concepto e para a evolução da gestação. O uso não aumentou o risco de malformação fetal, aborto e parto prematuro.
ConclusãoOs dados referentes ao uso da cabergolina durante a gravidez tornam‐se cada vez mais consistentes e grande parte dos artigos demonstra a confiabilidade e segurança desse medicamento.
Cabergoline is a dopaminergic agonist and exhibits a suppression effect on prolactin. It is used to treat hyperprolactinemia in infertile patients and to prevent the ovarian hyperstimulation syndrome in vitro fertilization cycles.
ObjetiveA systematic review on the literature looking for studies that evaluate the safety use of Cabergoline in the embryogenesis and in pregnancy.
MethodSystematic review of articles published in last 23 years that try to establish the relationship between the use of Cabergoline in the gestational period with a possible teratogenic effect. The papers were available in the following scientific databases: Medline, Lilacs e Scielo. The key words used were cabergoline, pregnancy and teratogen.
ResultsTwelve articles published from 1994 to 2013 were selected. It has been found that 800 pregnant women were exposed to cabergoline. Most of the papers analysed showed that the cabergoline is a safety alternative for theconceptus and for the pregnancy outcome. Its use did not increase the risk of fetal malformation, miscarriage and premature birth.
ConclusionData regarding the use of cabergoline during pregnancy have become increasingly consistent, and most articles have demonstrated the reliability and safety of this drug.
O interesse pelo conhecimento, pela prevenção e pelo tratamento das anomalias do desenvolvimento humano tem aumentado progressivamente, principalmente quando os medicamentos são agentes etiológicos dessas anomalias. A possível relação do uso de fármacos durante a gravidez com o aparecimento de eventos adversos sobre o embrião e o feto gera um grande número de dúvidas.1
Segundo Dicke (1989, apud Schuler‐Faccini et al., 2011), um agente teratogênico é externo ao genoma e pode ser definido como qualquer substância, organismo, agente físico ou estado de deficiência que, presente durante a vida embrionária ou fetal, produz uma alteração na estrutura ou na função da descendência e gera, por exemplo, malformações fetais.1 O primeiro trimestre da gravidez é o período em que a teratogenicidade é mais elevada independentemente da droga usada.2
A cabergolina é um agonista dopaminérgico derivado do ergot com meia‐vida longa (63‐69 horas)3 e apresenta uma potente e prolongada atividade redutora de prolactina4,5 que pode durar até três meses.5,6 É uma medicação usada para o tratamento de hiperprolactinemias em pacientes inférteis6‐8 e prevenção da síndrome de hiperestimulação ovariana nos ciclos de fertilização in vitro.9‐14
Em comparação com outras drogas agonistas dopaminérgicas, a cabergolina se sobressai pelo maior tempo de efeito, pela melhor tolerância e eficácia, principalmente quando comparada com a bromocriptina (BRC),3,15‐17 medicação mais usada no tratamento da hiperprolactinemia3,4,6‐8 e da síndrome da hiperestimulação ovariana.
Estudos indicam que a bromocriptina pode atravessar a barreira placentária e, embora não seja formalmente demonstrado, é provável que a cabergolina tenha esse atributo.18 Usualmente esses fármacos são descontinuados após a confirmação da gestação, mas há ocasiões, como no crescimento de prolactinomas durante a gravidez, que se faz necessário o uso dessas medicações.19 No tratamento da hiperprolactinemia a exposição fetal ao medicamento pode ocorrer pelo menos três a quatro semanas, até se constatar a concepção e permitir a suspensão da medicação.16
A cabergolina, como uma opção de agonista dopaminérgico, melhorou muito o tratamento e a qualidade de vida das pacientes,8,16 mas ainda é necessário avaliar a segurança do uso durante a gestação.17,18 Como se trata de uma medicação lançada no mercado posteriormente à bromocriptina,20 não existem muitos estudos que autorizam o uso na gravidez, o que justifica este estudo. Este trabalho tem como objetivo fazer uma revisão sistemática dos estudos que avaliaram a segurança do uso da cabergolina na embriogênese e na gestação.
MétodoFoi feita uma busca nas bases de dados do Medical Literature Analysis and Retrieval System Online (Medline), Scientific Electronic Library Online (Scielo) e Literature Latin American and Caribbean (Lilacs) de julho de 2013 a fevereiro de 2014, com os seguintes descritores: carbegoline, pregnancy e teratogen.
Os artigos publicados entre 1990 e 2013 escritos nas línguas inglesa, espanhola e portuguesa que apresentavam metodologia adequada foram incluídos na análise. A seleção dos estudos foi feita por dois autores de forma independente e cega, que obedeceram aos critérios de inclusão. Nos casos em que houve discordância entre os dois primeiros autores, a opinião de um terceiro autor foi empregada.
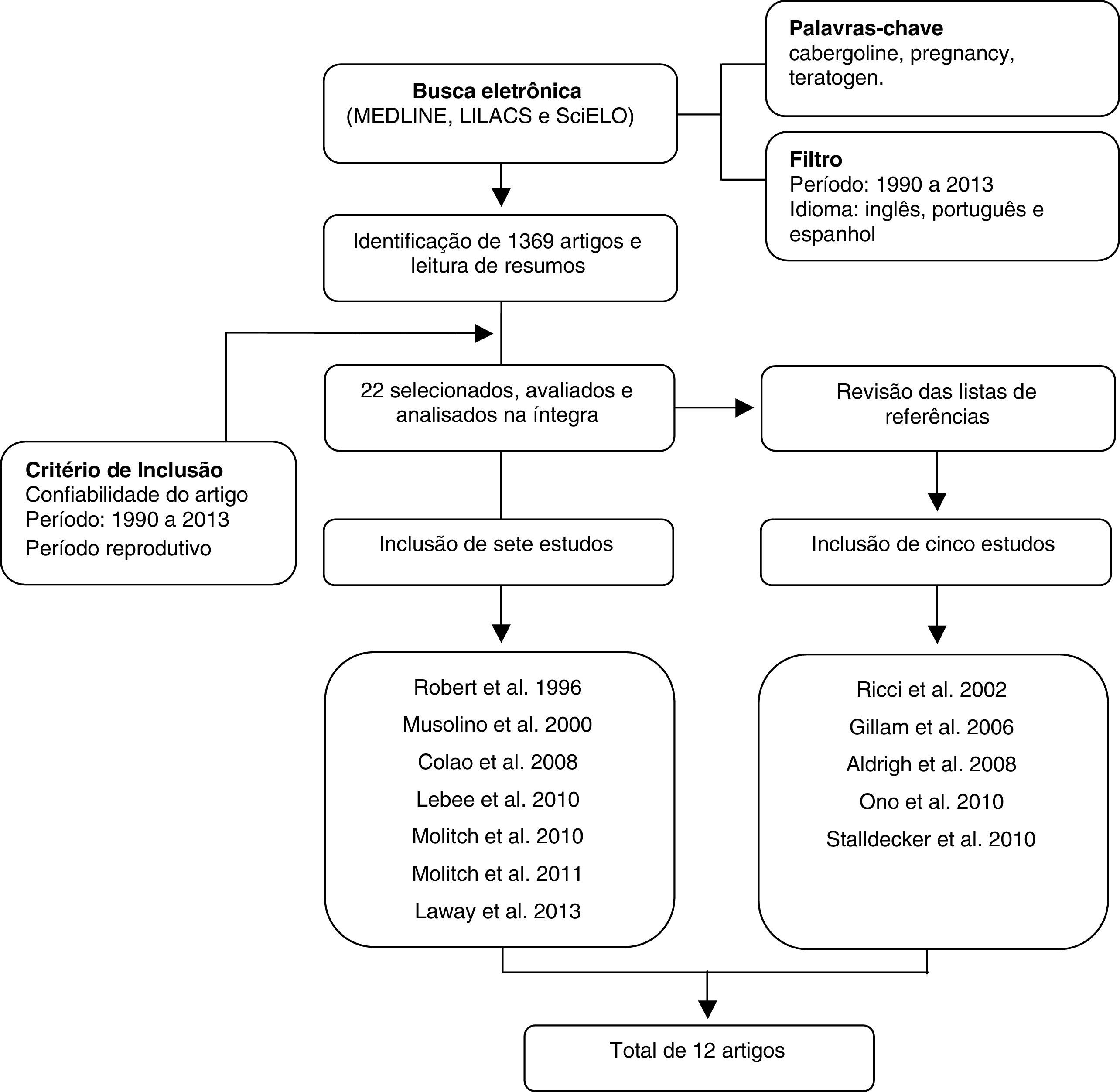
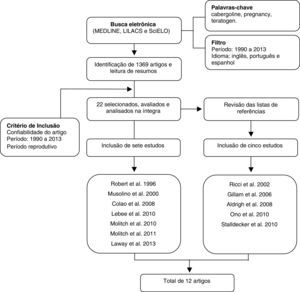
Dos 1.140 artigos levantados, 10 foram excluídos por estar em mais de uma base de dados. Os 1.130 restantes foram analisados e 22 deles usaram a cabergolina no período gestacional. Desses, sete foram escolhidos por se enquadrar nos critérios de inclusão e por relacionar o uso da cabergolina com a teratogênese. As listas de referência desses sete artigos foram analisadas para verificar a possibilidade de inclusão de novos estudos que abordassem o tema. Cinco estudos que obedeciam aos critérios propostos foram incluídos e o total foi de 12 trabalhos.
Para análise dos dados procedeu‐se à tabulação dos estudos encontrados com a distribuição dos artigos por ano, autores, tipo de estudo, população e resultados para avaliação comparativa. Como se trata de uma revisão de dados da literatura, não foi necessária aprovação do Comitê de Ética em Pesquisa. A figura 1 mostra o fluxograma que resume a estratégia adotada para identificação e inclusão dos estudos.
ResultadosA partir dos dados dos artigos foi construída a tabela 1 para análise comparativa da segurança do uso da cabergolina na embriogênese e na gestação. São descritos cerca de 800 casos na literatura dentre estudos prospectivos, retrospectivos e de revisão sistemática que usaram cabergolina no período gestacional. O estudo mais antigo que avaliou 226 gestações data de 1996 e foi feito por Robert et al., enquanto o mais atual foi publicado em 2013 por Laway et al.
Análise comparativa da segurança do uso da cabergolina na embriogênese e na gestação
| Autor | Ano | Desenho | Gestações | Síntese dos resultados |
|---|---|---|---|---|
| Robert et al. | 1996 | Prospectivo | 226 | Não sugeriu evento adverso para a mãe ou para o feto. |
| Ricci et al. | 2002 | Prospectivo | 61 | Não aumentou risco para o seguimento gestacional ou malformações fetais. |
| Gillam et al. | 2006 | Revisão | ‐ | Não exerce efeitos deletérios sobre a gestação, com mesma incidência de malformação que ocorre na população geral. |
| Colao et al. | 2008 | Prospectivo | 329 | Não aumentou risco de aborto ou malformação fetal. |
| Lebbe et al. | 2010 | Retrospectivo | 100 | Não encontrou aumento nas complicações da gestação/parto, malformação e anormalidade no desenvolvimento pós‐natal. |
| Molitch et al. | 2010 | Revisão | ‐ | Não demonstrou aumento da frequência de aborto espontâneo, parto prematuro ou nascimento múltiplo. Não houve aumento de malformação congênita. Desenvolvimento físico e mental neonatal normal. |
| Ono et al. | 2010 | Prospectivo | 93 | Não elevou as taxas de eventos adversos em mães e fetos. |
| Stalldecker et al. | 2010 | Retrospectivo | 103 | Mesma frequência de ocorrências da população geral. |
| Molitch et al. | 2011 | Revisão | ‐ | Sem relatos de efeitos deletérios sobre o feto e a ocorrência de malformações se equipara a população geral. |
| Laway et al. | 2013 | Revisão | ‐ | A incidência de aborto, natimorto, gravidez ectópica, gravidez molar, baixo peso ao nascer e malformações fetais são comparáveis com as da população geral. |
A maioria dos artigos demonstrou que a cabergolina é uma opção segura para o concepto e no acompanhamento da evolução da gestação. Os estudos ratificaram que o uso da droga não aumenta o risco de malformação fetal, aborto e parto prematuro.
Desde 1996, ensaios feitos em camundongos, ratos e coelhos por Beltrame et al. não demonstraram efeito teratogênico com o uso da cabergolina.21 No mesmo ano, Robert et al. publicaram estudo prospectivo em que foram acompanhadas 226 gestações. Houve 56 perdas precoces da gestação, dentre as quais 28 foram por abortamentos voluntários, 23 por abortos espontâneos, um por gravidez tubária, um por morte fetal intrauterina e três abortamentos foram provocados por síndrome de Down, atrofia cerebral e deformidade de parede abdominal. Dos 148 nascidos vivos, 141 apresentaram desenvolvimento normal, enquanto que os sete restantes apresentaram anormalidades neonatais, tais como megaureter, escafocefalia, subluxação de quadril, pé torto congênito, hérnia inguinal e umbilical, mancha café com leite em nádega e comunicação interatrial menor.
Esses dados não estiveram relacionados a eventos adversos decorrentes do uso da cabergolina, nem para o feto nem para a mãe.4 Entretanto, os autores consideraram necessário um maior número de casos para aumentar o poder do estudo e afastar qualquer risco reprodutivo.
Ricci et al. (2002)15 fizeram estudo prospectivo em uma população de 50 mulheres e verificaram que das 61 gestações ocorridas no período do estudo seis abortaram, houve um caso de mola hidatiforme e foi necessário abortar em outros cinco. Um desses casos de aborto induzido foi devido à malformação fetal. Dos 49 nascidos vivos, foram verificadas uma malformação maior (trissomia18) e uma menor (angioma). Em concordância com o estudo de Robert et al.,4 não houve acréscimo no risco para malformações fetais e seguimento gestacional.4,15
Na avaliação de Gillam et al. (2006),16 o uso de cabergolina não demonstrou elevação das taxas de aborto espontâneo, prematuridade, anormalidade fetal e gravidez múltipla. Esse estudo está de acordo com vários outros trabalhos encontrados na literatura.2,4,6,8,15,16,18,19,22,23 De 107 crianças avaliadas todas apresentaram desenvolvimento físico e mental normal.4,8,16,22,23 Verificou‐se assim que a cabergolina não exerceu efeitos deletérios sobre a gestação e que manteve a mesma incidência de malformação daquela manifestada na população geral.2,6,16,18,22
Com base no estudo prospectivo de Colao et al., de 2008,17 notou‐se que o uso da cabergolina em 329 gestações não induziu a qualquer aumento no risco de aborto ou malformação fetal.2,6,17,19,23 No mesmo ano, Aldrighi et al.19 ratificaram Colao quanto à segurança da cabergolina para o feto e a gestante. Foram verificados ainda, no estudo de Colao et al., 71 abortos, 31 voluntários, 30 espontâneos, nove terapêuticos e um por motivo desconhecido.
Dos nove terapêuticos, três foram devidos à síndrome de Down, um pé torto congênito, uma hidrocefalia fetal, um por síndrome de Prune‐Belly, um por estrangulamento umbilical, uma gravidez tubária e uma morte fetal. Em relação aos partos, houve quatro casos de natimorto, oito partos gemelares, 17 com baixo peso ao nascer, 45 prematuros e 27 anormalidades congênitas com acometimento prevalente dos sistemas musculoesquelético, cardiopulmonar, dermatológico, hepático e urogenital. Ainda assim, a taxa de anormalidades descrita foi semelhante à estimada para a população geral.7 O desfecho desse estudo fundamenta as conclusões de Robert et al.4 e de Ricci et al.15
Lebbe et al., em 2010,18 avaliaram 100 gestantes em uso de cabergolina e verificaram a ocorrência de 88 nascimentos e 17 perdas fetais. As causas de perdas fetais foram dez abortos espontâneos e dois voluntários, duas gravidezes ectópicas e três interrupções médicas. Dos 88 nativivos foram encontradas três malformações: surdez congênita, hidronefrose unilateral e ausência de polegar direito.
No tocante ao peso, nove exibiram baixo peso ao nascer. No acompanhamento pós‐natal não houve aumento na susceptibilidade aos problemas físicos, psicomotores ou retardo mental. Lebbe et al. consideraram que mais estudos são necessários para complementar e ampliar a segurança da cabergolina, apesar de não terem encontrado aumento nos índices de aborto espontâneo, complicação na gestação e parto, malformação e anormalidade no desenvolvimento pós‐natal no trabalho por eles feito.
Molitch et al. (2010)23 apresentaram 663 casos descritos na literatura em que não demonstravam acréscimo na frequência de abortos espontâneos, partos prematuros ou nascimentos múltiplos. Em complemento ao estudo de Lebbe et al.,18 reportaram 177 crianças nascidas de mães que usaram cabergolina durante a gestação, com desenvolvimento físico e mental normal.4,8,16,23
O estudo prospectivo de Ono et al., em 2010,8 avaliou 93 gestações e constatou que houve 83 nascimentos e dois abortos. Desses, um foi espontâneo e um voluntário. Entre os nascimentos houve um natimorto, nove com baixo peso ao nascer e um prematuro. Esse estudo não descreveu malformações, acompanhou os bebês por 78 meses e verificou que não houve anormalidade no crescimento nem no desenvolvimento mental. O estudo usou terapia com cabergolina em altas doses e, ainda assim, não verificou a elevação das taxas de eventos adversos em mães e fetos, o que apoia a segurança da cabergolina no período gestacional.2,4,8,16,19,20
Stalldecker et al. (2010)22 fizeram estudo observacional retrospectivo e multicêntrico e descreveram 103 gestações. Dessas, sete apresentaram abortos espontâneos, oito partos prematuros, um caso de baixo peso ao nascer e três anormalidades neonatais, entre elas síndrome de Down, hérnia inguinal e umbilical. Fez‐se o acompanhamento de 61 crianças e foi verificada a ocorrência de dois casos de epilepsia e um transtorno do desenvolvimento. Os autores consideraram a constância dos eventos relatados similares à da população geral,2,6,16,18,22 tanto para gestantes como para prole, e julgaram necessário um índice maior de pacientes para avaliar a segurança da cabergolina.4
Em 2011, Molitch et al.6 reuniram uma amostra de aproximadamente 800 casos sobre a exposição do embrião/feto no início da gestação. Eles mencionaram como intercorrências alguns abortos, términos gestacionais, inclusive aqueles devidos a anomalias fetais, gravidez ectópica, mola hidatiforme, partos prematuros, nascimentos múltiplos e malformações em nativivos. No entanto, essa exposição não atestou aumento de aborto espontâneo, parto prematuro e nascimentos múltiplos.6,16,17,19,23
Baseado em vários estudos, Molicth et al. (2011) afirmaram que a base de dados estudada da cabergolina é menor do que a da bromocriptina. No entanto, não há relato de efeitos deletérios sobre o feto nela4,8,15‐17,19,20 e a ocorrência de malformações se equipara à da população geral.6,16
Laway et al. (2013)2 afirmam que o conhecimento sobre o uso da cabergolina no período gestacional é crescente e que até o momento a incidência de aborto, natimorto, gravidez ectópica e molar, baixo peso ao nascer e malformações fetais se equipara às taxas da população geral.6,16,17 Eles presumem assim que há segurança para se usar a cabergolina nesse período e colocam‐na ainda como terapia de primeira escolha no tratamento de hiperprolactinemia.
ConclusãoOs dados referentes ao uso da cabergolina durante a gravidez são cada vez mais consistentes. As principais intercorrências apontadas pelos estudos foram casos de aborto espontâneo, gravidez ectópica, mola hidatiforme, gestação múltipla, malformação maior e menor, prematuridade, natimortalidade e baixo peso ao nascer. Nenhuma dessas patologias apresentou maior frequência quando comparadas à população em geral. Com isso, a maioria dos artigos já demonstra a confiabilidade do uso da cabergolina no período gestacional.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Trabalho feito no Ambulatório de Infertilidade, Faculdade de Medicina, Pontifícia Universidade Católica de Goiás (PUC‐GO), Goiânia, GO, Brasil.