identificar produção de oócitos em mamíferos adultos com o uso de camundongo como modelo experimental.
Métodoempregamos a técnica de imuno‐histoquímica em cortes de ovários de camundongos Balb‐c (45 dias de idade) com o uso de anticorpo específico para marcação de células germinativas. Como controles positivos da reação, usamos cortes de testículos de camundongos.
Resultadosas células germinativas (espermatogônias, espermatócitos e espermátides) dos controles positivos sofreram marcação, enquanto células não pertencentes a essa linhagem (células de Leydig e de Sertoli) mostraram negatividade de reação; nos cortes ovarianos observou‐se marcação de oócitos de folículos em diferentes estágios de maturação, mas houve também marcação de células não englobadas pela estrutura folicular.
Conclusõesos achados sugerem que durante a puberdade ovários de camundongos fêmeas contêm células da linhagem germinativa em estágios anteriores à formação folicular, o que corrobora estudos anteriores; o trabalho é pioneiro no Brasil e progredirá para a completa caracterização de células com potencial oogênico em outras espécies de mamíferos. Resultados positivos poderão alterar o entendimento da biologia reprodutiva e abrir novas portas para o tratamento de infertilidade.
to identify oocyte production in adult mammals using the mouse as the experimental model.
Methodwe used the immunohistochemistry technique on ovary sections of Balb‐c mice (45 days old), with antibody that labels germline cells specifically. We used sections of mice's testes as positive reaction controls.
Resultsin testes samples, germ cells (spermatogonia, spermatocytes and spermatids) were stained, while cells not belonging to germ lineage (Leydig and Sertoli cells) showed negative reaction; in ovarian samples, oocytes from follicles in different stages of maturation were stained, but the reaction was also positive for cells not enclosed by the follicular structure.
Conclusionsthe findings suggest that, during puberty, female mice ovaries contain germline cells in earlier stages before follicular formation, as was found in previous studies. The work, pioneering in Brazil, must progress to a complete characterization of these cells (with oogenesis potential) in mice and in other mammal species. Positive results may change the understanding of the reproductive biology and open new possibilities for infertility treatment.
Segundo a biologia reprodutiva de mamíferos, os machos são os únicos dotados de células capazes de produzir gametas durante toda a vida adulta, enquanto as fêmeas geram gametas somente durante a fase embrionário‐fetal e após o nascimento não há produção de novos oócitos (oogênese) nem formação de novos folículos (foliculogênese).1,2
Apesar de esse conhecimento representar um dogma desde 1951, ele vem sendo questionado. Estudos recentes apresentaram fortes indícios da existência de células precursoras de oócitos em ovários de camundongos adultos.3–6 Sendo essas células algo comum em diferentes espécies de mamífero, inclusive humanos, isso permitiria a elaboração de tratamentos diferenciados para infertilidade feminina, além de alargar as fronteiras do que se sabe sobre reprodução humana até os dias de hoje.
Ainda que seja possível a presença de células capazes de oogênese em tecido ovariano adulto, refutar o conhecimento tradicional é ainda algo distante, já que os achados recentes não são unanimidade na literatura científica nem são facilmente reprodutíveis.7,8 Na tentativa de verificar a possibilidade de oogênese adulta, nosso trabalho tem como objetivo identificar a presença pós‐natal de células precursoras de oócitos em mamíferos, por meio de marcadores pré‐diplóteno, com o uso de camundongo como modelo experimental.
MétodoUsamos a técnica de imuno‐histoquímica em ovários (cortes de 5μm de espessura) obtidos cirurgicamente de 10 camundongos da linhagem Balb‐c de 45 a 51 dias de idade, considerada adulta para esses organismos. Os órgãos foram fixados em formol 10% e permaneceram nessa solução pelo menos 24 horas antes de ser processados para inclusão em parafina.
A partir dos cortes feitos no material parafinado e após confirmação histológica por meio da observação microscópica dos cortes corados com hematoxilina e eosina (HE), as reações de imuno‐histoquímica foram executadas com o kit Polímero Picture TM Max® (Invitrogen), segundo protocolo fornecido pela empresa. Os cortes em lâmina, após ser desparafinizados e hidratados, passaram por recuperação antigênica em meio tamponado (tampão citraro, pH, 6,00) por 40 minutos a 98°C. Posteriormente foram tratados por 30 minutos com peróxido de hidrogênio (solução 3%) e depois com soro normal de cavalo (NCL‐H‐SERUM, Novocastra) por mais 30 minutos. Então, cada lâmina foi incubada com o anticorpo primário anti‐DDX/MVH (Abcam), diluído de acordo com as especificações do fabricante, por duas horas em câmara úmida. Em seguida, os cortes foram incubados com anticorpo secundário e, por último, foi feita a etapa de reação avidina‐biotina, por uma hora. As reações foram avaliadas por meio de microscopia de luz e identificadas após revelação por tratamento com o cromógeno diaminobenzidina (DAB) (Sigma‐Aldrich), por cinco minutos, e contra coloração com hematoxilina de Harris.
A imunorreatividade foi considerada positiva quando detectada coloração castanha no citoplasma das células. Cortes de testículos de camundongos, das mesmas idade e linhagem que as fêmeas, foram usados como controles positivos da reação. Paralelamente a todas as reações, um corte de tecido ovariano e um de tecido testicular serviram como controles negativos da reação a partir da omissão do anticorpo primário, o que resultou em completa ausência de sinal.
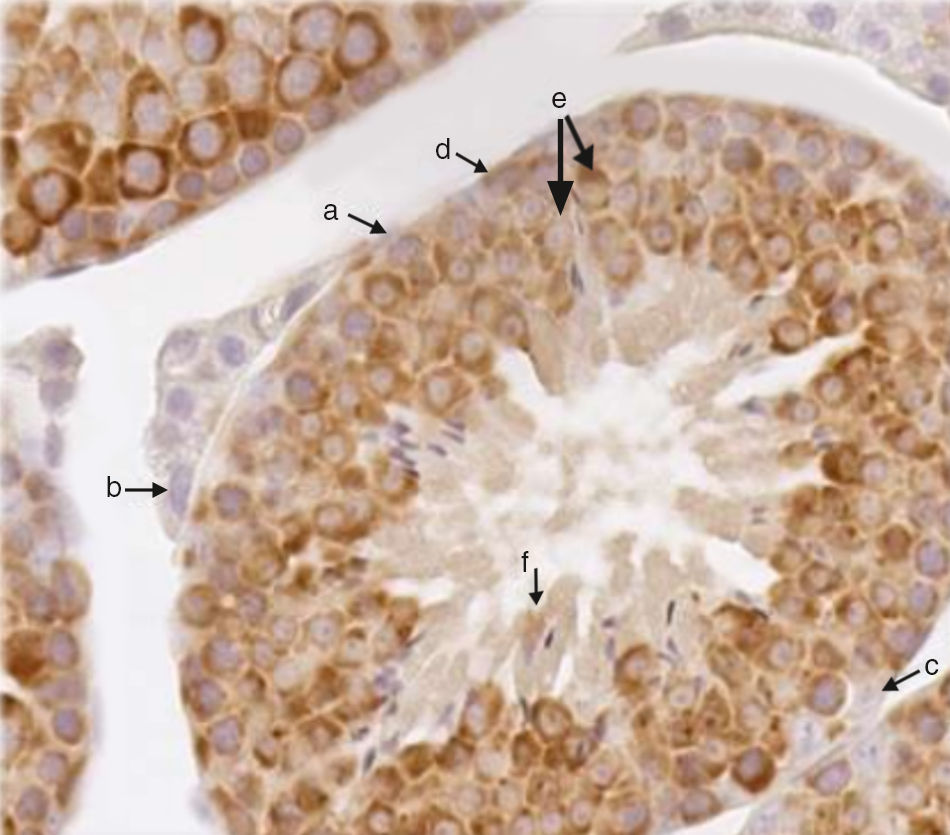
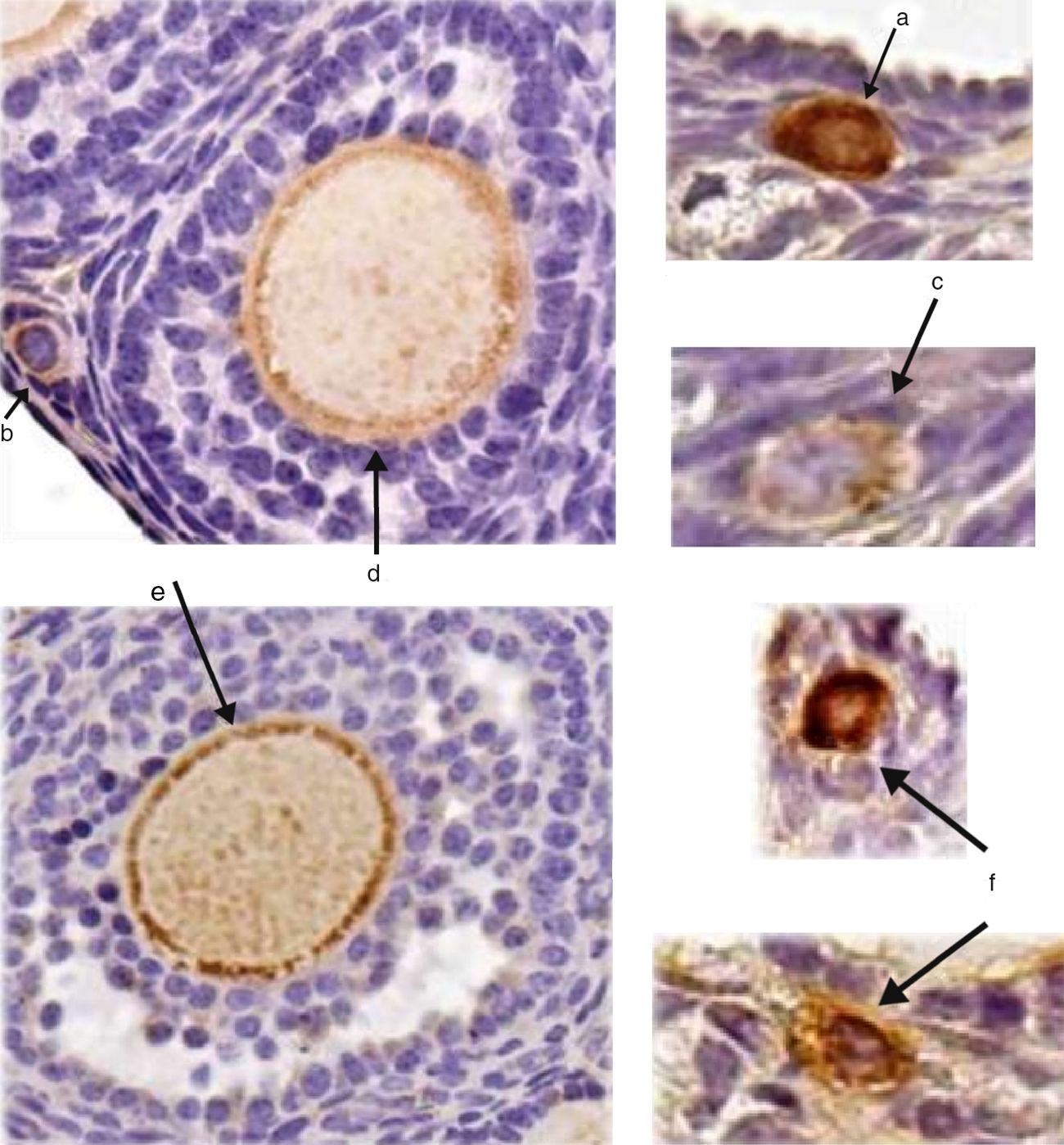
ResultadosNos controles positivos, as células da linhagem germinativa (espermatogônias, espermatócitos e espermátides) sofreram marcação, enquanto células não pertencentes a essa linhagem (células de Leydig e de Sertoli) mostraram negatividade de reação (fig. 1). Nos cortes ovarianos observou‐se positividade de reação em oócitos de unidades foliculares em diferentes estágios de maturação (primordial, primário, pré‐antral e antral), mas também células não englobadas pela estrutura folicular, dispostas na superfície ovariana, apresentaram marcação (fig. 2).
Corte de testículo. Nos túbulos seminíferos pode‐se observar que a marcação citoplasmática de DDX4/MVH (cor castanha) foi negativa para: a, fibroblasto; b, células de Leydig; c, células de Sertoli. Marcações positivas: d, espermatogônias; e, espermatócitos; f, espermátides (aumento de 40×).
Corte de ovário. A marcação citoplasmática de DDX4/MVH (cor castanha) foi positiva somente para oócitos em: a, oócito em folículo primordial; b, oócito em folículo em transição primordial‐primário; c, oócito em folículo primário; d, oócito em folículo pré‐antral; e, oócito em folículo antral; f, foram marcadas células germinativas alheias à estrutura folicular (aumento de 40×).
Como se acredita pelo ensino tradicional, em mamíferos não há renovação de gametas femininos. Seu número declina durante a vida, quer seja por meio da ovulação ou de mecanismos que envolvem morte celular.9,10 Desde 2004, porém, estudos sugerem que células capazes de gerar novos oócitos permaneceriam nas fêmeas de mamíferos até a vida adulta. Assim, poder‐se‐ia expandir, in vitro, o número de oócitos e impedir a falência ovariana que ocorre por causas naturais e/ou após tratamento quimioterápico.3,6 No entanto, estudos contradizem os resultados dessas pesquisas, além do que nenhuma pesquisa conseguiu, até agora, conclusões convincentes quanto à existência dessas células precursoras de oócitos em diferentes espécies de mamíferos.7,11–13
O presente trabalho corrobora os achados de que pode haver produção pós‐natal de oócitos. Como mostram nossos resultados, durante a puberdade, ovários de camundongos fêmeas mostraram abrigar células da linhagem germinativa não englobadas pela estrutura folicular, o que sugere que essas células estariam em estágios mais indiferenciados, anteriores à formação do folículo. São necessárias outras investigações para melhor caracterização celular, como grau de diferenciação, potencial de proliferação e meiótico. Somente assim saberemos sobre a biologia e real função dessas células.
Pesquisas na área têm significante aplicação clínica, como o desenvolvimento de tratamentos de pacientes com problemas reprodutivos. Além disso, o congelamento dessas células poderia permitir que mulheres em idade mais avançada gestassem com menor chance de gerar descendentes afetados por alterações gênicas e/ou cromossômicas.
Nosso estudo é pioneiro no Brasil e progredirá para a completa caracterização de células com potencial oogênico em outras espécies de mamíferos. Resultados positivos poderão alterar o entendimento da biologia reprodutiva humana e abrir novas portas para o tratamento de infertilidade.
FinanciamentoEste estudo foi financiado pela Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (Capes) e pelo Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq).
Conflitos de interesseOs autores declaram não haver conflitos de interesse.