Avaliar os efeitos da ablação da produção de esteroides e o papel da testosterona e da dihidrotestosterona no desenvolvimento de folículos secundários de primatas não humanos (Macaca mulatta) em matriz 3D.
MétodosO córtex ovariano (n=8 fêmeas adultas) foi cortado em cubos e os folículos secundários foram isolados e cultivados individualmente durante 40 dias em matriz a base de alginato. Experimento 1: Ablação da produção de esteroides, com uso do trilostano (TRL) e reposição de testosterona. Folículos de quatro animais foram distribuídos nos grupos: controle (veículo), TRL (TRL desde o início do cultivo), testosterona (T) baixa (TRL e testosterona 10ng/mL)e testosterona(T) alta (TRL e testosterona 50ng/mL), Experimento 2: Ablação da produção de esteroides, com uso do trilostano (TRL) e reposição de dehidrotestosterona (DHT). Folículos de quatro animais foram distribuídos nos grupos: controle (veículo), TRL (TRL desde o início do cultivo), DHT (DHT 50ng/mL) e DHT+TRL (TRL e DHT 50ng/mL). Foram analisados: sobrevida, crescimento, formação de antro, produção de hormônios esteroides e grau de maturação e qualidade oocitária.
ResultadosA porcentagem de folículos sobreviventes em cultivo, o crescimento e a formação de antro foi menor em presença de TRL em todos os experimentos, em comparação com o grupo controle. A reposição de T e DHT, na presença de TRL, recuperou a sobrevida, o crescimento, a formação de antro, a produção hormonal e a qualidade e maturidade oocitária, comparáveis com o grupo controle. A DHT adicionada ao meio de maturação padrão promoveu aumento da percentagem de sobrevida e formação de antro quando comparada com o grupo controle.
ConclusõesEste estudo apresentou evidências do papel local dos androgênios desde o início da foliculogênese em primatas e fortaleceu a existência de mecanismos moleculares que regulam a atividade androgênica e de novas interações entre os androgênios e os hormônios esteroides. Nossos achados mostraram que a T e a DHT podem recuperar sobrevida, crescimento, formação de antro, produção hormonal e viabilidade oocitária de folículos pré‐antrais cultivados in vitro expostos a ablação da produção de esteroides. A DHT adicionada ao meio de maturação padrão promoveu aumento da percentagem de sobrevida e formação de antro folicular quando comparada com o grupo controle e abriu perspectivas de se avaliar se a suplementação desse androgênio poderia melhorar o desenvolvimento folicular in vitro. Os conhecimentos obtidos contribuem para ampliar o entendimento da dinâmica da foliculogênese em primatas, ainda pouco compreendida, e auxilia na identificação das condições ótimas para o cultivo folicular, o que poderá futuramente ser aplicado à assistência a pacientes oncológicas que desejam preservar sua fertilidade futura
To evaluate the effects of ablation of steroid production and the role of testosterone and dihydrotestosterone in the development of secondary follicles of nonhuman primates (Macaca mulatta) in 3D matrix.
MethodsThe ovarian cortex (n=8 adult females) was diced and secondary follicles were isolated and cultured individually for 40 days on alginate matrix. Experiment 1: Ablation of steroid production with use of trilostane (TRL) and testosterone replacement. Follicles of 4 animals were assigned to 4 groups: control (vehicle), TRL (TRL from the start of culture), Low testosterone (T) (TRL testosterone and 10ng/mL), high T (TRL testosterone and 50ng/mL); Experiment 2: Ablation of steroid production with use of trilostane (TRL) and replacement of dihydrotestosterone (DHT). Follicles of 4 animals were assigned to 4 groups: control (vehicle), TRL (TRL from the start of culture), DHT (DHT 50ng/mL), DHT+TRL (TRL and DHT 50ng/mL). It were analyzed: survival, growth, antrum formation, steroid hormone production, and degree of maturation and quality of oocytes.
ResultsThe percentage of surviving follicles in culture, growth and antrum formation was lower in the presence of TRL in all experiments, compared with the control group. Replacement of T and DHT in the presence of TRL, recovered survival, growth, antrum formation, hormone production, and the quality and maturity of oocytes comparable to the control group. DHT added to standard maturation media promoted an increase in the percentage of survival follicles and antrum formation compared to the control group.
ConclusionsThis study provided evidence of the role of androgens since the beginning of folliculogenesis in primates, reinforcing the existence of molecular mechanisms regulating androgenic activity, and new interactions between androgens and steroid hormones. Our findings show that T and DHT can recover survival, growth, antrum formation, hormone production and oocyte viability of in vitro cultured preantral follicles exposed to ablation of steroid production. DHT added to standard maturation media promoted an increase in the percentage of follicle survival and antrum formation compared to the control group, opening perspectives to evaluate whether this androgen supplementation could improve follicular development in vitro. The knowledge obtained contribute to a understanding of the dynamics of folliculogenesis in primates, still poorly understood, and assists in identifying the optimal conditions for growing follicle, which may in future be applied to assist cancer patients who wish to preserve their future fertility
Além do reconhecido papel dos androgênios como precursores do hormônio esteroide, estradiol, e possíveis ações endócrinas no sexo feminino, evidências consideráveis sugerem que os androgênios têm ações parácrinas e autócrinas no ovário, particularmente no folículo em desenvolvimento.1‐5 Estudos recentes que reportaram a expressão de receptores de androgênio (ARs) em folículos em desenvolvimento2,3 sugerem seu papel na fisiologia reprodutiva do sexo feminino.4,6,7 Evidências da presença e atividade de ARs em todos os estágios do crescimento folicular em diferentes espécies4,5 incluindo murinos,8‐11 suínos,12,13 bovinos,14‐16 primatas não humanos17‐20 e humanos21‐23 sugerem que os androgênios têm efeitos ao longo do desenvolvimento folicular. Por meio de observações em camundongos fêmeas, foi descoberto que a inativação de ARs resulta em falência ovariana prematura (FOP). Isso indica que o processo de foliculogênese normal requer ação androgênica mediada por receptores androgênicos.2,9,10 Em ovários humanos, pode ser observada a expressão proteica de ARs nas células da granulosa, células da teca e células do estroma durante quase todos os estágios do ciclo menstrual. Contudo, existe uma diferença entre as observações em relação à intensidade imuno‐histoquímica observada nos estudos que comprovam esse fato,21 o que pode estar relacionado a uma expressão variável desses receptores, que depende do status do desenvolvimento folicular.24
Por um lado, evidências sugerem que os androgênios promovem crescimento folicular precoce.25‐28 Em sistemas de cultivo in vitro de folículos de camundongo, a exposição a androgênios contribuiu para o desenvolvimento de folículos pré‐antrais29 e aumentou o diâmetro folicular.30 Outros estudos também observaram que doses farmacológicas de testosterona promovem desenvolvimento precoce em folículos de bovinos31 e macacos.32‐34 Estes dados reforçam os esforços clínicos em determinar se o pré‐tratamento com testosterona transdérmica contribui para o aumento da resposta ovariana a gonadotrofinas em pacientes má‐respondedoras em ciclos de fertilização in vitro (FIV).35‐40
Por outro lado, os androgênios podem se tornar prejudiciais em folículos antrais e apresentar efeitos antimaturação e anticrescimento nesse estágio.25,27,28,41 Estudos com mulheres portadoras da síndrome dos ovários policísticos (SOP) frequentemente sugerem que a hiperandrogenemia afeta negativamente o desenvolvimento folicular e a maturação oocitária.7,42 Dessa forma, é provável que a ação androgênica nos folículos seja estágio e/ou dose dependente. Os androgênios podem ser, a depender do estágio folicular, promotores ou inibidores do crescimento folicular.17,43
Estudos mais detalhados são necessários para definir os efeitos diretos dos androgênios nos folículos31,33,34 e seus oócitos44 em estágios específicos da foliculogênese, principalmente em primatas, o que estimulou a feitura do presente estudo. O sistema de cultivo tridimensional (3D), que usa folículos individuais encapsulados no biomaterial alginato,45‐47 pode contribuir para estudos sobre as ações diretas de hormônios e fatores locais na foliculogênese em primatas. Recentemente esse sistema de cultivo foi usado por nosso grupo para o desenvolvimento de folículos de primatas (macacos rhesus) a partir do estágio pré‐antral (secundário) até estágio antral de pequeno diâmetro, com a obtenção de função esteroidogênica e maturação oocitária.48‐50
O presente estudo teve como objetivo avaliar, pela primeira vez, as ações dos androgênios no desenvolvimento folicular (sobrevida, formação de antro, produção hormonal e maturação oocitária), em folículos pré‐antrais individuais de primatas (Macaca mulatta – macacos rhesus), com o uso do sistema de cultivo em matriz 3D, por meio da ablação da produção de esteroides51,52 e reposição de testosterona (T) e dihidrotestosterona (DHT).
MétodosAnimais e coleta ovarianaA habitação e o cuidado com os animais, macacos rhesus, foram fornecidos pela Divisão de Recursos Animais, no Oregon National Primate Research Center (ONPRC). Os animais foram mantidos dentro de gaiolas, em pares, a temperatura (22°C) e luminosidade (12 horas claro/escuro) controladas. A dieta oferecida foi a ração Purina (Ralston Purina‐, Richmond, IN, EUA), ideal para alimentação de macacos, fornecida duas vezes ao dia, acrescida de frutas frescas ou vegetais, uma vez por dia e água ad libitum. Os animais foram tratados de acordo com o Instituto Nacional de Guia de Saúde para o Cuidado e Uso de Animais de Laboratório, dos Estados Unidos, e os protocolos foram aprovados pelo Comitê Institucional de Cuidados aos Animais do Centro de Pesquisas com Primatas da Universidade do Oregon (Oregon National Primate Research Center, Oregon Health and Science University).
Oito fêmeas adultas de Macaca mulatta (idade média nove anos) que exibiam ciclos menstruais regulares de 28 dias, sendo o primeiro dia de menstruação considerado o dia 1 do ciclo, foram usadas neste estudo. A ooforectomia foi feita sob anestesia, por laparoscopia, durante a fase folicular precoce do ciclo (entre os dias 1 e 4), como previamente descrito.53 Os ovários, após removidos, foram imediatamente transferidos para meio Hepes buffered holding media (CooperSurgical, Inc., Trumbull, CT, USA), suplementado com 0,2% de soro humano proteico (SPS, CooperSurgical, Inc.) e 10μg/ml de antibiótico gentamicina (Sigma‐Aldrich, St. Louis, MO, USA) e mantidos a 37°C até o momento do isolamento folicular.50,54
Os meios de cultivo e os reagentes usados foram adquiridos da Sigma Aldrich Company (St. Louis, MO, USA), exceto quando indicado, e o Trilostano (Vetoryl‐trilostane Capsules Letter), da FDA (U.S. Food and Drug Administration). O Trilostano foi preparado como uma solução estoque, em que 2,5mg de trilostano foram diluídos em 10mL de etanol (veículo), armazenada a 4°C, que era diluída em meio de cultivo folicular, semanalmente na ocasião da preparação dos meios para o cultivo, de modo que sua concentração fosse 250ng/mL.
Isolamento folicular, encapsulamento e cultivoO isolamento, o encapsulamento e o cultivo in vitro dos folículos individuais foram feitos conforme já previamente descrito.50 O córtex ovariano foi cortado em pequenos cubos de 1×1×1mm e os folículos foram mecanicamente isolados em meio de manipulação (Hepes buffered holding media) com o uso de agulhas calibre 31. Foram selecionados para o encapsulamento folículos secundários de diâmetros entre 125‐225mm que apresentavam as seguintes características: (i) membrana basal intacta, (ii) duas a três camadas de células da granulosa e (iii) um oócito saudável visível que fosse arredondado e localizado centralmente no interior do folículo, sem a presença de vacúolos ou citoplasma escuro. Os folículos obtidos individualmente de cada um dos animais foram divididos randomicamente entre os grupos de tratamento com 12/24 folículos por grupo.
Os folículos foram transferidos individualmente para gotículas de 5μL 0,25% (w/v) de alginato de sódio estéril (FMC BioPolymers, Philadelphia, PA, USA) e solução tamponada PBS (phosphate‐buffered saline ‐ 137mM NaCl, 10M phosphate, 2,7mM KCl, Invitrogen, Carlsbad, CA, USA). As gotas foram colocadas sobre uma tela de polipropileno (0,1mm de abertura; McMaster‐Carr, Atlanta, GA), que foi então invertida e suavemente batida sobre uma solução cross‐linking (50mM CaCl2, 140mM NaCl e 10nM HEPES solution ‐ pH 7,2). Isso fez com que as gotas caíssem na solução e fossem mantidas nela por 30 segundos. Cada folículo encapsulado em alginato foi transferido para poços individuais em uma placa de 48 poços com 300μL do meio αMEM (alpha minimum essential médium ‐ Invitrogen) suplementado com 0,3% (v/v) de soro sintético substituto (SSS), 0,5mg/ml de fetuína bovina purificada, 5μg/ml de insulina, 5μg/ml de transferrina e 5ng/ml de selenito de sódio (Sigma‐Aldrich).
Os folículos foram cultivados a 37°C e 5% de oxigênio (em 6% CO2/89% N2), com FSH recombinante humano (rh) (NV Organon, Oss, Netherlands) a uma dose de 3ng/mL durante os primeiros 20 dias de cultivo e 0,3ng/mL pelo período de cultivo restante. Folículos que atingiram o estágio antral foram tratados com gonadotrofina coriônica humana recombinante (hCG) (Merck Serono, Geneva, Switzerland) (100ng/ml) por 34horas para iniciar a maturação meiótica do oócito. Após esse período, os oócitos foram coletados com a finalidade de se determinar o grau de maturação e competência oocitária. Amostras de meios de cultivo (150μL) foram coletadas, repostas a cada dois dias e armazenadas a ‐20°C para posterior análise de hormônios esteroides ovarianos e hormônio anti‐Mulleriano (AMH).
Experimento 1: reposição de testosteronaPara avaliar o papel da testosterona na foliculogênese, foi feito um experimento, por meio da reposição de duas diferentes doses de testosterona (T; 10 ou 50ng/mL, grupos T baixa e T alta) em meio de cultivo com trilostano (TRL – 250ng/mL, que atua no bloqueio da ação da enzima 3‐beta‐hidroxiesteroide desidrogenase ‐3‐βHSD) usado desde o início do cultivo até o fim (40 dias).
Folículos secundários obtidos de quatro animais foram cultivados em meio padrão contendo: (1) veículo por 40 dias (grupo controle; n=85); (2) TRL na dose de 250ng/mL por 40 dias (grupo TRL; n=82); (3) TRL e 10ng/mL de testosterona por 40 dias (grupoT baixa; n=84); (4) TRL e 50ng/mL de testosterona por 40 dias (grupoT alta; n=86).
Experimento 2: reposição de dihidrotestosteronaCom o intuito de confirmar o papel androgênico na foliculogênese de primatas, independentemente de uma possível conversão a estrógeno, um segundo experimento foi feito, por meio da adição de dihidrotestosterona (DHT) (50ng/mL) ao meio de cultivo com TRL (usado desde o início até o fim do cultivo ‐ 40 dias) ou DHT isoladamente.
Folículos secundários de quatro animais foram cultivados em meio padrão contendo: (1) veículo (grupo controle; n=72); (2) TRL na dose de 250ng/mL desde o início até o fim do cultivo (40 dias) (grupo TRL; n=66); (3) DHT isoladamente (50ng/mL) (grupo DHT; n=69); (4) DHT acrescido de TRL (grupo TRL+DHT; n=66).
Sobrevida folicular, crescimento e formação de antroA sobrevida folicular, o diâmetro e a formação de antro foram avaliados por meio de um microscópio invertido Olympus CK40 (Tóquio, Japão) com luz transmitida e objetivas de fase e uma câmera digital Olympus DP11 anexada (Olympus Imaging America Inc., Center Valley, PA, USA) e software de imagem ImageJ 1.44 p (National Institutes of Health, Bethesda, MD, USA).54 Os folículos foram medidos a partir da camada externa de células e as medidas incluíram uma medida no maior diâmetro do folículo e uma segunda medição perpendicular à primeira. A média desses valores foi calculada e considerada como o diâmetro do folículo. Os folículos foram considerados degenerados e em processo de atresia quando o oócito estava escuro ou não estava cercado por células da granulosa, as células da granulosa se tornaram escuras e fragmentadas ou o diâmetro do folículo estava diminuído.49,50
Classificação do crescimento folicularOs folículos foram divididos em três categorias de acordo com o seu padrão de crescimento até a quinta semana de cultivo:50,54 (1) crescimento rápido: aqueles que atingiram um diâmetro de 500μm ou mais; (2) crescimento lento: aqueles que atingiram entre 230 e 500μm de diâmetro; (3) sem crescimento: aqueles que não excederam um diâmetro de 230μm no fim da quinta semana de cultivo.
Dosagem de esteroides ovarianosAmostras de meio coletadas semanalmente durante todo o período de cultivo foram analisadas para a determinação das concentrações de estradiol (E2) e progesterona (P4) para os experimentos 1 e 2. As análises das concentrações de E2 e P4 foram feitas pelo laboratório de ensaios hormonais do ONPRC, Endocrine Technology Support Core,50,54 por meio do método de quimiluminescência, com o uso de um Immulite 2000, com técnica previamente validada para meios de cultivo folicular de macacos, reportados previamente.49
Coleta de oócitos, maturação e fertilizaçãoOs oócitos coletados foram fotografados e classificados de acordo com o estágio de maturação nuclear.54 Foi feita coleta de sêmen e fertilização in vitro convencional nos oócitos em metáfase II (MII) dos experimentos de Reposição de T e DHT, pelo Laboratório de Reprodução Assistida (Assisted Reproductive Technology (ART)/Embryonic Stem Cell Support Core) no ONPRC.54 A fertilização in vitro convencional foi feita nos oócitos MII como previamente descrito.54,55 O zigoto resultante foi transferido para 500μL de meio de cultura embrionária hamster‐9 com 5% de FBS e cultivado a 37° C a 6% CO2, 5% O2 e 89% de N2.56 O embrião foi fotografado diariamente durante seu desenvolvimento. Reagentes e protocolos para a cultura de embriões foram fornecidos pelo núcleo ART/ONPRC.57,58
Análise estatísticaA significância estatística foi analisada por meio do software R 2.15.3, com o uso de uma regressão binomial logística para as análises de sobrevida e formação de antro e regressão marginal log‐linear para a análise de hormônios esteroides. Diferenças foram consideradas significativas quando p<0,05 e valores foram representados como média±erro padrão. A sobrevida folicular e a formação de antro representaram quatro animais individualmente para cada grupo de tratamento em ambos os experimentos. O crescimento folicular, a produção de esteroides e a maturação oocitária foram analisados para cada folículo individualmente.
ResultadosExperimento 1: reposição de testosteronaA) Efeito sobre a sobrevida folicular e a formação de antro.
A adição de dose alta de T ao TRL aumentou a sobrevida comparada ao grupo TRL (fig. 1A). Alguns folículos atingiram a formação de antro no grupo TRL (fig. 1B), porém a porcentagem de folículos antrais no grupo T alta+TRL (83±8%) foi maior em relação ao grupo que recebeu TRL isoladamente (65±22%, p<0,05). Além disso, a porcentagem de folículos antrais no grupo T baixa+TRL (92±8%) também foi maior do que no grupo TRL.
Efeito da reposição de T e DHT sobre a sobrevida e formação de antro de folículos secundários de Macaca mulatta cultivados individualmente em matriz 3D por 40 dias.
Nota: A. Sobrevida – Reposição de T; B. Formação de antro – Reposição de T; C. Sobrevida – Reposição de DHT; D. Formação de antro – Reposição de DHT.
CTRL: controle (veículo); TRL: trilostano (250ng/mL desde o início do cultivo); TRL+T baixa (250ng/mL de trilostano+10ng/mL de testosterona, desde o início do cultivo); TRL+T alta (250ng/mL de trilostano+50ng/mL de testosterona, desde o início do cultivo); DHT: 50ng/mL de dihidrotestosterona, desde o início do cultivo; TRL+DHT: 250ng/mL de trilostano+50ng/mL de dihidrotestosterona, desde o início do cultivo; Diferentes letras (A, B, C) indicam diferença significativa (p<0,05).
B) Efeito sobre o crescimento folicular
A porcentagem de folículos sem crescimento foi maior no grupo TRL, em relação aos grupos TRL+T baixa e TRL+T alta (tabela 1, Reposição de T). Contudo, também foi evidente a observação de folículos de crescimento rápido nesse grupo. Folículos sem crescimento não foram observados nos grupos de reposição de baixa ou alta dose de T e a porcentagem de folículos que apresentam crescimento rápido atingiu, pela primeira vez, mais do que 30% da população folicular total em ambos os grupos com reposição de T e apresentou diferença significativa (p<0,05) entre os grupos TRL (21%) e TRL+T baixa (38%). O diâmetro folicular dos folículos de crescimento lento, tanto no grupo de reposição de baixa quanto no de alta dose de T (350±15 ou 361±14μm), foi maior em relação ao grupo TRL (260±12μm, p<0.05) e comparável à média do diâmetro encontrado no grupo controle (318±14μm). Em contraste, a alta dose de T diminuiu (p<0,05) o diâmetro de folículos de crescimento rápido (572±42μm) comparado com o diâmetro no grupo controle (773±56μm).
Efeito da reposição de T e DHT sobre as características de crescimento folicular de folículos secundários de Macaca mulatta cultivados individualmente em matriz 3D por 40 dias
| Cultivo folicular | Total | Sem crescimento | Crescimento lento | Crescimento rápido |
|---|---|---|---|---|
| Reposição de T | ||||
| CTRL | 47 | 3 (6%)a,b | 31 (66%)a,b | 13 (28%)a,b |
| TRL | 23 | 5 (22%)b | 13 (57%)b | 5 (21%)a |
| TRL+T baixa | 47 | 0 (0%)a | 29 (62%)a,b | 18 (38%)b |
| TRL+T alta | 53 | 0 (0%)a | 37 (70%)a | 16 (30%)a,b |
| Reposição de DHT | ||||
| CTRL | 51 | 9 (18%)a | 22 (43%)a | 20 (39%)a |
| TRL | 30 | 5 (17%)a,b | 16 (53%)b | 9 (30%)b,c |
| DHT | 58 | 4 (7%)c | 35 (60%)c | 19 (33%)b |
| TRL+DHT | 51 | 11 (22%)d | 26 (51%)b,d | 14 (27%)c |
Nota: CTRL: controle (veículo); TRL: trilostano (250ng/mL desde o início do cultivo); TRL+T baixa (250ng/mL de trilostano+10ng/mL de testosterona, desde o início do cultivo); TRL+T alta (250ng/mL de trilostano+50ng/mL de testosterona, desde o início do cultivo); DHT: 50ng/mL de dihidrotestosterona, desde o início do cultivo; TRL+DHT: 250ng/mL de trilostano+50ng/mL de dihidrotestosterona, desde o início do cultivo; Diferentes letras (a, b, c) dentro da mesma coluna indicam diferença significativa (p<0,05).
C) Efeito sobre a produção de esteróides ovarianos
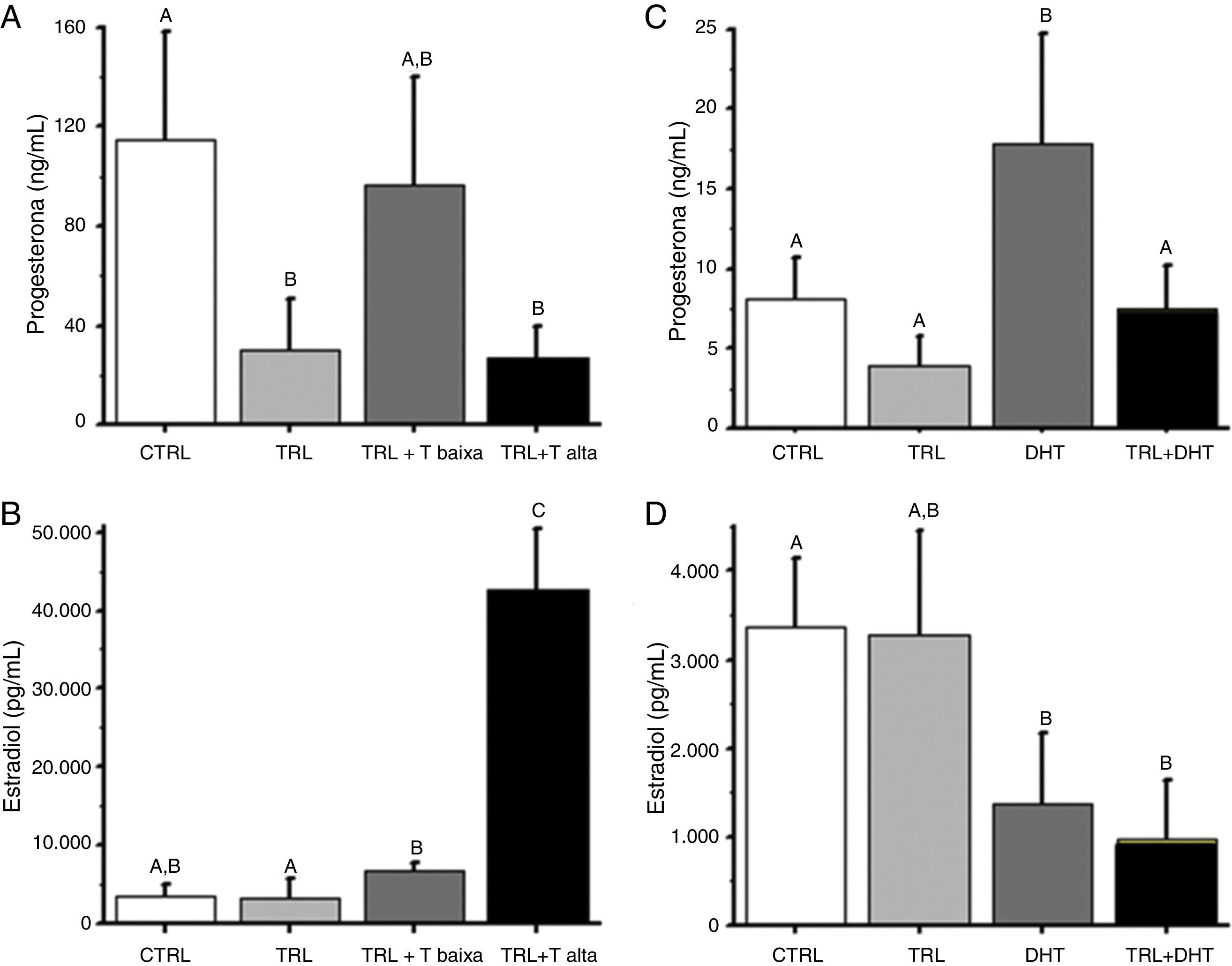
O TRL adicionado isoladamente diminuiu os níveis de P4 produzidos por folículos de crescimento lento (dados não mostrados) e rápido (fig. 2A). Inesperadamente, a adição de baixa dose de T restabeleceu os níveis de P4 para níveis semelhantes aos do grupo controle, especialmente para folículos de crescimento rápido. Em contraste, os níveis de P4 apresentaram‐se diminuídos (p<0,05) no grupo T alta em relação ao grupo controle a concentrações que se assemelham às encontradas no grupo TRL.
Efeito da reposição de T e DHT sobre a produção de progesterona e estradiol por folículos secundários de Macaca mulatta cultivados individualmente em matriz 3D por 40 dias.
Nota: A e B. Reposição de T; C e D. Reposição de DHT; CTRL: controle (veículo); TRL: trilostano (250ng/mL desde o início do cultivo); TRL+T baixa (250ng/mL de trilostano+10ng/mL de testosterona, desde o início do cultivo); TRL+T alta (250ng/mL de trilostano+50ng/mL de testosterona, desde o início do cultivo); DHT: 50ng/mL de dihidrotestosterona, desde o início do cultivo; TRL+DHT: 250ng/mL de trilostano+50ng/mL de dihidrotestosterona, desde o início do cultivo; Diferentes letras (A, B, C) indicam diferença significativa (p<0,05).
Quando E2 foi mensurado como um marcador de função folicular esteroidogênica, observou‐se que o TRL administrado isoladamente reduziu a concentração de E2 em relação ao grupo controle (63±13 vs. 247±47pg/mL, p<0,05) em folículos de crescimento lento. Mas a exposição a doses baixa ou alta de T na presença de TRL marcadamente elevaram os níveis de E2 (2734±338 e 18723±1758pg/mL) respectivamente. Os resultados para folículos de crescimento rápido exibiram uma tendência similar (fig. 2B), exceto que o TRL adicionado isoladamente não diminuiu os níveis de E2, aumentados em 14 vezes em comparação com os folículos de crescimento lento. Apesar disso, observou‐se um aumento dependente da dose (p<0,05) nos níveis de E2, com a adição de T, em relação ao grupo TRL.
D) Efeitos sobre o grau de maturação, qualidade oocitária e fertilização
Poucos folículos antrais e seus oócitos foram analisados após exposição ao hCG durante a exposição ao TRL (tabela 2; Reposição de T). Porém, a exposição a T durante o tratamento com TRL recuperou a formação de folículos antrais, que de forma consistente deram origem a oócitos saudáveis, embora sua maioria se encontrasse no estágio de vesícula germinativa (GV). Ambos os grupos T baixa e controle apresentaram folículos que deram origem a um oócito MI e os grupos T alta e controle apresentaram folículos que deram origem a oócitos MII após a exposição ao hCG. Os diâmetros de ambos os oócitos MII obtidos eram superiores a 130μm. Após FIV, a fertilização foi confirmada pela presença de dois corpúsculos polares e dois pró‐núcleos (dados não mostrados). Entretanto, os zigotos mantiveram‐se sem apresentar divisão celular.
Efeito da reposição de T e DHT nas características de oócitos coletados de folículos antrais no fim do cultivo (34h após administração de hCG)
| Cultivo folicular | Número (n) de | Diâmetro (μm)* | |||||||
|---|---|---|---|---|---|---|---|---|---|
| Folículos analisados | Oócitos coletados | Oócitos degenerados | Oócitos saudáveis | Oócitos VG | Oócitos MI | Oócitos MII | |||
| VG | MI | MII | |||||||
| Reposição de T | |||||||||
| CTRL | 15 | 15 | 2 | 12 | 1 | 1 | 119±5a | 143 | 131 |
| TRL | 4 | 4 | 2 | 2 | 0 | 0 | 117±2a | ‐ | ‐ |
| TRL+T baixa | 16 | 16 | 1 | 13 | 1 | 0 | 119±14a | 131 | ‐ |
| TRL+T alta | 13 | 13 | 0 | 12 | 0 | 1 | 102±14a | ‐ | 147 |
| Reposição de DHT | |||||||||
| CTRL | 21 | 21 | 6 | 13 | 0 | 2 | 110±2a | ‐ | 123±3 |
| TRL | 8 | 8 | 6 | 2 | 0 | 0 | 112±2a,b | ‐ | ‐ |
| DHT | 10 | 10 | 4 | 6 | 0 | 0 | 116±4a,b | ‐ | ‐ |
| TRL+DHT | 13 | 13 | 3 | 9 | 0 | 1 | 118±2b | ‐ | 117 |
Nota: CTRL: controle (veículo); TRL: trilostano (250ng/mL desde o início do cultivo); TRL+T baixa (250ng/mL de trilostano+10ng/mL de testosterona, desde o início do cultivo); TRL+T alta (250ng/mL de trilostano+50ng/mL de testosterona, desde o início do cultivo); DHT: 50ng/mL de dihidrotestosterona, desde o início do cultivo; TRL+DHT: 250ng/mL de trilostano+50ng/mL de dihidrotestosterona, desde o início do cultivo; VG: vesícula germinativa; MI: metáfase I; MII: metáfase II. * Valores expressos em média±erro padrão, com cada diâmetro oocitário como um dado individual; Diferentes letras (a, b, c) dentro da mesma coluna indicam diferença significativa (p<0,05); O número de folículos analisados corresponde ao número de folículos que atingiram o diâmetro médio de 1mm e receberam hCG.
A) Efeito sobre a sobrevida folicular e a formação de antro
A adição de DHT em presença do TRL recuperou a porcentagem de folículos sobreviventes para os níveis encontrados no grupo controle (fig. 1C); a resposta foi similar ao observado após adição de T (fig. 1A). Notavelmente, a administração de DHT isoladamente contribuiu para o aumento da porcentagem de folículos que sobreviveram para mais do que 80%, acima (p<0,05) do que foi observado para o grupo controle.
Além disso, a porcentagem de folículos antrais no grupo que recebeu DHT isoladamente (grupo DHT) (93±3%) foi superior (p<0,05) à porcentagem encontrada no grupo controle (82±4%) (fig. 1D).B) Efeito sobre o crescimento folicular
Diferentemente do que foi observado no Experimento 1, a exposição ao TRL isoladamente não alterou as porcentagens de folículos sem crescimento ou que apresentam crescimento lento ou rápido e a reposição de DHT não apresentou um efeito positivo aparente (tabela 1; Reposição de DHT). Entretanto, a adição isolada de DHT reduziu o número/porcentagem (7%) de folículos sem crescimento, comparado com os grupos controle, TRL e TRL+DHT. O TRL novamente diminuiu o diâmetro de folículos de crescimento lento em relação aos folículos controle (315±13 vs. 357±16μm, p<0.05), porém essa diferença desapareceu quando o tratamento com TRL foi combinado com a adição de DHT (373±14μm). DHT administrada isoladamente não apresentou efeito no diâmetro de folículos de crescimento lento (dados não mostrados), mas contribuiu para a diminuição do tamanho de folículos de crescimento rápido comparado com os controles (607±29 vs. 726±50μm, p<0,05).
C) Efeito sobre a produção de esteroides ovarianos
Como no Experimento 1, TRL diminuiu (p<0,05) os níveis de P4 produzidos por folículos de crescimento lento e a reposição com DHT recuperou os níveis produzidos e os tornou similares aos níveis encontrados no grupo controle (dados não mostrados). Da mesma forma, nem a adição de DHT (fig. 2C) ou T (fig. 2A) alterou a produção de P4 quando combinados com o TRL. Contudo, a adição de DHT isoladamente aumentou os níveis de P4 produzidos por folículos de crescimento lento (dados não mostrados) e de crescimento rápido (fig. 2C). Diferentemente da adição de T (fig. 2B), a adição de DHT+TRL reduziu significativamente o E2 produzido por folículos de crescimento lento (dados não mostrados) e de crescimento rápido (fig. 2D) quando comparados com o grupo controle. Além disso, DHT administrado de forma isolada replicou esse mesmo efeito, também quando comparado ao grupo controle.
D) Efeitos sobre o grau de maturação, qualidade oocitária e fertilização
Como notado para o Experimento 1, poucos oócitos saudáveis foram coletados a partir de folículos antrais no grupo TRL comparados com os do grupo controle (tabela 2; Reposição de DHT). Em contraste, o grupo de reposição de DHT apresentou folículos que deram origem tipicamente a oócitos saudáveis (10 de 13), incluindo um oócito em estágio MII. Notavelmente, o diâmetro dos oócitos VG obtidos a partir do grupo de reposição de DHT (grupo TRL+DHT) foi maior (p<0,05) do que os obtidos no grupo controle. A exposição a DHT isoladamente (grupo DHT) deu origem a oócitos com características semelhantes àqueles obtidos no grupo controle ou de reposição de DHT, exceto que nenhum oócito MII foi observado.
DiscussãoA proposta do presente estudo foi investigar pela primeira vez, o papel dos androgênios no desenvolvimento folicular (sobrevida, formação de antro, produção hormonal e maturidade oocitária) de folículos pré‐antrais frescos de primatas não humanos cultivados individualmente, em sistema de cultivo in vitro em matriz 3D por meio da ablação da produção de esteroides e reposição de T e DHT.
Nossos achados mostraram claramente que a T e a DHT podem recuperar a sobrevida, o crescimento, a formação de antro, a produção hormonal e a viabilidade oocitária de folículos pré‐antrais cultivados in vitro em matriz 3D de alginato, expostos a ablação da produção de esteroides.
A exposição ao TRL desde o início do cultivo para a sustentação de um ambiente pobre em esteroides afeta a sobrevida, o crescimento e a formação de antro dos folículos. Os efeitos do bloqueio da esteroidogênese também puderam ser observados na qualidade oocitária e grau de maturação. Os efeitos da ablação da produção de esteroides podem dever‐se a perda da ação local dos progestagênios, androgênios ou estrogênios, individualmente ou em conjunto. Além dos ARs,19,21,59,60 há evidências da presença de PRs,61‐63 e ERs64,65 em folículos de primatas com possíveis ações locais (progestagênios63,66,67; estrogênios68,69). Os resultados deste estudo são consistentes com achados obtidos em estudos in vivo com macacas, que mostraram que um dos efeitos da ação do TRL parece ser a inibição da produção/ação da progesterona, uma vez que a administração do TRL conjunta com o hCG bloqueou a ovulação, enquanto que a administração concomitante de progestina (R5020) preveniu a ação antiovulatória.70 Estudos prévios in vitro também mostraram que a administração do TRL efetivamente inibiu a produção de P4 e reduziu o número de células positivas para receptores de progesterona (PRs).71
A adição de testosterona ao meio de cultivo desprovido de esteroides contribuiu marcadamente para o aumento da sobrevida e a formação de antro de folículos pré‐antrais individuais de primatas não humanos cultivados in vitro. A adição de testosterona em presença de TRL também deu origem a oócitos maduros e saudáveis. Um maior número de folículos antrais foi formado tanto quando uma dose baixa (remanescente aos níveis circulantes em primatas) ou uma dose alta (como encontrado no fluido folicular de folículos maduros de primatas) de testosterona foi adicionada no meio de cultivo, em relação ao número de folículos antrais formados no grupo TRL. O crescimento também foi recuperado para o padrão observado no grupo controle. Oócitos saudáveis foram produzidos após exposição a T durante o tratamento com TRL, nos estágios VG, MI e MII, e dois embriões foram formados. Esses dados sugerem que a reposição de androgênios pode promover a maturação e a viabilidade oocitária e que a ação androgênica no folículo pode estar relacionada a interações entre o oócito e células somáticas via fatores secretados pelo oócito.24
O E2 apresentou‐se marcadamente aumentado na exposição a doses baixa e alta de T em presença de TRL, presumidamente devido à aromatização de T por células da granulosa de folículos antrais.72 Efeitos locais do E2 nos folículos têm sido reportados e parecem ser espécie‐dependentes. O E2 parece ser importante em eventos envolvidos na foliculogênese, especialmente em roedores,50,65,68,73 porém seu papel em folículos de primatas ainda está pouco claro.64,73 A recuperação da sobrevida, a formação de antro e o crescimento nos grupos com reposição de T podem ser devidos em parte à possível conversão de T em E2 pela aromatase P450 e sinalização estrogênio‐receptor no folículo. Experimentos anteriores, nos quais altas doses de T foram administradas,74,75 permitiram que fosse proposto que os efeitos “androgênicos” eram mediados por estrogênios que foram convertidos por meio de ERs, e não por meio de ARs. Contudo, os androgênios também podem ser produzidos pelo ovário e a testosterona reposta poderia ser convertida em dihidrotestosterona pela enzima 5α‐redutase nas células da granulosa ou ter efeitos diretos sobre os folículos, responsáveis em parte pela restauração da sobrevida, formação de antro e pelo crescimento observados em nosso experimento in vitro. Com o intuito de testar essa hipótese, a DHT, um androgênio não aromatizável, foi adicionado ao cultivo dos folículos, conforme descrito no Experimento 2.
Assim como para a exposição a T, a DHT em conjunto com TRL recuperou a habilidade dos folículos em se desenvolver e produzir oócitos maduros. A adição de DHT com TRL recuperou a porcentagem de folículos sobreviventes aos níveis encontrados no grupo controle. Como esperado, o diâmetro de folículos com crescimento lento foi reduzido na presença de TRL administrado isoladamente, comparado aos controles, mas a diferença desapareceu quando DHT foi adicionada ao cultivo, como aconteceu quando T foi adicionada. Para folículos que cresceram rapidamente, a DHT (isoladamente) diminuiu o tamanho dos folículos comparado com controles, o que foi similarmente observado quando uma dose alta de T foi administrada em presença de TRL. Os níveis de P4 foram encontrados reduzidos em folículos de crescimento lento quando TRL foi adicionado isoladamente e os níveis foram restaurados aqueles encontrados no grupo controle quando DHT foi reposta, de forma similar como o que foi observado quando uma dose baixa de T foi adicionada ao cultivo para folículos de crescimento rápido. Da mesma forma, foi observado um efeito positivo em relação à qualidade oocitária quando os folículos foram expostos a DHT. A maioria dos oócitos coletados de folículos antrais quando DHT foi reposta foi saudável, incluindo um oócito MII. É importante ressaltar que o diâmetro dos oócitos VG saudáveis foi superior no grupo DHT comparado com os controles e a exposição a DHT isoladamente deu origem a oócitos com características similares as observadas no grupo controle ou de reposição de DHT, exceto que oócitos MII não foram observados. Esses resultados embasam fortemente a ideia de que as ações dos androgênios promovem crescimento folicular precoce, esteroidogênese e desenvolvimento oocitário em folículos de primatas desde o início da foliculogênese.
Diferentemente da adição de T, a combinação de DHT com TRL não contribuiu para o aumento da produção de E2 por folículos de crescimento lento e rápido comparados com os grupos controle e TRL (isoladamente), o que base à conclusão de que a T, e não a DHT, é aromatizada no folículo. Como notado, muitas mudanças causadas por T foram mimetizadas por DHT. Dessa forma, muitos dos efeitos positivos no desenvolvimento folicular encontrados após a reposição de T provavelmente não são devidos AA ação estrogênica. Sendo assim, é possível inferir que os androgênios apresentam um papel local essencial durante o desenvolvimento e a maturação folicular em primatas não humanos. Corroborando nossos resultados em folículos de primatas, o tratamento de folículos de camundongo com hidroxiflutamida ou bicalutamida, dois componentes antiandrogênicos, reduziu o crescimento folicular durante o estágio pré‐antral, alterou a função esteroidogênica e impediu a maturação meiótica de oócitos em resposta ao hCG.3
Nossos resultados apoiam a evidência de que ação dos androgênios no folículo pode ser estágio e/ou dose‐dependente. Estudos têm evidenciado o papel dos androgênios no estágio folicular pré‐antral.2,3 Contudo, como frequentemente observado em estudos in vivo com pacientes com SOP,7,42 os androgênios podem apresentar efeitos negativos sobre os folículos, a depender de seus níveis intrafoliculares, especialmente se eles são altos, e afetar o desenvolvimento folicular e a maturação oocitária.17,43,76 Particularmente perplexo nesse experimento é a evidência de que uma dose baixa de T (e DHT), mas não uma dose alta de T, restaurou os níveis de P4 aos níveis encontrados no grupo controle, apesar da presença de TRL. Nesse caso, a T demonstra um efeito dose dependente, no qual uma baixa dose de T contribui para a manutenção de níveis adequados de P4 e uma dose alta afeta negativamente a produção de P4. Entretanto, os possíveis mecanismos envolvidos na conversão ativa de androgênios em progesterona, ou na sinalização de receptores androgênicos que promovem a produção de 3‐β‐HSD independentemente da progesterona, não são claros.
A administração isolada de DHT replicou muitos dos efeitos observados quando T ou DHT foi adicionado em conjunto com TRL. A porcentagem de folículos sobreviventes e a porcentagem de formação de folículos antrais foi maior do que o observado no grupo controle. Em relação aos efeitos no crescimento de folículos de crescimento rápido, DHT administrada isoladamente diminuiu o tamanho dos mesmos, o que também foi observado quando uma dose alta de T foi adicionada em presença de TRL. A adição isolada de DHT também reduziu a porcentagem de folículos sem crescimento, comparado com controles ou quando DHT estava presente em conjunto com TRL. Em contraste ao observado quando DHT e T foram adicionados com TRL, a adição de DHT isoladamente aumentou os níveis de P4 produzidos por folículos de crescimento lento e rápido. Esses resultados também são consistentes com a ideia de que os androgênios são essenciais na foliculogênese.
Apesar de outros androgênios estarem presentes no ovário, apenas a T e seu metabólito DHT têm atividade androgênica direta por meio de ARs.77‐79 Diversos estudos documentam a expressão de ARs em ovários de mamíferos,8‐13,15‐23,59 e a ação dos androgênios durante a foliculogênese ovariana e mostram que são indispensáveis para um processo de foliculogênese normal.80‐82
Este estudo in vitro apresentou novas evidências do papel local essencial dos androgênios desde os estágios inicias da foliculogênese de primatas não humanos, fortaleceu a existência de mecanismos moleculares que regulam a atividade de ARs, a atividade androgênica3,77 e novas possíveis interações entre androgênios com outros hormônios esteroides. A DHT adicionada ao meio de maturação padrão promoveu aumento da percentagem de sobrevida e formação de antro folicular quando comparada com o grupo controle e abriu perspectivas de se avaliar se a suplementação desse androgênio poderia melhorar o desenvolvimento folicular in vitro. Novos conhecimentos obtidos por meio deste estudo podem ajudar no entendimento da dinâmica do processo do desenvolvimento folicular, que ainda é muito pouco compreendida, principalmente em primatas.83 Além disso, desempenharia um papel crucial no entendimento da etiopatogênese de distúrbios ovulatórios humanos, com destaque para a SOP, além de favorecer a identificação das condições ótimas para o crescimento de folículos de primatas in vitro, com inúmeras aplicabilidades clínicas, como para a obtenção de oócitos maduros saudáveis após cultivo in vitro de tecido ovariano criopreservado em pacientes oncológicas.84‐89
Conflitos de interesseOs autores declaram não haver conflitos de interesse.